-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Úloha alogenní transplantace buněk krvetvorby v léčbě získané aplastické anémie u dětí – zkušenost v České republice v letech 1991–2007
The role of allogeneic haematopoietic stem cell transplantation in the treatment of acquired aplastic anaemia in children – experience in the Czech Republic from 1991-2007
Allogeneic haematopoietic stem cell transplantation has a defined role in the treatment scheme of acquired aplastic anaemia in children. This article summarises the development and current status of such treatment in paediatric patients in the Czech Republic, covering a period of 17 years (1991–2007). During this period, a total of 38 children underwent transplantation, of which 74% were transplanted using grafts from HLA matched siblings (n=28) and 26% (n=10) from alternative donors. Median follow-up was 9.8 years (3.3 – 20.3). 5 year overall survival of the entire group is 92±4.3% (CI 95%) – sibling donor group 96±3.5%, alternative donor group 80±12.6%. The principal complication and cause of morbidity and mortality is GVHD – higher in the group of recipients of alternative grafts as expected. Our experience demonstrates the benefit of allogeneic hematopoietic stem cell transplantation in children suffering from acquired aplastic anaemia. Very satisfactory results have been achieved mainly in the group of unrelated matched donors. The main trend has been to optimise conditioning regimens with the aim of reducing both early and late toxicity, also in view of possible late effects.
Key words:
acquired aplastic anaemia, immunosuppressive therapy, haematopoietic stem cell transplantation, alternative donor, conditioning
Autoři: Pindurová E.ihash2ihash4ihash6ihash8ihash10ihash12ihash14ihash16ihash18ihash20ihash22 Pro Pracovní Skupinu Dětské Hematologie (psdh) 1 1 1 1 1 1 1 1 1 2 3 1
Působiště autorů: Klinika dětské hematologie a onkologie, 2. lékařská fakulta a FN v Motole, Praha, Ústav hematologie a krevní transfuze, Praha, Radioterapeuticko-onkologické oddělení FN Motol, Praha 1
Vyšlo v časopise: Transfuze Hematol. dnes,17, 2011, No. 3, p. 122-129.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Alogenní transplantace kmenových buněk krvetvorby má v léčbě dětí se získanou aplastickou anémií svou danou úlohu. V následujícím textu je shrnut vývoj a současný stav takovéto léčby u dětí v České republice a to za dobu 17 let (1991–2007). V tomto období bylo pro danou diagnózu transplantováno celkem 38 dětí, ze kterých 74 % (n = 28) bylo transplantováno štěpem od HLA identického sourozence a 26 % (n = 10) od alternativního dárce. Medián sledování byl 9,8 let (3,3 - 20,3). 5leté přežití celé skupiny je 92 ± 4,3 % (CI 95 %) – u sourozeneckých transplantací 96 ± 3,5 %, v případě využití alternativních dárců 80 ± 12,6 %. Hlavní komplikací a příčinou morbidity i mortality je reakce štěpu proti hostiteli – předpokládaně výrazněji ve skupině pacientů transplantovaných štěpem od alternativních dárců. Naše zkušenost potvrzuje benefit alogenních transplantací buněk krvetvorby u dětských pacientů se získanou aplastickou anémií. Ve skupině transplantací od alternativních dárců jsou dosahovány velmi dobré výsledky především ve skupině shodných dárců. I s ohledem na pozdní následky je hlavním trendem optimalizace přípravných režimů v této skupině s omezením bezprostřední i pozdní toxicity.
Klíčová slova:
získaná aplastická anémie, imunosupresivní terapie, transplantace kmenových buněk krvetvorby, alternativní dárce, přípravný režimÚvod
Získaná aplastická anémie (AA) je syndrom selhání kostní dřeně (KD) charakterizovaný periferní cytopenií a hypoplazií kostní dřeně. Jde o onemocnění vzácné jak v populaci obecně, tak i v dětském věku. Incidence v Evropě a USA bývá udávána 2/ 1 milion obyvatel, se dvěma maximy výskytu ve věku 15–25 let a nad 60 let (1, 2). V diferenciální diagnostice daného klinického stavu v dětském věku je nutné vyloučit na prvním místě kongenitální syndromy selhání kostní dřeně (IBMFS; zejména Fanconiho anémii, Shwachman-Diamondův syndrom, dyskeratosis congenita), hypoplastický myelodysplastický syndrom (MDS) či leukemii. Patofyziologicky jde v případě získané aplastické anémie o autologní cytotoxickou reakci zprostředkovanou oligoklonální expanzí Th1 lymfocytů namířenou proti vlastním hematopoetickým progenitorům. Až 30 % pacientů má neuspokojivou odpověď na podávanou imunosupresivní terapii – v těchto případech jsou diskutovány i jiné etiologické faktory vedoucí k selhání krvetvorby. Abnormální zkracování telomeráz v hematopoetických prekurzorech (porucha jejich reparace zprostředkovaná přes TERT a TERC je dobře známá u pacientů s dyskeratosis congenita) by mohlo být jedním z možných faktorů vysvětlujících „zranitelnost“ hematopoetických kmenových buněk i u pacientů s AA získanou během života a větší tendenci onemocnění k relapsu či klonální evoluci (1, 3). Získaná aplastická anémie byla do osmdesátých let minulého století onemocněním s velmi špatnou prognózou. Osmdesát procent pacientů umíralo na krvácení či infekční komplikace (4). Zásadní zlepšení léčebných výsledků přinesla léčba antilymfocytárním globulinem (5). V současnosti je v terapii dětské získané AA (bez ohledu na vyvolávající příčinu) možné využít dvě modality. V případě dostupnosti HLA identického sourozence je časná alogenní transplantace s užitím kmenových buněk krvetvorby (SCT) léčbou první volby. Není-li takovýto dárce dostupný, je zahájena imunosupresivní terapie (IST) kombinací antithymocytárního globulinu (ALG/ATG), cyklosporinu A (CsA) a granulocyty stimulujícího růstového faktoru (G-CSF) s očekávaným mediánem odpovědi 2–3 měsíce. V případě nedostatečné odpovědi, tedy při selhání IST (non response – NR) či relapsu onemocnění, byla zvažována intenzifikace imunosupresivní léčby opakováním cyklu či transplantace od alternativního dárce. V porovnání výsledků SCT a IST je dlouhodobě dosahováno signifikantně lepšího přežívání do události (EFS) u pacientů podstupujících transplantaci (97 % vs. 40 %, p = 0,0001) (6). U primárně indikované imunosupresivní terapie bylo v období po zavedení ALG v kombinaci s CsA dokumentováno zlepšení předpokládaného přežití (88 % vs. 65 % před érou kombinované imunosuprese), nadále ale zůstává hlavním rizikem této léčby vysoké procento relapsů (20–40 %) a tím dlouhodobě dosažené EFS kolem 50 % (6, 7). Vedle relapsů pak ve skupině pacientů léčených kombinovanou imunosupresivní léčbou přispívá ke snížení EFS riziko rozvoje pozdních klonálních abnormit – paroxysmální noční hemoglobinurie (PNH), myelodysplastického syndromu / akutní myeloidní leukemie či solidních tumorů (8).
V této práci hodnotíme s mediánem sledování 9,8 let vývoj a výsledky transplantací buněk krvetvorby v terapii dětí se získanou AA za období 17 let, kdy se stala centralizovaná péče o tyto pacienty standardem v rámci Pracovní skupiny pro dětskou hematologii (PSDH) v České republice.
Pacienti a metody
Definice
Aplastická anémie (AA) je definovaná periferní cytopenií (nejméně ve 2 liniích) a hypocelulární kostní dření (bez infiltrace či fibrózy, celularita v biopsii pod 30 %). Těžká aplastická anémie (SAA) předpokládá počet granulocytů < 0,5 x 109/l, trombocytů < 20 x 109/l, retikulocytů < 20 x 109/l. U velmi těžké aplastické anémie (vSAA) pak navíc počet granulocytů klesá < 0,2 x 109/l. Non-SAA je stavem s definovanými změnami kostní dřeně, ale ne ještě hlubokým poklesem v řadách periferní krve. Základem diagnostického algoritmu je aspirace KD ze dvou míst, trepanobiopsie, vyšetření cytogenetických změn a přítomnosti PNH klonu, testy vedoucí k vyloučení vrozeného selhání KD. Posouzení odpovědi na imunosupresivní terapii proběhlo 120 dní od zahájení léčby po zhodnocení klinického stavu (závislost na transfuzích), krevního obrazu, vyšetření aspirátu KD i trepanobiopsie (9).
Pacienti
Od 1. ledna 1991 do 31. prosince 2007 bylo v České republice diagnostikováno celkem 90 dětí se získanou AA (bez ohledu na tíži onemocnění). Z této skupiny pacientů bylo celkem 38 (42 %) dětí v určité fázi onemocnění indikováno k alogenní transplantaci buněk krvetvorby – 28 dětí bylo transplantováno s užitím HLA identického sourozence jako dárce štěpu (MSD), 10 pacientů s využitím štěpu od alternativního dárce. Věk pacientů v době transplantace byl 2,2–17,9 let (medián 13,5 let), 19 chlapců a 19 dívek. Etiologicky byla aplastická anémie asociovaná se sérologicky negativní hepatitidou v 9 případech, v ostatních případech bylo onemocnění označeno jako idiopatické (n = 29). Stratifikace dle tíže AA byla následující: SAA (n = 22), vSAA (n = 13), nonSAA (n = 3).
Ve skupině sourozeneckých transplantací byla SCT indikována jako léčba první volby u 27/28 pacientů. Interval od definitivního potvrzení diagnózy AA k transplantaci byl v mediánu 30 dnů (rozmezí: 15–96). Jedna pacientka byla transplantována po selhání 2 cyklů IST s intervalem primární diagnóza-SCT 1250 dnů (HLA identická sestra byla jako dárkyně celkem dvakrát nedostupná pro opakovaná těhotenství). Transplantace s využitím štěpu od alternativního dárce byla léčbou následné volby po selhání předchozí imunosupresivní terapie – non response (NR) po 1. cyklu IST terapie (n = 2), NR po 2. cyklu (n = 4), relaps po 1. cyklu IST (n = 1), relaps a selhání následné IST (n = 3). Interval od diagnózy onemocnění k provedení transplantace byl 212–1713 dnů (medián 358).
Dárci
U sourozeneckých transplantací byl užit štěp od dárců ve věku 2–27 let (medián 14), jedním dárcem bylo syngenní dvojče. Alternativním dárcem byl rodinný příslušník (HLA identická matka) v jednom případě, ostatní dárci byli získáni s využitím národních (n = 3) a mezinárodních registrů (n = 6). Plně shodná nepříbuzenská transplantace (HLA alelická shoda 9–10/10; MUD) byla provedena u 7 dětí, 2 děti byly transplantovány štěpem od neshodného dárce (mMUD) – 8/10 (neshoda v alelách B*, Cw*) (tab. 1). Věk dobrovolných dárců z registru byl 20–57 let (medián 31), jednalo se o 6 mužů a 4 ženy. Dominantním zdrojem buněk krvetvorby byla v obou skupinách kostní dřeň (BM), méně často periferní buňky krvetvorby (PBSC) (tab. 2). Všechny štěpy byly podány bez předchozí úpravy štěpu (T-deplece).
Tab. 1. Charakteristika skupiny dětí transplantovaných štěpem od alternativního dárce - ve všech přípravných režimech bylo použito ATG. 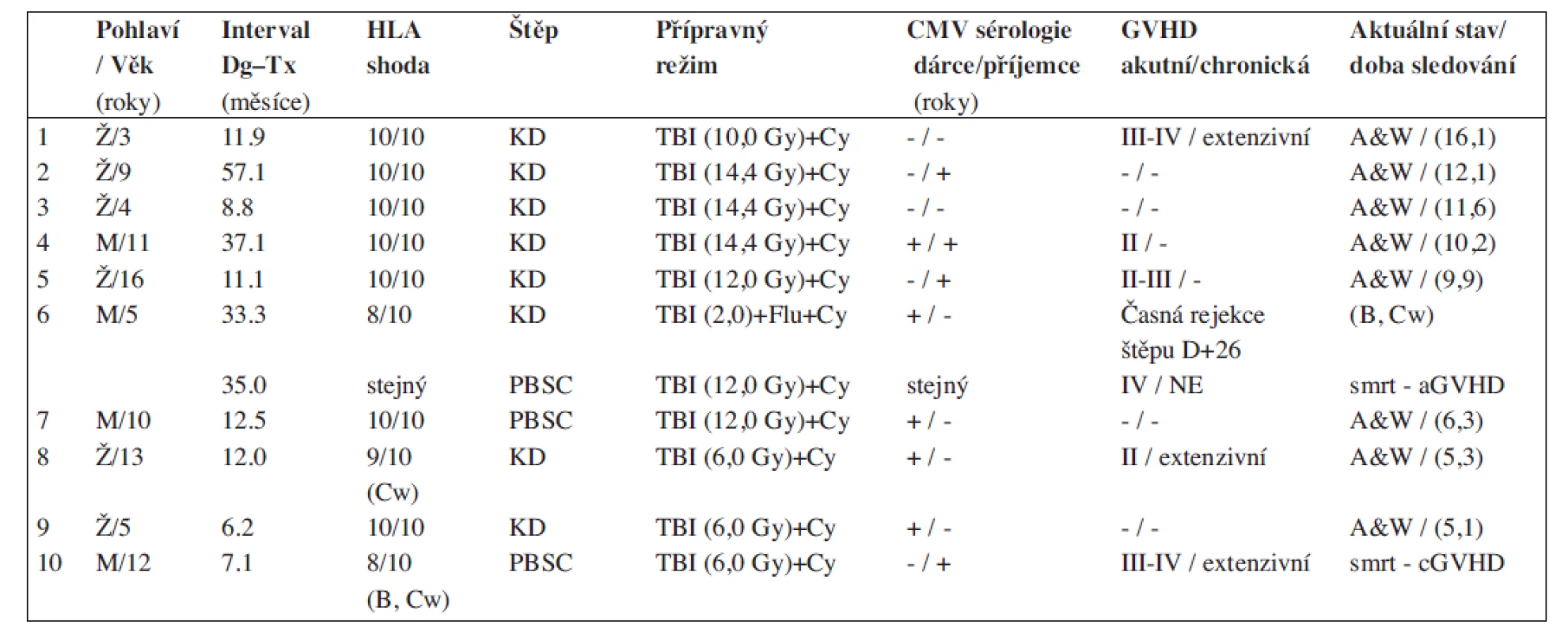
Dg - diagnóza, Tx - léčba, GVHD - reakce štěpu vůči hostiteli, KD - kostní dřeň, PBSC - periferní krvetvorné buňky, TBI - celotělové ozáření, A&W - živ a v celkově dobrém stavu. Tab. 2. Charakteristika štěpů – dle dostupnosti metody v čase transplantace (u 2 pacientů nebyl stanoven počet CD3). 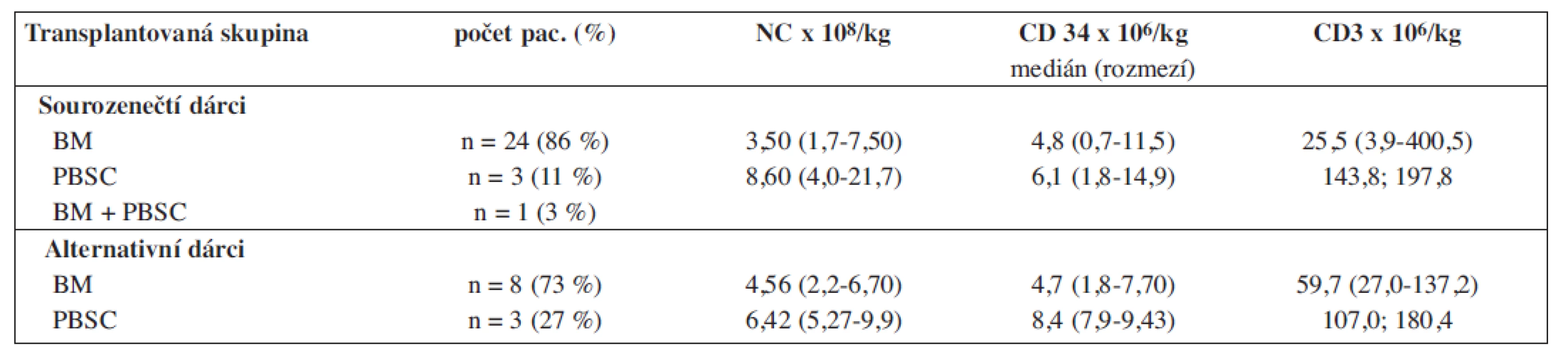
NC - jaderné buňky, BM - kostní dřeň, PBSC - periferní krvetvorné buňky. Přípravné režimy
Použité přípravné režimy charakterizuje tabulka 3. U transplantací od sourozeneckých dárců byl krátce užit samostatně cyklofosfamid (Cy), od r. 1993 byla standardním režimem kombinace Cy + ALG/ATG. U pacientky transplantované po opakovaných cyklech IST byla užita kombinace fludarabinu, cyklofosfamidu a alemtuzumabu. U alternativních dárců dominovaly myeloablativní režimy založené na TBI (total body irradiation) v kombinaci s cyklofosfamidem: vysoké dávky TBI (10–14,4 Gy) byly postupně redukovány (6 Gy). Jednou byl použit režim s redukovanou intenzitou, po kterém ale došlo k časné rejekci štěpu a pacient byl retransplantován štěpem od stejného dárce po přípravě vysokodávkovaným TBI+Cy. ATG bylo u této skupiny standardní součástí režimu (celková dávka 40 mg/kg; rATG Fresenius).
Tab. 3. Přípravné režimy užité při SCT u získané aplastické anémie na našem pracovišti. 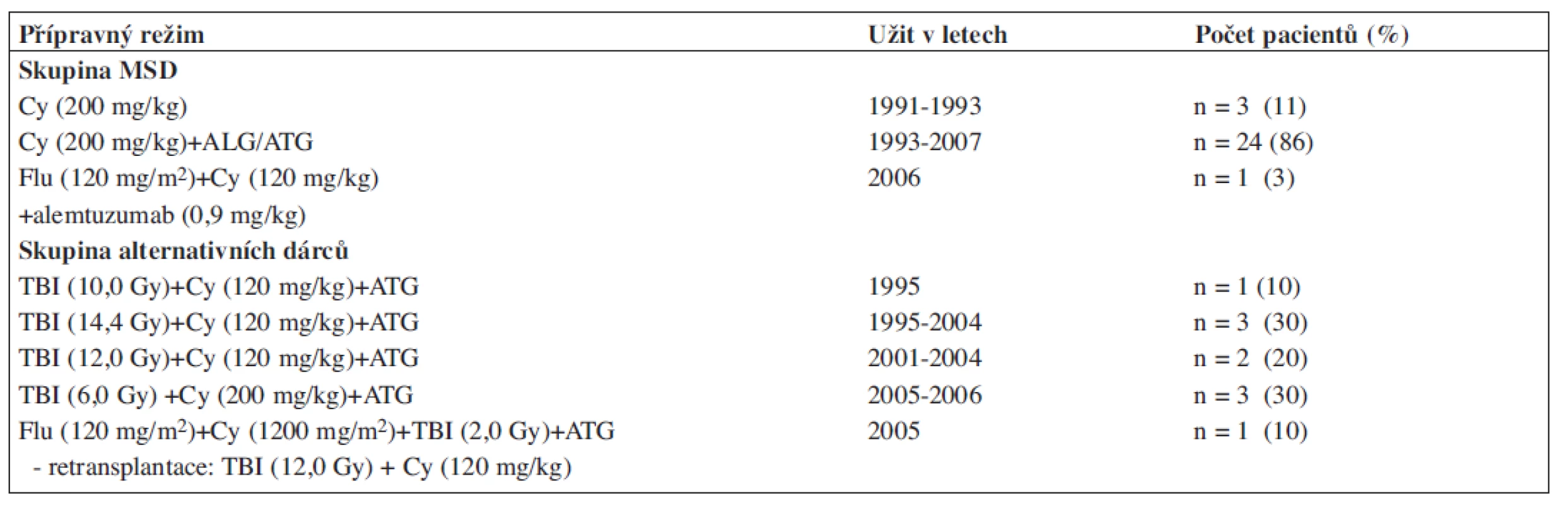
MSD - dárcem HLA identický sourozenec, Cy - cyklofosfamid, ALG/ATG - antilymfocytární/ antithymocytární globulin, Flu - fludarabin, TBI - celotělové ozáření GVHD profylaxe, GVHD léčba
GVHD profylaxi shrnuje tabulka 4. Délka podávání CsA v plné dávce (event. jiné imunosuprese) byla optimálně 9 měsíců po transplantaci, s následným postupným vysazováním při nepřítomnosti GVHD do konce prvního roku po transplantaci (prevence pozdní rejekce štěpu). Akutní GVHD (aGVHD) byla stážovaná dle Glucksberg-Seattle kritérií jako grade 0–IV (10), při známkách aktivace aGVHD byl v léčbě v první linii použit metylprednizolon v dávce 1–2 mg/kg dle stadia a stupně progrese. Chronická GVHD (cGVHD) byla klasifikovaná jako limitovaná či extenzivní (11).
Tab. 4. GVHD profylaxe. 
MTX - metotrexát, CsA - cyklosporin A. Engraftment, chimerismus
Engraftment byl definovaný jako první ze 3 po sobě následujících dnů, kdy bylo dosaženo absolutního počtu neutrofilů (ANC) v periferní krvi ≥ 0,5 x 109/l. Přihojení trombocytů ≥ 20 x 109/l (a interval 7 dnů od poslední transfuze separovaných trombocytů) se začalo užívat jako kritérium na našem pracovišti až od r. 1993, do této doby bylo za přihojení trombocytů považováno dosažení jejich počtu stabilně ≥ 50 x 109/l. Selhání štěpu (GF, graft failure) nebylo hodnoceno u pacientů, kteří zemřeli do D+28 po transplantaci. Primární GF byl definován jako trvalá hodnota ANC ≤ 0,1 x 109/l do D+29 po převodu štěpu či při počtu ANC ≤ 0,1 x 109/l D+21 po transplantaci a trvající počet ANC ≤ 0,5 x 109/l po následující 4 týdny. Jako sekundární GF byl definován rozvoj neutropenie (tedy počet ANC < 0,1 x 109/l) po předchozím přihojení bez jiného vysvětlení pro nízké počty leukocytů. GF jsme hodnotili jako časný, pokud se manifestoval do D+100 a jako pozdní GF, pokud se objevil po D+100 po transplantaci.
Chimerismus byl testován z periferní krve i kostní dřeně s použitím Y chromozom specifické sondy u pacientů s dárcem opačného pohlaví nebo specifickými sondami pro DNA polymorfismus u dárců stejného pohlaví (VNTR, STR). Pravidelné monitorování chimerismu používáme ve spolupráci s ÚHKT od r. 1993, v souboru pacientů tedy nebyl tímto způsobem prospektivně monitorován potransplantační průběh u 3 dětí.
Podpůrná léčba
Podpůrná léčba prošla během 17 let mnoha změnami. V posledních letech již nebyla užívána selektivní dekontaminace gastrointestinálního traktu ani antibiotická profylaxe, cotrimoxazol jako prevence infekce Pneumocystis jiroveci byl podáván 2–3 dny v týdnu. Nezbytnou zůstává profylaxe antimykotická (flukonazol či v pozdějších letech itrakonazol, pokud nevyžadovala předchozí anamnéza pacienta volbu jiného antimykotika) a virostatická (acyklovir).
Statistika
Data byla hodnocena k 1. březnu 2011. Data s nenominální distribucí jsou vyjádřena v hodnotách mediánu. Celkové přežití (OS) a přežití do události (EFS) byly získány metodou Kaplan-Meier. Při stanovení přežití do události (EFS) byly jako událost hodnoceny smrt, relaps onemocnění, sekundární malignita. Pro hodnocení celkového přežití byla jako událost hodnocena smrt.
Výsledky
Ve skupině sourozeneckých transplantací přihojilo štěp 27/28 pacientů (1x časná smrt před přihojením). Medián engrafmentu granulocytů byl D+19 po transplantaci (rozmezí 13–28), trombocytů D+20 (rozmezí 10–42). Trvalého kompletního chimerismu (CC) dosáhlo 17/25 vyšetřovaných dětí s průměrnou dobou do jeho dosažení 2 měsíce (rozmezí 1–18 měsíců), 4 děti dosáhly CC pouze přechodně, 4 děti CC nikdy nedosáhly – žijí se stabilním smíšeným chimerismem (MC) s podílem autologní krvetvorby mezi 10–18 %, bez známek onemocnění. Ve skupině transplantací od alternativních dárců přihojili štěp všichni pacienti (10/10). Medián engrafmentu granulocytů byl D+18 (rozmezí 15–25), trombocytů D+22 (rozmezí 14–44). Trvalého CC bylo dosaženo u 9/10 dětí (90 %) v rozmezí 8–35 dnů po transplantaci (medián 21 dnů), u 1 dítěte CC trval přechodně do 7. měsíce (dále přetrvává smíšený chimerismus s podílem autologní krvetvorby do 7 %). Časná sekundární rejekce štěpu ve sledované skupině byla zaznamenána u 1 dítěte (10 %), kdy akutní odhojení štěpu nastalo D+26. Dítě bylo retransplantováno štěpem od stejného dárce za 1 měsíc od rejekce s dobrým přihojením.
GVHD v souladu s předpoklady dominovala ve skupině alternativních dárců. Mezi sourozeneckými transplantacemi se aGVHD (grade II–IV) rozvinula v 11 % případů, cGVHD celkově v 11 % s tím, že extenzivní forma přetrvávala u 7 % (n = 2) hodnotitelných pacientů. V případě alternativních dárců aGVHD (grade II–IV) představovala peritransplatační komplikaci u 60 % dětí, cGVHD (vždy extensivní) se rozvinula u 3/9 hodnotitelných dětí, což činí 33 %.
Výsledky jsou udávány s mediánem sledování žijících pacientů 9,8 let (rozmezí 3,3–20,3).
Příčiny selhání léčby, komplikace, celkové přežití
Ve skupině pacientů transplantovaných od sourozeneckých dárců zemřela jedna pacientka ještě před přihojením štěpu z důvodu multiorgánového selhání v důsledku diseminované invazivní mykózy (Zygomycetes). Další pacient zemřel tragicky 5,5 let po úspěšné transplantaci. U jedné pacientky byla 8 měsíců od transplantace diagnostikována počínající rejekce štěpu s recidivou cytopenie. 5letý EFS této skupiny je 92,7 ± 5 % a 5letý OS 96 ± 3,5 %. Mezi pacienty transplantovanými štěpy od alternativních dárců (tab. 1.) zemřel jeden pacient (č. 6) v souvislosti s těžkou aGVHD (grade IV) 47 dnů po retransplantaci po předchozím časném selhání štěpu. Druhý pacient (č. 10) zemřel 145 dnů po transplantaci z důvodu progredující extenzivní cGVHD a opakovaných reaktivací CMV. 5letý OS této skupiny přestavuje 80 ± 12,6 %. U pacientky č. 3 se 14 měsíců od transplantace vyvinula sekundární malignita v centrálním nervovém systému (periferní T-nehodginský lymfom, T-NHL). Vyšetření prokázalo dárcovský původ maligního klonu, přítomnost EBV v maligních buňkách byla vyloučena. Pacientka byla léčena vysokodávkovanou chemoterapií a zářením na centrální nervový systém s dosažením kompletní remise lymfomu, která trvá. U pacientky č. 1 byla provedena 15 let po léčbě strumektomie s nálezem ložiska papilárního karcinomu, s negativním výsledkem vyšetření regionálních lymfatických uzlin (dále je pouze dispenzarizována). 5letý EFS skupiny představuje 70 ± 14,5 %. V rámci celé skupiny transplantovaných dětí dosahujeme velmi dobrých výsledků – 5letý OS je 92 ± 4,3 % (CI 95 %).
Graf 1. Celkové přežití (OS) a přežití do události (EFS) v celé sledované skupině s udanými hodnotami v 5 letech 
Diskuse
HLA typizace pacienta a rodinná HLA studie jsou standardní součástí vyšetřovacího postupu při stanovení diagnózy získané AA, s průměrnou pravděpodobností existence HLA identického sourozence 20–30 % (v námi posuzované skupině 31 %). Ve skupině dětských pacientů, vzhledem k věku a ve většině případů nízké komorbiditě, získala primárně provedená MSD SCT v co nejkratší době od diagnózy své dominantní postavení (12,13). První sourozenecké transplantace byly provedeny po přípravě režimy založenými pouze na vysokodávkovaném cyklofosfamidu (Cy) a byly spojeny s vysokým rizikem rejekce štěpu – 18–30 % (14, 15). Ve skupině našich pacientů byl tento režim použit pouze u 3 dětí. V prvním případě jsme zaznamenali dobré a stabilní přihojení, druhá pacientka zemřela ještě před přihojením a třetí pacientka 8 měsíců po úspěšné transplantaci prodělala relaps AA (lze také hodnotit jako pozdní rejekci štěpu) a po imunosupresivní léčbě kombinací ATG+CsA rekonstituovala částečně i dárcovskou krvetvorbu. Sledováním chimerismu zachovává stacionárně významné procento autologní krvetvorby (až 27 %), ale při normálních počtech krvinek. Intenzifikace přípravného režimu s cyklofosfamidem přidáním ATG přispěla k významnému snížení rejekce štěpu (4 %) a dosažení OS 88 % (16). Přípravný režim Cy/ALG byl v průběhu sledované periody aplikován u 24 dětí a pro velmi dobré výsledky (EFS 100 % a OS 100 % v 5 letech) se stal standardním režimem pro transplantaci od sourozeneckých dárců. Umožnil dosažení úspěšného přihojení ve 100 % a v 68 % také kompletního chimerismu i přes svůj nemyeloablativní charakter. Nižší zastoupení aGVHD i extenzivní cGVHD (12 %; 8 % respektive) ve srovnání s jinými obdobnými studiemi (Champlin et al. 11 %; 32 % respektive; Kahl et al. 24 %; 26 % respektive) (15, 16) jsou nejspíše důsledkem malého počtu pacientů v námi sledované skupině dětí a také věkem pacientů (většina udávaných studií hodnotí věkově širší skupiny). Dle EBMT/CIBMTR studie existuje i u mladších pacientů (≤ 20 let věku) transplantovaných štěpem od identického sourozence vyšší relativní riziko rozvoje cGVHD při užití periferních kmenových buněk ve srovnání s kostní dření (17). Při převážném užití kostní dřeně (86 %) v naší skupině jsme cGVHD pozorovali u 3 pacientů (11 %), extensivní formu pouze u 2 pacientů – obě děti byly transplantovány s použitím periferních kmenových buněk. V době sledování se ukazuje i efekt nízké toxicity tohoto režimu, pokud jde o zachování fertility. K datu posledního sledování se 4 pacienti a 3 pacientky stali přirozeným způsobem rodiči celkem 12 zdravých potomků. Mezi pozdními následky v této skupině pacientů jsme nejčastěji pozorovali hypertenzi (20 % pacientů), z ostatních pak hypothyreózu (11 %), jednou bilaterální osteonekrózu hlavic obou femorů. Další sledovaná onemocnění nejsou nejspíše pozdními následky transplantace, ale dokladují zvýšené riziko jiných autoimunitních onemocnění v této skupině pacientů (1 pacientka podstoupila strumektomii pro thyreotoxikózu, u 1 pacientky se po těhotenství rozvinul diabetes mellitus s nutností aplikace inzulinu, jedna pacientka je sledovaná pro jednostrannou těžkou angiopatii retiny nejasné etiologie) (18). Jeden pacient je dispenzarizován pro Castlemanovu chorobu.
Základním předpokladem úspěchu transplantací od sourozeneckých dárců v léčbě získané AA je správné stanovení diagnózy, včasná indikace a provedení transplantace v co nejkratší době. Interval mezi stanovením diagnózy a transplantací s mediánem 30 dnů (a provedením transplantace u všech dětí primárně indikovaných k SCT do 100 dnů) ve sledované skupině pacientů reflektuje velmi dobrou spolupráci se všemi centry PSDH referujícími tyto děti k léčbě.
Alogenní transplantace s využitím štěpů od alternativních dárců – unrelated donor (UR) či jiný rodinný dárce, tedy mismatched related donor (mMRD) – je terapií druhé volby u pacientů, kteří odpověděli nedostatečně na primární imunosupresivní léčbu či u pacientů s recidivou AA po předchozí úspěšné léčbě. Indikace k transplantaci je dána stupněm odpovědi (event. délkou trvání remise), klinickým stavem pacienta, předchozími komplikacemi a zejména dostupností vhodného dárce. V průběhu hodnoceného časového období došlo vedle jednoznačného zlepšení podpůrné péče či HLA testování také k vývoji přípravných režimů (se snahou o omezení toxicity) a tendenci k časnějšímu zařazení transplantace do terapeutického plánu (12, 13). Při non-response je nyní SCT zvažována již po jednom neúspěšném cyklu IST hodnoceném 120 až 180 dní od zahájení léčby. To je i v současné době více aktuální při nedostupnosti koňského ATG (Lymphoglobuline, ALG).
Pro významně vyšší riziko rejekce štěpu byly dlouho užívány myeloablativní režimy zahrnující vyšší dávky celotělového záření v kombinaci s cyklofosfamidem (19–21). Především s ohledem na toxicitu těchto režimů zvlášť v dětském věku (poruchy růstu, endokrinní dysfunkce, katarakta, plicní toxicita, sekundární malignity, neplodnost) bylo v letech 1995–2005 postupnou snahou snížení dávky či plná eliminace TBI při zachování stabilního engrafmentu. Zkušenosti u mladších pacientů (20, 22, 23) prokázaly, že snížení dávek TBI je dobře možné i při neúplné shodě HLA, většinou v kombinaci s vyššími dávkami cyklofosfamidu (120 versus 200 mg/kg) a ATG. Význam podání ATG u nepříbuzenských transplantací je dán snížením rizika selhání štěpu i rizika rozvoje akutní a chronické GVHD. Zkušenost našeho centra je v souladu s obecným vývojem. Do roku 2004 obsahoval přípravný režim TBI ve vyšší dávce (10–14,4 Gy), vždy v kombinaci s Cy (120 mg/kg) a ATG. Toto umožnilo dobré přihojení granulocytů o mediánu 18 dnů a dosažení kompletního chimerismu ve 100 %. Od roku 2005 jsme snížili dávku TBI (6,0 Gy) při navýšení dávky Cy a nadále udrželi dobré výsledky u 3 transplantovaných pacientů, tedy 100% přihojení a jen v jednom případě rozvoj smíšeného chimerismu (do 10 % autologní krvetvorby). Mezi pozdní následky léčby pozorované mezi dlouhodobě přežívajícími pacienty naší skupiny patří: hypergonadotropní hypogonadismus u 5/8 pacientů, pubertas praecox u jedné pacientky, deficit růstového hormonu u 2/8 pacientů, hypothyreóza u 4/8 pacientů, osteonekróza obou hlavic femoru u jedné pacientky, bilaterální katarakta u 2/8 pacientů a hypertenze u 1 pacienta. U dvou pacientek se vyvinula sekundární malignita: T-NHL CNS (14 měsíců od transplantace), papilární karcinom štítnice (15 let od transplantace). Velkou část těchto obtíží lze jistě spojit s celotělovým ozářením.
Trend k dalšímu užití přípravných režimů s redukovanou intenzitou založených na fludarabinu bez TBI (event. s jeho nízkou dávkou do 2 Gy) ve skupině dospělých a také u dětí reflektuje snahu o omezení bezprostřední toxicity i pozdních následků (24, 25, 26). Kombinace fludarabinu, cyklofosfamidu a ATG je dostatečně imunosupresivní a umožňuje dosažení dobrého přihojení s tím, že rejekce štěpu je ve skupině mladých pacientů do 15 let nízká (5 %) (24). Naše jediná zkušenost s redukovaným režimem (Cy+fludarabin, zachovávající navíc TBI 2,0 Gy) byla v hodnocené skupině u pacienta s relapsem vSAA a neshodou HLA ve dvou alelách (B, Cw). Po časné rejekci štěpu (D+26) byl pacient retransplantován po plné myeloablativní přípravě štěpem od stejného dárce s dobrým přihojením, ale zemřel 1,5 měsíce po druhé transplantaci pro těžkou aGVHD. Časnou rejekci štěpu u tohoto pacienta dáváme do souvislosti především s významnou předléčeností a HLA neshodou. Od roku 2008 jsme u všech 4 následujících pacientů transplantovaných od nepříbuzného dárce použili režimy s redukovanou toxicitou bez TBI s velmi dobrými výsledky – ve 3 případech použití štěpu od shodného dárce byla podána kombinace fludarabin+cyklofosfamid, u dosud jediné pacientky transplantované štěpem od neshodného dárce pak vyhovovala kombinace fludarabin+thiotepa+treosulfan. U všech pacientů jsme dokumentovali dobré přihojení.
Akutní i chronická GVHD představuje i v naší skupině pacientů transplantovaných od alternativních dárců významnou komplikaci potransplantačního průběhu (aGVHD se manifestovala u 60 % pacientů, cGVHD u 33 %). Ve 2 případech byla GVHD příčinou či významně přispěla k úmrtí pacienta, přičemž v obou případech šlo o alelickou neshodu (tab. 1). Vedle spekulací o vlivu věku dárce a příjemce, specifikaci typu HLA neshody (27), časování podání ATG v rámci „conditioningu“ (22) či existenci protilátek proti ATG, zůstává k dalšímu řešení otázka, zda jiné agens použité v prevenci GVHD (např. alemtuzumab) může skutečně vést ke snížení výskytu GVHD a současně nezvýší riziko selhání štěpu či infekčních komplikací (25, 28). K snížení výskytu závažné GVHD může přispívat i volba méně intenzivního předtransplantačního režimu (ve studii EBMT-SAA byl u režimu s fludarabinem, cyklofosfamidem a ATG dokumentován výskyt aGVHD v 11 % a cGVHD ve 27 %) (24).
HLA shoda je významným predikčním faktorem u alogenních transplantací. Ve skupině našich nepříbuzenských plně HLA shodných transplantací (HLA shoda 9–10/10) jsou dosažené výsledky (5letý OS 100 %) srovnatelné s transplantacemi sourozeneckými (5letý OS 96,4 3,5 %; p = 0,44). Toto je obdobné s publikovanými studiemi u mladých pacientů (do věku 17–21 let) (22, 27), které vedou k diskusím, zdali by při existenci takovýchto dárců neměla být transplantace u této věkové kategorie zvažována jako „frontline“ terapie i za cenu mírného zdržení v zahájení léčby (a tím snížení potenciálního rizika neúspěchu transplantace u těchto pacientů, pokud by byla zařazena až po selhání předchozí IST) (8). V současnosti při pokračující závislosti na transfuzích krevních derivátů 120 dní od začátku IST indikujeme pacienta k SCT, je-li nalezen HLA identický nepříbuzný dárce.
Závěr
Získaná aplastická anémie patří k vzácným, ale život ohrožujícím onemocněním v dětském věku. I naše zkušenost ukazuje, že alogenní transplantace provedená v jasně definované indikaci na zkušeném pracovišti má svou nezastupitelnou úlohu v léčbě tohoto onemocnění. Výborné výsledky ve skupině sourozeneckých transplantací potvrzují význam spolupráce jednotlivých center specializujících se na léčbu hematologických onemocnění. Ve skupině ostatních transplantací je základem nalezení vhodného dárce, trendem je omezení toxicity přípravných režimů při zachování účinné imunosuprese a snaha o snížení morbidity spojené s GVHD. V případě shodných alternativních dárců jsou dosahované výsledky srovnatelné s transplantacemi sourozeneckými.
Poděkování
Dosahování příznivých výsledků by nebylo možné bez velmi úzké a flexibilní spolupráce všech center v rámci Pracovní skupiny pro dětskou hematologii (PSDH) – Brno (prof. MUDr. J. Štěrba, MUDr. J. Blatný, prof. MUDr. H. Hrstková), České Budějovice (MUDr. Y. Jabali, MUDr. P. Timr), Hradec Králové (MUDr. J. Hak, MUDr. K. Toušovská), Olomouc (prof. MUDr. V. Mihál, doc. MUDr. D. Pospíšilová), Ostrava (MUDr. B. Blažek, MUDr. H. Ptoszková), Plzeň (MUDr. Z. Černá), Ústí nad Labem (MUDr. D. Procházková). Dále je na místě poděkování všem, kteří se na bezprostřední péči o pacienty podíleli a podílejí při každodenní práci v rámci dříve Hematologického oddělení II. dětské kliniky a nyní Kliniky dětské hematologie a onkologie FN v Motole.
Významná byla spolupráce s pracovníky NRL pro DNA diagnostiku ÚHKT (RNDr. M. Loudová, CSc., RNDr. M. Dobrovolná – HLA analýza, RNDr. Z. Sieglová, PhD., Mgr. H. Čechová – vyšetření buněčného chimerismu) a s pracovníky Českého registru dárců krvetvorných buněk (MUDr. E. Ivašková, CSc., Ing. L. Kupková, Mgr. M. Kuříková) a Českého národního registru dárců dřeně (MUDr. H. Pittrová a MUDr. J. Navrátilová).
Podpora: Podpořeno výzkumným záměrem MZ0FNM 2005
autorka
MUDr. Ester Pindurová
Klinika dětské hematologie a onkologie
2. LF UK a FN v Motole
V Úvalu 84, 150 06, Praha
Korespondence
Prof. MUDr. Petr Sedláček, CSc.
Klinika dětské hematologie a onkologie
2. LF UK a FN v Motole
V Úvalu 84, 150 06, Praha
petr.sedlacek@lfmotol.cuni.cz
Doručeno do redakce: 2. 6. 2011
Přijato po recenzi: 8. 6. 2011
Zdroje
1. Davies JK, Guinan EC. An update on the management of severe idiopathic aplastic anaemia in children. Br J Haematol 2007; 136 : 549-564.
2. Young NS, Calado RT, Scheinberg P. Current concepts in the pathophysiology and treatment of aplastic anemia. Blood 2006; 108 : 2509-2519.
3. Scheinberg P, Cooper JN, Sloand EM. Association of telomerase length of peripheral blood leukocytes with hematopoietic relapse, malignant transformation, and survival in severe aplastic anemia. JAMA 2010; 304 : 1358-1364.
4. Hrodek O, Hyniová H, Chudomel V. Dřeňové útlumy u dětí. Čs Pediatrie 1982; 37 (10): 562-570.
5. Starý J, Sedláček P, Kobylka P, et al. Významný pokrok v léčbě získané aplastické anémie u dětí v 90. letech. Čs Pediatrie 1998; 53 (5): 260-266.
6. Kojima S, Horine K, Inaba J, et al. Long term outcome of acquired aplastic anaemia in children: comparison between immunosuppressive therapy and bone marrow transplantation. Br J Haematol 2000; 111 : 321-328.
7. Frickhofen N, Heimpel H, Kaltwasser JP, Schrezenmeier H. Antithymocyte globulin with or without cyclosporin A: 11-year follow-up of a randomized trial comparing treatments of aplastic anemia. Blood 2003; 101 : 1236-1242.
8. Armand P, Antin JH. Allogeneic stem cell transplantation for aplastic anemia. Biol Blood Marrow Transplant 2007; 13 : 505-516.
9. Koza V, Cetkovský P, Faber E, et al. Indikace k alogenním a autologní transplantacím krvetvorných buněk. Doporučení ČHS ČLS JEP a ČOS ČLS JEP. Transfuze Hematol dnes 2006, 4 : 223-231.
10. Glucksberg H, Storb R, Fefer A, et al. Clinical manifestations of graft-versus-host disease in human recipients of marrow from HLA matched sibling donors. Transplantation 1974; 18 : 295-304.
11. Hofman MA, Vogelsang GB. Chronic graft versus host disease. Br J Haematol 2004; 125 : 435-454.
12. Marsh JC, Ball SE, Cavenagh J, et al. Guidelines for the diagnosis and management of aplastic anaemia. Br J Haematol 2009; 147 : 43-70.
13. Pulsipher MA, Young NS, Tolar J, et al. Optimization of therapy for severe aplastic anemia based on clinical, biologic and treatment response parameters: Conclusion of an International Working Group on Severe Aplasti Anemia convened by the Blood and Marrow Transplant Clinical Network, March 2010. Biol Blood Marrow Transplant 2011; 17 : 291-299.
14. Storb R, Longton G, Anasetti C, et al. Changing trends in marrow transplantation for aplastic anemia. Bone Marrow Transplant 1992; 10 : 45-52.
15. Champlin RE, Perez WS, Passweg JR, et al. Bone marrow transplantation for severe aplastic anemia: a randomized controlled study of conditioning regimens. Blood 2007; 109 : 4582-4585.
16. Kahl Ch, Leisenring W, Deek HJ, et al. Cyclophosphamide and antithymocyte globulin as a conditioning regiment for allogeneic marrow transplantation in patients with aplastic anaemia: a long term follow up. Br J Haematol 2005; 130 : 747-751.
17. Schrezeinmeier H, Passweg JR, Marsh JC, et al. Worse outcome and more chronic GVHD vith peripheral blood progenitor cells than bone marrow in HLA-matched sibling donor transplants for young patients with severe acquired aplastic anemia. Blood 2007; 110 : 1397-1400.
18. Stalder MP, Rovó A, Halter J, et al. Aplastic anemia and concomitant autoimmune diseases. Ann Hematol 2009; 88(7): 659-656.
19. Kojima S, Inaba J, Yoshimi A, et al. Unrelated donor marrow transplantation in children with severe aplastic anaemia using cyclophosphamide, anti-thymocyte globulin and total body irradiation. Br J Haematol 2001; 114 : 706-711.
20. Kojima S, Matsuyama T, Kato S, et al. Outcome of 154 patients with severe aplastic anemia who received transplants from unrelated donors: the Japan Marrow Donor Program. Blood 2002; 100 : 799-803
21. Kim SY, Lee JW, Lim J, et al. Unrelated donor Bone marrow transplantants for severe aplastic anemia with conditioning using total body irradiation and cyclophosphamide. Biol Blood Marrow Transplant 2007; 13 : 863-870.
22. Deeg HJ, OęDonnell M, Tolar J, et al. Optimization of conditioning for marrow transplantation from unrelated donors for patients with aplastic anemia after failure of immunosuppressive therapy. Blood 2006; 108 : 1485-1491.
23. Inagaki J, Nagatoshi Y, Kawano Y, et al. Bone marrow transplantation in children with severe aplastic anemia using a conditioning regiment containing 3 Gy of total body irradiation, cyclophosphamide with or without antithymocyte globulin. Pediatr Transplant 2007; 11 : 180-186.
24. Bacigalupo A, Locatelli F, Lanino E, et al. Fludarabine, cyclophosphamide and anti-thymocyte globulin for alternative donor transplants in acquired severe aplastic anemia: a report from EBMT-SAA Working party. Bone Marrow Transplant 2005; 36 : 947-950.
25. Gupta V, Ball SE, Sage D, et al. Marrow tranplantants from matched unrelated donors for aplastic anaemia using alemtuzab, fludarabine and cyclophosphamide based conditioning. Bone Marrow Transplant 2005; 35 : 467-471.
26. Kang HJ, Shin HY, Choi HS, et al. Fludarabine, cyclophosphamide plus thymoglobulin conditioning regiment for unrelated bone marrow transplantation in severe aplastic anaemia. Bone Marrow Transplant 2004; 34 : 939-943.
27. Maury S, Balere-Appert ML, Chir Z, et al. Unrelated stem cell transplantation for severe acquired aplastic anemia: improved outcome in the era of high resolution HLA matching between donor and recipient. Haematologica 2007; 92 : 589-596.
28. Siegal D, Xu W, Sutherland R, et al. Graft-versus-host disease following marrow transplantation for aplastic anaemia: different impact of two GVHD prevention strategies. Bone Marrow Transplant 2008; 42 : 51-56.
Štítky
Hematológia Interné lekárstvo Onkológia
Článek Transformace folikulárního lymfomu – výjimka nebo pravidlo? Přehledný článek a vlastní výsledkyČlánek Symptomatický myeloidný sarkóm uteru v čase diagnózy akútnej myeloblastovej leukémie – kazuistikaČlánek Oznámení o nové knize
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2011 Číslo 3- Nejasný stín na plicích – kazuistika
- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Léčebná studie Relapsed AML 2001/01, 02 pro děti s relapsem akutní myeloidní leukemie nebo primárně rezistentní nemocí zlepšila jejich naději na vyléčení
- Who is fit for allogeneic transplantation? (PERSPECTIVES)
- Úloha alogenní transplantace buněk krvetvorby v léčbě získané aplastické anémie u dětí – zkušenost v České republice v letech 1991–2007
- A randomized controlled study in patients with newly diagnosed severe aplastic anemia receiving antithymocyte globulin (ATG), cyclosporine, with or without G-CSF: a study of the SAA Working Party of the European Group for Blood and Marrow Transplantation
- Nežádoucí reakce při odběru hemopoetických kmenových buněk u nepříbuzných dárců – desetiletá zkušenost Českého národního registru dárců dřeně (ČNRDD)
- Transformace folikulárního lymfomu – výjimka nebo pravidlo? Přehledný článek a vlastní výsledky
- Symptomatický myeloidný sarkóm uteru v čase diagnózy akútnej myeloblastovej leukémie – kazuistika
- Hematopoietic cell transplantation comorbidity index predicts transplantation outcomes in pediatric patients
- Kazuistika závažné pancytopenie s dominující megaloblastovou anémií malnutriční etiologie
- Oznámení o nové knize
- Incidence of factor VIII inhibitors throughout life in severe hemophilia A in the United Kingdom
- Long-term clinical outcomes of patients with primary chronic immune thrombocytopenia: a Danish population-based cohort study
- Monosomal karyotype in primary myelofibrosis is detrimental to both overall and leukemia-free survival
- New insights into childhood autoimmune hemolytic anemia: a French national observational study of 265 children
- A randomized, double-blind study of romiplostim to determine its safety and efficacy in children with immune thrombocytopenia
- Významná data z historie československé a české hematologie
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Nežádoucí reakce při odběru hemopoetických kmenových buněk u nepříbuzných dárců – desetiletá zkušenost Českého národního registru dárců dřeně (ČNRDD)
- Kazuistika závažné pancytopenie s dominující megaloblastovou anémií malnutriční etiologie
- Transformace folikulárního lymfomu – výjimka nebo pravidlo? Přehledný článek a vlastní výsledky
- Významná data z historie československé a české hematologie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



