-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Retrospektívna analýza krátkodobých a strednodobých výsledkov perkutánnej endovaskulárnej liečby pacientov s aneuryzmou abdominálnej aorty
Retrospective analysis of short-term and mid-term results of percutaneous endovascular repair in patients with abdominal aortic aneurysm
Introduction:
Endovascular abdominal aortic aneurysm repair (EVAR) is a modern and, compared to conventional open surgery, less invasive therapeutic strategy with short-term lower morbidity and mortality. The aim of our retrospective analysis was the assessment of safety, technical success, short-term and mid-term results of elective patients scheduled for total percutaneous EVAR implantation (PEVAR).Material and methods:
One hundred and sixteen consecutive patients (M:F 104 : 12, age 71±9 years, maximum AAA diameter 60±14mm) underwent elective PEVAR between January 2009 and August 2012. All the patients were treated under local anaesthesia by total percutaneous approach via femoral access. The immediate technical success of stentgraft implantation as well as the presence of 30-day and 1-year complications and the need of reintervention rate were assessed.Results:
In 115/116 patients (99.1%),immediate technical success of the procedure was recorded, with no need of conversion to open surgery; in 1 patient (0.9%) the performance technically failed due to unfavourable arterial anatomy. The mortality in 30–day follow-up was 2.6% (3 patients), during 1-year follow-up it amounted to 8.6% (10 patients), without causal relationship with stentgraft implantation. Overall event-free survival was 85% (98/116) without serious complications (mortality, MI, stroke, reintervention, severe ischemic complication) in the one-year follow-up period.Conclusion:
Endovascular AAA repair is a safe and feasible method with low mortality and acceptable complication rate in patients scheduled for EVAR implantation. Percutaneous approach allows for the extension of indications also for the highest-risk group of polymorbid patients. Technical feasibility and adequate periprocedural management are essential for further reduction in adverse events after PEVAR.Key words:
abdominal aortic aneurysm – endovascular treatment – stentgraft – percutaneous approach
Autoři: M. Tóth 1; J. Maďarič 1; T. Balázs 2; J. Mikuláš 2; D. Hladíková 1; R. Bažík 2; E. Drangová 2; T. Urlandová 1; A. Klepanec 2; I. Vulev 2
Působiště autorů: Oddelenie kardiológie a angiológie, Kardiologická klinika NÚSCH, a. s., Bratislava primár: MUDr. J. Maďarič, PhD., MPH. 1; Oddelenie diagnostickej a intervenčnej rádiológie, NÚSCH, a. s., Bratislava primár: MUDr. I. Vulev, PhD., MPH. 2
Vyšlo v časopise: Rozhl. Chir., 2013, roč. 92, č. 12, s. 715-721.
Kategorie: Původní práce
Souhrn
Úvod:
Endovaskulárna liečba aneuryziem abdominálnej aorty (AAA) je moderný, v porovnaní s konvenčnou otvorenou chirurgickou liečbou menej invazívny terapeutický postup, s krátkodobou nižšou morbiditou a mortalitou. Cieľom retrospektívnej analýzy bolo stanovenie bezpečnosti, technickej úspešnosti, krátkodobých a strednodobých výsledkov u pacientov indikovaných na elektívne plne perkutánne endovaskulárne riešenie aneuryzmy brušnej aorty (PEVAR).Materiál a metodika:
Medzi 1/2009 až 8/2012 absolvovalo 116 pacientov elektívny PEVAR (M:Ž 104 : 12, vek: 71±9 rokov, maximálny AAA diameter 60±14 mm). Všetci pacienti boli riešení v lokálnej anestézie plne perkutánnym prístupom cestou arteria femoralis communis. Hodnotený bol bezprostredný technický úspech implantácie, ako aj výskyt komplikácií a potreba opakovaných intervencií v 30–dňovom a 1–ročnom sledovaní.Výsledky:
U 115/116 pacientov s AAA (99,1 %) sme zaznamenali bezprostredný technický úspech po PEVAR, bez potreby konverzie na otvorený chirurgický prístup, u 1 pacienta (0,9%) bol výkon z technického hľadiska neúspešný pre anatomickú nepriaznivosť artériového riečiska. Mortalita v 30-dňovom sledovaní bola 2,6 % (3 pacienti), počas 1-ročného obdobia 8,6% (10 pacientov), bez príčinnej súvislosti s implantáciou stentgraftu. Prežívanie bez závažných komplikácií (úmrtie, infarkt myokardu, cievna mozgová príhoda, reintervencia, závažná ischemická komplikácia) bolo v ročnom sledovaní 85 % (98/115).Záver:
Endovaskulárna liečba AAA je v súčasnosti hodnotená ako bezpečný, dobre zvládnuteľný výkon spojený s nízkou mortalitou a akceptovateľným výskytom komplikácií u správne indikovaných pacientov. Perkutánny prístup umožňuje rozšírenie indikácií aj pre skupinu najrizikovejších polymorbídnych pacientov. Technická realizovateľnosť a adekvátny periprocedurálny manažment sú nevyhnutné pre ďalšiu redukciu nežiaducich komplikácií po PEVAR.Kľúčové slová:
aneuryzma abdominálnej aorty – endovaksulárna liečba – stentgraft – perkutánny prístupÚvod
Aneuryzma abdominálnej aorty je relatívne časté ochorenie vo vyššom veku, a to predovšetkým v mužskej populácii, spojené s vysokou mortalitou a morbiditou. Väčšina aneuryziem je asymptomatických (75 %) a prejaví sa väčšinou až ruptúrou (RAAA), ktorá je spojená s vysokou celkovou i perioperačnou mortalitou a je významnou príčinou náhleho úmrtia [1,2]. Mortalita RAAA sa pohybuje medzi 65–85 % a asi 50 % pacientov zomrie predoperačne [1,2]. Perioperačná mortalita pre ruptúru sa pohybuje v rozmedzí 30–94%, v kontraste s elektívnymi operáciami s mortalitou 1,1–7 % [2–8]. Cieľom starostlivosti o pacientov s AAA je teda prevencia ruptúry, a to včasnou diagnostikou a elektívnou liečbou.
V roku 1951 Charles Dubost prvý krát realizoval úspešný a dlhodobo účinný chirurgický zákrok pre AAA – resekciu brušnej AAA s použitím homograftu. Od tej doby sa výkony na AAA stali významnou časťou cievne – chirurgických procedúr [9]. S cieľom znížiť perioperačnú mortalitu a morbiditu a rozšíriť indikačné kritériá pre liečbu AAA i na pacientov s vysokým operačným rizikom, u ktorých bola chirurgická liečba sprevádzaná vysokou mortalitou a morbiditou, bola od roku 1991 do klinickej praxe zavedená endovaskulárna liečba aneuryzmy abdominálnej aorty nezávisle na sebe Volodosom a Parodim. V porovnaní s chirurgickou liečbou je endovaskulárna liečba menej invazívna a menej hemodynamicky zaťažujúca [10].
Hlavnou indikáciou k liečbe AAA je hroziaca ruptúra ako najzávažnejšia komplikácia, ktorá neliečená väčšinou končí fatálne [5,6,11]. Za najvýznamnejší prediktívny faktor ruptúry je považovaný maximálny priemer AAA (12) (Tab. 1).
Tab. 1. Zastoupení jednotlivých cystických lézí Tab. 1: Types of cystic lesions presented 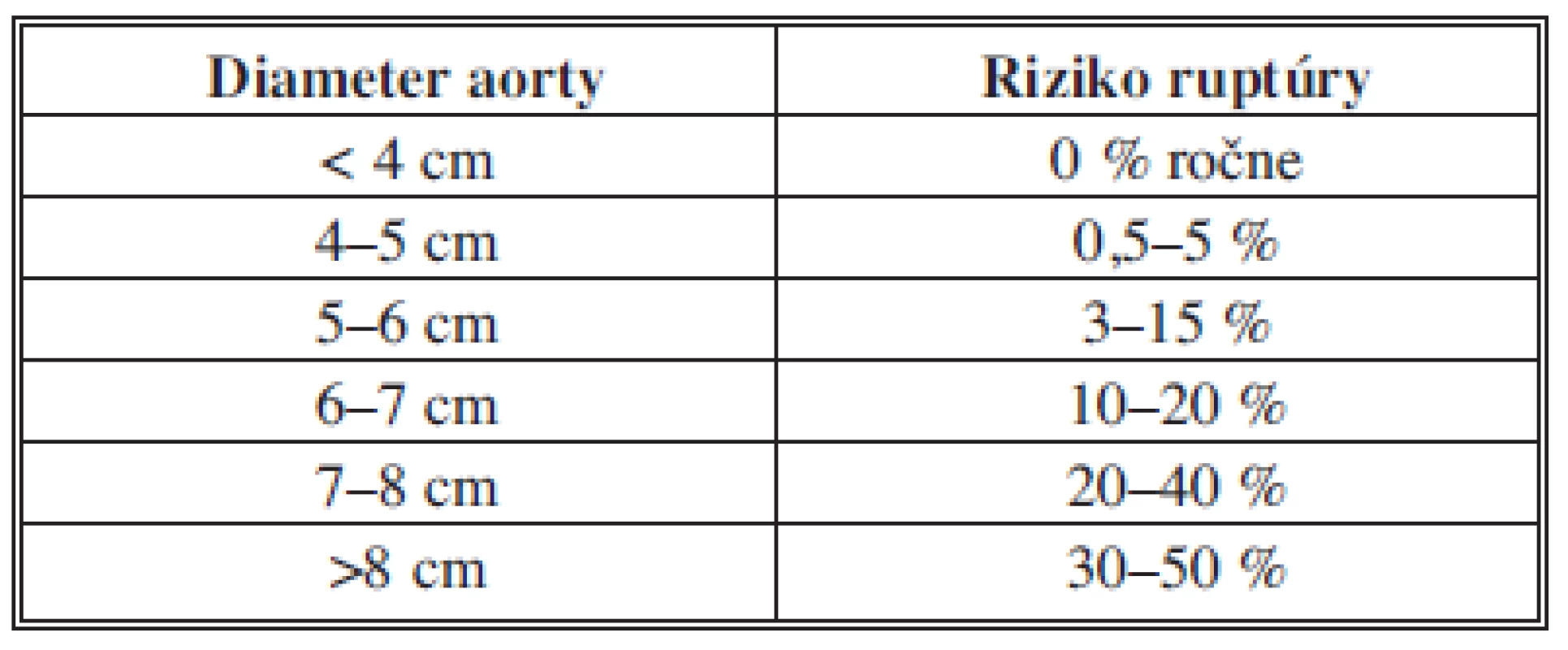
Materiál a metodika
Predmetom retrospektívnej analýzy je 116 za sebou nasledujúcich pacientov hospitalizovaných na Oddelení kardiológie a angiológie Národného ústavu srdcových a cievnych chorôb v Bratislave v období od 1/2009 do 8/2012, u ktorých bol na Oddelení diagnostickej a intervenčnej rádiológie NÚSCH realizovaný elektívny PEVAR. Indikáciou na výkon bol diameter abdominálnej aorty ≥ 5,0 cm, alebo nárast diametra o ≥ 0,5 cm počas 6 mesiacov, alebo prítomnosť penetrujúceho aortálneho ulkusu.
Pacienti boli odoslaní do angiologickej ambulancii vaskulárneho centra s cieľom zváženia realizácie PEVAR, buď vzhľadom k prítomnosti závažných komorbidít, alebo s ohľadom na preferencie pacienta. Poukázaní boli väčšinou z lôžkových pracovísk cievnej chirurgie, zo spádových angiologických ambulancií, zo spádových ambulancií cievnej chirurgie a z gastroenterologických ambulancií. Následného rozhodovacieho procesu o spôsobe liečby sa zúčastňuje angiológ a intervenčný rádiológ, v prípade náročného anatomického nálezu, respektíve výrazne komplikovaného klinického stavu, resp. v prípade zmeny preferencie spôsobu liečby zo strany pacienta, je do diskusie prizývaný cievny chirurg.
Implantácia stentgraftov (Endurant) bola realizovaná v lokálnej anestéze kompletne perkutánnym prístupom, technikou preclose, ktorá využíva na uzatvorenie princíp sutúry pomocou Prostar XL alebo ProGlide uzatváracieho systému (Abbott Vascular, US). Vo všetkých prípadoch išlo o implantáciu bifurkačného stentgraftu.
Analyzované boli demografické údaje pacientov (vek, pohlavie, BMI, komorbidity, rizikové faktory), dáta spojené s intervenčným výkonom (typ výkonu, veľkosť aneuryzmy, použitý typ graftu, primárna konverzia na chirurgický výkon, úspech výkonu, periprocedurálna mortalita a morbidita) a sledovanie po výkone (dĺžka hospitalizácie, výskyt endoleaku, nutnosť sekundárnej konverzie na chirurgickú intervenciu, postprocedurálna mortalita a morbidita). Pacienti boli sledovaní klinicky a pomocou CT angiografie v intervale 30 dní, 6 mesiacov, 1 rok po výkone. Ako závažné komplikácie boli hodnotené mortalita, infarkt myokardu, cievna mozgová príhoda, potreba reintervencie, resp. závažná ischemická komplikácia spojená s PEVAR.
Anatomické indikácie endovaskulárnej liečby AAA
Morfológia aneuryzmy a iliakálneho riečiska bola hodnotená na základe CT angiografického zobrazenia (Toshiba Aquilion ONE) a merania vybraných parametrov subrenálnej aorty a výduťou iliakálneho riečiska (Obr. 1). Hodnotí sa proximálny krčok, uhol medzim pozdĺžnou osou proximálneho krčka a pozdĺžnou osou aneuryzmy, vak výdute, oblasť bifurkácie, distálny krčok a šírenie na iliakálne tepny. Najvýznamnejšími parametrami, ktoré ovplyvňujú možnosť endovaskulárnej liečby z technického hľadiska sú dĺžka proximálneho krčka a angulácia subrenálnej aorty. Ďalšími všeobecnými morfologickými kritériami sú nekonický proximálny krčok bez kalcifikácií a nástenného trombu, iliakálne tepny bez výrazného vinutia alebo stenóz (aspoň jednostranne), priemer vonkajších iliakálnych tepien viac ako 8 mm alebo 6–8 mm u tepien bez kalcifikácií.
Obr. 1. Schéma spôsobu merania vybraných parametrov infrarenálnej aorty s výduťou a iliakálneho riečiska A,B: D1 – priemer aorty (proximálneho krčka aneuryzmy) tesne pod odstupom distálne uloženej renálnej tepny, D2 – priemer aorty (proximálneho krčka aneuryzmy) tesne nad aneuryzmou, D3 – priemer aneuryzmy, D4 – priemer aorty (distálneho krčka, pokiaľ je prítomný) pod aneuryzmou, D5 – priemer „zdravého úseku“ AIC (arteria iliaca communis) pod aneuryzmou vpravo, D6 – priemer „zdravého úseku“ AIC pod aneuryzmou vľavo, D7 – priemer AIE (arteria iliaca externa) vpravo, D8 – priemer AIE vľavo, L1 – dĺžka proximálneho krčka aneuryzmy, L2 – dĺžka výdute, L3 – dĺžka distálneho krčka aneuryzmy (pokiaľ je prítomný), L4 – celková dĺžka subrenálnej aorty, L5 – dĺžka aneuryzmy postihnutého úseku AIC vpravo, L6 – dĺžka aneuryzmy postihnutého úseku AIC vľavo, L7 – dĺžka AIC vpravo, L8 – dĺžka AIC vľavo. C: uhol medzi pozdĺžnou osou proximálneho krčka a pozdĺžnou osou aneuryzmy. Fig. 1: Diagram of the measurement method for selected parameters of infrarenal aortic aneurysm and iliac arteries A,B: D1 – aortic diameter (proximal aneurysm neck) just below the origin of distally located renal artery, D2 – aortic diameter (proximal aneurysm neck) just above the aneurysm, D3 – diameter of the aneurysm, D4 – aortic diameter (distal neck, if present) below the aneurysm, D5 – diameter of the “healthy segment” of AIC (common iliac artery) under the aneurysm on the right side, D6 – diameter of the “healthy segment” of AIC below the aneurysm on the left side, D7 – diameter of AIE (external iliac artery) on the right, D8 – diameter of AIE on the left, L1 – the length of the proximal neck of the aneurysm, L2 – the length of the aneurysm, L3 – the length of the distal neck of the aneurysm (if present), L4 – the total length of the infrarenal aorta, L5 – the length of the affected segment of the right AIC, L6 – the length of the affected segment of the left AIC, L7 – the length of the right AIC, L8 – the length of the left AIC. C: the angle between the longitudinal axis of the proximal neck and the longitudinal axis of the aneurysm. 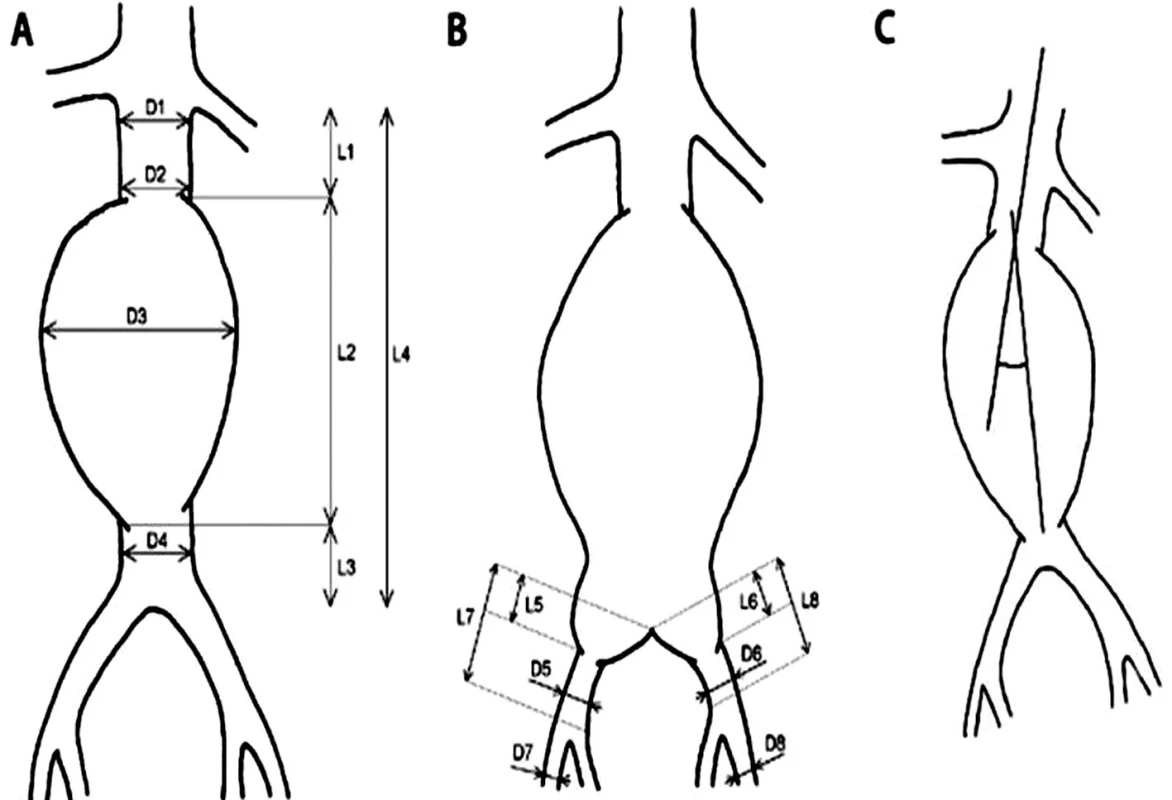
Štatistické metódy
Všetky kontinuálne premenné sú prezentované ako priemer ± SD. Normálne rozdelenie súboru bolo testované Kolmogorovým-Smirnovovým testom. Na porovnanie hodnôt sme použili t-test pre kontinuálne údaje, resp. Mann-Whitneyov test. Pre všetky analýzy sme hodnotu p<0,05 považovali za štatisticky významnú.
VÝSLEDKY
Endovaskulárny výkon pre AAA sme realizovali u 116 pacientov. Základné demografické a anatomické charakteristiky pacientov sú uvedené v Tab. 2. Rizikové faktory a komorbidity pacientov sú uvedené v Tab. 3. Z komorbidít bol prítomný vysoký výskyt artériovej hypertenzie (93 %) a dyslipidémie (85 %), z rizikových faktorov, podobne ako v iných štúdiách, fajčenie (88 %).
Tab. 2. Základné charakteristiky pacientov Tab. 2: Baseline characteristics of patients 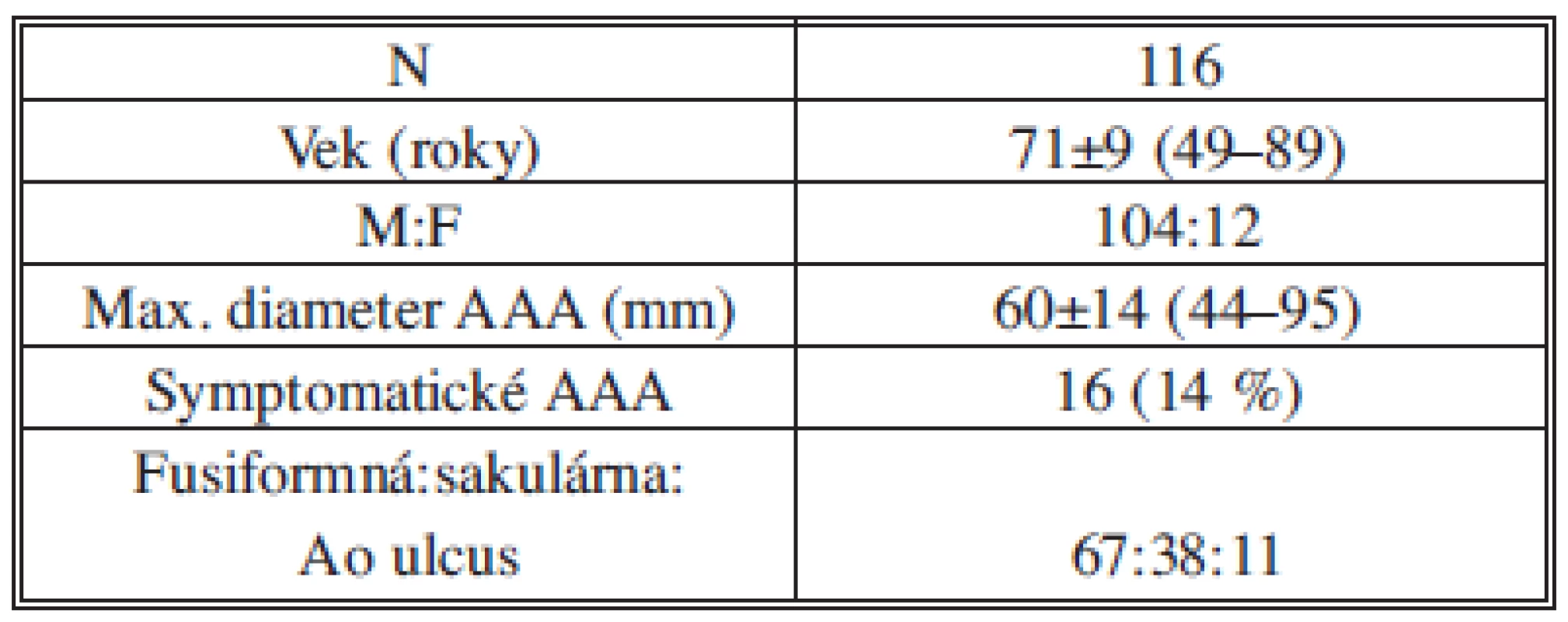
Vysvětlivky: AAA – aneuryzma abdominálnej aorty; Ao – aortálny. Tab. 3. Rizikové faktory a komorbidity pacientov Tab. 3: Risk factors and patients co-morbidities 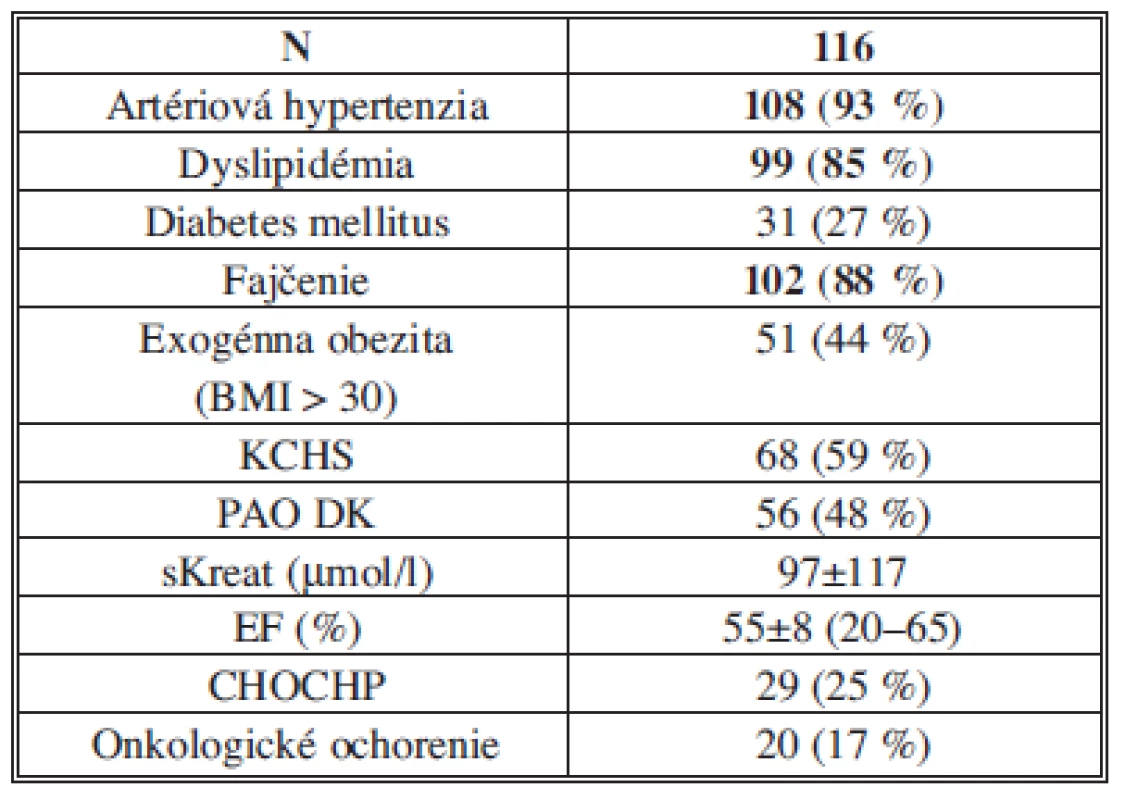
Vysvětlivky: BMI – body mass index; CHOCHP – chronická obštrukčná choroba pľúc; EF – ejekčná frakcia, KCHS – koronárna choroba srdca; PAO DK – periférne artériové ochorenie dolných končatín. Priemerná dĺžka hospitalizácie pacientov po PEVAR bola 7,5±4 dňa (celkové rozmedzie 2–30 dní). U 115 pacientov (99,1 %) sme zaznamenali bezprostredný technický úspech výkonu – stentgraft bol úspešne implantovaný. Len u 1 pacienta (0,9 %) bola pri endovaskulárnom výkone nemožná implantácia stentgraftu – technický neúspech – pre anatomickú nepriaznivosť artériového riečiska. V jednom prípade pre nedostatočný perkutánny uzáver v postintervenčnom období arteria femoralis communis a pretrvávajúcimi prejavmi krvácania bol potrebný chirurgický spôsob uzáveru. V priebehu hospitalizácie sme nezaznamenali úmrtie, infarkt myokardu (IM), ani cievnu mozgovú príhodu (CMP). Závažná anémia s potrebou hemosubstitúcie sa vyskytla u 12 pacientov (10 %). U jedného pacienta sa v priebehu 12 hodín od implantácie rozvinulo akútne prerenálne zlyhanie v dôsledku prekrytia odstupov renálnych artérií telom stentgraftu s potrebou prechodnej dialýzy a neskoršej chirurgickej revízie – splenorenálny bypass. U jedného z pacientov sa postupne v priebehu 48 hodín rozvinuli príznaky akútnej intestinálnej ischémie riešenej operačne. Febrility ≥ 38°C sme postupne postprocedurálne zaznamenali u 49 pacientov (42 %), priemerný vzostup CRP po výkone bol 166±92 mg/l.
Najčastejšou komplikáciou bol výskyt pseudoaneuryzmy (PSA) v oblasti punkčného miesta - arteria femoralis communis (29 PSA/232 punkcií – 13 %). V 6 prípadoch (21 %) došlo k uzáveru konzervatívne – lokálnou kompresiou, v 20 prípadoch (69 %) sa dosiahol uzáver intrakavitárnou perkutánnou aplikáciou trombínu, v 3 prípadoch (10 %) bola nutná pre ošetrenie chirurgická revízia.
V 30–dňovom postintervenčnom období došlo k úmrtiu troch pacientov (2,6 %), bez priameho vzťahu s endovaskulárnym výkonom – 1krát v dôsledku akútnej pankreatitídy, 1krát v dôsledku komplikácií po operácii adenoCa sigmy (PEVAR realizovaný prednostne pred plánovanou laparotómiou a operáciou adenoCa sigmy hrubého čreva v celkovej anestéze podľa odporúčania chirurga), 1krát pre CMP (v spádovom zdravotníckom zariadení s 3 – týždňovým odstupom po implantácii stentgraftu). V 30 – dňovom období u pacientov nebol prítomný IM, CMP sa vyskytla u jedného pacienta (0,9 %).
Potreba reintervencie bola nutná u 6 pacientov (5,2 %) – v dôsledku akútnej končatinovej ischémie u troch pacientov (2,6 %) pre trombózu ramena stentgraftu, jedenkrát (0,9 %) pre akútnu stenózu truncus coeliacus (TC) a arteria mesenterica superior (AMS) a dvakrát (1,8 %) pre závažný endoleak (typ II a III). Ostiálne stenózy TC a AMS vzniknuté v dôsledku dislokácie hrubých aterosklerotických plátov počas implantácie tela stentgraftu alebo jeho dodilatácie, boli riešené stentingom. Akútne trombózy ramena stentgraftu boli riešené reolytickou farmako-mechanickou trombektómiou systémom AngioJet s prípadným následným ošetrením demaskovanej stenózy graftu pomocou stentu. Endoleak bol celkovo zaznamenaný v 16 prípadoch (13,8 %), prevažne s postupnou úpravou konzervatívnym spôsobom. V jednom prípade bol endoleak II. typu riešený superselektívnou embolizáciou vaku cestou AMS cez arkádu do a.mesenterica inferior a následne onyxom do vaku. U jedného pacienta s endoleakom III. typu bola realizovaná extenzia stentgraftu pre ruptúru pôvodnej protézy v jej zalomení.
Mortalita v ročnom sledovaní bola 8,6 % (10 pacientov), pričom žiadna príčina úmrtia nebola v súvislosti s ruptúrou implantovaného stentgraftu pre AAA. Infarkt myokardu ako závažná komplikácia sa nevyskytla u žiadneho pacienta, náhla cievna mozgová príhoda u 1 pacienta (0,9 %), nutnosť reintervencie v oblasti implantácie stentgraftu bola celkovo nutná počas celého obdobia u 7 pacientov (6 %). Po 1 roku sledovania celkové prežívanie bez výskytu závažných komplikácií (event-free survival) bolo prítomné u 98 pacientov (85 %) (Graf 1).
Graf 1. Ročné prežívanie pacientov po PEVAR bez závažných komplikácií Graph 1: One-year event-free survival after PEVAR 
DISKUSIA
Aneuryzma abdominálnej aorty (AAA) patrí medzi časté príčiny úmrtia mužov vo veku >60 rokov (v USA je trinástou najčastejšou príčinou v tejto skupine) a trpí ňou približne 5–7 % populácie staršej ako 60 rokov. Podľa literárnych údajov až 75 % pacientov s aneuryzmou abdominálnej aorty je bez klinickej symptomatológie, pričom jej ruptúra býva nezriedka prvým klinickým prejavom (mortalita až 85 %) [10,12]. Prognóza pacientov s ruptúrou AAA v porovnaní s pacientmi elektívne operovanými je mimoriadne nepriaznivá. Preto sa v súčasnosti kladie dôraz hlavne na vyhľadávanie pacientov s AAA, ich dispenzarizáciu v prípade malých aneuryziem, elektívne operačné alebo endovaskulárne riešenie aneuryziem nad 5–5,5 cm a urgentnú diagnostiku a liečbu v prípade ruptúry AAA za účelom záchrany životov.
Endovaskulárna liečba získala výraznú popularitu a význam v kardiovaskulárnej komunite. Vložením endograftu do lumenu aneuryzmy EVAR vyraďuje krv z prietoku cez aneuryzmu, dôsledkom čoho minimalizuje jej riziko ruptúry. Komplikáciami spojenými s endovaskulárnou liečbou AAA sú endoleak, končatinová ischémia, dislokacia stentgraftu s možným prekrytím viscerálnych tepien, disekcia respektíve perforácia prístupových artérií, arteriálna pseudoaneruyzma v mieste punkcie [13,14].
Endoleak po EVAR
Endoleak je prítomnosť stáleho toku krvi do vaku aneuryzmy po umiestnení stentgraftu. Rozlišujeme I.–V. typ endoleaku (Tab. 4), incidencia po výkone sa udáva 15–45 %. Približne polovica endoleakov sa uzatvára spontánne v prvých 12 mesiacoch. Po 1 roku zaznamenávame prítomnosť endoleaku približne v 10 % prípadov [4,15]. Na našom pracovisku bolo prítomných po výkone 16 endoleakov (13,8 %), z toho klinicky závažné jedenkrát II. typ a jedenkrát III. typ s nutnosťou endovaskulárne úspešnej reintervencie.
Tab. 4. Klasifikácia endoleaku podľa príčiny a miesta vzniku Tab. 4: Endoleak classification according to etiology and origin 
Akútna končatinová ischémia po EVAR
Akútna končatinová ischémia (ALI – acute limb ischemia) po EVAR sa vyskytuje ako príčina oklúzie, embolizácie alebo trombózy vetvy stentgraftu. U našich sledovaných pacientov sa vyskytla v období do 30–dní po výkone u troch pacientov (2,6 %) s nutnosťou primárnej endovaskulárnej reintervencie. V ročnom sledovaní sa ALI vyskytla u jedného pacienta (0,8%) s nutnosťou sekundárnej endovaskulárnej reintervencie.
Nutnou súčasťou manažmentu pacienta s AAA riešeného endovaskulárnou cestou je antiagregačná terapia, ktorú t.č. predstavujú prevažne blokátory tromboxánovej cesty – inhibítory cyklooxygenázy – kyselina acetylosalicylová (ASA) a blokátory ADP receptorov – thienopyridíny (ticlopidin, clopidogrel) [16]. K dlhodobej antiagregačnej monoterapii prechádzame po 1–mesačnej duálnej antiagregačnej liečbe (ktorej predĺženie zvažujeme u rizikových pacientov).
Pseudoaneuryzma arteria femoralis communis po EVAR
Najčastejšou komplikáciou po PEVAR bol výskyt katetrizačnej pseudoaneuryzmy (PSA) arteria femoralis communis (29 PSA/232 punkcií, 13 %). V terapeutickom procese bol uzáver najčastejšie dosiahnutý intrakavitárnou perkutánou aplikáciou trombínu – 20 prípadov (69 %), v 6 prípadoch (21 %) dosiahnutý konzervatívne, v 3 prípadoch (10 %) pre uzáver prítomnej pseudoaneuryzmy bolo potrebné chirurgické riešenie. Ako sme už v minulosti referovali, rizikový faktor vzniku PSA je antikoagulačná liečba. Naše výsledky poukazujú na vzťah medzi antikoagulačnou liečbou a vznikom iatrogénnej postkatetrizačnej femorálnej pseudoaneuryzmy ako frekventnej komplikácie pri použití 14–24 F inštrumentária. V jednej s predchádzajúcich prác s použitím 5–10 F inštrumentária bol výskyt rekurencie PSA po jej uzávere perkutánnou injekciou trombínu vyšší u pacientov s kombináciou antikoagulačnej a antiagregačnej liečby, samotná antikoagulačná liečba nebola nezávislým rizikovým faktorom výskytu PSA [17]. Keďže pri PEVAR ide o širšie inštrumentárium, možno predpokladať väčší vplyv antikoagulačnej liečby na lokálne komplikácie v mieste artériovej punkcie.
Postimplantačný syndróm
U 49 pacientov sa v krátkom období po výkone objavili febrility, leukocytóza, výrazné zvýšenie C – reaktívneho proteínu. Hemokultúry u týchto pacientov boli negatívne a spontánne došlo k normalizácii laboratórnych parametrov a k vymiznutiu febrilít v rozmedzí 3–5 dní po liečbe. Tieto príznaky sme hodnotili ako prejavy postimplantačného syndrómu, teda celkovej reaktívnej odpovede na zavedený cudzí materiál do krvného riečiska.
Systémová zápalová odpoveď známa ako postimplantačný syndróm (PIS), je obyčajne prechodná počas včasného pooperačného obdobia a je charakterizovaná zvýšenou telesnou teplotou, leukocytózou, poruchou koagulácie a vzostupom zápalových markerov v sére pacienta [18–22]. Viaceré štúdie s touto problematikou boli realizované. Gabriel a kolektív [23,24] hodnotili zápalovú reakciu po EVAR a dokázali eleváciu IL–6 u všetkých pacientov s vyvrcholením hladín po 24–hodinách a spustením rozvoja telesnej teploty o 24–hodín neskôr. Arnaoutoglou [24,25] a kolektív informovali o 35 % výskyte postimplantačného syndrómu po EVAR zloženého z pretrvávajúcou pyrexiou napriek antibiotickej liečbe, negatívnym výsledkom hemokultúry, leukocytózou alebo poruchou koagulácie. Pacienti s PIS boli charakterizovaní výrazne vyššími hodnotami zápalových parametrov, vrátane C – reaktívnym proteínom a IL–6, v porovnaní s non–PIS skupinou. PIS skupina bola spojená s dlhšou dobou hospitalizácie.
Celkovo 10 pacientov v tejto štúdii exitovalo počas jedného roka. S výnimkou 1 pacienta (adenoCa hrubého čreva s mts do pľúc) boli všetci pacienti v období intervencie vo veku ≥70 rokov. U tohto typu pacientov bolo prítomné vysoké riziko komplikácií – kardiovaskulárne, neurologické, onkologické – v príčinnej súvislosti so smrťou počas sledovaného obdobia. Nebola zaznamenaná prítomnosť výskytu úmrtia súvisiaca s aneuryzmou aorty, alebo priamou komplikáciou implantácie stentgraftu. Prežívanie bez výskytu závažných komplikácií v 1–ročnom sledovaní bolo 85 %, čo je porovnateľné s inými štúdiami [26]. V našom súbore, ako aj v iných štúdiách sa závažné komplikácie po EVAR vyskytovali častejšie u starších obéznych pacientov s viacerými závažnými komorbiditami, resp. u osôb ženského pohlavia.
Bezprostredné pooperačné výhody menej invazívnej procedúry, ktorou je EVAR, sú dobre dokumentované v prospektívnych klinických štúdiách nielen pre chirurgicky rizikových pacientov [27,28]. Výhody zahŕňajú redukciu morbidity, nižšie straty krvi, nižšiu nutnosť transfúzií, nižšiu potrebu intenzívnej starostlivosti, kratšiu dobu hospitalizácie, rýchlejšie zotavenie, rýchlejší návrat do bežného života. Endovaskulárny postup je naopak spojený s možnými komplikáciami typu endoleakov, či potreby opakovaného intervenčného riešenia, ktoré sa postupne redukujú s rýchlym technickým vývojom v tejto oblasti vaskulárnej medicíny. S EVAR riešením je spojená aj potreba pravidelného CT sledovania týchto pacientov. Tu takisto s postupným vývojom metodiky sa po prvom roku dôsledného CT sledovania prechádza v prípade priaznivého stavu na menej zaťažujúce ultrazvukové vyšetrenie. Otázka dĺžky životnosti brušných stentgraftov a EVAR procedúry bude zodpovedaná až dlhodobejším sledovaním, ktoré má už otvorené chirurgické riešenie za sebou, netreba však zabúdať, že v prípade AAA ide o liečbu starších a vo väčšine prípadov polymorbídnych pacientov.
Odporúčania
Endovaskulárna liečba AAA (EVAR – Endovascular Abdominal Aortic Repair) je dnes štandartnou liečebnou metódou, predovšetkým u pacientov so stredným a zvýšeným rizikom operačného chirurgického výkonu (29). Podľa odporúčaní amerických odborných spoločností American College of Cardiology Foundation/American Heart Association (ACCF/AHA) je endovaskulárny spôsob riešenia infrarenálnej AAA, alebo aneuryziem spoločnej iliackej tepny, zaradený rovnako ako otvorený operačný postup do indikačnej triedy I, úroveň dôkazov A [30–32].
Ako potvrdzujú výsledky klinických randomizovaných štúdií (EVAR–1, DREAM, OVER), endovaskulárna liečba AAA v porovnaní s chirurgickou terapiou ponúka predovšetkým výhody z hľadiska redukcie výskytu nežiaducich účinkov v pooperačnom období a 30–dňovej mortalite [33]. Na základe metaanalýz realizovaných randomizovaných klinických štúdií je operačná mortalita v skupine chirurgickej liečby 4,7 % versus 1,6 % v skupine endovaskulárne riešených AAA [34].
Záver
Perkutánna endovaskulárna liečba pacientov s AAA predstavuje efektívny, minimálne invazívny výkon a je spojená s nízkym rizikom mortality a akceptovateľným výskytom komplikácií. EVAR je dnes štandardnou liečebnou metódou a alternatívou otvorenému operačnému riešeniu s nižšou krátkodobou mortalitou a porovnateľnou dlhodobou mortalitou. Kompletne perkutánny prístup je vhodným spôsobom liečby väčšiny pacientov s AAA a otvára tak potenciálne možnosti použitia tejto metódy u väčšieho počtu prevažne stredne a vysoko rizikových pacientov spĺňajúcich indikačné kritériá. Dlhodobý prínos endovaskulárnych metodík liečby pacientov s AAA, vrátane plne perkutánnych, prinesú ďalšie väčšie štúdie.
MUDr. Juraj Maďarič, PhD., MPH.
Oddelenie kardiológie a angiológie,
Kardiologická klinika, NÚSCH, a.s.
Pod Krásnou hôrkou 1
833 48 Bratislava
e-mail: madaricjuraj@gmail.com
Zdroje
1. Thomson MM. Controlling the expansion of abdominal aortic aneurysms. Br J Surg 2003;90 : 897–898.
2. Scott RA, Asthon HA, Kay DN. Abdominal aortic aneurysm in 4237 screened patients: prevalence, development and management over 6 years. Br J Surg 1991;78 : 1122–1125.
3. Ashon HA, Buxton MJ, Day NE, et al. The Multicentre Aneurysm Screening Study (MASS) into effect of abdominal aortic aneurysm screening on mortality in men: a randomised controlled trial. Lancet 2002;360 : 1531–1539.
4. Berridge DC, Chamberlain J, Guy AJ, et al. Prospective audit of abdominal aortic aneurysm surgery in the northern region from 1988 to 1992. Northern Vascular Surgeons Group. Br J Surg 1995;82 : 906–910.
5. Brady AR, Fowkes FG, Greemhalgh RM, et al. Risk factors for postoperative deaths following elective surgical repair of abdominal aortic aneurysm: results from UK Small Aneurysm Trial. Br J Surg 2000;87 : 742–749.
6. Darling Rc, Cordero JA, Chang BB, et al. Advanced in the surgical repair of ruptured abdominal aortic aneurysms. Cardiovasc Surg 1996;4 : 720–723.
7. Feinglass J, Couper D, Dunlop D, et al. Late survival risk factors for abdominal aortic aneurysm repair: experience from fourteen Department of Veterans Affair hospitals. Surgery 1995;118 : 16–24.
8. Choksy S, Wilmink A, Quick C. Ruptured abdominal aortic aneurysms in Huntingdon district: a 10 – year experience. Br J Surg 1997;84(Suppl 1):44.
9. Vařejka P, Linhart A. www.sanguis.cz/articles/files/62_Aneurysma_brisni_aorty.pdf
10. Köcher M, Utíkal P. Endovaskulární léčba aneuryzmat břišní aorty. In: Krajina A, Peregrín JH: Intervenční radiologie. Olga Čermáková, Hradec Králové 2005 : 281–294.
11. Kniemeyer HW, Kessler T, Reber PV, et al. Treatment of ruptured abdominal aortic aneurysm, a permanent challenge or a waste of resources? Prediction of outcome using a multiple – organ – dysfunction score. Eur J Vasc Endovasc Surg 2000 : 190–196.
12. Brown LC, Powel JT. Risk factors for aneurysm rupture in patients kept under ultrasound surveillance. UK Small Aneurysm Trial Participants. Ann Surg 1999;230 : 289–296
13. Parodi JC, Barone A, Piraino R, et al. Endovascular treatment of abdominal aortic aneurysms: Lessons learned. J Endovasc Surg 1997;4 : 102–110.
14. Allen RC, Zarins CK, Fogarty TJ. The Medtronic – AneuRx medular bifurcated graft. In Yao JST, Pearce WH, eds. Techniques in Vascular and Endovascular Surgery. Stamford, Conticut, Appleton and Lange 1998 : 401–409.
15. van Marrewijk C, Buth J, Harris PL, et al. Significance of endoleaks after endovascular repair of abdominal aortic aneurysms: The EUROSTAR experience. J Vasc Surg 2002;35 : 461–473.
16. Patrono C, Bachmann F, Baigent C, et al. Antiplatelet agents - Expert Consensus Document on the Use of Antiplatelets Agent. European Heart Journal 2004;25 : 166–181.
17. Madaric J, Mistrik A, Vulev I, et al. The recurrence of iatrogenic femoral artery pseudoaneurysm afterocclusion by ultrasound guided percutaneous thrombin injection. Eurointervention 2009;5 : 443–447.
18. Storck M, Scharrer–Pamler R, Kapfer X, et al. Does a postimplantation syndrome following endovascular treatment of aortic aneurysm exist? Vasc Surg 2001;35 : 23–29.
19. Zimmer S, Heiss MM, Schardey HM, et al. Inflammatory syndrome after endovascular implantation of an aortic stent – a comparative study. Langenbecks Arch Chir Suppl Kongessbd 1998;115 : 13–17.
20. Burger T, Heucke A, Halloul Z, et al. Interleukin pattern, procalcitonin level and cellular immune status after endovascular aneurysm surgery. Zentralbl Chir 2000;125 : 15–21.
21. Boyle JR, Goodall S, Thompson JP, et al. Endovascular AAA repair attenuates the inflammatory and renal responses associated with coventional surgery. J Endovasc Ther 2000;7 : 359–371.
22. Velázquez OC, Carpenter JP, Baum RA, et al. Perigraft air, fever, and leukocytosis after endovascular repair of abdominal aortic aneurysms. Am J Surg 1999;178 : 185–189.
23. Gabriel EA, Locali RF, Romano CC, et al. Analysis of the inflammatory response in endovascular treatment of aortic aneurysms. Eur J Cardiothorac Surg 2007;31 : 406–413.
24. Konstantinos G, Moulakakis MD, et al. The impact of endograft type on inflammatory response after endovascular treatment of abdominal aortic aneurysm. J Vasc Surg 2013;668–677.
25. Arnaoutoglou E, Kouvelos G, Milionis H, et al. Post – implantation syndrome following endovascular abdominal aortic aneurysm repair: preliminary data. Interact Cardiovasc Thorac Surg 2011;12 : 609–614.
26. Schermehorn M, OęMalley A, Jhaveri A, et al. Endovascular versus open repair of abdominal aortic aneurysms in the medicare population. N Engl J Med 2008;358 : 464–474.
27. Zarins CK, White RA, Schwarten DE, et al. AneuRx stent graft versus open surgical repair of abdomainal aortic aneurysms: multicenter prospective clinical trial. J Vasc Surg 1999;29 : 292–305.
28. Matsuramura JS, Bremster DC, Makaroun MS, et al. A multicenter controlled clinical trial of open verus endovascular treatment of abdominal aortic aneurysm. J Vasc Surg 2003;37 : 262–271.
29. Giles KA, Pomposseli F, Hamdan A, et al. Decrease in total aneurysm – related deaths in the era of endovasculart aneurysm repair. J Vasc Surg 2009;49 : 543–550.
30. Rocke TW, Hirsch AT, Misra S, et al. Society for Cardiovascular Angiography and Interventions; Society of Interventional Radiology; Society for Vascular Medicine; Society for Vascular Surgery. 2011 ACCC/AHA Focused Update of the Guideline for the management of Patients With Peripheral Arthery Disease (updating the 2005 guideline): a report of the Americane College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2011;58 : 2020–2045.
31. Greenhalgh RM, Brown LC, Powell JT, et al. Endovascular versus open repair of abdominal aortic aneurysm. N Eng J Med 2010;362 : 1863–1871.
32. De Bruin JL, Baas AF, Buth J, et al. Long – term outcome of open or endovascular repair of abdominal aortic aneurysm. N Eng J Med 2010;362 : 1881–1889.
33. Greenhalgh RM, Brown LC, Kwong GP, et al. EVAR trial participants. Comparison of endovascular aneurysm repair with open repair in patients with abdominal aortic aneurysm (EVAR trial 1), 30 – days operative mortality results: Randomised controlled trial. Lancet 2004;364 : 843–848.
34. Becquemin JP, Allaire E, Desgranges P, et al. Delayed complications following EVAR. Tech Vasc Interv Radiol 2005;8 : 30–40.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2013 Číslo 12- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Pozitivní sentinelová uzlina u karcinomu prsu – kdy a proč doplňovat axilární disekci?
- Je celkové přežití objektivním kritériem kvality chirurgické léčby kolorektálního karcinomu?
- K 80. narozeninám prim. MUDr. Vojtecha Blaška
- Opakované plicní resekce v chirurgii plicních metastáz
- Miniinvazivní videoasistovaná paratyreoidektomie (MIVAP) v terapii primární hyperparatyreózy (pHPT)
- Zvýšení kvality histopatologického hodnocení preparátů kolorektálního karcinomu prostřednictvím zavedení standardního protokolu
- Zemřel primář MUDr. Jiří Hamous
- Je přesná předoperační diagnostika cystických lézí pankreatu možná?
- K životnímu jubileu docenta Vladimíra Visokaie
- Retrospektívna analýza krátkodobých a strednodobých výsledkov perkutánnej endovaskulárnej liečby pacientov s aneuryzmou abdominálnej aorty
- Zdvojení žlučníku a duktus cystikus jako raritní nález při cholecystektomii – kazuistika
- Epiteliální cysta intrapankreaticky uložené akcesorní sleziny – kazuistika
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Pozitivní sentinelová uzlina u karcinomu prsu – kdy a proč doplňovat axilární disekci?
- Epiteliální cysta intrapankreaticky uložené akcesorní sleziny – kazuistika
- Miniinvazivní videoasistovaná paratyreoidektomie (MIVAP) v terapii primární hyperparatyreózy (pHPT)
- Zdvojení žlučníku a duktus cystikus jako raritní nález při cholecystektomii – kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



