-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Endoskopická léčba časného karcinomu žaludku
Autoři: O. Urban
Působiště autorů: Centrum péče o zažívací trakt Vítkovická nemocnice, a. s. Ostrava a Lékařská fakulta Ostravské University, primář: MUDr. O. Urban, Ph. D.
Vyšlo v časopise: Rozhl. Chir., 2012, roč. 91, č. 8, s. 442-445.
Kategorie: Postgraduální vzdělávání
Zlepšení diagnostiky časného karcinomu žaludku (EGC) otevřelo cestu k endoskopické terapii. Filozofie endoskopické léčby vychází z úvahy, že pokud je vyloučeno riziko metastazování do lymfatických uzlin (nebo je velmi nízké) a endoskopickou cestou lze dosáhnout kompletního odstranění tumoru (R0 resekce), je zbytečné nemocného vystavovat daleko vyšším rizikům chirurgického výkonu. Jinými slovy, endoskopická resekce EGC je indikována v případech, kdy léze je přístupná „en bloc“ resekci a riziko metastazování do spádových lymfatických uzlin je nižší než letalita spojená s klasickou operací. Zatímco pravděpodobnost nádorové diseminace dokážeme relativně přesně určit, riziko chirurgického výkonu zůstává variabilní v závislosti na věku, komorbiditách, rozsahu výkonu a v neposlední řadě i na kvalitě a zkušenostech chirurgického týmu. Většina autorů považuje za přijatelné riziko do 2–4 %. Stejně jako v chirurgii platí i v případě endoskopické léčby zásada, že neléčíme nemoc (karcinom), ale nemocného. Riziko lymfatického metastázování je závislé na hloubce nádorové invaze, morfologickém a histologickém typu nádoru. Zjednodušeně lze konstatovat, že pokud se jedná o dobře diferencovaný karcinom postihující pouze sliznici (m1–3), je riziko uzlinového postižení i vzdálených metastáz téměř nulové. S hloubkou invaze do submukózy pravděpodobnost uzlinového metastazování roste. Většina autorů proto dnes doporučuje endoskopickou léčbu u karcinomů intramukózních (m1–3) a u nádorů postihujících horní třetinu submukózy (sm 1, tj. 500 μm od lamina muscularis mucosae) [1].
Endoskopická resekce (ER) je terapeutický endoskopický zákrok, při kterém je odstraněna část trávicí trubice obsahující sliznici a přilehlou submukózu. Pokud je řez proveden diatermickou kličkou, hovoříme o endoskopické slizniční resekci (EMR). Pokud je řez submukózou veden diatermickým nožem, jedná se o endoskopickou submukózní disekci (ESD).
Postup ER můžeme rozdělit do následujících kroků:
- Klasifikace a ohraničení léze, posouzení resekability
- Submukózní injekce
- Snesení léze kličkou nebo diatermickým nožem a ošetření spodiny
- Vybavení resekátu
- Fixace na korkové podložce
Endoskopická slizniční resekce (EMR) umožňuje „en block“ snesení povrchových neoplazií žaludku velikosti do 20 mm [2]. Větší léze je možné odstranit EMR po částech technikou „piecemeal“. Tento postup však není v současnosti považován za vhodný, protože neumožňuje přesné histologické zhodnocení resekčních okrajů. Popsán byl také vyšší výskyt lokálních recidiv nádoru. Metoda EMR se většinou provádí v analgosedaci na endoskopické vyšetřovně a trvá řádově několik desítek minut. Techniku lze provést některým z následujících způsobů. Metoda „lift and cut“ – jedná se o historicky první endoskopický způsob léčby EGC [3]. Endoskopista injektorem aplikuje roztok do submukózy pod lézi. Nejčastěji se jedná o fyziologický roztok s adrenalinem v ředění 1 : 10 000. Lze použít také roztok hyaluronátu sodného nebo glycerolu. Pokud se jedná o povrchovou neoplazii bez hlubší invaze do submukózy, dochází v průběhu injektáže k tzv. „liftingu“, tedy vyzdvižení léze na vrchol uměle vytvořeného pseudopolypu. Submukózně aplikovaný roztok vytvoří depo, které oddělí mukózu od vlastní svaloviny žaludku a umožní bezpečné snesení kličkou. Druhou možností je technika „suck and cut“, kdy se na distální konec tubusu gastroskopu připojí průhledný nástavec (tzv. „cap“). Po zavedení přístroje do žaludku je do vodicí drážky na konci nástavce zavedena pracovním kanálem monofilamentózní mukozektomická klička. Po submukózní injekci roztoku je léze nasáta do nástavce, zaškrcena a následně zresekována – Obr. 1. Další možnou technikou je způsob „band and snare“, kdy na distální konec tubusu gastroskopu připojíme průhledný nástavec, na kterém jsou navléknuty gumové kroužky. Uvolnění kroužků je ovládáno otočením speciálního knoflíku připevněného k zevnímu ústí pracovního kanálu. Po nasátí do nástavce je léze podvázána gumovým kroužkem a zresekována kličkou.
Obr. 1. Endoskopická slizniční resekce „suck and cut“: průhledný nástavec s mukozektomickou kličkou v zorném poli 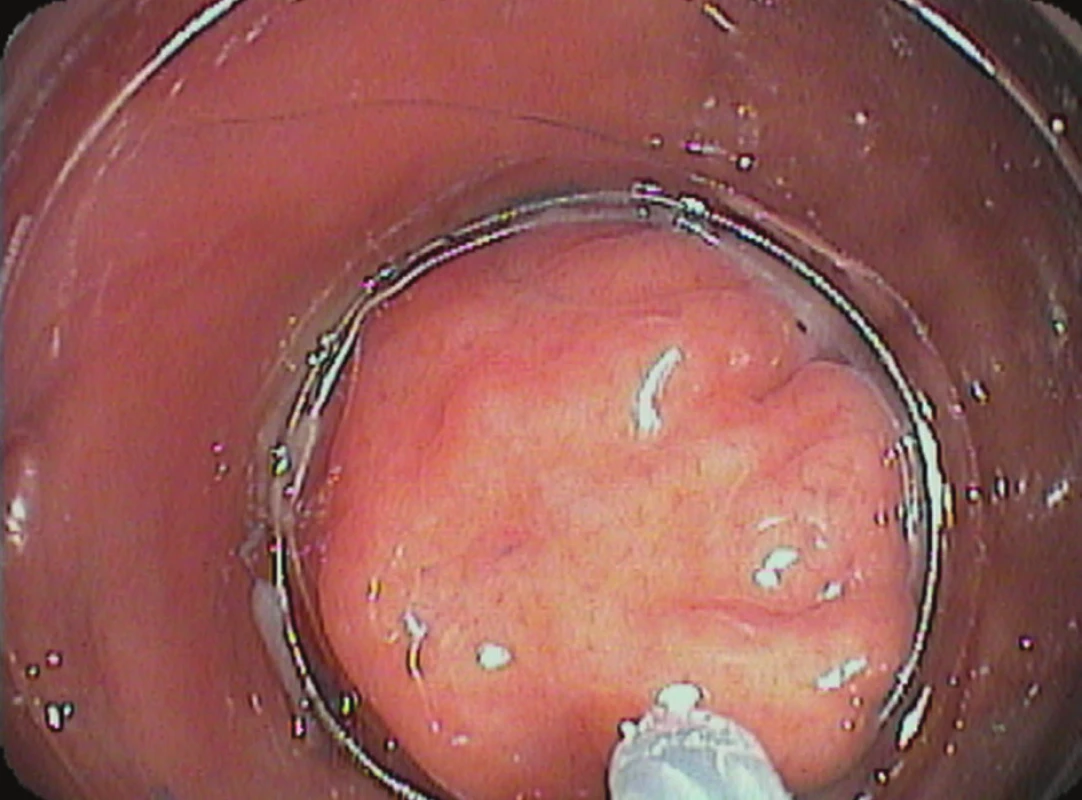
Endoskopická submukózní disekce (ESD) je druhou variantou endoskopické terapie časného karcinomu žaludku. Při ESD je řez veden v submukóze některým ze speciálních diatermických nožů zavedených pracovním kanálem endoskopu. V žaludku se nejčastěji používá tzv. insulated tip (IT) nůž. Jedná se o variantu jehlového diatermického nože, jehož špička je ukončena keramickou kuličkou o průměru 2,2 mm [4]. Kulička fixuje řezací část nože v submukóze a jako izolátor současně brání transmurálnímu šíření koagulačního proudu a perforaci. Výkon je zahájen cirkulární incizí zdravé sliznice ve vzdálenosti 5 mm od okrajů léze. Následuje submukózní disekce. Výhodou ESD je možnost odstranit i poměrně rozsáhlé neoplázie žaludku „en block“ [5]. Nevýhodou je délka výkonu, která může dosahovat až 180 minut, a technická náročnost, která řadí tento výkon k jedněm z nejobtížnějších v terapeutické endoskopii – Obr. 2–4.
Obr. 2. Časný karcinom žaludku typ 0IIc + Is o průměru 25 mm v antru žaludku (Chromodiagnostika indigokarmínem, okraj léze označen koagulačními body.) 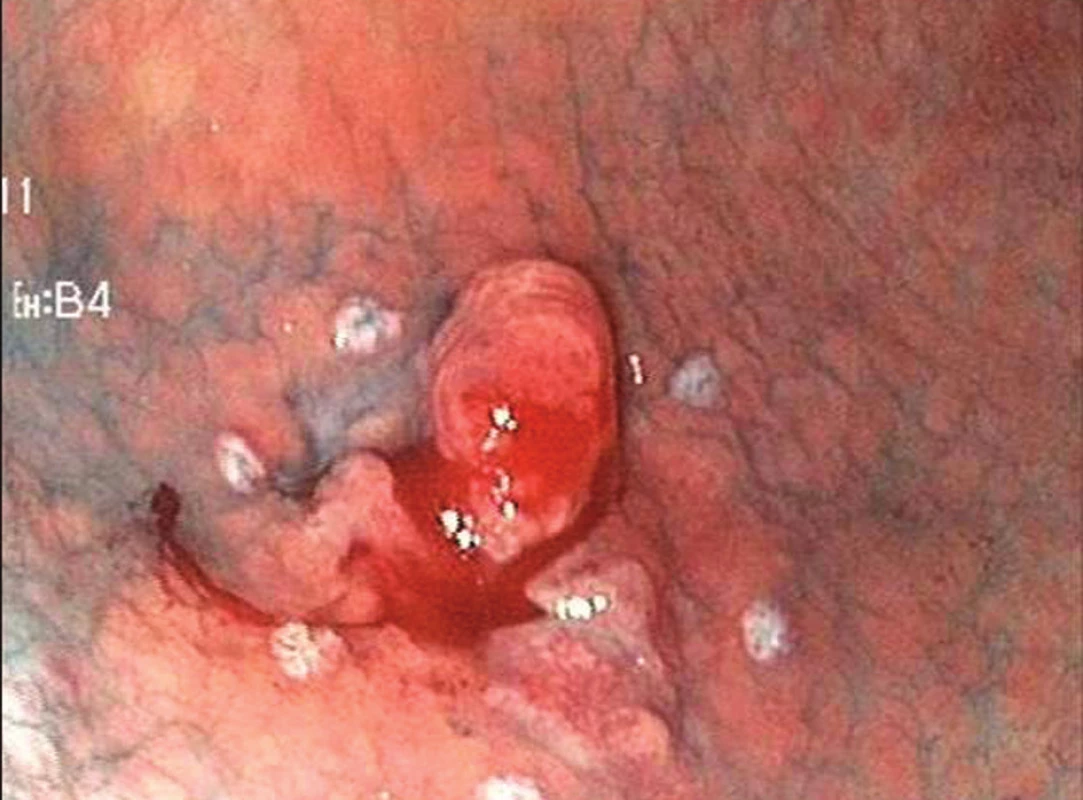
Obr. 3. Endoskopická submukózní disekce: Cirkulární incize 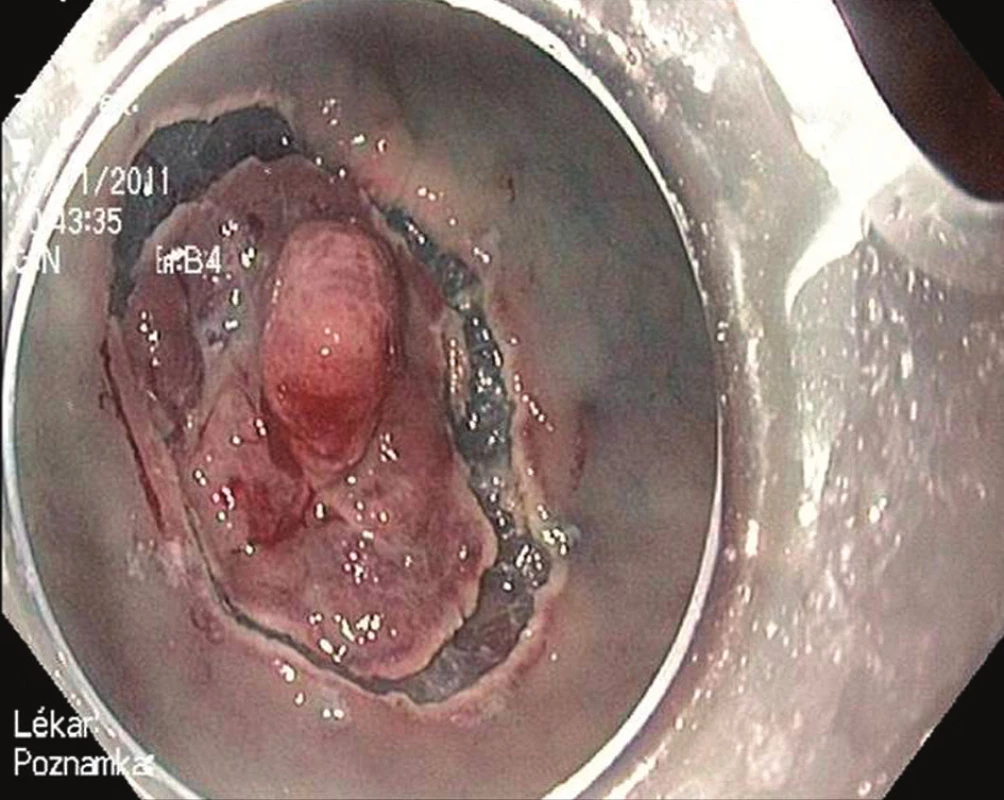
Obr. 4. Endoskopická submukózní disekce: Disekce submukózy 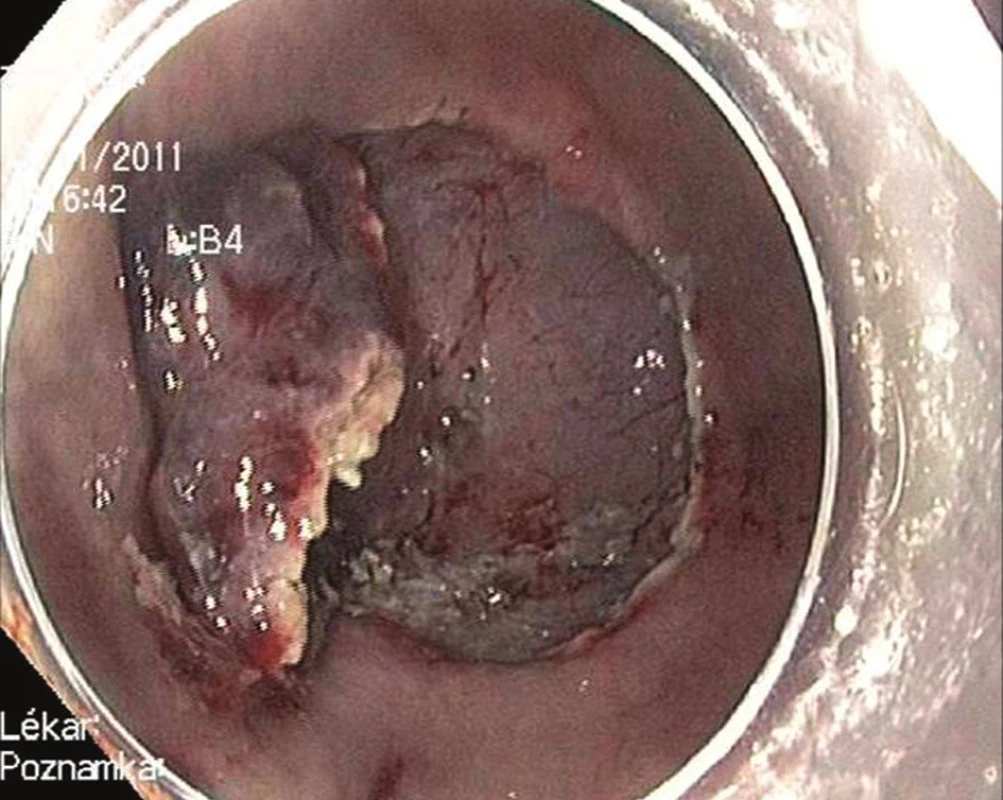
Jako každý výkon má i endoskopická resekce své komplikace. Ty dělíme na obecné a speciální. Podrobný rozbor obecných komplikací endoskopie přesahuje rozsah tohoto sdělení, zde se proto zaměřujeme jen na komplikace specifické pro endoskopickou resekci. Mezi ty patří především krvácení a perforace trávicí trubice. Malé krvácení se vyskytuje u 11,3–15,8 % nemocných, významné krvácení bývá popisováno v rozmezí 0–11,5 %. Krvácení v průběhu výkonu je běžné a je standardně ošetřováno některou z metod endoskopické hemostázy (opich adrenalinem, koagulace nebo aplikace klipů). Výskyt perforací žaludku je popisován u 4–5 % nemocných. Drobnou perforaci lze řešit endoskopicky nasazením klipů s následnou observací za hospitalizace a konzervativní terapií (NG sonda, antibiotika, parenterální výživa). Velké perforace vyžadují chirurgické řešení, stejně tak situace, kdy endoskopická léčba selhává a stav nemocného se zhoršuje. Snížení rizika těchto komplikací lze docílit maximálním dodržováním zásad bezpečné digestivní endoskopie.
Většina nemocných je po výkonu hospitalizována. V den výkonu povolujeme perorální příjem malého množství tekutin. Někteří autoři doporučují kontrolní endoskopii první den po výkonu s cílem ošetřit viditelné pahýly cév na spodině po resekci a předejít tak pozdnímu krvácení. Následující den povolujeme šetřicí stravu. V den operace aplikujeme blokátor protonové pumpy intravenózně, další dny perorálně a pokračujeme až do endoskopické kontroly zhojení, což bývá za 8–12 týdnů. Vždy je nutné vyloučit i infekci H. pylori a v případě pozitivního nálezu provést eradikaci. Důvodem je fakt, že v neléčené populaci byl potvrzen zvýšený výskyt metachronního EGC [6]. Pacienty po kontrole zhojení nadále endoskopicky sledujeme. Metachronní karcinomy se vyskytují s frekvencí 5–10 % a většinou je opět lze léčit endoskopicky.
Zásadní roli hraje u endoskopické resekce histopatologické vyšetření preparátu. Jeho cílem je klasifikovat lézi a posoudit kritéria splnění kompletní (R0) resekce. Pro správné vyšetření resekátu je nezbytná jeho orientace řeznou plochou na podložku a fixace kovovými nebo dřevěnými hroty – Obr. 5. Pro popis resekátu je nejčastěji doporučována revidovaná vídeňská klasifikace [7]. Rozhodující je určení hloubky invaze neoplazie. O R0 resekci hovoříme v případě, kdy jak vertikální, tak horizontální okraj léze jsou prosty nádorové tkáně a nejsou přítomny známky invaze do krevních a lymfatických cév.
Obr. 5. Endoskopická submukózní disekce: Krvácení ze spodiny ošetřeno klipy 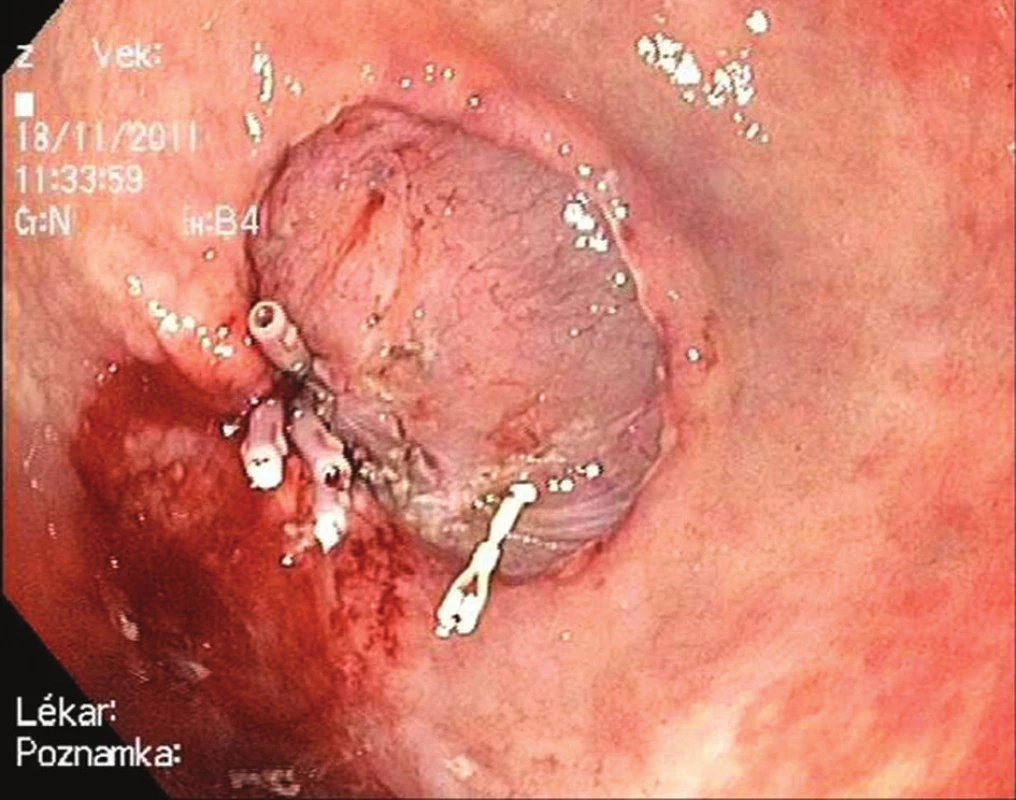
Obr. 6. Resekát rozepjatý na korkové podložce 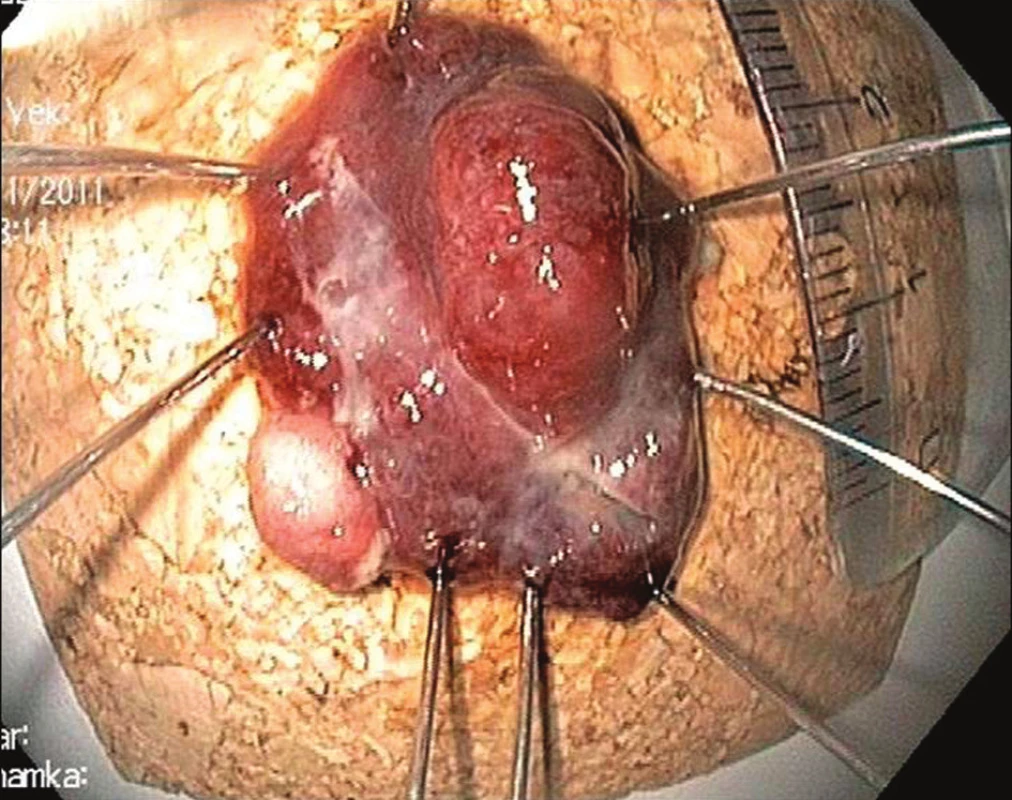
Metody endoskopické resekce jsou dnes standardem léčby definovaných EGC v Japonsku a zemích jihovýchodní Asie, odkud se postupně rozšiřují na západní polokouli včetně České republiky [8, 9]. Zde se někdy setkávají s konzervativními názory, a to především z chirurgické obce. Je to pochopitelné, vždyť výsledky chirurgické léčby jsou vynikající, jak ukazují další části tohoto postgraduálního bloku. Minimální invazivita a zachování žaludku jsou hlavními argumenty endoskopistů, možnost odstranění spádových lymfatických uzlin posiluje pozici chirurgů. Při tvorbě léčebného plánu pro konkrétního nemocného v evropských podmínkách je rovněž významná skutečnost, že zatímco resekci žaludku zvládá na požadované úrovni řada chirurgických týmů, kvalitní endoskopická léčba je v současnosti dostupná jen na několika pracovištích. Spolupráce s chirurgem ve prospěch pacienta je proto velice důležitá. Role chirurga je navíc nezastupitelná v případě komplikací a samozřejmě při nepříznivém výsledku histopatologického vyšetření, které značí inkompletní endoskopickou resekci. Význam spolupráce s histopatologem vyplývá z předchozího textu. Histopatolog je jediným a definitivním arbitrem kurativní resekce. Preparáty musejí být zpracovány tak, aby bylo možné hodnotit kritéria R0 resekce. Spolupracující patolog také musí mít povědomí o hranicích endoskopické léčby. Jako každé nádorové onemocnění má být i nemocný s EGC konzultován s onkologem. V neposlední řadě je součástí týmu dobře poučený pacient, který musí o způsobu léčby svého onemocnění nakonec rozhodnout. Pokroky v endoskopické diagnostice a léčbě kladou vysoké nároky na celý endoskopický tým, technické vybavení a finanční zdroje. Diskuse o tom, zda má být terapeutická endoskopie v rukou chirurgů či gastroenterologů, je již minulostí, stejně jako univerzální dostupnost všech endoskopických metod. Terapeutická endoskopie se dnes stává samostatným oborem vyžadujícím speciální a dlouhotrvající erudici lékařů-endoskopistů. Jen tak lze efektivně využít obrovský terapeutický potenciál současné digestivní endoskopie k maximálnímu prospěchu nemocných.
Prim. MUDr. Ondřej Urban, Ph.D.
Centrum péče o zažívací trakt Vítkovická nemocnice, a.s. Ostrava a Lékařská fakulta Ostravské University
Zalužanského 1192/15
703 84 Ostrava – Vítkovice
e-mail: ondrej.urban@nemvitkovice.cz
Zdroje
1. Gotoda T, Yanagisawa A, Sasako M et al. Incidence of lymph node metastasis from early gastric cancer: estimation with a large number of cases at two large centers. Gastric Cancer 2000;3 : 219–225.
2. Ono H, Kondo H, Gotoda T et al. Endoscopic mucosal resection for treatment of early gastric cancer. Gut 2001;48 225–229.
3. Tada M, Karita M, Yanai M. Treatment of early gastric cancer using strip biopsy: A new technique for jumbo biopsy: in Takemoto T, Kakai K. Recent Topics of Digestive Endoscopy. Tokyo, Japan Excerpta Medica 1987;137–142.
4. Miyamoto S, Muto M, Hamamoto Y et al. A new technique for endoscopic mucosal resection with an insulated-tip electrosurgical knife improves the completness of resection of intramucosal gastric neoplasms. Gastrointest Endosc 2002; 55 : 576–581.
5. Oka S, Tanaka S, Kaneko I et al. Advantage of endoscopic submucosal dissection compared with EMR for early gastric cancer. Gastrointest Endosc 2006;64 : 877–883.
6. Uemura N, Mukai T, Okamoto S et al. Effect of Helicobacter pylori eradication on subsequent development of cancer after endoscopic resection of early gastric cancer: Cancer epidemiology Biomarkters and Prevention, 1997; Vol 16,8 : 639–642.
7. Dixon MF. Gastrointestinal epithelial neoplasia. Vienna revisited. Gut 2002;51 : 130–131.
8. Urban O, Vítek P, Fojtík P, Chalupa J. Endoskopická diagnostika a léčba časných nepolypózních neoplázií trávicí trubice. Folia Gastroenterol Hepatol 2004;2(4):165–173.
9. Urban O, Fojtík P, Kliment M, Janík D, Čegan M, Bužga M. Endoskopická submukózní disekce časného karcinomu žaludku. Endoskopie 2008; 3/4,17 : 81–84.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článek Karcinom žaludku
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2012 Číslo 8- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Proběhly první elektronické volby do orgánů České chirurgické společnosti ČLS JEP
- 110 let od narození prof. MUDr. Vladislava Rapanta, DrSc.
- Chirurgická léčba jaterních metastáz karcinomu žaludku
- Porucha evakuace žaludku po parciální duodenopankreatektomii
- K-ras mutace a nádory infiltrující lymfocyty u karcinomu kolon, současnost a výhledy
- Poranenie brušnej steny cudzím telesom s neskorou perforáciou GITu
- Komplikace augmentace – kazuistika
- K životnímu jubileu prof. MUDr. Jiřího Hocha, CSc.
- 44. setkání Evropského pankreatického klubu
- Karcinom žaludku
- Endoskopická léčba časného karcinomu žaludku
- Chirurgická léčba karcinomu žaludku
- Chirurgická léčba nádorů gastroezofageální junkce
- Laparoskopické operace pro karcinom žaludku
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Komplikace augmentace – kazuistika
- Chirurgická léčba karcinomu žaludku
- Chirurgická léčba nádorů gastroezofageální junkce
- Chirurgická léčba jaterních metastáz karcinomu žaludku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



