-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Imunosuprese po transplantaci žilních allograftů – naše zkušenosti
Immunosuppression Following Venous Allografts Transplantations – The Authors’ experience
Aim:
Venous and arterial graft usage in vascular reconstructions was re-discovered in connection with organ transplantation development. Allografts are employed in many clinics, however, uniform opinion on the use of immunosuppression after the procedure of venous graft transfer from a cadaveric donor, is still lacking.Material and Methods:
The authors present their own group of patients who underwent vascular reconstructions, and in whom allogenic vein was used. The majority of indications for bypass procedures resulted from critical limb ischemia. Immunosuppressive medication was administered during the vascular procedure and, over the past several years, it purely consisted of tacrolimus monotherapy.Results:
In the group of 101 patients, no serious complications due to adverse effects of immunosuppresion therapy were recorded.Key words:
immunosuppression – venous allograft – transplantation – critical limb ischemia
Autoři: M. Adamec; I. Matia; L. Janoušek
Působiště autorů: KTCH IKEM Praha, přednosta: prof. MUDr. Miloš Adamec, CSc.
Vyšlo v časopise: Rozhl. Chir., 2011, roč. 90, č. 2, s. 130-133.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Cíl:
S rozvojem orgánových transplantací došlo k znovuobjevení žilních a tepenných štěpů k cévním rekonstrukcím. Allografty jsou dnes používány na mnoha pracovištích, ale zatím neexistuje jednotný názor na použití imunosuprese po přenosu cévy ze zemřelého dárce.Materiál a metodika:
Autoři předkládají vlastní soubor pacientů po cévní rekonstrukci, kdy byla použita allogenní žíla. Indikací k bypassu byla ve většině případů kritická končetinová ischemie. Cévní rekonstrukce byla zajištěna podáváním imunosuprese, v poslední době výhradně monoterapií tacrolimem.Výsledky:
V souboru 101 pacientů nebyla zaznamenána vážnější komplikace z nežádoucích účinků imunosuprese.Klíčová slova:
imunosuprese – žilní allograft – transplantace – kritická končetinová ischemieÚVOD
Cévní a transplantační chirurgie mají společnou historii. V současné době jsou to především orgánové transplantace, které patří k jednomu z nejrychleji se rozvíjejících oborů medicíny. Propojení cévního a transplantačního programu umožňuje použití chladem konzervovaných žilních a tepenných alloštěpů ve speciálních indikacích rekonstrukční cévní chirurgie. Žilní alloštěpy se dnes nejčastěji používají k infrainguinálním rekonstrukcím u pacientů s kritickou ischemií dolních končetin, kteří nemají vhodný autologní materiál. Tepenné allografty pak mají své nezastupitelné místo při léčbě infekcí umělých cévních protéz.
Přestože se cévy ze zemřelého dárce orgánů používají desítky let na mnoha pracovištích, nebyly dosud vyřešeny všechny problémy spojené s přenosem tohoto typu cizí tkáně. Zásadní je otázka zabránění vzniku rejekčních změn ve stěně cévy, které následně vedou k selhání cévní rekonstrukce.
První použití cévních štěpů při rekonstrukčních výkonech se datuje do poloviny minulého století. Výsledky však nebyly dobré a zvláště časné degenerace tepenných náhrad vedly k sníženému zájmu o tento materiál. Cévní chirurgii na mnoho let ovládly umělé cévní protézy. K znovuobjevení cévních allograftů došlo na konci minulého století s rozvojem orgánových transplantací a detailnějším poznáním odhojovacích mechanismů.
MATERIÁL A METODA
V letech 2000–2010 jsme na našem pracovišti provedli 111 infrainguinálních cévních rekonstrukcí pomocí žilního štěpu ze zemřelého dárce. Chladem konzervované žilní alloštěpy jsme použili jako materiál k bypassu u 101 pacientů (103 končetin, M/Ž 60/41, medián věku 66 let, rozmezí 41–87 let). Hypertenzní nemoc mělo 81 %, diabetes mellitus 60 %, nikotinismus 60 %, ischemickou chorobu srdce 54 % a chronickou renální insuficienci 16 % pacientů. Pět pacientů (5 %) mělo v čase periferní allovenózní rekonstrukce funkční transplantovaný orgán (ledvina 3x, srdce 2x).U většiny nemocných (95 %) byla indikací k operaci kritická končetinová ischemie ve stadiu klidových bolestí nebo defektů. Šest žilních alloštěpů (5 %) jsme použili k léčbě infekce cévní protézy v infrainguinální oblasti. V 70 % byl allovenózní periferní bypass indikován již jako další rekonstrukce postižené končetiny (39x jako druhá, 28x jako třetí, 9x jako čtvrtá rekonstrukce). U 81 % pacientů byla výtoková tepna pod úrovní štěrbiny kolenního kloubu (32x distální arteria politea, 50x krurální tepny, 8x arteria dorsalis pedis).
Pacienty indikované k transplantaci žíly jsme zařadili na čekací listinu. Vyžadovali jsme shodu v krevní skupině AB0 systému mezi dárcem a příjemcem. HLA typizaci ani cross match jsme neprováděli. Žíly jsme získávali v průběhu multiorgánového odběru a uchovávali je ve standardních konzervačních roztocích bez antibiotik. Medián věku dárce byl 50 let (rozmezí 18–75 let). Medián času studené ischemie pro žilní alloštěpy byl 60 hodin (rozmezí 5–312 hodin). Medián času příjemce čekajícího na allogenní žílu po zařazení na čekací listinu byl 14 dní (rozmezí 1–137 dní).
Imunosupresivní terapie nebyla u cévních rekonstrukcí provedených v období od září 2000 do září 2004 (30 rekonstrukcí, 27 %) standardizována. Pacienti užívali prednison nebo azathioprin či cyklosporin A. Malá část pacientů byla bez imunosuprese. Přehled imunosuprese v tomto období uvádíme v tabulce 1. Na základě vlastní experimentální práce a klinických zkušeností jsme od září 2004 začali jako imunosupresi používat výlučně tacrolimus. V tomto období jsme transplantovali celkem 81 allovenózních žil u 74 pacientů. Pacienti s transplantovaným orgánem dostávali dál svoji chronickou imunosupresi (Tab. 2). Průměrná koncentrace tacrolimu v době dimise po transplantaci byla 7,2 ± 4,4 μg/l při průměrné denní dávce 4,7 ± 2,2 mg. Koncentrace kreatininu v době příjmu k transplantaci byla 96,2 ± 33,8 μmol/l a v době dimise 102,7 ± 43,7 μmol/l. Imunosuprese byla podávána po celou dobu průchodnosti rekonstrukce. Koncentraci tacrolimu a kreatininu v průběhu prvních 12 měsíců po transplantaci uvádí tabulka 3.
Tab. 1. Imunosuprese při dimisi u pacientů bez transplantovaného orgánu s průchodnou allovenózní rekonstrukci Tab. 1. Immunosuppression during dismission in patients without organ transplantations with patent allovenous reconstructions 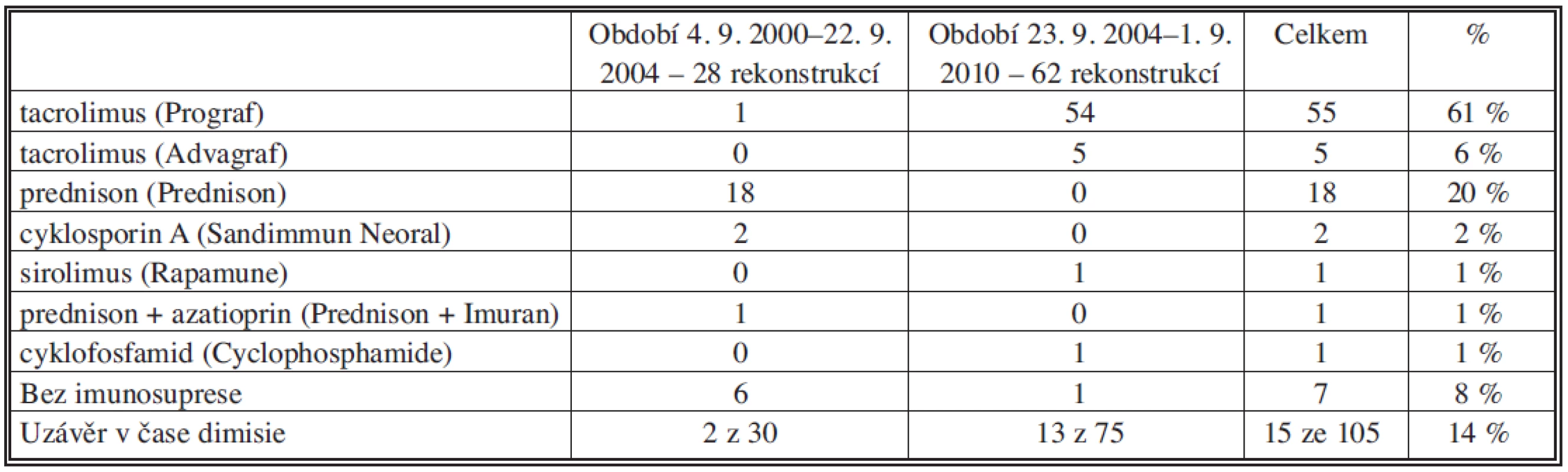
Tab. 2. Imunosuprese při dimisi u pacientů s transplantovaným orgánem a s průchodnou allovenózní rekonstrukci Tab. 2. Immunosuppression during dismission in patients with transplanted organs and with patent allovenous reconstructions 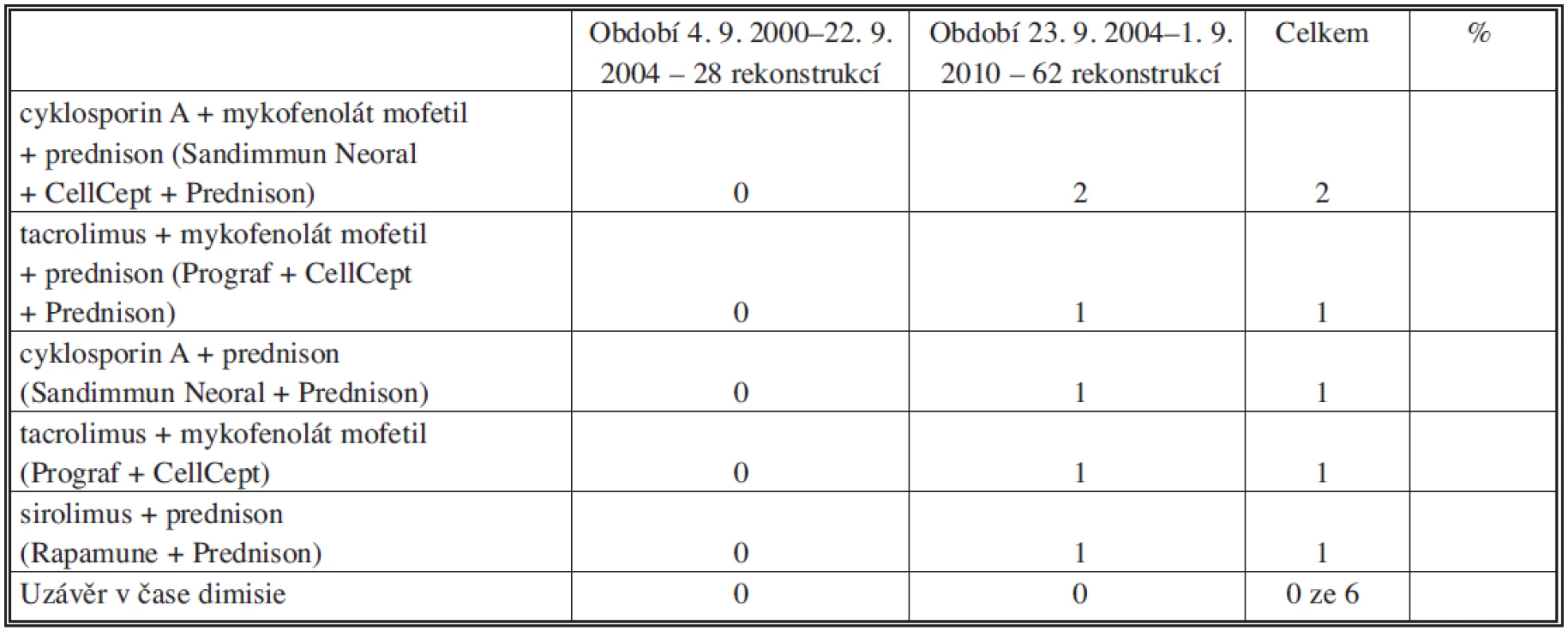
Tab. 3. Koncentrace tacrolimu a kreatinínu u pacientů bez transplantovaného orgánu a s průchodnou allovenózní rekonstrukcí v prvním roce po transplantaci Tab. 3. The first postoperative year tacrolimus and creatinine concentrations in patients without organ transplants and with patent allovenous reconstructions 
VÝSLEDKY
Přežívání pacientů a průchodnosti rekonstrukcí
Přežívání pacientů a průchodnosti rekonstrukcí jsme analyzovali Kaplanovou-Maierovou metodou (± SE). Přežívání pacientů do 36. měsíce od operace se mezi skupinou pacientů imunosuprimovaných tacrolimem (75 ± 10 %) a skupinou pacientů s jiným typem imunosuprese (76 ± 11 %) nelišilo. Primární průchodnost rekonstrukcí v 36. měsíci po operaci byla vyšší ve skupině bypassů imunosuprimovaných tacrolimem (27 ± 7 %) ve srovnání s jiným typem imunosuprese (19 ± 9 %). Tento rozdíl ale nebyl statisticky významný.
Komplikace imunosuprese
U jednoho pacienta s anamnézou chronické renální insuficience bylo nutné vzhledem k nefrotoxicitě tacrolimu jeho podávání v prvním týdnu po ilikopopliteálním allovenózním bypassu přerušit. Dále jsme pokračovali v imunosupresi sirolimem. U jiného pacienta po femoropopliteální a femoroprofundální rekonstrukci jsme měnili tacrolimus za sirolimus měsíc po transplantaci vzhledem k náhodnému CT nálezu tumoru levé ledviny. Pacient podstoupil levostrannou nefrektomii 2 měsíce po cévním bypassu. Histologicky se jednalo o středně diferencovaný konvenční renální karcinom. Pacient je nyní 3,5 roku bez známek recidivy tumoru.
DISKUSE
Myšlenka stará více než 100 let, tj. použít při rekonstrukci cévního řečiště jako náhradu analogický cévní úsek z jiného organismu stejného druhu, se zdála nejschůdnější již prvním průkopníkům na tomto poli. V roce 1903 Hopner poprvé popsal užití čerstvé tepny při přenosu z jednoho psa na druhého. V klinice cévní transplantaci poprvé použil v roce 1906 Goyaness. Ten po resekci výdutě podkolenní tepny nahradil resekovaný úsek stejnojmennou žilou, ponechanou in situ. Během následujících desetiletí techniku cévního přenosu vyzkoušela řada autorů, vesměs se špatným výsledkem. [1]. Brzy totiž docházelo k těžkým imunitním reakcím, které vedly k rozsáhlé tkáňové destrukci transplantátu.
V současnosti se na žilní i tepenné alloštěpy hledí jako na tkáň vyvolávající imunitní odpověď podobnou rejekčním procesům vznikajícím u pacientů po transplantaci parenchymatózních orgánů. Jejich imunogenicita je podmíněná zejména expresí HLA antigenů třídy I i II ve stěně cévy [2]. Přesto není použití imunosuprese po jejich transplantaci ve světě všeobecně běžné a přístup jednotlivých center se pohybuje od jejího absolutního odmítání až po použití v trojkombinaci, obdobně jako je tomu po orgánové transplantaci [3].
U části pacientů s kritickou ischemií dolních končetin nelze k cévní rekonstrukci z různých důvodů použít vlastní žílu nebo cévní protézu, a proto jednou z posledních možností záchrany končetiny je použití allogenní žíly.
HLA antigeny I. a II. třídy exprimované na povrchu stěny žilních allograftů dárce ale stimulují buněčnou a humorální složku imunitního systému příjemce [4]. Výsledkem je ztráta normální struktury žilní stěny, což se klinicky projeví jako trombóza a uzávěr, nebo jako dilatace a ruptura štěpu s krvácením a ohrožením postižené končetiny a pacienta. Jedním z řešení k potlačení imunitní reakce příjemce a zlepšení průchodností žilních alloštěpů je použití imunosuprese. Ve světě však zatím nepanuje konsenzus o jejím užití v této indikaci a není tedy ani definován imunosupresivní protokol.
Od 70. let minulého století byla testována schopnost různých typů imunosupresiv inhibovat imunitní reakci příjemce a tím prodloužit průchodnost žilních alloštěpů. Nejlepší výsledky byly dosaženy u cyklosporinu A, avšak bylo nutné jej podávat ve vysokých dávkách [5]. To vedlo k poškození buněk endoteliální vrstvy a fibróze cévní stěny v důsledku zvýšené produkce transformujícího růstového faktoru beta (TGF-beta) [6, 7].
Jako novější imunosupresivum s výraznějšími imunosupresivními vlastnostmi je u transplantace parenchymatózních orgánů podáván tacrolimus (FK506). V experimentu byl tacrolimus použit v monoterapii po transplantaci aortálních štěpů s dobrými výsledky [8]. Tento preparát patří do skupiny inhibitorů kalcineurinů. Jeho nejdůležitějším imunosupresivním účinkem je inhibice aktivace T-lymfocytů interleukinem 2. V našem ukončeném experimentálním projektu jsme použili model allogenní transplantace ileolumbálních žil do břišní aorty potkanů s imunosupresí minimálními dávkami FK506. Imunohistochemická a histologická analýza transplantovaných žil prokázala inhibiční efekt této dávky na buněčnou složku rejekce. Inhibice imunitní reakce umožnila proces žilní přestavby a adaptaci žilní stěny na tlakové podmínky v tepenném systému [9]. Hlavním efektem FK506 byla v tomto případě pravděpodobně inhibice infiltrace žilní stěny imunokompetentními buňkami příjemce a jejich reakce s MHC alloantigeny dárce. V další experimentální práci jsme dokázali imunosupresivní účinky i při oddálené aplikaci FK506 po transplantaci břišní aorty u potkanů [10].
ZÁVĚR
Největší limitací použití žilních alloštěpů při cévních rekonstrukcích byla jejich krátkodobá průchodnost, eventuelně jiné postižení způsobené odhojováním cizí tkáně. Na základě literárních údajů a našich experimentálních studií jsme zavedli u pacientů po bypassu allogenní žilou imunosupresivní protokol sestávající se z monoterapie tacrolimem. Průchodnost rekonstrukcí u vysoce rizikových pacientů se v našem souboru zvýšila. Nezaznamenali jsme žádné závažné komplikace z vedlejších účinků imunosuprese. Samozřejmostí byly pravidelné kontroly pacientů a sledování hladiny imunosuprese.
Prof. MUDr. Miloš Adamec, CSc.
IKEM
Vídeňská 1958
140 21 Praha 4
e-mail: miad@ikem.cz
Zdroje
1. Hejnal, J., Krajíček, M., Zástava, V. Cévní náhrady. Academia, 1967.
2. Lopez-Cepero, M., Sanders, C. E., Buggs, J., et al. Sensitization of renal transplant candidates by cryopreserved cadaveric venous or arterial allografts. Transplantation, 2002; 73 : 817–819.
3. Prager, M., Holzenbein, T., Aslim, E., et al. Fresh arterial homograft transplantation: A novel concept for critical limb ischaemia. Eur. J. Vasc. Endovasc. Surg., 2002; 24 : 314–321.
4. Madden, R., Lipkowitz, G., Benedetto, B., et al. Decellularized cadaver vein allografts used for hemodialysis access do not cause allosensitization or preclude kidney transplantation. Am. J. Kidney Dis., 2002; 40 : 1240–1243.
5. Bandlien, K. O., Toledo-Pereyra, L. H., MacKenzie, G. H., et al. Immunosuppression with cyclosporine. A new approach to improve patency of venous allografts. Arch. Surg., 1983; 118 : 829–833.
6. Zoja, C., Furci, L., Ghilardi, F., et al. Cyclosporin-induced endothelial cell injury. Lab. Invest., 1986; 55 : 455–462.
7. Khanna, A., Kapur, S., Sharma, V., et al. In vivo hyperexpression of transforming growth factor-beta1 in mice: Stimulation by cyclosporine. Transplantation, 1997; 63 : 1037–1039.
8. Azuma, N., Sasajima, T., Kubo, Y. Immunosuppression with fk506 in rat arterial allografts: Fate of allogeneic endothelial cells. J. Vasc. Surg., 1999; 29 : 694–702.
9. Matia, I., Varga, M., Lodererova, A., et al. The positive effect of immunosuppression on adaptation of venous allografts to arterialisation in rats. Eur. J. Vasc. Endovasc. Surg., 39 : 478–484.
10. Matia, I., Lodererova, A., Adamec, M. Delayed administration of fk506 is sufficient to suppress acute rejection changes after aortal transplantation in rats. Transpl. Int., 2007; 20 : 371–380.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2011 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Kardiochirurgické operace u pacientů odmítajících krevní transfuze: výsledky v IKEM
- Cévní komplikace při transkatetrové implantaci aortální chlopně v IKEM
- Simultánní transplantace ledviny a Langerhansových ostrůvků
- Transplantace jater u pacientů s trombózou portální žíly
- Časné biliární komplikace po transplantaci jater
- První Česko-Slovenská domino transplantace jater
- Vývoj chirurgické techniky transplantací pankreatu v IKEM
- Imunosuprese po transplantaci žilních allograftů – naše zkušenosti
- Vliv biologických lepidel na cévní stěnu v modelu disekce aorty v experimentu
- IKEM – Institut klinické a experimentální medicíny – na prahu páté dekády úspěšné existence
- IKEM – odborné, politické a další souvislosti vzniku a dosavadního vývoje
- Technika implantace a zkušenosti s dočasnou mechanickou srdeční podporou při selhání pravé komory
- Výsledky kombinované plastiky mitrální a náhrady aortální chlopně v IKEM Praha
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Časné biliární komplikace po transplantaci jater
- Kardiochirurgické operace u pacientů odmítajících krevní transfuze: výsledky v IKEM
- Výsledky kombinované plastiky mitrální a náhrady aortální chlopně v IKEM Praha
- Vývoj chirurgické techniky transplantací pankreatu v IKEM
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



