-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Léčba inhibitory aromatázy u postmenopauzálních pacientek s karcinomem prsu a možnosti ovlivnění nežádoucích účinků
Treatment with Aromatase Inhibitors in Postmenopausal Women with Breast Cancer and the Possibility of Influencing Side Effects
Background:
The third generation aromatase inhibitors (anastrozole, letrozole, exemestane) have become standard endocrine treatment for postmenopausal estrogen receptor – positive breast cancers in all settings (neoadjuvant, adjuvant, metastatic breast cancer), based on superiority to tamoxifen. Aromatase inhibitors interfere with the conversion of androgens into estrogens by blocking the enzyme aromatase resulting in low estradiol levels. Aromatase inhibitors are contraindicated in women with functional ovaries. Many premenopausal women develop amenorrhea after adjuvant chemoterapy. Aromatase inhibitors may promote recovery of ovarian function which could lead to therapeutic failure or even to unexpected pregnancy. Currently available measures to determine the menopausal status are conflicting.Aim:
This paper focuses primarily on adverse effects of aromatase inhibitors which can lead to non-compliance or to discontinuation of treatment.Results:
Many side effects of aromatase inhibitors are related to estrogen deprivation. On the other hand as aromatase inhibitors lack estrogenic activity, they are not associated with serious adverse events typical for tamoxifen, such as endometrial cancer and thromboembolic disease. Aromatase inhibitors therapy is often associated with vasomotor symptoms (hot flashes), vaginal dryness, dyspareunia, bone loss, arthralgias and myalgias (musculoskeletal symptoms). Management of these side effects can lead to improved adherence and persistence with therapy.Key words:
breast cancer – menopause – aromatase inhibitors – ovarian function recovery – adverse effects
This work was supported by Czech Ministry of Health – RVO (MOÚ, 00209805).
The author declares she has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
10. 7. 2016Accepted:
3. 8. 2016
Autoři: M. Krásenská
Působiště autorů: Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno
Vyšlo v časopise: Klin Onkol 2016; 29(Supplementum 3): 39-49
Kategorie: Přehled
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko20163S39Souhrn
Východiska:
Inhibitory aromatázy 3. generace (anastrozol, letrozol, exemestan) jsou vzhledem k lepším výsledkům ve srovnání s tamoxifenem již standardní součástí hormonální léčby postmenopauzálních pacientek s hormonálně dependentním karcinomem prsu ve všech indikacích (neoadjuvance, adjuvance, metastatické onemocnění). Inhibitory aromatázy brání inhibicí enzymu aromatázy přeměně cirkulujících androgenů na estrogeny a tím výrazně snižují jejich sérovou hladinu. Jejich podání je kontraindikováno u žen s funkčními ovarii. U mnoha původně premenopauzálních pacientek léčených adjuvantní chemoterapií vymizí menstruace (chemoterapií indukovaná amenorea). Těmto nemocným někdy bývají – bez ohledu na věk – podávány inhibitory aromatázy, které však u nich mohou způsobit obnovení ovariálních funkcí s následným selháním léčby nebo nechtěným těhotenstvím. Techniky měření hormonálních hladin pro ověření menopauzálního stavu dostupné v běžné praxi jsou pro tyto situace často nedostačující.Cíl:
Toto sdělení se věnuje především vedlejším nežádoucím účinkům inhibitorů aromatázy, které mohou vést ke špatné adherenci k léčbě nebo jejímu ukončení.Závěr:
Mnoho nežádoucích účinků inhibitorů aromatázy je způsobeno estrogenní deprivací. Na druhou stranu tím, že inhibitory aromatázy nemají žádnou estrogenní aktivitu, neprovázejí jejich podání závažné nežádoucí účinky typické pro léčbu tamoxifenem, jako je endometriální karcinom nebo tromboembolická nemoc. Léčba inhibitory aromatázy bývá často spojena s vazomotorickými symptomy (návaly horka), suchostí poševní sliznice, dyspareunií, úbytkem kostní hmoty, artralgiemi a myalgiemi (muskuloskeletální symptomy). Prevence a léčba těchto nežádoucích účinků může pacientkám pomoci pokračovat v léčbě.Klíčová slova:
karcinom prsu – menopauza – inhibitory aromatázy – obnovení ovariální funkce – nežádoucí účinkyÚvod
Karcinom prsu je ve vyspělých zemích po maligních nemelanomových nádorech kůže nejčastějším zhoubným nádorovým onemocněním žen. Asi 75–80 % karcinomů prsu postmenopauzálních žen exprimuje estrogenové receptory (ER). Hormonoterapie je základní modalitou systémové léčby pro tyto nemocné a užívá se ve všech klinických situacích, v neoadjuvanci, adjuvanci a také u metastatického onemocnění. Ve všech indikacích nacházejí svoje místo inhibitory aromatázy. V neoadjuvanci dosahují ve srovnání s tamoxifenem vyššího procenta klinických odpovědí na léčbu a vyššího procenta prs šetřících chirurgických výkonů [1,2]. Zařazení inhibitoru aromatázy do adjuvantní terapie je doporučováno aktuálními mezinárodními standardy (ESMO, St. Gallen konsenzus, NCCN) [3–5] u všech postmenopauzálních žen s časným karcinomem prsu se středním a vysokým rizikem relapsu. Inhibitory aromatázy ve studiích adjuvantní léčby v porovnání s tamoxifenem účinněji redukovaly riziko relapsu a mortalitu na karcinom prsu [6]. Možnými schématy jsou sekvenční podání inhibitoru aromatázy po 2–3 letech tamoxifenu (tzv. switch adjuvance), iniciální (up-front) podání inhibitoru aromatázy, případně prodloužená adjuvantní léčba letrozolem po pěti letech tamoxifenu podle studie MA.17 [7]. U hormonálně dependentního metastatického karcinomu prsu je hormonoterapie v současné době preferovanou léčbou 1. linie a linií následných až do rozvoje kompletní hormonorezistence, a to u všech nemocných s výjimkou rychle progredujícího onemocnění s hrozící viscerální krizí [8]. Nesteroidní inhibitory aromatázy (anastrozol, letrozol) jsou v 1. linii účinnější než tamoxifen, dosahují zlepšení přežití bez progrese (progression-free survival – PFS) a mírného prodloužení celkového přežití (overall survival – OS) [9]. Po jejich selhání je možné pacientku léčit fulvestrantem [10] nebo kombinací steroidního inhibitoru aromatázy exemestanu s mTOR inhibitorem everolimem, která je účinná v překonání hormonorezistence (významné prodloužení PFS) [11].
Mechanizmus účinku inhibitorů aromatázy
Mechanizmus účinku tamoxifenu a inhibitorů aromatázy na nádorovou buňku karcinomu prsu je odlišný. Tamoxifen brání vazbě ligandu (estrogenu) na receptor jako kompetitivní antagonista. Inhibitory aromatázy brání přeměně cirkulujících androgenů na estrogeny a tím výrazně snižují množství dostupného ligandu (schéma 1). Účinnost inhibitorů aromatázy 3. generace (anastrozol, letrozol, exemestan) je > 95 %, nejsilnějším inhibitorem je letrozol (inhibice > 99 %). Zdrojem androgenů v postmenopauze jsou především nadledviny a v menší míře ovaria. Aromatáza se tvoří v premenopauze pod vlivem gonadrotropinů v granulózových buňkách ovariálních folikulů a dále v periferních tkáních, jako jsou podkožní tuk, játra, svaly, kost a mozek, je přítomna v buňkách normální prsní žlázy a v nádorových buňkách karcinomu prsu. Intratumorózní koncentrace estrogenů mohou u postmenopauzálních žen dosahovat až 20násobku plazmatických hladin [12]. Po menopauze jsou zdrojem cirkulujících estrogenů výhradně periferní tkáně, především podkožní tuk [12]. V postmenopauze korelují periferní aktivita aromatázy a plazmatické hladiny estradiolu s body mass indexem (BMI). Obézní pacientky s karcinomem prsu mají větší riziko recidivy onemocnění a úmrtí po recidivě, ve studiích byl u nich pozorován menší relativní benefit adjuvantní léčby anastrozolem ve srovnání s tamoxifenem [13,14]. Letrozol je nejsilnějším inhibitorem aromatázy. Ve studii ALIQUOT byl poměr reziduálních hladin estradiolu a estron sulfátu během léčby anastrozolem vzhledem k iniciálním hladinám vyšší ve srovnání s hladinami ve skupině léčené letrozolem, a to napříč všemi rozmezími BMI [15]. Není však jasné, zda je tento rozdíl klinicky signifikantní. Přímé srovnání anastrozolu a letrozolu v adjuvanci ER pozitivního časného karcinomu prsu ukážou výsledky studie FACE (NCT00248170). Spolupodíl na nepříznivé prognóze obézních žen může mít také zvýšená hladina inzulinu a další změny metabolizmu [16].
Schéma 1. Schéma mechanizmu účinku inhibitorů aromatázy. 
Volně upraveno dle [86]. Efekt inhibitorů aromatázy v premenopauze
U premenopauzálních žen vede užití inhibitorů aromatázy k nárůstu sekrece gonadotropinů aktivací osy hypotalamus–hypofýza–ovarium. Krátkodobé užití letrozolu bylo ověřeno jako efektivní v indukci ovulace u infertilních premenopauzálních žen [17]. Podání samotného inhibitoru aromatázy jako léčby ER pozitivního karcinomu prsu je proto v premenopauze kontraindikováno, v případě kontraindikace tamoxifenu je nutná kombinace s medikamentózní nebo chirurgickou kastrací. Před zahájením léčby inhibitorem aromatázy je vždy nutné ověřit postmenopauzální stav u pacientek mladších 60 let, zvláštní opatrnost je nutná u žen, u kterých došlo k vymizení menstruace během předchozí léčby chemoterapií nebo tamoxifenem, a to zejména u žen mladších 50 let (tab. 1). Během terapie je nutné pravidelně monitorovat hladiny estradiolu a folikulostimulačního hormonu (FSH), během prvního roku 1krát za tři měsíce a v dalších letech po šesti měsících [18].
Tab. 1. NCCN definice postmenopauzy (podle NCCN guidelines pro invazivní karcinom prsu, verze 1/2016). 
LHRH – hormon uvolňující luteinizační hormon (liberin), FSH – folikulostimulující hormon, NCCN – National Comprehensive Cancer Network Podmínky a známky úspěšné léčby inhibitorem aromatázy, význam monitorace hladin estradiolu a FSH
Nemůžeme očekávat účinnou terapii pacientky v situaci, kdy měříme vysoké plazmatické hladiny estradiolu, a to bez ohledu na zvýšenou hladinu FSH. Určující pro hodnocení účinnosti terapie inhibitory aromatázy je trvalé dosažení nízkých plazmatických hladin estradiolu na dolní hranici použité metody měření (zpravidla < 30 pmol/l, některé techniky 18 pmol/l). Ve skutečnosti by měla být naměřená plazmatická hladina estradiolu při účinné blokádě aromatázy řádově nižší (< 10 pmol/l), jak vyplývá ze studií, které používaly tzv. vysoce senzitivní techniky měření [19]. Běžně užívané analytické metody stanovení hladiny estradiolu (komerčně dostupné analytické sety) byly vyvinuty jako technika měření hormonálních hladin premenopauzálních žen pro potřeby vyšetření poruch fertility a monitorování indukce ovulace. Fyziologické hodnoty estradiolu premenopauzálních žen se podle fáze cyklu pohybují zhruba mezi 100 a 1 200 pmol/l [19]. Výhodou komerčně dostupných setů, imunoesejí, je jejich jednoduchost, rychlost, nízká cena a malý objem vzorku krve, ze kterého je vyšetření možné provést. Určitá limitace přesnosti výsledku je v tomto případě akceptovatelná a nemá žádný zásadní dopad na klinické rozhodování. V případě měření hladin estradiolu u postmenopauzálních žen a zejména potom žen s karcinomem prsu léčených inhibitory aromatázy je však jejich užití problematické a v určitých situacích může nepřesný výsledek nebo jeho chybná interpretace vést ke špatnému terapeutickému rozhodnutí. Tyto techniky udávají rozmezí normálních hladin estradiolu u postmenopauzálních žen v širokém rozmezí (např. metoda Cobas E601 firmy Roche, užívaná na našem pracovišti, uvádí hodnoty v rozmezí < 18,4–183 pmol/l) [20].
Pro měření velmi nízkých hladin estradiolu byly vyvinuty vysoce senzitivní, ale časově, finančně i technologicky výrazně náročnější způsoby měření [21]. Nepřímé imunoeseje, zpravidla radioimunoeseje, využívají preanalytickou purifikaci analyzátu. V případě stanovení estradiolu je nejprve separován od svého nosiče (sex hormone binding protein – SHBG) a od konjugovaných, ve vodě rozpustných estrogenů (např. estron sulfát), které mohou zkříženě reagovat s estradiol antisérem a být zdrojem nepřesných výsledků. I když dochází ke zkřížené reaktivitě jen v malé míře, může být výsledek klinicky významný, protože hladiny ve vodě solubilních estrogenů významně převyšují sérovou hladinu estradiolu [19]. V práci Dowsetta a Folkerdové bylo ukázáno, že nejméně 70 % hodnoty estradiolu měřené dvěma různými komerčními sety je artefaktem. Autoři demonstrovali zásadně rozdílné výsledky měření estradiolu před podáním a po podání anastrozolu ve stejných vzorcích krve při užití standardních a vysoce senzitivních technik měření [19].
V praxi je i podle našich zkušeností problematické hodnocení rozkolísaného hormonálního profilu u pacientek užívajících před onkologickou léčbou delší dobu hormonální substituční léčbu [22], u žen původně premenopauzálních, u nichž bylo dosaženo chemoterapií indukované amenorey a u pacientek užívajících tamoxifen. U postmenopauzálních nemocných tamoxifen typicky snižuje hladinu FSH, někdy dokonce až do premenopauzálních hodnot [23] a rozhodující pro určení postmenopauzálního stavu je právě nízká hladina estradiolu. U původně premenopauzálních žen s chemoterapií indukovanou amenoreou naproti tomu nacházíme vysoce zvýšené FSH [24], které však může být dočasné a nezaručuje, že v budoucnu nedojde k obnově zrání folikulů. Neexistuje žádná hodnota FSH garantující, že již k obnově funkce ovarií nedojde. Dlouhodobé podání tamoxifenu premenopauzálním ženám neovlivňuje hladinu gonadotropinů, ale může významně zvyšovat hladinu estradiolu na 2–3násobek fyziologických hodnot [25]. Zvýšená sekrece estrogenů může odrážet zvýšenou stimulaci jednoho dozrávajícího folikulu gonadotropinem nebo simultánní zrání vícečetných folikulů.
Rizika při léčbě pacientek mladších 50 let
U žen s nejasným menopauzálním stavem je bezpečnou léčbou tamoxifen. Indukce zbytkové ovariální funkce (ovarian function recovery – OFR) inhibitorem aromatázy byla opakovaně popsána různými autory [18,26,27]. Chemoterapií indukovaná amenorea (chemotherapy-induced amenorrhea – CIA) nemusí být spojena s postmenopauzálními hladinami estradiolu a FSH, stejně jako amenorea při léčbě tamoxifenem. Frekvence CIA po chemoterapii obsahující alkylační látky (cyklofosfamid) je závislá na věku nemocné (< 50 % pacientek mladších 40 let, 65–100 % žen starších 40 let). U mladších žen je amenorea častěji reverzibilní, obnovení ovariální funkce je možné s odstupem 2,5 roku po chemoterapii [28]. V souboru 45 žen Royal Marsden Hospital starších 40 let (medián 47 let, rozmezí 39–52 let) léčených anastrozolem nebo letrozolem po ověření postmenopauzálního hormonálního profilu došlo u 27 % z nich k návratu ovariální funkce. Jedna žena neplánovaně otěhotněla bez předchozího návratu menstruace. Medián doby podání inhibitoru aromatázy před obnovením ovariální funkce byl 6 měsíců (rozmezí 3–18 měsíců) [18]. V recentně publikované práci bylo pozorováno obnovení ovariální funkce v souboru 177 nemocných u 39 % z nich. Sérová hladina FSH s obnovením ovariální funkce nekorelovala, jejím signifikantním prediktorem byl pouze věk < 45 let a inhibin B [26]. Podobně v prospektivní studii, ve které byly pacientky s CIA po nejméně dvou letech podání tamoxifenu léčeny exemestanem za monitorace hormonálních hladin, byla incidence obnovení ovariální funkce 32 %, medián doby do OFR byl 5,4 měsíce (95% CI 1,2–9,6) a jediným signifikantním prediktorem byl průměrný věk při zahájení léčby exemestanem < 48 let. Pacientky s OFR měly vyšší průměrné hladiny estradiolu (43,6 vs. 5,76 pmol/l; p = 0,001) a zhoršené přežití bez známek onemocnění (disease-free survival – DFS; HR 9,3; 95% CI 3,3–48,0; p = 0,04) [27]. Během prvních 12 měsíců léčby exemes - tanem a triptorelinem ve studii SOFT mělo nejméně 17 % pacientek trvale vyšší hladiny estradiolu, než byl definovaný limit, a 34 % mělo vyšší hladinu estradiolu ve sledovaném období minimálně jednou. Tento nález byl častější u nemocných, které nebyly léčeny chemoterapií a u žen mladších 35 let. Jsou očekávána data ze 4letého sledování [29].
U žen s intaktními ovarii, u kterých vznikla chemoterapií indukovaná amenorea, je doporučeno odložit léčbu inhibitory aromatázy až do věku přirozené menopauzy. Ve studii MA.17 byla hlášena velmi nízká incidence OFR u pacientek s CIA starších 50 let [7].
Nežádoucí účinky inhibitorů aromatázy
Pokles sérové hladiny estrogenů v menopauze je provázen řadou nepříjemných symptomů, které mohou být u konkrétní ženy více nebo méně vyjádřené. Rozsáhlá symptomatologie klimakteria bývá dělena na syndromy akutní, vegetativní (vazomotorické a psychosomatické poruchy), subakutní, organické (změny tělesné hmotnosti, změny kožní a urogenitální) a chronické, metabolické (změny lipidového spektra, osteoporóza, ateroskleróza). Vegetativní symptomy snižují kvalitu života, ale neohrožují zdraví ženy. Z pohledu morbidity jsou závažnější změny subakutní (organické) a chronické (metabolické) [30]. Vlivem dalšího snížení hladiny estrogenů při léčbě inhibitory aromatázy se tyto projevy mohou stát výraznějšími.
Typickými nežádoucími účinky inhibitorů aromatázy jsou vazomotorické symptomy (návaly, pocení), urogenitální symptomy – suchost poševní sliznice, bolesti při pohlavním styku (dyspareunie), úbytek kostní hmoty a soubor příznaků označovaných jako muskuloskeletální symptomy. Je diskutován možný nepříznivý vliv na kardiovaskulární systém a hladinu cholesterolu. V následující části se budeme věnovat jednotlivým příznakům, jejich závažnosti a možnostem terapeutického ovlivnění.
Vazomotorické příznaky
V menopauze jejich výskyt udává asi 70 % žen. Jde o návaly horka či pálení (hot flashes), začínající zpravidla v oblasti hlavy, odkud se šíří kaudálně, jsou následované zvýšeným pocením, někdy doprovázené bolestmi hlavy a palpitacemi. Patofyziologie tohoto jevu není zcela objasněná, předpokládá se dysfunkce termoregulačního centra (u žen s návaly byla prokázána užší termoregulační zóna), aktivace noradrenergní a serotoninové dráhy v CNS (pokles hladiny estrogenů vede k upregulaci serotoninových receptorů v hypotalamu a zvyšuje hladiny noradrenalinu) [31]. Za návaly není přímo odpovědná nízká hladina estrogenů, spíše její relativní pokles, tuto teorii podporuje fakt, že intenzivnější návaly mívají ženy po bilaterální chirurgické ovarektomii ve srovnání s ženami s přirozeným postupným nástupem menopauzy. Návaly v placebem kontrolovaných studiích s tamoxifenem udávalo asi 67 % pacientek [32]. V případě inhibitorů aromatázy byl ve studiích při srovnání s tamoxifenem jejich výskyt nižší (anastrozol 35,7 vs. 40,9 %; p < 0,0001, letrozol 33,5 vs. 38 %; p < 0,001) [33,34]. V případě switch adjuvance byl ovšem výskyt návalů při pokračování léčby tamoxifenem nebo výměně za exemestan, případně anastrozol, stejný [35,36]. Překvapivě výskyt návalů zvyšoval letrozol ve srovnání s placebem ve studii s prodlouženou adjuvantní léčbou MA.17 [7]. Výskyt návalů zvyšuje chemoterapií indukovaná amenorea [37].
Terapeutická opatření
Kauzální léčba substitucí estrogenů a progestinů je kontraindikovaná. Z účinných postupů je možné doporučit podání inhibitorů zpětného vychytávání serotoninu (selective serotonin reuptake inhibitors – SSRI), případně serotoninu a noradrenalinu (serotonin-norepinephrine reuptake inhibitors – SNRI), jako jsou citalopram [38] a venlafaxin [39] (redukce výskytu návalů o 50–60 %). Gabapentin prokázal redukci návalů o 35–38 %, bývá však hůře tolerován. Jeho podání může být výhodné u pacientek s výraznými nočními symptomy rušícími spánek (sedativní účinek) [40,41]. Účinné je také antihypertenzivum klonidin [42]. Výživové doplňky jako vitamin E a sójové fytoestrogeny neprokázaly ve studiích signifikantní efektivitu. Jako částečně přínosná se jevila hypnóza, akupunktura (přetrvávající zlepšení dva týdny po léčbě) a dechové relaxační techniky (zlepšení návalů o 35 %), u jógy taková data chybějí [31]. Důležitá jsou režimová opatření, jako je nošení volnějšího oblečení z přírodních materiálů a jeho vrstvení, omezení kávy a alkoholu, vynechání ostrých, horkých jídel a nápojů, spánek v chladnější místnosti, podle potřeby opatrné používání ventilátoru nebo vějíře [31].
Urogenitální symptomy
ER byly prokázány v dlaždicovém epitelu uretry, pochvy a trigonu močového měchýře, ve svalstvu a v buňkách vazivové tkáně pánevního dna. Byl prokázán maturační index buněk močového měchýře pod vlivem estrogenů, podobně jako u buněk poševní sliznice. ER jsou přítomny také v mozku, v oblastech odpovědných za řízení mikce (kůra, limbický systém, hippocampus, mozeček). Nedostatek estrogenů působí atrofickou vaginitis a další morfologické změny na urogenitálním traktu (urogenitální atrofie), které se klinicky projeví jako vaginální suchost, dyspareunie, pruritus, opakované uroinfekce, urgentní mikce. Estrogeny jsou jedinou kauzální léčbou atrofické vaginitidy, snižují výskyt recidivujících infekcí dolního močového traktu u postmenopauzálních žen obnovou normální poševní flóry (Lactobacillus acidophillus), lokální léčba estrogeny má prokazatelně dobré výsledky v léčbě urgentní inkontinence [30].
Terapeutická opatření
Kauzální léčbou atrofické vaginitidy je lokální (vaginální) podání estrogenů. Tato léčba je často gynekology považována za bezpečnou se zdůvodněním, že při ní nedochází k systémové resorpci léčiva. V roce 2003 byla publikována práce, která na malém souboru 69 pacientek s anamnézou karcinomu prsu ověřovala bezpečnost podání vaginálních estrogenů pro urogenitální symptomatologii. Nebylo prokázáno zvýšení rizika recidivy karcinomu prsu aplikovanou léčbou [43]. Ve studii MA.17 s prodlouženou adjuvantní hormonální léčbou letrozolem bylo překvapivě vaginální podání estrogenů povoleno [7]. V nedávné době však byly publikovány práce [44,45], které cíleně monitorovaly, jak jsou ovlivněny sérové hladiny estradiolu při léčbě inhibitory aromatázy a současném vaginálním podání estradiolu (Vagifemu) (graf 1). Ukazuje se, že u některých pacientek dochází k velmi významné systémové resorpci s dosažením sérových hladin v řádu stovek pmol/l přetrvávající i několik týdnů po zahájení aplikace, což pacientku léčenou inhibitory aromatázy vystavuje riziku zcela neúčinné léčby. Z dřívějších farmakokinetických prací vyplývá, že v úvodu léčby vaginálně aplikovaným estrogenem dochází k významné resorpci přes atrofickou sliznici a v průběhu času, jak epitel vlivem estrogenu vyzrává, během 10–14 dní vstřebávání klesá [46]. Zdá se však, že míra resorpce je individuální a u některých nemocných může přetrvávat dlouhodobě [44]. Je otázkou, jaký význam má pro pacientky byť krátkodobý významný vzestup hladin estradiolu na průběh jejich onemocnění. Je známa významná asociace mezi rizikem karcinomu prsu a plazmatickými hladinami cirkulujících estrogenů (estradiolu, estronu a estron sulfátu) u postmenopauzálních žen [47]. Ačkoliv se vede diskuze o významnosti plazmatické a intratumorózní hladiny estrogenů a jejich inhibici, recentní pub - likace ukazují, že plazmatické estrogeny pravděpodobně hrají dominantní roli [48].
Graf 1. Sérové hladiny estradiolu u žen se souběžným podáním inhibitorů aromatázy a estradiolu vaginálně (Vagifem). 
Podle [44]. V případě netolerovatelných obtíží je po vyloučení infekční etiologie obtíží možné doporučit nehormonálně působící zvlhčující látky, jako jsou čípky s kyselinou hyaluronovou (Cicatridina), které však působí jen krátkodobě, nebo aplikaci polykarbofilního gelu, který má prodloužený účinek na zvlhčení sliznice a úpravu pH. Ve studii na malém souboru nemocných prokázal přípravek Replens srovnatelnou účinnost s lokálně aplikovanými estrogeny [49,50] a v další studii pozitivní vliv na morfologii vaginálního epitelu [51]. Originální přípravek Replens (Wellspring) je dostupný pouze v USA a Kanadě. V Evropě je dostupný přípravek s touto účinnou látkou vyráběný v Irsku. V ČR je polykarbofilní gel k dispozici nově pod názvem Regelle Intimed, a to jako certifikovaný zdravotnický prostředek, v současné době nikoliv v lékárnách, ale v síti drogerií DM. Aplikuje se 3krát týdně po dobu 12 týdnů. Pokud není tato léčba efektivní, je možné zkusit výměnu hormonální léčby (jiný inhibitor, tamoxifen). Přestože léčba tamoxifenem může být provázena u části nemocných nepříjemnými pocity v pochvě a dyspareunií, jeho účinek na vaginální sliznici je podobně jako na endometrium agonistický, podporuje jeho maturaci a některými pacientkami může být proto lépe tolerován.
Vaginální aplikaci estrogenů nelze v současné době při léčbě inhibitory aromatázy doporučit jako bezpečnou. Krátkodobá aplikace je možná pouze jako krajní řešení u poučené pacientky (chybí data o bezpečnosti) za monitorace sérových hladin estradiolu, pokud je podáván estradiol (Vagifem). Na základě empirické úvahy se jeví v této situaci jako vhodnější podat estriol (Ovestin), který má nejslabší estrogenní efekt, nezvyšuje sérový estradiol a v léčbě vaginálních symptomů je přesto účinný. Pacientky však při jeho aplikaci ve srovnání s estradiolem častěji popisují vaginální výtok [30]. Jako efektivní se nedávno osvědčila v léčbě symptomů ve farmakokinetické studii fáze I i kombinace ultra-low-dose 0,03 mg estriolu a Lactobacillus acidophillus (přípravek Gynoflor). Léčba dočasně mírně zvyšovala sérovou hladinu estriolu bez dynamiky hladin estradiolu a estronu [53]. V obou případech však bezpečnostní data chybějí. V recentní práci bylo popsáno příznivé ovlivnění dyspareunie lokálně aplikovaným lidokainem [54]. U některých nemocných mohou netolerovatelné genitální obtíže vést k ukončení hormonální léčby.
Vliv inhibitorů aromatázy na zvýšení sérové hladiny lipidů a kardiovaskulární morbiditu
Premenopauzální ženy mají ve srovnání s muži stejného věku nižší riziko kardiovaskulárních onemocnění díky příznivému metabolickému efektu estrogenů (vliv na sérové hladiny lipidů, lipoproteinů, metabolizmus glukózy, inzulinu, distribuci tělesného tuku). U postmenopauzálních žen riziko kardiovaskulárních onemocnění narůstá. Tamoxifen působí díky svému parciálně agonistickému estrogennímu efektu kardioprotektivně (ve studiích signifikantně snižoval počet úmrtí na infarkt myokardu). Vliv inhibitorů aromatázy na kardiovaskulární morbiditu nebyl systematicky studován a zůstává v současné době nejasný. K dispozici jsou převážně data z klinických studií srovnávajících inhibitory aromatázy s tamoxifenem v adjuvanci, a to v rozdílných schématech (up-front podání, switch strategie, prodloužená adjuvantní léčba), s rozdílnou iniciální definicí nežádoucích kardiovaskulárních příhod a jejich monitorací. V každém případě byl počet kardiovaskulárních příhod v možné souvislosti s inhibitory aromatázy ve všech studiích velmi malý [33–36]. Jedinou studií, která srovnávala inhibitor aromatázy proti placebu, je studie MA.17 s letrozolem podávaným po dokončené standardní 5leté adjuvantní léčbě tamoxifenem, v níž letrozol nezvyšoval výskyt kardiovaskulárních příhod (5,8 % letrozol vs. 5,6 % placebo; p = 0,76) [7]. V současné době tak převládá názor, že spíše než nárůst incidence kardiovaskulárních příhod odrážejí data z adjuvantních studií s inhibitory aromatázy chybějící protektivní efekt tamoxifenu u nemocných léčených inhibitorem aromatázy [55].
Data z adjuvantních studií naznačila možnou souvislost mezi léčbou inhibitory aromatázy a změnou hladiny krevních tuků. Některé studie hladiny tuků nesledovaly vůbec, jiné se zásadními metodologickými chybami (pacientky nemusely být lačné). Ve studii BIG 1-98 zůstávaly průměrné hladiny cholesterolu během léčby letrozolem stabilní a u tamoxifenem léčených docházelo k iniciálnímu poklesu hladin s následnou stabilizací [34]. Ve studii MA.17 byl výskyt hypercholesterolemie v obou léčebných ramenech shodný (16 % letrozol vs. 16 % placebo; p = 0,79) [7]. Studie LEAP (letrozole, exemestane, anastrozole pharmacodynamics) u zdravých postmenopauzálních žen neprokázala žádný škodlivý vliv na hladinu krevních tuků a žádné rozdíly mezi jednotlivými inhibitory aromatázy při jejich přímém srovnání [56].
V současnosti dostupná data tedy nepodporují zvýšení kardiovaskulární morbidity ani významné nepříznivé ovlivnění metabolizmu lipidů inhibitory aromatázy.
Osteoporóza a riziko fraktury
Při osteoporóze ubývá ve skeletu kostní minerál (hydroxyapatit) i organická pojivová hmota a mění se architektonika kosti. Fyziologicky kost začíná ubývat po 30. roce života, u žen výrazněji po menopauze. S věkem stoupá výskyt osteoporózy u žen i mužů [57]. Jako nemoc se označuje takový úbytek, kdy i při nepřiměřeně malém úrazu hrozí riziko zlomenin. Typickými osteoporotickými frakturami jsou kompresivní fraktury obratlů, zlomeniny krčku stehenní kosti a zápěstí [57]. Zlomeniny krčku femuru mají významnou morbiditu [58], mortalitu (25–30 % během prvního roku) [59] a 2,5násobně zvyšují riziko další fraktury [60].
Množství kostního minerálu se označuje zkratkou BMD (bone mineral density). Známe průměrnou hodnotu BMD u zdravých mladých žen a mužů a rozptyl hodnot (resp. směrodatnou odchylku). Ta se označuje jako T-skóre. Hodnota T-skóre vyjadřuje, kolik kostní hmoty pacient ztratil od svých 30 let, jedno T-skóre odpovídá zhruba 10 % kostní hmoty v měřeném místě skeletu. Hodnoty T-skóre > –1,0 jsou považovány za normální kostní denzitu, hodnoty < –2,5 za osteoporózu (úbytek více než čtvrtiny kostní hmoty). T-skóre mezi –1,0 a –2,5 se hodnotí jako osteopenie. Měření se provádí dvouenergiovou rentgenovou absorbciometrií (DXA) v bederní páteři a v horním úseku kyčelní kosti (proximální femur a krček femuru), případně v distálním předloktí [57].
Aktivně probíhající léčba inhibitory aromatázy při srovnání s tamoxifenem zvyšovala v adjuvantních studiích frekvenci fraktur (2–8,6 vs. 1–5,8 %) [61–63]. Ve studii ATAC byl u pacientek léčených anastrozolem pět let zaznamenán pokles BMD v oblasti bederní páteře a kyčle o 8 % ve srovnání s pacientkami léčenými tamoxifenem (p < 0,0001) [61]. Po pěti letech mělo osteopenii 17 % pacientek léčených anastrozolem s normální BMD v úvodu léčby a 5 % původně osteopenických pacientek se stalo osteoporotickými [61]. Roční riziko fraktury u pacientek léčených anastrozolem ve studii ATAC bylo přibližně dvojnásobné ve srovnání s postmenopauzálními zdravými ženami stejného věku s osteopenií (2,2 vs. 1,3 %) [61].
Faktory zvyšující riziko fraktury u žen s karcinomem prsu léčených inhibitory aromatázy
Za zvýšené riziko se u pacientek léčených inhibitory aromatázy považuje již úbytek kostní hmoty s hodnotou T-skóre < –1,5, ukazuje se totiž, že většina fraktur vznikne u žen s nálezem pouhé osteopenie, nikoliv osteoporózy. Ženy s BMD v pásmu osteopenie jsou ve zvýšeném riziku fraktury a léčba by měla být zahájena dříve, než dojde k dalšímu úbytku kostní hmoty. Dalšími riziky jsou věk > 65 let, nízký BMI, rodinná a osobní anamnéza fraktury, kouření a léčba perorálními kortikosteroidy v dávce ekvivalentní ≥ 7,5 mg metylprednisolonu denně po dobu šesti měsíců a delší [64].
Léčebná doporučení v profylaxi úbytku kostní hmoty
Všem pacientkám je třeba nabídnout pravidelné vyšetření kostní denzitometrií. Doporučena je pravidelná fyzická aktivita (cvičení), dostatečný příjem vápníku 1 000–1 200 mg a vitaminu D 400–800 IU denně [64]. Literární data prokazují význam příjmu vápníku a vitaminu D na udržení BMD. Signifikantní vliv suplementace na snížení rizika fraktury není jednoznačný [65]. Ve studiích byl prokázán příznivý vliv pravidelného cvičení [64]. U pacientek léčených inhibitory aromatázy se jako účinné opatření ukázalo ve čtyřech studiích zahrnujících 2 600 premenopauzálních a postmenopauzálních žen intravenózní podání bisfosfonátu, konkrétně zoledronátu [66–70]. Trend k menšímu výskytu fraktur byl zaznamenán u žen, kterým byl zoledronát podáván současně se zahájením hormonoterapie ve srovnání s těmi, které byly léčeny až při signifikantním poklesu BMD [68–70]. Kyselina zoledronová v dávce 4 mg podaná 1krát za šest měsíců intravenózně byla účinná v prevenci úbytku kostní hmoty spojené s léčbou inhibitory aromatázy a v prevenci fraktur ve skupině premenopauzálních i postmenopauzálních žen. Léčba byla dobře tolerovaná, vyskytly se přechodné reakce typu reakce na infuzi a mírné flu-like symptomy, výskyt osteonekrózy čelisti a renální toxicity byl velmi nízký. Současně byl metaanalýzou studií prokázán přídatný protinádorový efekt u postmenopauzálních žen. Adjuvantní bisfosfonáty u nich signifikantně redukovaly riziko rekurence ve skeletu o 34 % a mortalitu o 17 % [71]. Adjuvantní léčbu zoledronátem jako další modalitu k redukci rizika rekurence lze v praxi nabídnout všem postmenopauzálním pacientkám v režimu samoplátce co nejdříve po zahájení systémové terapie. Pokud tento postup ve své praxi nepoužíváme, standardní doporučení pro vyšetřování nemocných a indikaci léčebně-preventivních opatření pro jednotlivé skupiny nemocných podle hodnot BMD a přídatných rizik ukazuje schéma 2.
Schéma 2. Doporučená strategie péče o pacientky léčené inhibitory aromatázy. 
Doporučení vychází z výsledků klinických studií s pacientkami s karcinomem prsu a zdravou populací. *Pokud je roční úbytek denzity kostního minerálu (bone mineral density – BMD) ≥ 5 % (duální rentgenová kostní absorbciometrie – stejný přístroj), je třeba vyloučit nedostatek vitaminu D a zvážit podání bisfosfonátů. Nejlepší data o efektivitě pro léčbu ztráty kostní hmoty spojené s léčbou inhibitory aromatázy má zoledronát 4 mg intravenózně každých šest měsíců. Pro hodnocení je použito nejnižší T-skóre ze tří vyšetřených míst. BMI – body mass index Upraveno podle [64]. Muskuloskeletální symptomy
Jde o soubor příznaků, které provázejí léčbu inhibitory aromatázy asi u poloviny nemocných a bývají odpovědné za špatnou adherenci k léčbě, někdy vedou k jejímu úplnému ukončení. Rozumí se jimi symetrická bolest kloubů postihující zejména zápěstí, ruce, kolena, kyčle a ramena, ale také páteř [72]. Zařazuje se sem také syndrom karpálního tunelu a lupavý (skákavý) palec, ztuhlost s maximem v ranních hodinách, bolesti svalů, snížená síla stisku. Pacientky někdy popisují pocit, jako by během krátké doby zestárly o mnoho let. Symptomy se objevují v řádu týdnů až měsíců od nasazení léčby, maxima dosahují kolem šestého měsíce [73]. Incidence artralgií se ve velkých adjuvantních studiích s inhibitory aromatázy pohybovala mezi 20 a 30 % a 5 % pacientek z tohoto důvodu ukončilo léčbu [7,33–35], zatímco z pozdějších prací vyplývá, že léčbu navzdory známému přínosu inhibitorů aromatázy proti tamoxifenu časně ukončuje z důvodu nežádoucích účinků 23–40 % žen [72]. Často jde o potíže závažného stupně. V práci z roku 2007 autoři hodnotili soubor 200 nemocných, z nichž 64 % bylo léčeno anastrozolem, 19 % letrozolem a 17 % exemestanem. Pacientky posuzovaly míru bolesti a ztuhlosti podle škály VAS (vizuální analogová stupnice) od 0 do 10 (0 – žádná bolest, 10 – nejhorší bolest, kterou si nemocná umí představit). Bolest kloubů v souvislosti s léčbou inhibitory aromatázy udávalo 47 % žen, polovina jako novou bolest a polovina jako zhoršení stávající bolesti. Bolest středního (5–7) a těžkého (8–10) stupně udávalo 67 % nemocných, podobně ztuhlost středního a těžkého stupně 66 % nemocných. Analgetika užívalo s efektem 53 % pacientek, z toho 7 % opiáty. Při hodnocení nebyl rozdíl při srovnání jednotlivých inhibitorů aromatázy [72].
Jak ukončení léčby, tak nepravidelné užívání inhibitorů aromatázy je spojeno se zhoršením prognózy [34]. Retrospektivní analýzy dat adjuvantních studií s inhibitory aromatázy vyhodnotily rozvoj artralgií do tří měsíců od zahájení léčby jako příznivý prognostický faktor [74–76].
Mechanizmus vzniku artralgií/myalgií a rizikové faktory pro jejich rozvoj
Běžně se za důvod muskuloskeletálních symptomů považuje nedostatek estrogenů. Některé studie ukazují, že příčinou by mohl být spíše jejich náhlý pokles, vzhledem k častějšímu výskytu artralgií v perimenopauze proti premenopauze a postmenopauze. Zdá se, že artralgie jsou zprostředkovány cytokiny. Vyšší hladiny estrogenů potlačují produkci zánětlivých cytokinů, nižší hladiny jejich tvorbu zvyšují. Jde zejména o interleukin-1 (IL-1), IL-6 a tumor necrosis factor-α (TNF-α) [77]. Vyšší hladiny zánětlivých mediátorů, zejména IL-17, mají obézní pacientky, což může vysvětlovat udávaný vyšší výskyt artralgií u žen s BMI ≥ 30 [72]. Častější výskyt artralgií a ztuhlosti byl pozorován u žen, kterým byla před zahájením podání inhibitorů aromatázy podávána hormonální substituční terapie nebo chemoterapie, zejména pokud obsahovala taxány (více než 4krát zvýšené riziko proti nemocným, které taxány léčeny nebyly). Riziko zvyšuje také již iniciální přítomnost artralgií a osteoartritidy. Nižší riziko rozvoje symptomů mají naopak nemocné, které byly předléčeny tamoxifenem (OR 0,40; 95% CI 0,19–0,87) [72].
Vyšetření pacientky s muskuloskeletálními symptomy
Je vhodné vyloučit boreliózu a revmatoidní artritidu. U pacientek s muskuloskeletálními symptomy byly opakovaně prokázány morfologické změny při vyšetření kloubů ultrasonografií a magnetickou rezonancí (ztluštění a přítomnost tekutiny ve šlachových pochvách flexorů prstů, intraartikulární tekutina v metakarpálních kloubech, synovitida radiokarpálního kloubu) [78]. Vyšetření elektromyografií může prokázat změny typické pro syndrom karpálního tunelu.
Terapeutické možnosti ovlivnění muskuloskeletálních symptomů
- Edukace pacientky před zahájením léčby – poučené ženy jsou častěji schopné léčbu tolerovat i za cenu nežádoucích účinků.
- Redukce váhy u obézních pacientek.
- Pravidelné cvičení – ve studii HOPE byla ověřena účinnost pravidelného aerobního i posilovacího cvičení, které vedlo ke zmírnění výskytu a intenzity bolesti a lepšímu zvládání běžných denních aktivit [79].
- Výměna jednotlivých inhibitorů aromatázy mezi sebou – ve studii ATTOL některé pacientky se špatnou snášenlivostí anastrozolu mnohem lépe tolerovaly letrozol [80]. I když výměna zcela neodstraní artralgie, může pacientkám poskytnout nějakou úlevu a umožnit pokračování v léčbě. Je možné také zvážit změnu léčby na tamoxifen. Ve studii BIG 1-98 měly nemocné léčené v úvodu dva roky letrozolem s následným switchem na tamoxifen podobné výsledky jako nemocné léčené letrozolem up-front po dobu pěti let [34]. V adjuvantních studiích s anastrozolem i letrozolem [33,34] byl výskyt artralgií při podání tamoxifenu nižší.
- Vitamin D – ženy neužívající inhibitory aromatázy s nespecifickou muskuloskeletální bolestí a artralgiemi měly ve studiích častěji nedostatečnou sérovou hladinu vitaminu D. Estrogeny se přímo podílejí na vzniku biologicky aktivní formy 1,25-dihydroxyvitaminu D (vitamin D3). V malé prospektivní studii byla účinná substituce vyššími dávkami vitaminu D s dosažením hladiny > 66 nmol/l, kdy 52 % žen neudávalo žádné kloubní obtíže, na rozdíl od pouhých 19 % žen, jejichž hladina byla nižší [81]. Bezpečnost dlouhodobého podání vysokých dávek vitaminu D není jasná (riziko gastrointestinální intolerance, hyperkalcemie, renální toxicity). Ve dvou randomizovaných studiích s běžným dávkováním vitaminu D nebylo významné zlepšení artralgií pozorováno.
- Akupunktura [82].
- Kloubní výživa – glukosamin a chondroitin [83].
- Analgetika – nutno vytitrovat minimální účinnou dávku, pro dlouhodobou léčbu nejsou vhodné COX-2 inhibitory.
- Další možnosti farmakoterapie, která se ve studiích jevila jako účinná (nízká dávka kortikoidů, duloxetin) [84,85].
Souhrnně přehled léčebných možností všech nežádoucích účinků uvádí tab. 2.
Tab. 2. Přehled terapeutických možností ovlivnění nežádoucích účinků inhibitorů aromatázy. 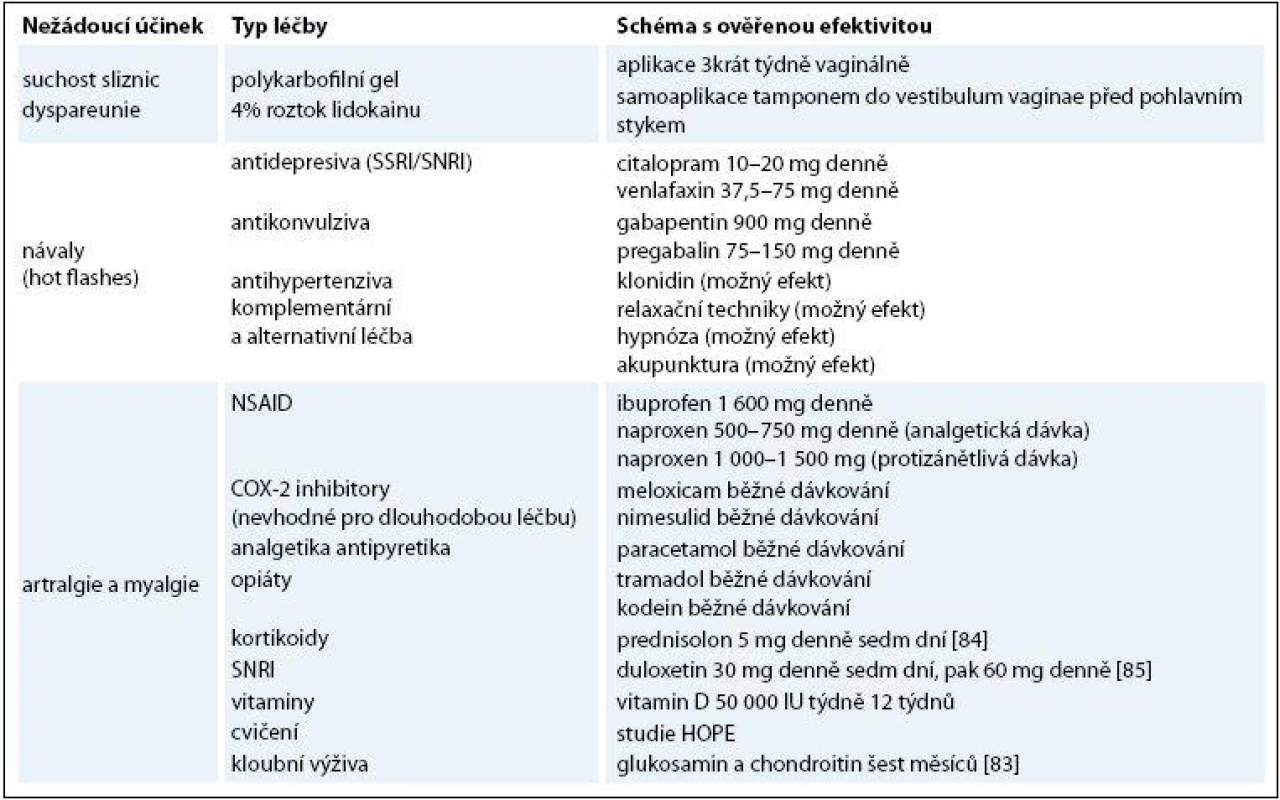
NSAID – nesteroidní antirevmatika, COX-2 inhibitory – selektivní inhibitory cyklooxygenázy 2, SNRI – inhibitory zpětného vychytávání serotoninu a noradrenalinu, SSRI – inhibitory zpětného vychytávání serotoninu Závěr
Inhibitory aromatázy přinesly významné zlepšení léčebných výsledků hormonálně dependentního karcinomu prsu ve všech klinických indikacích. Kombinace steroidního inhibitoru aromatázy exemestanu s mTOR inhibitorem everolimem je účinná v překonání hormonální rezistence, v Evropě zatím nemá registraci další ověřená kombinace účinná v 1. linii léčby pokročilého onemocnění, kterou je letrozol s inhibitorem cyklin dependentních kináz 4/6 palbociclibem. Přestože je hormonoterapie ve srovnání s chemoterapií lépe tolerována, má její podání řadu úskalí. Je důležité správně vybrat nemocné, které jsou k této léčbě vhodné, a v jejím průběhu kontrolovat účinnost inhibice aromatizace. V neposlední řadě je nutné myslet na prevenci a symptomatickou terapii celé řady nežádoucích účinků, které mohou adherenci nemocných k probíhající terapii ohrozit.
Práce byla podpořena MZ ČR – RVO (MOÚ, 00209805).
Autorka deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Marta Krásenská
Klinika komplexní onkologické péče Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: krasenska@mou.cz
Obdrženo: 10. 7. 2016
Přijato: 3. 8. 2016
Zdroje
1. Eiermann W, Paepke S, Appfelstaedt J et al. Preoperative treatment of postmenopausal breast cancer patients with letrozole: a randomized double-blind multicenter study. Ann Oncol 2001; 12 (11): 1527–1532.
2. Wang W, Liu C, Zhou W et al. Network Meta-analysis of the effectiveness of neoadjuvant endocrine therapy for postmenopausal, HR-positive breast cancer. Sci Rep 2016; 6 : 25615. doi: 10.1038/srep25615.
3. Henry NL, Somerfield MR, Abramson VG et al. Role of patient and disease factors in adjuvant systemic therapy decision making for early-stage, operable breast cancer: American Society of Clinical Oncology Endorsement of Cancer Care Ontario Guideline Recommendations. J Clin Oncol 2016; 34 (19): 2303–2311. doi: 10.1200/JCO.2015.65.8609.
4. Coates AS, Winer EP, Goldhirsch A et al. Tailoring therapies – improving management of early breast cancer: St Gallen International Expert Consensus on the Primar Therapy of Early Breast Cancer 2015. Ann Oncol 2015; 26 (8): 1533–1546. doi: 10.1093/annonc/mdv221.
5. Senkus E, Kyriakides S, Ohno S et al. Primary breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2015; 26 (Suppl 5): v8–v30. doi: 10.1093/annonc/mdv298.
6. Dowsett M, Cuzick J, Ingle J et al. Meta-analysis of breast cancer outcomes in adjuvant trials of aromatase inhibitors versus tamoxifen. J Clin Oncol 2010; 28 (3): 509–518. doi: 10.1200/JCO.2009.23.1274.
7. Goss P, Ingle JN, Martino S et al. Randomized trial of letrozole following tamoxifen as extended adjuvant therapy in receptor – positive breast cancer: updated findings from NCIC CTG MA.17. J Natl Cancer Inst 2005; 97 (17): 1262–1271.
8. Rugo HS, Rumble RB, Macrade E et al. Endocrine therapy for hormone receptor-positive metastatic breast cancer: American Society of Clinical Oncology Guideline. J Clin Oncol 2016; JCO671487. doi: 10.1200/JCO.2016.67. 1487.
9. Gibson L, Lawrence D, Dawson C et al. Aromatase inhibitors for treatment of advanced breast cancer in postmenopausal women. Cochrane Database Syst Rev 2009; 4: CD003370. doi: 10.1002/14651858.CD003370.pub3.
10. Di Leo A, Jerusalem G, Petruzelka L et al. Results of the CONFIRM phase III trial comparing fulvestrant 250 mg with fulvestrant 500 mg in postmenopausal women with estrogen receptor-positive advanced breast cancer. J Clin Oncol 2010; 28 (30): 4594–4600. doi: 10.1200/JCO.2010.28.8415.
11. Baselga J, Campone M, Piccart M et al. Everolimus in postmenopausal hormone-receptor-positive advanced breast cancer. N Eng J Med 2012; 366 (6): 520–529. doi: 10.1056/NEJMoa1109653.
12. Lønning PE, Eikesdal HP. Aromatase inhibition 2013: clinical state of the art and questions that remain to be solved. Endocr Relat Cancer 2013; 20 (4): 183–201. doi: 10.1530/ERC-13-0099.
13. Kwan ML, Chen WY, Kroenke CH et al. Pre-diagnosis body mass index and survival after breast cancer in the After Breast Cancer Pooling Project. Breast Cancer Res Treat 2011; 132 (2): 729–739. doi: 10.1007/s10549-011-1914-3.
14. Sestak I, Distler W, Forbes JF et al. Effect of body mass index on recurrences in tamoxifen and anastrozole treated women: an exploratory analysis from the ATAC trial. J Clin Oncol 2010; 28 (21): 3411–3415. doi: 10.1200/JCO.2009.27.2021.
15. Folkerd EJ, Dixon JM, Renshaw L et al. Suppression of plasma estrogen levels by letrozole and anastrozole is related to body mass index in patients with breast cancer. J Clin Oncol 2012; 30 (24): 2977–2980. doi: 10.1200/JCO. 2012.42.0273.
16. Soler JT, Folsom AR, Kaye SA et al. Associations of abdominal adipozity, fasting insulin, sex hormone binding globulin, and estrone with lipids and lipoproteins in post-menopausal women. Aterosclerosis 1989; 79 (1): 21–27.
17. Casper RF, Mitwally FM. Review: aromatase inhibitors for ovulation induction. J Clin Endocrinol Metab 2006; 91 (3): 760–771.
18. Smith IE, Dowsett M, Yap YS et al. Adjuvant aromatase inhibitors for early breast cancer after chemotherapy-induced amenorrhoea: caution and suggested guidelines. J Clin Oncol 2006; 24 (16): 2444–2447.
19. Dowsett M, Folkerd E. Deficits in plasma oestradiol measurement in studies and management of breast cancer. Breast Cancer Res 2005; 7 (1): 1–4.
20. Referenční hodnoty laboratorních vyšetření OLM MOÚ. [online]. Dostupné z: www.mou.cz.
21. Folkerd EJ, Lonning PE, Dowsett M. Interpreting plasma estrogen levels in breast cancer: caution needed. J Clin Oncol 2014; 32 (14): 1396–1400. doi: 10.1200/JCO.2013.53.9411.
22. Burger HG, Dudley EC, Hopper JL et al. Prospectively measured levels of serum follicle-stimulating hormone, estradiol, and the dimeric inhibins during the menopausal transition in a population-based cohort of women. J Clin Endocrinol Metab 1999; 84 (11): 4025–4030.
23. Rossi E, Morabito A, Di Rella F et al. Endocrine effects of adjuvant letrozole compared with tamoxifen in hormone-responsive postmenopausal patients with early breast cancer: the HOBOE trial. J Clin Oncol 2009; 27 (19): 3192–3197. doi: 10.1200/JCO.2008.18.6213.
24. Han HS, Ro J, Lee KS et al. Analysis of chemotherapy-induced amenorhea rates by three different anthracycline and taxane containing regimens for early breast cancer. Breast Cancer Res Treat 2009; 115 (2): 335–342. doi: 10.1007/s10549-008-0071-9.
25. Sherman BM, Chapler FK, Crickard K et al. Endocrine consequences of continuous antiestrogen therapy with tamoxifen in premenopausal women. J Clin Invest 1979; 64 : 398–404.
26. Krekow LK, Hellrstedt BA, Collea RP et al. Incidence and predictive factors for recovery of ovarian function in amenorrheic women in their 40s treated with letrozole. J Clin Oncol 2016; 34 (14): 1594–1600. doi: 10.1200/JCO.2015.62.2985.
27. Guerrero A, Gavilá J, Folkerd E et al. Incidence and predictors of ovarian function recovery (OFR) in breast cancer (BC) patients with chemotherapy-induced amenorrhea (CIA) who switched from tamoxifen to exemestane. Ann Oncol 2013; 24 (3): 674–679. doi: 10.1093/annonc/mds464.
28. Bines J, Oleske DM, Cobleigh MA. Ovarian function in premenopausal women treated with adjuvant chemotherapy for breast cancer. J Clin Oncol 1996; 14 (5): 1718–1729.
29. Bellet M, Gray KP, Francis PA et al. Twelve-month estrogen levels in premenopausal women with hormone receptor – positive breast cancer receiving adjuvant triptorelin plus exemestane or tamoxifen in the suppression of ovarian function trial (SOFT): the SOFT-EST substudy. J Clin Oncol 2016; 34 (14): 1584–1593. doi: 10.1200/JCO.2015.61.2259.
30. Fait T. Klimakterická medicína. Maxdorf 2006 : 15–17.
31. Morrow PK, Mattair DN, Hortobagyi GN. Hot flashes: a review of pathophysiology and treatment modalities. Oncologist 2011; 16 (11): 1658–1664. doi: 10.1634/theoncologist.2011-0174.
32. Loprinzi CL, Zahasky KM, Sloan JA et al. Tamoxifen-induced hot flashes. Clin Breast Cancer 2000; 1 (1): 52–56.
33. Howell A, Cuzick J, Baum M et al. Results of the ATAC (arimidex, tamoxifen, alone or in combination) trial after completion of 5 years’ adjuvant treatment for breast cancer. Lancet 2005; 365 (9453): 60–62.
34. Thurlimann B, Keshavian A, Coates AS et al. A comparison of letrozole and tamoxifen in postmenopausal women with early breast cancer. N Eng J Med 2005; 353 (26): 2747–2757.
35. Coombes RC, Kilbum LS, Snowdon CF et al. Survival and safety of exemestane versus tamoxifen after 2–3 years tamoxifen treatment (Intergroup Exemes - tane Study): a randomised controlled trial. Lancet 2007; 369 (9561): 559–570.
36. Jakesz R, Jonat W, Gnant M et al. Switching of postmenopausal women with endocrine-responsive early breast cancer to anastrozole after 2 years’ adjuvant tamoxifen: combined results of ABCSG trial 8 and ARNO 95 trial. Lancet 2005; 366 (9484): 455–462.
37. Mar Fan HG, Houédé-Tchen N, Chemerynsky I et al. Menopausal symptoms in women undergoing chemotherapy-induced and natural menopause: a prospective controlled study. Ann Oncol 2010; 21 (5): 983–987. doi: 10.1093/annonc/mdp394.
38. Barton DL, LaVasseur BI, Sloan JA et al. Phase III, placebo-controlled trial of three doses of citalopram for the treatment of hot flashes: NCCTG Trial N05C9. J Clin Oncol 2010; 28 (20): 3278–3283. doi: 10.1200/JCO.2009.26.6379.
39. Loprinzi CL, Kugler JW, Sloan JA et al. Venlafaxine in management of hot flashes in survivors of breast cancer: a randomised controlled trial. Lancet 2000; 356 (9247): 2059–2063.
40. Guttuso T Jr, Kurlan R, McDermott MP et al. Gabapentin’s effects on hot flashes in postmenopausal women: a randomized controlled trial. Obstet Gynecol 2003; 101 (2): 337–345.
41. Bordeleau L, Pritchard KI, Loprinzi CL et al. Multicenter, randomized, cross-over clinical trial of venlafaxine versus gabapentin for the management of hot flashes in breast cancer survivors. J Clin Oncol 2010; 28 (35): 5147–5152. doi: 10.1200/JCO.2010.29.9230.
42. Laufer LR, Erlik Y, Meldrum DR et al. Effect of clonidine on hot flashes in postmenopausal women. Obst Gynecol 1982; 60 (5): 583–586.
43. Dew JE, Wren BG, Eden JA. A cohort study of topical vaginal estrogen therapy in women previously treated for breast cancer. Climacteric 2003; 6 (1): 45–52.
44. Kendall A, Dowsett M, Folkerd E et al. Caution: vaginal estradiol appears to be contraindicated in postmenopausal women on adjuvant aromatase inhibitors. Ann Oncol 2006; 17 (4): 584–587.
45. Wills S, Ravipati A, Venuturumilli P et al. Effects of vaginal estrogens on serum estradiol levels in postmenopausal breast cancer survivors and women at risk of breast cancer taking an aromatase inhibitor or a selective estrogen receptor modulator. J Oncol Practice 2012; 8 (3): 144–148. doi: 10.1200/JOP.2011.000352.
46. Nilsson K, Heimer G. Low-dose oestradiol in the treatment of urogenital oestrogen deficiency – a pharmacokinetic and pharmacodynamic study. Maturitas 1992; 15 (2): 121–127.
47. Key T, Appleby P, Barnes I et al. Endogenous hormones and breast cancer collaborative group. endogenous sex hormones and breast cancer in postmenopausal women: reanalysis of nine prospective studies. J Natl Cancer Inst 2002; 94 (8): 606–616.
48. Lonning PE, Haynes B, Straume AH et al. Exploring breast cancer estrogen disposition: the basis for endocrine manipulation. Clin Cancer Res 2011; 17 (15): 4948–4958. doi: 10.1158/1078-0432.CCR-11-0043.
49. Nachtigall LE. Comparative study: replens versus local oestrogen in menopausal women. Fertil Steril 1994; 61 (1): 178–180.
50. Loprinzi CL, Abu-Ghazaleh S, Sloan J et al. Phase III randomized double blind study to evaluate the efficacy of a polycarbophil-based vaginal moisturizer in women with breast cancer. J Clin Oncol 1997; 15 (3): 969–973.
51. Van der Laak JA, de Bie LM, de Leeuw H et al. The effect of Replens on vaginal cytology in the treatment of postmenopausal atrophy: cytomophology versus computerised cytometry. J Clin Pathol 2002; 55 (6): 446–451.
52. Informace o přípravku Regelle Intimed. [online]. Dostupné z: http: //www.dmdrogeriemarkt.cz/cz_homepage/nove/nove_produkty/771700/regelle.html; http: //www.intimedcare.cz/.
53. Donders G, Neven P, Moegele M et al. Ultra-low-dose estriol and Lactobacillus acidophilus vaginal tablets (Gynoflor®) for vaginal atrophy in postmenopausal breast cancer patients on aromatase inhibitors: pharmacokinetic, safety, and efficacy phase I clinical study. Breast Cancer Res Treat 2014; 145 (2): 371–379. doi: 10.1007/s10549-014-2930-x.
54. Goetsch MF, Lim JY, Caughey AB. A Practical solution for dyspareunia in breast cancer survivors: a randomized controlled trial. J Clin Oncol 2015; 33 (30): 3394–3400. doi: 10.1200/JCO.2014.60.7366.
55. Perez EA. Safety profiles of tamoxifen and the aromatase inhibitors in adjuvant therapy of hormone-responsive early breast cancer. Ann Oncol 2007; 18 (Suppl 8): viii26–viii35.
56. McCloskey E, Eastell R, Lakner G et al. Initial results from the LEAP study: the first direct comparison of safety parameters between aromatase inhibitors in healthy postmenopausal women. Breast Canbcer Res Treat 2005; 94 (Suppl 1): abstr. 2052.
57. Štěpán J. Osteoporóza a zlomeniny ve vyšším věku. [online]. Dostupné z: http: //www.osteo-liga.cz/index.php/osteoporoza.
58. Cooper C. The crippling consequences of fractures and their impact on quality of life. Am J Med 1997; 103 (2A): 12S–17S.
59. Roberts SE, Goldacre MJ. Time trends and demography of mortality after fractured neck of femur in an English population, 1968–98: database study. BMJ 2003; 327 (7418): 771–775.
60. Colón-Emeric C, Kuchibhatla M, Pieper C. The contribution of hip fracture to risk of subsequent fractures: data from two longitudinal studies. Osteoporos Int 2003; 14 (11): 879–883.
61. Coleman RE. Effect of anastrozole on bone mineral density: 5-year results from the ’Arimidex’, tamoxifen, alone or in combination (ATAC) trial. J Clin Oncol 2006; 24 (Suppl): 5s; abstr. 511.
62. Perez EA, Josse RG, Pritchard KI et al. Effect of letrozole versus placebo on bone mineral density in women with primary breast cancer completing 5 or more years of adjuvant tamoxifen: a companion study to NCIC CTG MA.17. J Clin Oncol 2006; 24 : 3229–3635.
63. Coleman RE, Banks LM, Girgis SI et al. Skeletal effects of exemestane on bone-mineral density, bone biomarkers, and fracture incidence in postmenopausal women with early breayst cancer participating in the Intergroup Exemestane Study (IES): a randomised controlled study. Lancet Oncol 2007; 8 (2): 119–127.
64. Hadji P, Body JJ, Aapro MS et al. Practical guidance for the management of aromatase inhibitor-associated bone loss. Ann Oncol 2008; 19 (8): 1407–1416. doi: 10.1093/annonc/mdn164.
65. Jackson RD, LaCroix AZ, Gass M et al. Calcium plus vitamin D supplementation and the risk of fractures. N Engl J Med 2006; 354 (7): 669–683.
66. Gnant MF, Mlineritsch B, Luschin-Ebengreuth G et al. Zoledronic acid effectively prevents cancer treatment-induced bone loss in premenopausal women receiving adjuvant endocrine therapy for hormone-responsive breast cancer: a report from the Austrian Breast and Colorectal Cancer Study Group. J Clin Oncol 2007; 25 (7): 820–828.
67. Brufsky A, Harker WG, Beck JT et al. Zoledronic acid inhibits adjuvant letrozole-induced bone loss in postmenopausal women with early breast cancer. J Clin Oncol 2007; 25 (7): 829–836.
68. Bundred N, Cambell I, Coleman R et al. Zoledronic acid in the prevention of cancer treatment-induced bone loss in postmenopausal women receiving letrozole as adjuvant therapy for early breast cancer (ZOFAST study). Nice, France: Presented at 5th European Breast Cancer Conference, 21–25 March 2006; abstr. 12.
69. Schenk N, Lombart A, Frassoladti A et al. The E-ZO-FAST trial: zoledronic acid (ZA) effectively inhibits aromatase inhibitor associated bone loss (AIBL) in postmenopausal women (PMW) with early breast cancer (EBC) receiving adjuvant letrozole (LET). Barcelona, Spain: presented at ECCO 14: the European Cancer Conference, 23–27 September 2007; abstr. 2008.
70. De Boer R. Zoledronic acid in the prevention of aromatase inhibitor-associated bone loss in postmenopausal women receiving letrozole as adjuvant therapy for early breast cancer (ZO-FAST Trial). Breast Cancer Res Treat 2007; 106 (Suppl 1): S36; abstr. 501.
71. Coleman R, Gnant M, Paterson A et al. Effects of bisphosphonate treatment on recurrence and cause-specific mortality in women with early breast cancer: a meta-analysis of individual patient data from randomised trials. Program and abstracts of the 2013 San Antonio Breast Cancer Symposium; December 10–14, 2013; San Antonio, Texas: abstr. S4–07.
72. Crew K, Greenlee H, Capodice J et al. Prevalence of joint symptoms in postmenopausal women taking aromatase inhibitors for early stage breast cancer. J Clin Oncol 2007; 25 (25): 3877–3883.
73. Henry N, Giles J, Ang D et al. Prospective characterization of musculoskeletal symptoms in early stage breast cancer patients treated with aromatase inhibitors. Breast Cancer Res Treat 2008; 111 (2): 365–372.
74. Cuzick J, Sestak I, Cella D. Treatment-emergent endocrine symptoms and the risk of breast cancer recurrence: a retrospective analysis of the ATAC Trial. Lancet Oncol 2008; 9 (12): 1143–1148. doi: 10.1016/S1470-2045 (08) 70259-6.
75. Hadji P, Kieback D, Tams J et al. Correlation of treatment-emergent adverse events and clinical response to endocrine therapy in early breast cancer: a retrospective analysis of the German cohort of TEAM. Ann Oncol 2012; 23 (10): 2566–2572.
76. Huober J, Cole B, Wu J et al. Symptoms of endocrine treatment and outcome: a retrospective analysis of the monotherapy arms of the BIG 1-98 trial. Paper presented at: 2011 ASCO Annual Meeting; June 2011, Chicago, IL.
77. Cutolo M, Villagio B, Seriolo B et al. Synovial fluid estrogens in rheumatoid arthritis. Autoimmun Rev 2003; 3 (3): 193–198.
78. Moraless L, Pans S, Paridaens R et al. Debilitanting musculoskeletal pain and stiffness with letrozole and exemestane: associated tenosynovial changes on magnetic resonance imaging. Breast Cancer Res Treat 2007; 104 (1): 87–91.
79. Irwin ML, Cartmel B, Gross CP et al. Randomized exercise trial of aromatase inhibitor-induced arthralgia in breast cancer survivors. J Clin Oncol 2015; 33 (10): 1104–1111. doi: 10.1200/JCO.2014.57.1547.
80. Briot K,Tubiana-Hulin M, Bastit L et al. Effect of a switch of aromatase inhibitors on musculoskeletal symptioms in postmenopausal women with hormone-receptor-positive breast cancer: the ATTOL study. Breast Cancer Res Treat 2010; 120 (1): 127–134.
81. Khan Q, Reddy P, Kimler B et al. Effect of vitamin D supplentation on serum 25 hydroxy vitamin D levels, joint pains, and fatique in women starting adjuvant letrozole treatment for breast cancer. Breast Cancer Res Treat 2010; 119 (1): 111–118. doi: 10.1007/s10549-009-0495-x.
82. Crew KD, Capodice JL, Greenlee H et al. Randomized, blinded, sham-controlled trial of acupuncture for the management of aromatase inhibitor-associated joint symptoms in women with early-stage breast cancer. J Clin Oncol 2010; 28 (7): 1154–1160. doi: 10.1200/JCO.2009.23.4708.
83. Greenlee H, Crew KD, Shao T et al. Phase II study of glucosamine with chondroitin on aromatase inhibitor-associated joint symptoms in women with breast cancer. Supp Care Cancer 2013; 21 (4): 1077–1087. doi: 10.1007/s00520-012-1628-z.
84. Kubo M, Onishi H, Kuroki S et al. Short term and low-dose prednisolone administration reduces aromatase inhibitor-induced arthralgia in patients with breast cancer. Anticancer Res 2012; 32 (6): 2331–2336.
85. Henry N, Banerjee M, Wicha M et al. Pilot study of duloxetine for treatment of aromatase inhibitor-associated musculoskeletal symptomas. Cancer 2011; 117 (24): 5469–5475. doi: 10.1002/cncr.26230.
86. Andreetta C, Smith I. Adjuvant endocrine therapy for early breast cancer. Cancer Lett 2007; 251 (1): 17–27.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek Editorial
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2016 Číslo Supplementum 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- S těhotenstvím spojený karcinom prsu
- Těhotenství po léčbě karcinomu prsu
- Ovariální ablace u pacientek s karcinomem prsu a možnosti ovlivnění vedlejších účinků léčby
- Editorial
- Léčba inhibitory aromatázy u postmenopauzálních pacientek s karcinomem prsu a možnosti ovlivnění nežádoucích účinků
- Sledování cirkulujících hladin estradiolu u pacientek s karcinomem prsu léčených inhibitory aromatázy – přínos v klinické praxi
- Karcinom prsu – specifika gynekologické péče a poradenství
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Léčba inhibitory aromatázy u postmenopauzálních pacientek s karcinomem prsu a možnosti ovlivnění nežádoucích účinků
- Karcinom prsu – specifika gynekologické péče a poradenství
- Sledování cirkulujících hladin estradiolu u pacientek s karcinomem prsu léčených inhibitory aromatázy – přínos v klinické praxi
- Těhotenství po léčbě karcinomu prsu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



