-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Elongázy mastných kyselin a jejich účast v patogeneze chorobných stavů
Fatty acid elongases and their involvement in the pathogenesis of disease states
Fatty acids possess plenty of functions in human organism. They take a part in regulation of the structure and function of cell membranes and signal pathways, transcription factors activities and gene expression. Fatty acid profiles in the individual tissues are determined by dietary intake, endogenous synthesis, catabolism and as well by desaturation and elongation processes, that are catalysed by the enzymes – desaturases and elongases. Elongases play a principal role in the synthesis of very long chain fatty acids (chain with 22 or more carbons), both saturated and unsaturated. Dysregulation of fatty acid metabolism was recognized to be associated with many diseases, such as atherosclerosis and its complications, type 2 diabetes mellitus, neuropsychiatric and malignant diseases, as well. Activities of fatty acid elongases could serve as significant markers of abovementioned diseases. Moreover, modulation of elongase activities could represent a therapeutic option in some cases.
Keywords:
Metabolism – fatty acids – desaturases – elongases
Autoři: M. Zeman; J. Macášek; M. Vecka; B. Staňková; A. Žák
Působiště autorů: IV. Interní klinika, 1. LF UK a VFN v Praze, U Nemocnice 2, Praha 2, 128 01
Vyšlo v časopise: Klin. Biochem. Metab., 27, 2019, No. 2, p. 66-71
Souhrn
Mastné kyseliny mají v lidském organismu řadu funkcí. Účastní se regulace struktury i funkce buněčných membrán, intracelulárních signálních cest, regulují aktivitu transkripčních faktorů a expresi genů. Profil mastných kyselin v jednotlivých tkáních je dán jejich příjmem ve stravě, jejich endogenní syntézou, katabolismem a přeměnou desaturačními a elongačními pochody, katalyzovanými enzymy desaturázami a elongázami. Elongázy hrají zásadní roli při syntéze mastných kyselin s velmi dlouhým řetězcem (délka řetězce ≥ 22 uhlíků), jak nasycených, tak nenasycených. Poruchy regulace mastných kyselin jsou spojeny s řadou chorobných stavů (např. diabetes mellitus, ateroskleróza a její komplikace, arteriální hypertenze, neuropsychiatrická i nádorová onemocnění. Aktivity elongáz mastných kyselin by mohly sloužit jako významné klinické biomarkery uvedených onemocnění a v některých případech by modulace jejich aktivit mohla být i terapeutickým cílem.
Klíčová slova:
metabolismus – mastné kyseliny – desaturázy – elongázy
Metabolické přeměny mastných kyselin
Mastné kyseliny (MK) jsou v organismu zdrojem energie, ale také významným způsobem ovlivňují metabolismus buněk i tkání člověka. Účastní se regulace struktury i funkce buněčných membrán, intracelulárních signálních cest, regulují aktivitu transkripčních faktorů a expresi genů [1]. Mastné kyseliny lze dělit podle nasycenosti alifatického uhlíkového řetězce na nasycené (SFA), monoenové (MFA) a vícenenasycené (polyenové, PUFA). Podle délky uhlíkového řetězce se dále mohou rozdělovat na mastné kyseliny s krátkým řetězcem (short-chain fatty acid - SCFA), jejichž řetězec je kratší než šest uhlíků, mastné kyseliny se středně dlouhým řetězcem (medium-chain fatty acids – MCFA), obsahujícím 6 až 12 uhlíků, dlouhým řetězcem (long-chain fatty acids – LCFA) s 13 až 21 uhlíky a mastné kyseliny s velmi dlouhým řetězcem (very long-chain fatty acids - VLCFA), zahrnujícím 22 a více uhlíků.
Spektrum mastných kyselin v tkáních organismu je dáno jejich příjmem ve stravě, endogenní syntézou „de novo“ i jejich dalším metabolismem (desaturace, elongace a degradace beta-oxidací či lipoperoxidací). Výsledný profil MK je u každého jedince ovlivněn rasovými, etnickými, genetickými faktory i působením různých onemocnění [2]. Složení MK esterifikovaných v různých lipidových třídách (estery cholesterolu, celkové fosfolipidy, fosfatidylcholiny, triacylglyceroly) vykazuje u různých patologických stavů specifické odchylky. Velký význam mají i faktory genetické. Endogenní syntézou jsou vytvářeny nasycené MK (SFA) až ke kyselině palmitové (16 : 0). V další fázi vznikají sledem desaturací a elongací SFA s dlouhým a velmi dlouhým řetězcem, monoenové MK (MFA) a mastné kyseliny s více dvojnými vazbami v řetězci (PUFA). Desaturace jsou katalyzovány enzymy desaturázami, které zavádějí do molekuly mastné kyseliny dvojné vazby. Nasycené MK palmitová (16 : 0) a stearová (18 : 0) jsou desaturovány na odpovídající monoenové mastné kyseliny (palmitolejová, 16 : 1 n-7 a olejová, 18 : 1 n-9) za účasti klíčového enzymu syntézy MFA stearoyl-CoA desaturázy-1 (SCD1), neboli delta-9 desaturázy, D9D). Postupně vznikají MK s delším řetězcem a více dvojnými vazbami (LC-PUFA s více než 18 uhlíky a VLC-PUFA s více než 22 uhlíky. MFA mají význam pro udržování lipidových struktur, pro signální transdukci, buněčnou diferenciaci i pro apoptózu. SCD-1 je považována za klíčový regulátor oxidace lipidů a de novo lipogeneze [3]. Delta-5 desaturáza (D5D) a D6D katalyzují postupnou přeměnu MK na vícenenasycené MK (PUFA). U člověka desaturázy PUFA zavádějí dvojnou vazbu mezi již existující dvojnou vazbu a karboxylový konec PUFA [4]. Symbol delta označuje číslo uhlíku MK, počítáno od karboxylového konce. Jelikož savci nejsou vybaveni delta-12 a delta-15 desaturázami, nemohou přeměňovat 18 : 1 n-9 na PUFA s dlouhým řetězcem a musí ze stravy získávat tzv. esenciální MK (kyselina linolová, 18 : 2 n-6 a alfa-linolenová, 18 : 3 n-3), které vznikají působením delta-12 a delta-15 desaturáz v rostlinách [5]. Při zavádění dalších dvojných vazeb do molekul mastných kyselin se uplatňují D5D a D6D, které jsou kódovány clusterem genů FADS (fatty acid desaturase) na chromozomu 11 [6]. Prodlužování řetězce mastných kyselin s více než dvanácti uhlíky je realizováno postupnou adicí dvouuhlíkatých jednotek působením enzymů elongáz, kódovaných skupinou genů na chromozomu 6 [7]. Zatímco význam aktivit desaturáz mastných kyselin pro metabolismus byl intenzivně studován, znalosti o významu jednotlivých elongáz jsou dosud podstatně menší.
Elongázy mastných kyselin
Elongace MK probíhá v cytosolu, mitochondriích, a zejména v mikrosomech. Mikrosomální elongace MK probíhá ve čtyřech cyklech – kondenzace, redukce, dehydratace a redukce za účasti MK s 12 nebo více uhlíky jak z endogenních, tak z exogenních zdrojů [7], viz též obr. 1.
Obr. 1. Elongation of fatty acid in mammals. The elongation cycle of fatty acids and respective enzyme is presented. Acyl-CoA incorporates two-carbon unit from malonyl CoA in every turn of elongation cycle. ELOVL = elongation of very long-chain fatty acids; KAR = 3-ketoacyl-CoA reductase; HACD = 3-hydroxyacyl-CoA dehydratase; TER = trans-2-enoyl-CoA reductase. 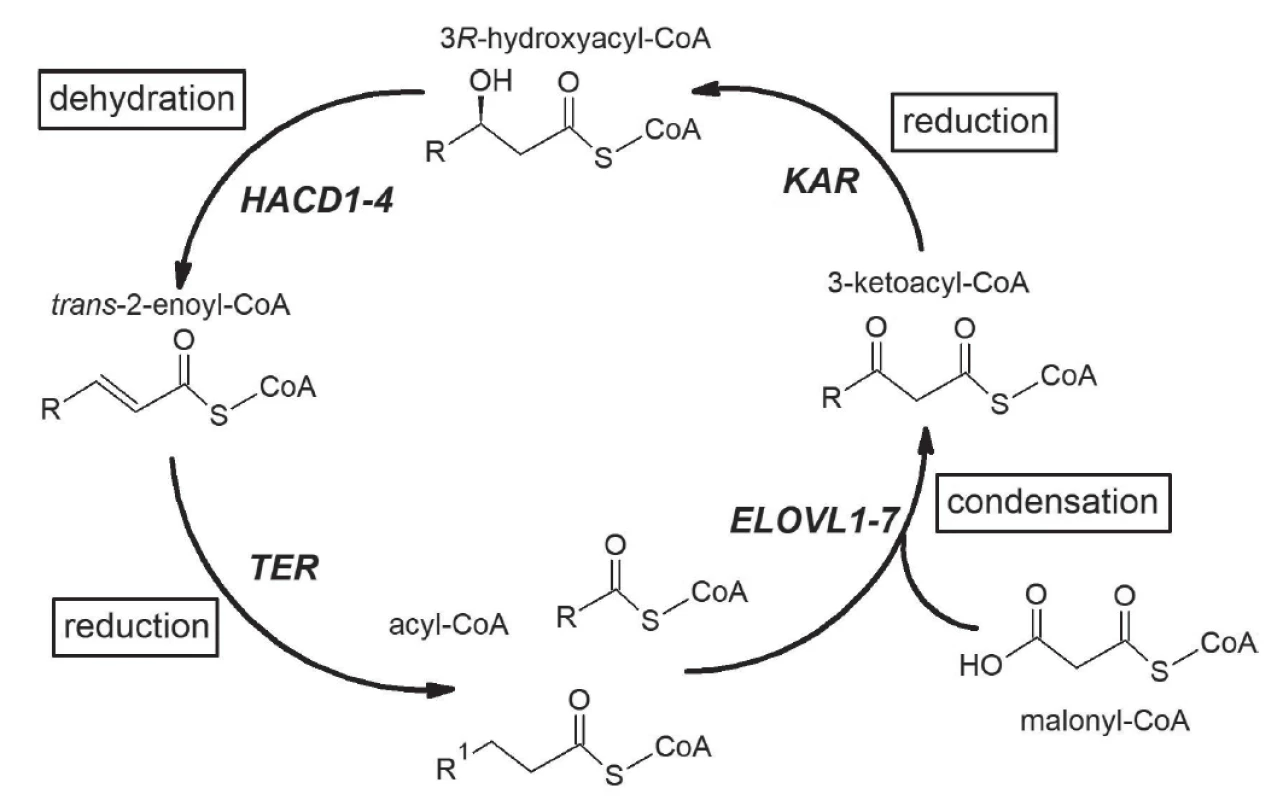
U savců je klíčová první kondenzační reakce katalyzována enzymy elongázami. V současné době známe sedm elongáz mastných kyselin (ELOVL, elongation of very long-chain fatty acids) [8]. ELOVL1, ELOVL3, ELOVL6 a ELOVL7 katalyzují elongaci zejména SFA a MFA, zatímco ELOVL2, ELOVL4 a ELOVL5 preferují jako substrát PUFA [7]. ELOVL1, 3, 4, 6 a 7 se podílejí na elongaci SFAs a MFAs. ELOVL6 působí při elongaci C16 : 0-CoA nebo kratších nasycených MK. Geny pro ELOVL 1, 5 a 6 (ELOVL1, ELOVL5 a ELOVL6) jsou nacházeny ve všech tkáních, exprese ELOVL2, ELOVL3, ELOVL4 a ELOVL7 je výrazně tkáňově specifická. Produkty ELOVL 1, 5 a 6 jsou proto přítomny téměř ve všech tkáních [7]. Exprese ELOVL2 je nejvyšší v játrech a varlatech, ELOVL3 v tukové tkáni, kůži a játrech a ELOVL4 v sítnici, kůži, mozku a varlatech [9]. Tkáňově specifické exprese jednotlivých elongáz pravděpodobně souvisejí s požadavky příslušných tkání na specifické VLCFA, které jsou produkty určitých elongáz. V buňkách uvedených tkání probíhá elongace mastných kyselin zejména na membránách endoplasmatického retikula. Proteiny ELOVL1-7 mají 5 až 7 transmembránových domén a na karboxylovém konci mají lysin nebo arginin [10]. V experimentálních studiích in vitro je možné elongázy stanovit v homogenátech příslušné tkáně (nejčastěji se jedná o játra či tukovou tkáň), po izolaci mikrosomální frakce [10,11]. Přímé stanovení ELOVL je u člověka z etických důvodů obtížné, proto se obecně užívá jejich odhad vypočteným poměrem produkt/prekurzor; např. odhadovaná aktivita ELOVL6 poměrem kyselina stearová (18 : 0) / kyselina palmitová (16 : 0), ELOVL 2 poměrem kyselina dokosapentaenová n-3 (22 : 5 n-3) / kyselina eikosapentaenová (20 : 5 n-3) nebo kyselina dokosatetraenová (22 : 4 n-6)/ kyselina arachidonová (20 : 4 n-6), ELOVL5 poměrem 20 : 5 n-3/18 : 3 n-3, atd. Tyto indexy mohou být vypočítávány z hodnot koncentrací relevantních mastných kyselin v lipidech celé plasmy, ve frakci neesterifikovaných mastných kyselin či v esterifikovaných v hlavních lipidových třídách (fosfolipidy, triacylglyceroly, estery cholesterolu).
Elongázy mastných kyselin u patologických stavů
ELOVL1 elonguje nasycené MK s 18-22 uhlíky, také monoenové 20 : 1 n-9 a 22 : 1 n-9 acyl-CoA (7) a je odpovědná za syntézu MK s velmi dlouhým řetězcem (VLCFA). Elonguje mastné kyseliny s 22 uhlíky (C22 MK) na C24 a 26 MK. Funkce ELOVL1 je významná pro syntézu tzv. C24 sfingolipidů [7], obsahujících ve své struktuře např. kyselinu lignocerovou (24 : 0) nebo nervonovou (24 : 1 n-9). Tyto sfingolipidy jsou charakterizovány specifickými fyzikálními vlastnostmi, které umožňují v membránách vznik lipidových mikrodomén a ovlivňují tak i signální transdukci. Vysoká exprese ELOVL1 je v myelinu CNS a nálezy u experimentálních myších modelů myelinizační deficience ukazují na význam tvorby VLC-SFA a sfingolipidů pro myelinizaci [7].
ELOVL2 je specifická elongáza vícenenasycených MK. Exprese ELOVL2 je nejvyšší v játrech a varlatech, ale je zjišťována také v tukové tkáni, ledvinách, mozku a v plicích. ELOVL2 elonguje kyselinu arachidonovou (20 : 4 n-6), eikosapentaenovou (EPA, 20 : 5 n-3) adrenovou (22 : 4n-6) a dokosapentaenovou (DPA, 22 : 5 n-3) [7]. U ELOVL2 knockoutovaných myší jsou zvýšené hladiny kyseliny adrenové a DPA, zatímco koncentrace jejich derivátů jsou výrazně sníženy. Aktivita ELOVL2 je rozhodující pro elongaci MK s 22 C, jak n-6, tak i n-3 řady. V játrech má ELOVL2 význam pro tvorbu DHA a inhibici akumulace tuků v hepatocytu u nealkoholové jaterní steatózy, přičemž důsledky poklesu endogenní syntézy DHA mohou být zmírněny exogenním přívodem DHA ve stravě [12]. I v případě ELOVL2 několik studií sledovalo vliv genetických polymorfismů na metabolické i klinické parametry. U nosičů minoritních alel ELOVL2
byla zjištěna nižší míra elongace PUFA s následným vzestupem koncentrací substrátů a poklesem hladin produktů příslušných metabolických cest [13]. V Itálii byla u osob, zúčastněných ve studii InCHIANTI, zjištěna významná asociace polymorfismu ELOVL2 (rs953413 G>A) s koncentrací EPA, zatímco ve studii GOLDN (Genetics of Lipid Lowering Drugs and Diet Network) byl SNP ELOVL2 asociován s koncentrací kyseliny dokosapentaenové (22 : 5 n-3) a s DHA (vyšší hladiny DPA a nižší DHA u nosičů minoritní alely A) [14]. V čínské populaci byl studován vliv polymorfismů FADS1/2 a ELOVL2 na poruchy autistického spektra a bylo mimo jiné zjištěno, že polymorfismy FADS2 rs526126 and ELOVL2 rs10498676 byly asociovány s menším rizikem poruchy a A/A genotyp rs10498676 koreloval s poklesem schopnosti verbální i nonverbální komunikace [15].ELOVL3 je exprimována v tukové tkáni, kůži, sebaceózních žlázkách, vlasových folikulech a játrech. Elonguje nasycené a monoenové MK s 16 až 22 uhlíky, přičemž s nejvyšší aktivitou působí na elongaci aktivovaných MK s 18 uhlíky [7]. Z hlediska rozdílnosti metabolických vlastností jednotlivých tělesných depot tukové tkáně je zajímavé, že ELOVL3 je zvláště exprimována v hnědých a „béžových“ adipocytech a její exprese mnohonásobně stoupá v hnědé tukové tkáni po indukci chladem, což ukazuje na možnou funkční specificitu ELOVL3 [16]. Delece genu pro ELOVL3 u myší působí poruchu tvorby srsti, hyperplastické sebaceózní žlázy a abnormality kožní bariéry. V lipidech srsti postižených hlodavců se hromadí kyselina gondoová (20 : 1 n-9), proto gondooyl-CoA by mohla být hlavním substrátem ELOVL3.
ELOVL4. Elonguje jak nasycené, tak nenasycené mastné kyseliny, je však specializována pro syntézu tzv. „ultra dlouhých mastných kyselin” (ULCFA), tedy MK s více než 26 uhlíky v řetězci [17] a nachází se proto ve tkáních, které ULCFA tvoří. Patří sem zejména fotoreceptorové buňky v sítnici, v mozku a varlatech, kde jsou koncentrovány ULC-PUFA a také v kůži, kde se nacházejí ULC-SFA [18]. ULC-PUFA v rozvíjejícím se i v dospělém mozku mají významné, dosud ne zcela známé funkce. Myši homozygotní pro chybění ELOVL4 umírají za několik hodin po narození. Mutace genu pro ELOVL4 odpovídá za autosomálně dominantní formu Stargardtovy makulární degenerace (STGD). Makulární degenerace je charakterizována degenerativními změnami fotoreceptorů a atrofií retinálních pigmentových epitelií [19]. Tyto nálezy ukazují na to, že pro normální funkci sítnice není důležitá jen DHA, ale také ULC-PUFA.
ELOVL5 je exprimována nejvíce v Purkyňových buňkách, plicích, varlatech, nadledvinách, ale nachází se i v dalších tkáních. ELOVL5 elonguje PUFA s 18 a 20 uhlíky. Její funkce se částečně překrývá s ELOVL2, na rozdíl od ELOVL2 však nekatalyzuje elongaci PUFA s 22 a více uhlíky. Deplece ELOVL5 vede k poklesu hladin v mikrozomech k elongaci 18 : 3 n-6 na 20 : 3 n-6 a 18 : 4 n-3 na 20 : 4 n-3, což vede k poklesu výsledných produktů, tj. 20 : 4 n-6 and 22 : 6 n-3. U myší s deplecí těchto MK v hepatocytech dochází k rozvoji jaterní steatózy, je pozorována upregulace transkripčního faktoru SREBP-1c (sterol regulatory element binding protein-1c) a jeho cílových genů [7]. Významné je, že ELOVL5 kromě PUFA elonguje také některé MFA, např. kyselinu palmitolejovou (16 : 1 n-7) za vzniku kyseliny cis-vakcenové (18 : 1 n-7) [20, 21]. V experimentu vedla restaurace aktivity ELOVL5 v játrech obézních myší s porušenou glukózovou tolerancí k vzestupu koncentrace 18 : 1 n-7, PUFA s 20-22 uhlíky v játrech i v plasmě a současně k úpravě inzulinové rezistence, glukózové tolerance a k poklesu glykémie [22]. Aktivita ELOVL5, podobně jako ELOVL2, určuje spektrum vytvářených PUFA a jejich následně tvořených metabolitů. Polymorfismy ELOVL5 ovlivňují spektrum MK v mateřském mléce. Nosičky minoritních alel SNPs (rs2397142 a rs9357760) ELOVL5 měly vyšší hladiny kyseliny linolové (18 : 2 n-6), dihomo-γ-linolenové (20 : 3 n-6), dokosatetraenové (adrenové, 22 : 4 n-6) a dokosahexaenové (DHA, 22 : 6 n-3) zatímco v případě polymorfismu rs209512 ELOVL5 byla přítomnost minoritních alel spojena s nižší hladinou adrenové kyseliny než u homozygotů majoritních alel [23]. Mutace genu pro ELOVL5 působí spinocerebelární ataxii (SCA), což je heterogenní skupina autosomálně dominantních neurodegenerativních onemocnění. V jedné studii u SCA38 byla identifikována u ELOVL5 mutace (c.689G>T [p.Gly230Val]) na 6. chromozomu. V séru postižených jedinců byly nalezeny snížené koncentrace kyseliny arachidonové (AA, 20 : 4 n-6) a DHA [24]. Polymorfismy ELOVL5 jsou asociovány s náchylností ke vzniku glaukomu [25]. Uvažuje se zde o vztahu nedostatku DHA k poškození neuronů oxidačním stresem. Na druhé straně v jedné studii nebyly u variací ELOVL2, ELOVL4 a ELOVL5 nalezeny asociace s mastnými kyselinami tukové tkáně, kardiovaskulárními rizikovými faktory (hsCRP, HDL-cholesterol, triacylglyceroly) nebo rizikem infarktu myokardu [26].
ELOVL6 katalyzuje elongaci nasycených a monoenových MK s 12, 14 a 16 uhlíky a patří k hlavním enzymům, podílejícím se na endogenní syntéze MK. Vyřazení funkce ELOVL6 v experimentu vede k poklesu hladin kyseliny stearové (18 : 0) a olejové, (18 : 1 n-9) a k vzestupu kyseliny palmitové (16 : 0) a palmitolejové (16 : 1 n-7) [27]. Metabolické asociace a možné klinické konsekvence manipulací s aktivitou ELOVL6 byly zkoumány v experimentálních studiích. Ve studiích s cílenou delecí ELOVL6 bylo zjištěno např., že (ELOVL6-/-) myši, krmené vysokotukovou a vysokosacharidovou dietou byly, ve srovnání s běžnými kmeny chráněny před rozvojem inzulínové rezistence v játrech a před poruchou sekrece inzulínu v pankreatických beta-buňkách, přestože stupeň jaterní steatózy i obezity byly u obou skupin zvířat stejné [27, 28].
V nedávno publikované experimentální studii izolované pankreatické ostrůvky u ELOVL6 -/ - myší byly méně náchylné k zánětu indukovanému palmitátem, stressu endoplasmatického retikula a k apoptóze beta-buněk [29]. Zvýšená aktivita ELOVL6 hraje zřejmě roli v patogenezi některých nádorů, spojovaných s obezitou. Např. ve vzorcích tkáně hepatocelulárního karcinomu (HCC) byla nalezena u nemocných s kratším přežitím vyšší aktivita ELOVL6 než u osob s delším přežitím. Současně inhibice ELOVL6 v buňkách HCC u myší zpomalovala růst tumoru a prodlužovala přežití [30]. Ve studii u mužů, kteří absolvovali rutinní koloskopii, byl vzestup podílu kyseliny palmitolejové a elaidové v plazmatických fosfolipidech i aktivita SCD-1 a ELOVL6 asociovány s výskytem adenomů tlustého střeva i po adjustaci na rizikové faktory spojené s obezitou [31].
ELOVL6 by mohla sloužit jako nový časný biomarker rizika některých nádorů, možná i jako terapeutický cíl. Jen několik studií zkoumalo vliv variant ELOVL6 na klinické parametry. Nosiči minoritních alel jednoduchých nukleotidových polymorfismů (SNP) rs9997926 a rs6824447 ELOVL6 v populaci jižního Španělska měli nižší riziko inzulínové rezistence, zatímco u nosičů minoritní alely SNP rs17041272 bylo toto riziko vyšší [30]. Současně byla v této studii zaznamenána interakce mezi polymorfismem rs6824447 a složením tuku ve stravě při ovlivnění inzulínové rezistence. Podle autorů studie ELOVL6 by mohl být terapeutickým cílem při léčbě diabetes mellitus typu 2 a přidružených onemocnění [32]. V případové studii u nově zjištěných diabetiků 2. typu a zdravých osob byly studovány tři SNP ELOVL6. V případě SNP rs12504538 byla zjištěna asociace CT genotypu s inzulínovou rezistencí ve srovnání s genotypem TT; homozygoti s minoritní alelou C nebyli nalezeni. U dalších dvou SNP (rs17041272 a rs6824447) nebyly zjištěny žádné asociace mezi genotypy či frekvencemi alel s inzulínovou rezistencí [33].
ELOVL7 je exprimována v prostatě, ledvinách, pankreasu a v nadledvinkách [34]. ELOVL7 elonguje jak nasycené, tak nenasycené MK s 16 až 22 uhlíky, přičemž s nejvyšší aktivitou působí na 18 : 3 n-6 a 18 : 3 n-3 [7]. ELOVL7 je výrazně exprimována u karcinomu prostaty, kde se VLC-SFA a jejich deriváty podílejí na růstu a vitalitě nádorových buněk [34].
Závěr
Působení jednotlivých mastných kyselin na metabolické aktivity organismu je mnohostranné a spektrum mastných kyselin tkáňově specifické. Profil mastných kyselin v jednotlivých tkáních je výsledkem jejich příjmu ve stravě, jejich endogenní syntézy, katabolismu a přeměny desaturačními a elongačními pochody, katalyzovanými enzymy desaturázami a elongázami. Genetické polymorfismy genů FADS i ELOVL ovlivňují hladiny LC-PUFA na všech úrovních syntézy. Elongázy hrají zásadní roli také při syntéze mastných kyselin s velmi dlouhým řetězcem-VLCFA (délka řetězce ≥ 22 uhlíků), jak nasycených, tak nenasycených. VLCFA jsou součástmi membránových lipidů i prekursory lipidových mediátorů, zúčastněných v regulaci zánětu. Poruchy regulace mastných kyselin jsou spojeny s řadou chorobných stavů (např. diabetes mellitus, ateroskleróza a její komplikace, arteriální hypertenze, neuropsychiatrická i nádorová onemocnění). Aktivity elongáz mastných kyselin by mohly sloužit jako významné klinické biomarkery kardiometabolických, ale i neurologických či nádorových onemocnění a v některých případech by modulace jejich aktivit mohla být i terapeutickým cílem.
Poděkování
Práce byla podporována výzkumným záměrem RVO-VFN64165/2012, PROGRES Q25/1LF.
Autoři prohlašují, že nejsou ve střetu zájmů.
Do redakce došlo 16. 1. 2019
Adresa pro korespondenci:
Doc. MUDr. Miroslav Zeman, CSc.
IV. Interní klinika, 1. LF UK a VFN v Praze,
U Nemocnice 2, 128 01 Praha 2,
Na Bojišti 3, 128 08 Praha 2,
Telefon: +420 224 962 092
Fax: +420 224 923 524
E-mail: mirozem@centrum.cz
Zdroje
1. Calder, P. C. Functional Roles of Fatty Acids and Their Effects on Human Health. J. Parenter. Enteral. Nutr., 2015, 39, Suppl 1, p.18-32.
2. Hodson, L., Skeaff, C. M., Fielding, B. A. Fatty acid composition of adipose tissue and blood in humans and its use as a biomarker of dietary intake. Prog. Lipid. Res., 2008, 47(5), p.348-80.
3. Sampath, H., Ntambi, J. M. Stearoyl-coenzyme A desaturase 1, sterol regulatory element binding protein-1c and peroxisome proliferator-activated receptor-alpha: independent and interactive roles in the regulation of lipid metabolism. Curr. Opin. Clin. Nutr. Metab. Care., 2006, 9(2), p. 84-8.
4. Meesapyodsuk, D., Qiu, X. The front-end desaturase: structure, function, evolution and biotechnological use. Lipids, 2012, 47, p.227–237.
5. Simopoulos, A. P. Essential fatty acids in health and chronic disease. Am. J Clin. Nutr., 1999, 70, Suppl 3, p. 560-569.
6. Žák, A., Slabý, A., Tvrzická, E., Jáchymová, M., Macášek, J., Vecka, M., et al. Desaturases of fatty acids (FADS) and their physiological and clinical implication. Cas. Lek. Cesk., 2016,155(2), p.15-21.
7. Guillou, H., Zadravec, D., Martin, P. G., Jacobsson, A. The key roles of elongases and desaturases in mammalian fatty acid metabolism: Insights from transgenic mice. Prog. Lipid Res., 2010, 49, p.186–199.
8. Denic, V., Weissman, J. S. A molecular caliper me-
chanism for determining very long-chain fatty acid length. Cell, 2007, 130, p. 663-677.9. Mandal, M. N., Ambasudhan, R., Wong, P. W., Gage, P. J., Sieving, P. A., Ayyagari, R. Characterization of mouse orthologue of ELOVL4: genomic organization and spatial and temporal expression. Genomics, 2004, 83, p. 626-635.
10. Tvrdik, P., Westerberg, R., Silve, S., Asadi, A., Jakobsson, A., Cannon, B., Loison, G., Jacobsson, A. Role of a new mammalian gene family in the biosynthesis of very long chain fatty acids and sphingolipids. J Cell Biol. 2000 May 1;149(3):707-18.
11. Suneja, S. K., Nagi, M. N., Cook, L., and Cinti, D. L. 1991. Decreased long-chain fatty acyl CoA elongation activity in quaking and jimpy mouse brain: deficiency in one enzyme or multiple enzyme activities? J. Neurochem. 57 : 140–146.
12. Pauter, A. M., Olsson, P., Asadi, A., Herslöf, B., Csikasz, R. I., Zadravec, D., Jacobsson, A. Elovl2 ablation demonstrates that systemic DHA is endogenously produced and is essential for lipid homeostasis in mice. J. Lipid Res., 2014,55, p. 718–728.
13. de la Garza Puentes, A., Montes Goyanes, R., Chisaguano Tonato, A. M., Torres-Espínola, F. J., Arias García, M., de Almeida, L. et al. Association of maternal weight with FADS and ELOVL genetic variants and fatty acid levels - The PREOBE follow-up. PLoS One., 2017, 9,12(6):e0179135.
14. Tanaka, T., Shen, J., Abecasis, G. R., Kisialiou, A., Ordovas, J. M., Guralnik, J. M., Singleton, A., Bandinelli, S., Cherubini, A., Arnett, D. et al. Genome-wide association study of plasma polyunsaturated fatty acids in the InCHIANTI Study. PLoS Genet., 2009, 5 :e1000338 .
15. Sun, C., Zou, M., Wang, X., Xia, W., Ma, Y., Liang, S., et al. FADS1-FADS2 and ELOVL2 gene polymorphisms in susceptibility to autism spectrum disorders in Chinese children. BMC Psychiatry., 2018, 4,18(1), 283.
16. Westerberg, R., Månsson, J. E., Golozoubova, V., et al. Elovl3 Is an important component for early onset of lipid recruitment in brown adipose tissue. J Biol. Chem., 2006, 281(8), p. 4958–4968.
17. Ohno, Y., Suto, S., Yamanaka, M., Mizutani, Y., Mitsutake, S., Igarashi, Y., Sassa, T., Kihara, A. ELOVL1 production of C24 acyl-CoAs is linked to C24 sphingolipid synthesis, Proc. Natl. Acad. Sci. U. S. A., 2010, p. 1–6.
18. Agbaga, M. P., Mandal, M. N., Anderson, R. E. Retinal very long-chain PUFAs: new insights from studies on ELOVL4 protein. J. Lipid Res., 2010, 51, p. 1624-1642.
19. Karan, G., Lillo, C., Yang, Z., Cameron, D. J., Locke, K. G., Zhao, Y., et al. Lipofuscin accumulation, abnormal electrophysiology, and photoreceptor degeneration in mutant ELOVL4 transgenic mice: a model for macular degeneration. Proc Natl Acad Sci U S A., 2005, 15, 102(11), p. 4164-9.
20. Wang, Y., Botolin, D., Xu, J., et al. Regulation of hepatic fatty acid elongase and desaturase expression in diabetes and obesity. Journal of lipid research., 2006, 47(9), p. 2028-2041.
21. Tripathy, S., Jump, D.B. Elovl5 regulates the mTORC2-Akt-FOXO1 pathway by controlling hepatic cis-vaccenic acid synthesis in diet-induced obese mice. J Lipid Res., 2013, 54(1), p. 71-84.
22. Tripathy, S., Torres-Gonzalez, M., Jump, D. B. Elevated hepatic fatty acid elongase-5 activity corrects dietary fat-induced hyperglycemia in obese C57BL/6J mice. J. Lipid Res., 2010, 51, p. 2642–2654.
23. Li, X., Gan, Z. W., Ding, Z., et al. Genetic Variants in the ELOVL5 but not ELOVL2 Gene Associated with Polyunsaturated Fatty Acids in Han Chinese Breast Milk. Biomed. Environ. Sci., 2017, 30(1), p. 64-67.
24. Di Gregorio, E., Borroni, B., Giorgio, E., Lacerenza, D., Ferrero, M., Lo Buono, N., et al. ELOVL5 mutations cause spinocerebellar ataxia 38. Am J Hum. Ge-net., 2014, 7, 95(2), p. 209-17.
25. Petty, H. R. Frontiers of Complex Disease Mechanisms: Membrane Surface Tension May Link Genotype to Phenotype in Glaucoma Front. Cell Dev. Biol., 2018, 06, https://doi.org/10.3389/fcell.2018.00032.
26. Aslibekyan, S., Jensen, M. K., Campos, H., Linkletter, C. D., Loucks, E. B., Ordovas, J. M., et al. Genetic variation in fatty acid elongases is not associated with intermediate cardiovascular phenotypes or myocardial infarction. Eur J Clin. Nutr., 2012, 66(3), p. 353-9.
27. Matsuzaka, T., Shimano, H., Yahagi, N., Kato, T., Atsumi, A., Yamamoto, T. et al. Crucial role of a long-chain fatty acid elongase, Elovl6, in obesity-induced insulin resistance. Nat. Med., 2007, 13(10), p. 1193-202.
28. Tang, N., Matsuzaka, T., Suzuki, M., Nakano, Y., Zao, H., Yokoo, T., et al. Ablation of Elovl6 protects pancreatic islets from high-fat diet-induced impairment of insulin secretion. Biochem. Biophys. Res. Commun., 2014, 18 450(1), p. 318-23.
29. Zhao, H., Matsuzaka, T., Nakano, Y., Motomura, K., Tang, N., Yokoo, T. et al. Elovl6 Deficiency Improves Glycemic Control in Diabetic db/db Mice by Expanding β-Cell Mass and Increasing Insulin Secretory Capacity. Diabetes, 2017, 66(7), p. 1833-1846.
30. Su, Y. C., Feng, Y. H., Wu, H. T., Huang, Y. S., Tung, C. L., Wu, P. et al. Elovl6 is a negative clinical predictor for liver cancer and knockdown of Elovl6 reduces murine liver cancer progression. Sci Rep., 2018, 26, 8(1), p. 6586.
31. Pickens, C. A., Lane-Elliot, A., Comstock, S. S., Fenton, J. I. Altered Saturated and Monounsaturated Plasma Phospholipid Fatty Acid Profiles in Adult Males with Colon Adenomas. Cancer Epidemiol. Biomarkers Prev., 2016, 25(3), p. 498-506.
32. Morcillo, S., Martín-Núnez, G. M., Rojo-Martínez, G., Almaraz, M. C., García-Escobar, E. et al. ELOVL6 Genetic Variation Is Related to Insulin Sensitivity: A New Candidate Gene in Energy Metabolism. PLoS ONE., 2011, 6(6), e21198.
33. Liu, Y., Wang, F., Yu, X. L., Miao, Z. M., Wang, Z. C., Chen, Y., Wang, Y. Genetic analysis of the ELOVL6 gene polymorphism associated with type 2 diabetes mellitus. Brazilian Journal of Medical and Biological Research., 2013, 46, p. 623-628.
34. Tamura, K., Makino, A., Hullin-Matsuda, F., Kobayashi, T., Furihata, M., Chung, S., et al. Novel lipogenic enzyme ELOVL7 is involved in prostate cancer growth through saturated long-chain fatty acid metabolism. Cancer Res., 2009, 69, p. 8133-8140.
Štítky
Biochémia Nukleárna medicína Nutričný terapeut
Článok vyšiel v časopiseKlinická biochemie a metabolismus
Najčítanejšie tento týždeň
2019 Číslo 2
-
Všetky články tohto čísla
- Vysoce citlivé (hs) kardiální troponiny. Pomníček velkému úsilí, které tak hned neustane.
- Porovnání výsledků vysoce senzitivních stanovení troponinů I (Abbott, Beckman Coulter, Siemens) a troponinu T (Roche)
- Role polymorfismu rs17817449 FTO genu ve vztahu k obezitě a kompenzaci u diabetiků 1. typu
- Elongázy mastných kyselin a jejich účast v patogeneze chorobných stavů
- POCT systém detekce hladin fekálního kalprotektinu při telemonitoringu pacientů s idiopatickými střevními záněty
- Pleurální exsudát pozitivní na paraprotein a volné lehké řetězce jako první příznak mnohočetného myelomu
- Změny močových a sérových markerů poškození ledvin u dospělých pacientů po podání kontrastní látky při angiografii
- Vzácný pyrofosfátový močový konkrement u pětiletého chlapce s kongenitální hypofosfatázií
- Klinická biochemie a metabolismus
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Porovnání výsledků vysoce senzitivních stanovení troponinů I (Abbott, Beckman Coulter, Siemens) a troponinu T (Roche)
- POCT systém detekce hladin fekálního kalprotektinu při telemonitoringu pacientů s idiopatickými střevními záněty
- Změny močových a sérových markerů poškození ledvin u dospělých pacientů po podání kontrastní látky při angiografii
- Elongázy mastných kyselin a jejich účast v patogeneze chorobných stavů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



