-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Rezistence k erytromycinu, ciprofloxacinu a k tetracyklinu u humánních izolátů Campylobacter spp. v České republice, vyšetřená standardní metodou EUCAST
Resistance monitoring working group: Resistance to erythromycin, ciprofloxacin, and tetracycline in human isolates of Campylobacter spp. in the Czech Republic tested by the EUCAST standard method
Study aim:
To determine the frequency of Campylobacter spp. isolated from humans in the Czech Republic and to test their susceptibility to antimicrobials commonly used to treat campylobacteriosis by the standard EUCAST method.Material and methods:
Consecutive Campylobacter isolates recovered from clinical specimens in 49 microbiological laboratories within one month in 2013 were identified using matrix-assisted laser desorption/ionization-time-of-flight mass spectrometry (MALDI-TOF MS). Susceptibility to erythromycin, ciprofloxacin, and tetracycline was tested by the microdilution method and the results were interpreted based on the EUCAST clinical breakpoints to differentiate between susceptible and resistant strains.Results:
Of the study set of 769 Campylobacter spp. strains, 90.1 % were assigned to C. jejuni, 9.8 % to C. coli, and a single strain to C. fetus (0.1 %). Except one blood isolate of C. jejuni, all other isolates were recovered from the stool. Ciprofloxacin resistance (MIC > 0.5 mg/l) was detected in 61.9 % strains of C. jejuni and in 72.0 % strains of C. coli, tetracycline resistance (MIC > 2 mg/l) was detected in 32.0 % of strains of both species, and erythromycin resistance was found in 0.3 % of strains of C. jejuni (MIC > 8 mg/l) and in 2.7 % of strains of C. coli (MIC > 4 mg/l). A C. coli strain was multidrug resistant (i.e. resistant to all three antimicrobials tested).Conclusions:
Despite the fact that most Campylobacter infections in humans cure on their own, the resistance of the causative strains to the antimicrobials of choice and alternative agents needs to be studied because of its relevance to the treatment of severe cases that require antibiotics. Resistance to macrolides was found rather infrequently in this study in both C. jejuni (0.1 %) and C. coli (2.7 %) strains. Nevertheless, alarming is ciprofloxacin resistance confirmed in 61.9 % of C. jejuni strains and 72.0 % C. coli strains. As the species C. coli is more often resistant to antimicrobials than C. jejuni and ciprofloxacin along with other fluoroquinolones is commonly used to treat severe food-borne and generalized infections, it is crucial to identify the Campylobacter strains to the species level and to test their susceptibility to relevant antibiotics by a valid and reproducible method to be able to provide an effective therapy.Keywords:
Campylobacter spp. – antimicrobial resistence – microdilution method – EUCAST breakpoints
Autoři: H. Žemličková 1; V. Jakubů 1; M. Marejková 2; P. Urbášková 1
Působiště autorů: Národní referenční laboratoř pro antibiotika, Státní zdravotní ústav, Praha 1; Národní referenční laboratoř pro E. coli a shigely, Státní zdravotní ústav, Praha 2
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 63, 2014, č. 3, s. 184-190
Kategorie: Souhrnná sdělení, původní práce, kazuistiky
*Pracovní skupina pro monitorování rezistence
Souhrn
Cíl práce:
Zjistit frekvenci výskytu druhů Campylobacter spp. izolovaných od lidí na území České republiky a standardní metodou EUCAST vyšetřit citlivost k antibiotikům, nejčastěji používaným k léčbě kampylobakterióz.Materiál a metody:
Konsekutivní izoláty kampylobakterů, izolované v průběhu jednoho měsíce roku 2013 z klinických vzorků pacientů ve 49 mikrobiologických laboratořích, byly identifikovány metodou MALDI-TOF MS. Citlivost k erytromycinu, ciprofloxacinu a tetracyklinu byla vyšetřena diluční mikrometodou a výsledky byly interpretovány podle klinických breakpointů EUCAST pro rozlišení citlivých a rezistentních kmenů kampylobakterů.Výsledky:
Soubor 769 kmenů Campylobacter spp. zahrnoval 90,1 % C. jejuni, 9,8 % C. coli a jediný kmen C. fetus (0,1 %). S výjimkou jednoho izolátu C. jejuni z krve byly všechny ostatní ze stolice. K ciprofloxacinu (MIC > 0,5 mg/l) bylo rezistentních 61,9 % kmenů C. jejuni a 72,0 % kmenů C. coli, k tetracyklinu (MIC > 2 mg/l) bylo shodně rezistentních 32,0 % kmenů obou druhů, a k erytromycinu bylo rezistentních 0,3 % kmenů C. jejuni (MIC > 8 mg/l) a 2,7 % kmenů C. coli (MIC > 4 mg/l). Jeden kmen C. coli byl multirezistentní (rezistentní ke všem třem antibiotikům).Závěry:
Přesto, že většina humánních infekcí způsobených kampylobaktery je samoúzdravná, je znalost stavu rezistence k antibiotikům volby a jejich alternativám nezbytná pro léčbu případů se závažným průběhem, které vyžadují podávání antibiotik. Frekvence výskytu rezistence k makrolidům, zjištěná v této studii, byla nízká u kmenů C. jejuni (0,1 %) i C. coli (2,7 %). Znepokojivá je však rezistence k ciprofloxacinu, potvrzená u 61,9 % kmenů C. jejuni a 72,0 % kmenů C. coli. Vzhledem k tomu, že u druhu C. coli je frekvence výskytu antibiotické rezistence vyšší než u druhu C. jejuni, a ciprofloxacin s dalšími fluorochinolony slouží jako častá volba pro léčbu závažných alimentárních i celkových infekcí, je pro volbu účinné léčby nutno i v rutinní laboratoři identifikovat kampylobaktery do druhu a vyšetřovat jejich citlivost k relevantním antibiotikům validní a reprodukovatelnou metodou.Klíčová slova:
Campylobacter spp. – rezistence k antibiotikům – mikrodiluční metoda – breakpointy EUCASTÚVOD
Význam kampylobakterů v etiologii humánních bakteriálních enteritid v České republice (ČR) v posledních 10 letech trvale roste. Podle údajů ze statistiky vybraných nemocí EPIDAT, zahrnující enteritidy způsobené kampylobaktery, salmonelami, shigelami a jinými bakteriálními původci, vzrostl v průběhu 10 let podíl kampylobakterů v etiologii těchto infekcí o 10 % a změnil se i poměr salmonelóz a kampylobakterióz. V roce 2004 převažovaly salmonely (52 %) nad kampylobaktery (43 %), v roce 2013 se podíl salmonel snížil na 30 % a podíl kampylobakterů zvýšil na 53 % [1].
Kampylobakteriózy patří mezi nemoci z potravin a vody, kontaminovaných výkaly domácích nebo divokých zvířat nebo ptáků, v jejichž zažívacím traktu jsou kampylobaktery běžně přítomny [2]. Hlavním rezervoárem této zoonózy jsou průmyslové chovy kuřat a prasat. Podobně jako u jiných střevních patogenů může dojít k přenosu infekce kampylobaktery také fekálně orální cestou mezi člověkem a zvířetem nebo mezi lidmi. Zatímco střevní infekce způsobují obvykle druhy Campylobacter jejuni a C. coli, nejčastější původce extraintestinálních infekcí je C. fetus [3]. Extraintestinální infekce způsobené vzácněji se vyskytujícími druhy kampylobakterů se vyskytují u imunokompromitovaných osob, zejména u pacientů s AIDS [4].
Léčba kampylobakterových enteritid většinou spočívá jen v náhradě tekutin, neboť tyto infekce mají obvykle mírný průběh a jsou samoúzdravné. Podání antibiotik je nezbytné u infekcí se závažným průběhem, u nemocných, jejichž symptomy nepolevují, zesilují nebo trvají více než týden, a u těhotných [5]. Lékem volby by měl být některý z makrolidů (erytromycin, klaritromycin, spiramycin), případně azitromycin [5, 6, 7], často je však podáván alternativní fluorochinolon (např. ciprofloxacin, ofloxacin, norfloxacin) pro předpokládanou účinnost této skupiny antibiotik na další původce bakteriálních enteritid, jako jsou salmonely a shigely.
V České republice chybí informace o aktuálním stavu rezistence humánních izolátů kampylobakterů k antibiotikům, doporučovaným k léčbě, získané standardní metodou vyšetření citlivosti. Tato studie byla uspořádána s cílem zjistit frekvenci výskytu druhů Campylobacter spp. izolovaných v průběhu jednoho měsíce na území ČR z klinických vzorků od lidí, a metodou EUCAST zjistit prevalenci rezistence k erytromycinu, ciprofloxacinu a tetracyklinu jako zástupcům antibiotik s identickým účinkem uvnitř skupin makrolidů (a azalidů), fluorochinolonů, respektive tetracyklinů.
MATERIÁL A METODY
Kmeny Campylobacter spp. Sběru kmenů se účastnili členové Pracovní skupiny pro monitorování rezistence (PSMR) z mikrobiologických laboratoří v České republice. Konsekutivní izoláty z klinických vzorků, odebraných pacientům v období jednoho měsíce (13. 5.–14. 6. 2013), byly v zúčastněných laboratořích rutinními metodami předběžně identifikovány do rodu Campylobacter. Opakované izoláty od jednoho pacienta byly vyloučeny. Kultury kmenů byly zasílány na transportní půdě (Stuartovo médium bez uhlí nebo Amiesovo médium) do Národní referenční laboratoře (NRL) pro antibiotika a zpracovány ve spolupráci s NRL pro E. coli a shigely. Kmeny byly vyočkovány na Columbia krevní agar (Oxoid) a inkubovány 48 hodin při 37 °C v anaerostatu s mikroaerofilním prostředím, generovaným pomocí CampyGen (Oxoid). Metodou MALDI-TOF MS (Microflex LT, Bruker Daltonics, USA) [8] byly zaslané kampylobaktery identifikovány do druhu. Naměřená spektra byla vyhodnocena programem MALDI Biotyper RTC v. 3.0. Identifikované kmeny, vyrostlé na Columbia krevním agaru, byly ihned po inkubaci předány k vyšetření citlivosti.
Vyšetření citlivosti na antibiotika. Citlivost kampylobakterů k erytromycinu, ciprofloxacinu a tetracyklinu byla vyšetřena v NRL pro antibiotika mikrodiluční metodou [9]. K vyšetření minimálních inhibičních koncentrací (MIC) antibiotik byla použita půda MH-F (Mueller Hinton bujon s 5 % defibrinované koňské krve a 20 mg/l beta-NAD) [10]. Pro studii byly připraveny koncentrace antibiotik ředěné půdou MH-F dvojnásobně geometrickou řadou v rozmezí: erytromycin 16–0,12 mg/l, ciprofloxacin 4–0,06 mg/l (u ciprofloxacinu byla jedna jamka bez antibiotika pro kontrolu růstu daného kmene), a tetracyklin 8–0,06 mg/l. Příslušné koncentrace antibiotik v půdě MH-F byly rozplněny v objemu 0,1 ml do jamek mikrotitračních destiček rozplňovacím zařízením Dynex. Destičky s antibiotiky byly před použitím uchovány při -80 °C. Do jamek destičky byl ručním jehlovým inokulátorem očkován 1 µl inokula vyšetřovaných kmenů s koncentrací buněk 0,5 podle McFarlandova zákalového standardu. Kvalita ředění antibiotik byla kontrolována kmenem Streptococcus pneumoniae ATCC 49619. Inkubace destiček probíhala při 41 °C v anaerostatu v mikroaerofilní atmosféře generované pomocí CampyGen. Po 24 hodinách inkubace (při nedostatečném růstu po dalších 24 hodinách) byla MIC odečítána jako nejnižší koncentrace antibiotika v jamce destičky inhibující viditelný růst. Naměřené hodnoty MIC byly interpretovány podle klinických breakpointů EUCAST stanovených pro kategorizaci citlivosti a rezistence u kmenů Campylobacter jejuni a C. coli [11].
VÝSLEDKY
Laboratoře a kmeny
Sběru a předběžné identifikace kmenů Campylobacter spp. se zúčastnilo 49 mikrobiologických laboratoří lokalizovaných ve 14 krajích ČR, které zpracovávají klinické vzorky odebrané komunitním nebo hospitalizovaným pacientům. Z celkem 1 074 zásilek kmenů, odeslaných laboratořemi, byla téměř 1/3 vyřazena, neboť po vyočkování z transportní půdy byla v 208 případech přítomna jen běžná střevní flóra, v 92 případech kmen nevyrostl, a 5 izolátů bylo vyloučeno pro duplicitu.
Konečný soubor obsahoval 769 kmenů Campylobacter spp., z nichž jediný byl C. fetus (0,1 %), 9,8 % bylo identifikováno jako C. coli, a převahu tvořily kmeny C. jejuni (90,1 %). Kmeny byly izolovány ze stolice s výjimkou jednoho kmene C. jejuni z krve (tab. 1).
Tab. 1. Druhy <i>Campylobacter</i> spp. a jejich původ v souboru 769 konsekutivních izolátů Table 1. <i>Campylobacter</i> spp. and their origin in the study set of 769 consecutive isolates 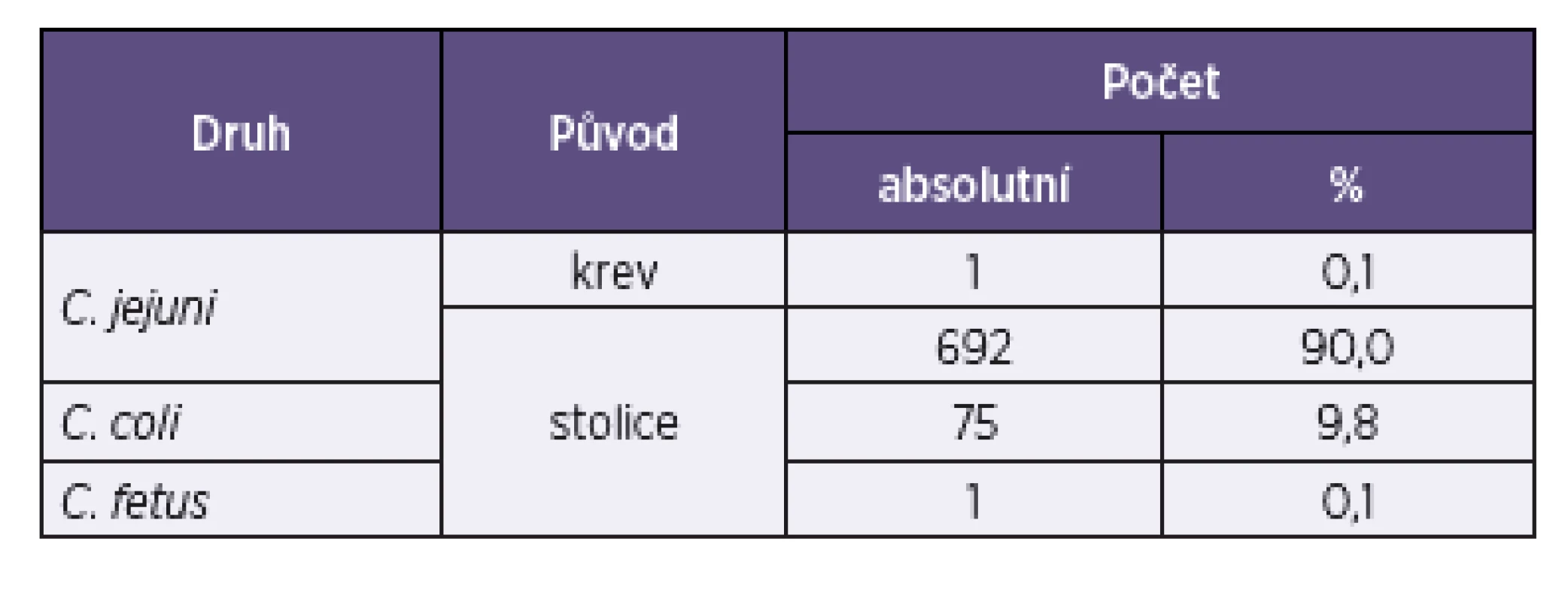
Rezistence k antibiotikům
Rozmezí MIC ciprofloxacinu, tetracyklinu a erytromycinu, koncentrace inhibující 50 % a 90 % kmenů, klinické breakpointy pro kategorizaci citlivosti a počet rezistentních kmenů u druhů C. jejuni a C. coli jsou v tabulce 2. Klinické breakpointy ciprofloxacinu (0,5 mg/l) a tetracyklinu (2 mg/l) pro druhy C. jejuni i C. coli jsou identické, zatímco klinický breakpoint erytromycinu je 4 mg/l pro C. jejuni a 8 mg/l pro C. coli. Podle klinických breakpointů bylo k ciprofloxacinu rezistentních 62,8 % kmenů C. jejuni a 72,0 % kmenů C. coli. Rezistence k tetracyklinu u kmenů C. jejuni a C. coli byla shodně 32,0 % a k erytromycinu bylo rezistentních 0,1 % kmenů C. jejuni a 2,7 % kmenů C. coli. Pro druh C. fetus nejsou klinické breakpointy k dispozici, avšak podle nízkých hodnot MIC lze kmen považovat za pravděpodobně citlivý k ciprofloxacinu (MIC 0,25 mg/l), tetracyklinu (MIC 0,5 mg/l) i k erytromycinu (MIC 0,25 mg/l).
Tab. 2. Rozmezí minimálních inhibičních koncentrací (MIC) antibiotik, MIC50 a MIC90, klinické breakpointy antibiotik [11] a frekvence rezistence k antibiotikům v souboru 693 kmenů Campylobacter jejuni a 75 kmenů C. coli Table 2. MIC range, MIC50 , MIC90, clinical breakpoints for antibiotics [11], and resistance rates in the set of 693 strains of Campylobacter jejuni and 75 strains of C. coli. ![Rozmezí minimálních inhibičních koncentrací (MIC) antibiotik, MIC50 a MIC90, klinické breakpointy antibiotik [11] a frekvence rezistence k antibiotikům v souboru 693 kmenů <i>Campylobacter jejuni</i> a 75 kmenů <i>C. coli</i>
Table 2. MIC range, MIC<sub>50</sub> , MIC<sub>90</sub>, clinical breakpoints for antibiotics [11], and resistance rates in the set of 693 strains of <i>Campylobacter jejuni</i> and 75 strains of <i>C. coli</i>.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/5a528635bb5732a1c4092f82ecd720b1.png)
MIC50: koncentrace antibiotika inhibující 50 % kmenů MIC90: koncentrace antibiotika inhibující 90 % kmenů * k odlišení citlivých a rezistentních kmenů ** rezistentní kmen: MIC antibiotika je vyšší než klinický breakpoint. MIC50: minimal inhibitory concentration for 50 % of strains tested MIC90: minimal inhibitory concentration for 90 % of strains tested * to differentiate between susceptible and resistant strains ** resistant strain: MIC of the antibiotic is higher than the clinical breakpoint. U druhu C. coli byl zaznamenán o 10 % nižší počet kmenů citlivých ke všem třem vyšetřovaným antibiotikům (24,0 %) než u C. jejuni (34,6 %) – tabulka 3. Tento rozdíl byl způsoben ciprofloxacinem, k němuž samotnému bylo rezistentních o 10 % více kmenů C. coli (42,7 %) než C. jejuni (33,2 %), zatímco sdružená rezistence k ciprofloxacinu a tetracyklinu se u obou druhů lišila jen nepatrně (28,7 % u C. jejuni a 26,7 % u C. coli) – viz tabulka 3. Jeden kmen C. coli byl multirezistentní (rezistentní ke všem třem antibiotikům). U obou rezistentních kmenů C. coli byla zjištěna MIC erytromycinu > 16 mg/l, zatímco jediný kmen C. jejuni byl inhibován koncentrací 8 mg/l erytromycinu.
Tab. 3. Rezistence, sdružená rezistence a multirezistence k ciprofloxacinu, tetracyklinu a erytromycinu v souboru 693 kmenů Campylobacter jejuni a 75 kmenů C. coli Table 3. Resistance, co-resistance, and multidrug resistance to ciprofloxacin, tetracycline, and erythromycin in the set of 693 strains of Campylobacter jejuni and 75 strains of C. coli. 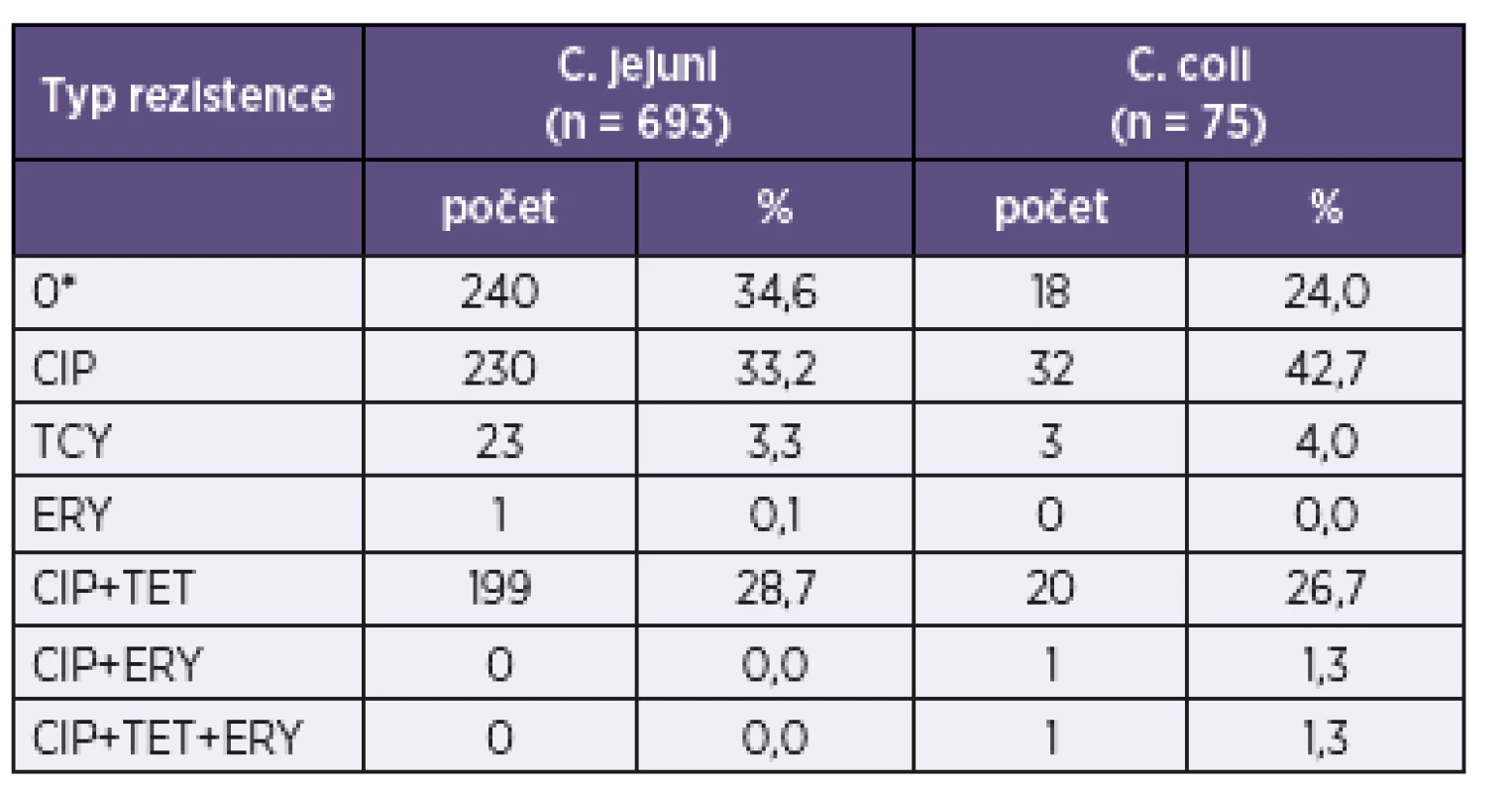
*kmeny citlivé ke všem vyšetřovaným antibiotikům * strains susceptible to all antibiotics tested. Grafy 1–4 ilustrují distribuci MIC vyšetřovaných antibiotik a obsahují příslušný klinický breakpoint EUCAST [11] oddělující citlivé a rezistentní kmeny. Klinické breakpointy ciprofloxacinu 0,5 mg/l a tetracyklinu (graf 1) 2 mg/l (graf 2) zřetelně oddělují populace citlivých a rezistentních kmenů, čtyři prostřední koncentrace neinhibují žádné, nebo minimální množství kmenů (≤ 0,4 %). Rozložení MIC erytromycinu u C. jejuni (graf 3) a C. coli (graf 4) se liší, se zřetelným posunem u C. coli směrem k vyšším koncentracím.
Graf 1. Distribuce minimálních inhibičních koncentrací (MIC) ciprofloxacinu v souboru 768 konsekutivních izolátů <i>Campylobacter jejuni</i> a <i>C. coli</i>. Přerušovaná šipka vyznačuje breakpoint 0,5 mg/l [11], oddělující citlivé a rezistentní kmeny. Fig 1. Distribution of minimal inhibitory concentrations (MICs) of ciprofloxacin in the set of 768 consecutive isolates of <i>Campylobacter jejuni</i> and <i>C. coli</i>. The dashed arrow indicates the breakpoint of 0.5 mg/l [11] which separates susceptible strains from resistant ones. ![Distribuce minimálních inhibičních koncentrací (MIC) ciprofloxacinu v souboru 768 konsekutivních izolátů <i>Campylobacter jejuni</i> a <i>C. coli</i>. Přerušovaná šipka vyznačuje breakpoint 0,5 mg/l [11], oddělující citlivé a rezistentní kmeny.
Fig 1. Distribution of minimal inhibitory concentrations (MICs) of ciprofloxacin in the set of 768 consecutive isolates of <i>Campylobacter jejuni</i> and <i>C. coli</i>. The dashed arrow indicates the breakpoint of 0.5 mg/l [11] which separates susceptible strains from resistant ones.](https://pl-master.mdcdn.cz/media/image/e4665f59c2277f81bcea7c43aaee53fb.png?version=1537797350)
Graf 2. Distribuce minimálních inhibičních koncentrací (MIC) tetracyklinu v souboru 768 konsekutivních izolátů. <i>Campylobacter jejuni</i> a <i>C. coli</i> Fig 2. Distribution of minimal inhibitory concentrations (MICs) of tetracycline in the set of 768 consecutive isolates of <i>Campylobacter jejuni</i> and <i>C. coli</i>. The dashed arrow indicates the breakpoint of 2 mg/l [11] which separates susceptible strains from resistant ones. ![Distribuce minimálních inhibičních koncentrací (MIC) tetracyklinu v souboru 768 konsekutivních izolátů. <i>Campylobacter jejuni</i> a <i>C. coli</i>
Fig 2. Distribution of minimal inhibitory concentrations (MICs) of tetracycline in the set of 768 consecutive isolates of <i>Campylobacter jejuni</i> and <i>C. coli</i>. The dashed arrow indicates the breakpoint of 2 mg/l [11] which separates susceptible strains from resistant ones.](https://pl-master.mdcdn.cz/media/image/ab150b63e4295aa47b7c953fee53be3d.png?version=1537795855)
Graf 3. Distribuce minimálních inhibičních koncentrací (MIC) erytromycinu v souboru 693 konsekutivních izolátů <i>Campylobacter jejuni</i>. Přerušovaná šipka vyznačuje breakpoint 4 mg/l [11], oddělující citlivé a rezistentní kmeny. Fig 3. Distribution of minimal inhibitory concentrations (MICs) of erythromycin in the set of 693 consecutive isolates of <i>Campylobacter jejuni</i>. The dashed arrow indicates the breakpoint of 4 mg/l [11] which separates susceptible strains from resistant ones. ![Distribuce minimálních inhibičních koncentrací (MIC) erytromycinu v souboru 693 konsekutivních izolátů <i>Campylobacter jejuni</i>. Přerušovaná šipka vyznačuje breakpoint 4 mg/l [11], oddělující citlivé a rezistentní kmeny.
Fig 3. Distribution of minimal inhibitory concentrations (MICs) of erythromycin in the set of 693 consecutive isolates of <i>Campylobacter jejuni</i>. The dashed arrow indicates the breakpoint of 4 mg/l [11] which separates susceptible strains from resistant ones.](https://pl-master.mdcdn.cz/media/image/09802271d6b431bf7b8463583a74e204.png?version=1537792176)
Graf 4. Distribuce minimálních inhibičních koncentrací (MIC) erytromycinu v souboru 75 konsekutivních izolátů <i>Campylobacter coli</i>. Přerušovaná šipka vyznačuje breakpoint 8 mg/l [11], oddělující citlivé a rezistentní kmeny. Fig 2. Distribution of minimal inhibitory concentrations (MICs) of erythromycin in the set of 75 consecutive isolates of <i>Campylobacter coli</i>. The dashed arrow indicates the breakpoint of 8 mg/l [11] which separates susceptible strains from resistant ones. ![Distribuce minimálních inhibičních koncentrací (MIC) erytromycinu v souboru 75 konsekutivních izolátů <i>Campylobacter coli</i>. Přerušovaná šipka vyznačuje breakpoint 8 mg/l [11], oddělující citlivé a rezistentní kmeny.
Fig 2. Distribution of minimal inhibitory concentrations (MICs) of erythromycin in the set of 75 consecutive isolates of <i>Campylobacter coli</i>. The dashed arrow indicates the breakpoint of 8 mg/l [11] which separates susceptible strains from resistant ones.](https://pl-master.mdcdn.cz/media/image/71bd7a73c5197bd9c66b11cd8e2c9279.png?version=1537794584)
DISKUSE
Příčinou humánních kampylobakterových infekcí je zhruba v 90 % Campylobacter jejuni [12] a téměř všechny zbývající infekce způsobuje C. coli [13], jiné druhy kampylobakterů se uplatňují jen velmi vzácně a ve specifických situacích [2, 3, 4, 5]. I když soubor v této studii tvořily konsekutivní izoláty 769 kampylobakterů bez další epidemiologické specifikace, bylo zastoupení obou druhů kampylobakterů (90,1 % izolátů C. jejuni, 9,8 % izolátů C. coli a jeden C. fetus) v téměř shodném poměru, jak se uvádí pro humánní izoláty [12, 13]. Campylobacter jejuni, který může být příčinou bakteriémie u zhruba 1 % pacientů se základním neinfekčním onemocněním [3], byl v našem souboru zastoupen kmenem izolovaným z krve 69letého pacienta.
Kampylobaktery jsou přirozeně citlivé (neobsahují inherentní geny rezistence) k řadě antibiotik, jako jsou makrolidy, azalidy, linkosamidy, chinolony, aminoglykosidy, tetracykliny, nitrofurany, amfenikoly a další [14, 15, 16]. Pro léčbu antibiotiky je nezbytné znát stav získané rezistence k antibiotikům volby makrolidům, reprezentovaných erytromycinem (který zastupuje další makrolidy a azitromycin) a k alternativním antibiotikům, jako jsou fluorochinolony (zastupované ciprofloxacinem) a k tetracyklinům (které zastupuje tetracyklin).
Do nedávné minulosti nebylo možno získat relevantní údaje o prevalenci antibiotické rezistence u kampylobakterů, neboť nebyla k dispozici verifikovaná metoda vyšetřování citlivosti k antibiotikům. První metodu obsahující specifické podmínky pro vyšetření citlivosti C. jejuni a C. coli zveřejnila v roce 2006 americká instituce Clinical and Laboratory Standards Institute (CLSI), podle této metody však bylo zapotřebí vyšetřit minimální inhibiční koncentrace antibiotik, neboť disková difuzní metoda zahrnovala jen screening pro ciprofloxacin a erytromycin a pro tetracyklin neuváděla žádná kritéria [17]. Teprve v roce 2012 zveřejnila evropská instituce EUCAST obě metody (stanovení MIC a diskovou difuzní metodu) pro vyšetření citlivosti k ciprofloxacinu, erytromycinu a tetracyklinu u druhů C. jejuni a C. coli [11] včetně uvedení aktualizovaných kritérií pro odlišení citlivých a rezistentních kmenů. Standardní metodu EUCAST jsme ihned v roce jejího zveřejnění použili k vyšetření antibiotické citlivosti našeho souboru kampylobakterů. Výsledky ukázaly:
- velmi dobrou diskriminační schopnost klinických breakpointů EUCAST [11] pro kategorizaci citlivosti kampylobakterů,
- vysokou frekvenci rezistence k ciprofloxacinu u 61,9 % kmenů C. jejuni a 72,0 % C. coli, shodnou rezistenci ve 32,0 % k tetracyklinu u obou druhů kampylobakterů, jeden kmen C. jejuni (0,1 %) s nízkým stupněm rezistence k erytromycinu (MIC 8 mg/l) a dva kmeny C. coli (2,7 %) s vysokou rezistencí k erytromycinu (MIC > 16 mg/l). Tyto výsledky lze použít jen k orientačnímu porovnání s výsledky prevalence rezistence kampylobakterů získanými v předchozích studiích kdekoli jinde na světě, neboť v nich byly použity různé breakpointy pro odlišení citlivých a rezistentních kmenů. Vzhledem k tomu, že tyto breakpointy byly většinou vyšší než breakpointy, které udává EUCAST, může být frekvence rezistence v předchozích studiích podhodnocena, zejména u kmenů s nízkou hladinou rezistence. V roce 2007 byla v České republice provedena studie sledující citlivost k antibiotikům u 77 humánních izolátů C. jejuni z Olomouckého regionu [18]. S výjimkou srovnatelné úrovně rezistence k erytromycinu (1,7 % v roce 2007 vs. 0,1 % v roce 2013), byla v předchozí studii zjištěna nižší hladina rezistence k ciprofloxacinu (54,6 % vs. 61,9 %) a především k tetracyklinu (11,7 % vs. 32,0 %). Tyto rozdíly mohou být způsobeny různými interpretačními kritérii výsledků testování (ciprofloxacin), nárůstem rezistence během tohoto období, ale i kvantitativní i kvalitativní odlišností ve skladbě těchto dvou souborů.
Poměrně nízkou a dlouhodobě stabilní rezistenci kampylobakterů k makrolidům potvrzuje řada studií. Například ve Finsku zůstala rezistence k erytromycinu na stejné úrovni 3 % po dobu 10 let (1980–1990), a podobně tomu bylo u tetracyklinu se shodnou frekvencí rezistence ve výši zhruba 17 %, avšak počet kmenů rezistentních k fluorochinolonům se v tomto období téměř ztrojnásobil [19]. Ve Švédsku se v přibližně stejném období zvýšení rezistence ke stejným antibiotikům nepotvrdilo, pravděpodobně pro velmi přísnou restriktivní antibiotickou politiku [20]. Rozdíly v rezistenci k erytromycinu závislé na druhu kampylobaktera jsou patrné při srovnání údajů z 16 zemí světa: zatímco u C. jejuni je rozmezí výskytu 0 % (Dánsko) až 10 % (Taiwan), rezistence u C. coli je v rozmezí 5,5 % (Rakousko) až 50 % (Taiwan) [21]. Antibiotická rezistence humánních izolátů do značné míry odráží rezistenci pozorovanou u některých druhů zvířat se značnými geografickými rozdíly [22]. Například ve Španělsku byla na přelomu tisíciletí zaznamenána rezistence k ciprofloxacinu u izolátů C. jejuni a C. coli ze zažívacího traktu kuřat v 99 %, respektive ve 100 % a u humánních izolátů bylo rezistentních 75 % kmenů C. jejuni a 70,7 % C. coli [23]. Rezistence k erytromycinu se značně liší podle druhu kampylobaktera a původu kmenů; zatímco u kuřat byla rezistence u obou druhů kampylobakterů nízká, a u prasat byly izolovány pouze kmeny C. coli, z nichž 81,5 % bylo rezistentních, a rezistence u izolátů od lidí byla potvrzena u 3,2 % kmenů C. jejuni a 34,5 % kmenů C. coli [23]. V jiné studii sledující rezistenci kampylobakterů izolovaných od zdravých potravinových zvířat byla potvrzena rozdílná frekvence rezistence mezi čtyřmi zúčastněnými evropskými zeměmi, mezi druhy zvířat i druhy kampylobakterů [24]. V této studii však byly ke kategorizaci citlivosti a rezistence použity breakpointy ciprofloxacinu (4 mg/l) a erytromycinu (32 mg/l) [24], vysoce převyšující breakpointy ustanovené EUCAST [11]. Vyšší frekvenci rezistence kmenů C. coli k ciprofloxacinu a erytromycinu než kmenů C. jejuni jsme potvrdili i v naší studii. Rozdíly ve frekvenci rezistence u stejných druhů kampylobakterů, které pocházejí z různých druhů zvířat a geografických lokalit jsou přikládány rozdílnému selekčnímu tlaku příslušných antibiotik, které se používají v chovech zvířat pro léčbu a profylaxi [21, 22,23, 24, 25]. Pro značné rozdíly v antibiotické rezistenci se doporučuje urychlit druhovou identifikaci kampylobakterů, neboť zvolit účinné antibiotikum je u druhu C. coli obtížnější.
Příčinou rezistence k fluorochinolonům je bodová mutace v podjednotce genu A DNA gyrázy [26], velmi často v kombinaci s mnohočetným efluxem, který způsobuje rezistenci k fluorochinolonům a dalším skupinám antibiotik, jako jsou makrolidy, tetracykliny a amfenikoly [27, 28, 29]. Závažné je zjištění, že u kampylobakterů vzniká rezistence k ciprofloxacinu poměrně rychle, pravděpodobně v důsledku synergie bodových mutací a efluxových pump [29]. Tato rezistence je stabilní i po úplném vysazení fluorochinolonů z používání v zemědělství, jak ukázaly výsledky surveillance rezistence k fluorochinolonům u drůbeže ve Spojených státech [30]. Rychlý vznik rezistence během léčby dokumentuje použití ciprofloxacinu nebo norfloxacinu u pacientů s infekcí způsobenou citlivými kmeny C. jejuni nebo C. coli, které byly po ukončení léčby rezistentní k fluorochinolonům [31]. Genetická analýza citlivých a rezistentních kmenů vyloučila přítomnost rezistentních buněk v populacích kampylobakterů před léčbou a jejich následnou selekci podávaným fluorochinolonem, a potvrdila jako příčinu rezistence bodovou mutaci, ke které došlo až v průběhu léčby [31].
Hlavní příčinou rezistence kampylobakterů k makrolidovým antibiotikům jsou bodové mutace v pozici A2059G genu pro 23S rRNA s důsledkem modifikace cílového místa pro aktivitu makrolidu na ribozomu [32, 33]. Tyto bodové mutace se stejně jako u fluorochinolonů často vyskytují v kombinaci s jednou nebo více efluxovými pumpami [32,34]. Makrolidová rezistence se obecně vyskytuje ve dvojím fenotypu podle stupně rezistence a v nižší frekvenci než je tomu u fluorochinolonů. Kmeny s rezistencí k makrolidům v nízkém stupni (MIC erytromycinu 8–32 mg/l) jsou na rozdíl od vysoce rezistentních kmenů (MIC erytromycinu > 32 mg/l) nestabilní v prostředí bez tlaku makrolidů [32, 35]. Kmeny s vysokým stupněm rezistence k makrolidům nevznikají stupňovitě bodovými mutacemi z kmenů s nízkým stupněm rezistence, ale náhle akumulací bodových mutací v genu pro 23SrRNA a jsou stabilní v prostředí bez přítomnosti makrolidů [32, 35]. Je však třeba zdůraznit, že kmeny kampylobakterů rezistentní k makrolidům jsou téměř vždy rezistentní také k fluorochinolonům a často i k dalším antibiotikům [33]. Také naše dva kmeny C. coli s vysokým stupněm makrolidové rezistence byly rezistentní k ciprofloxacinu a jeden i k tetracyklinu. Ve srovnání s rychlým nástupem a vysokou frekvencí fluorochinolonové rezistence se může jevit pravděpodobnost vzniku makrolidové rezistence mnohem pomalejší v důsledku nízké frekvence spontánních mutací a pro nestabilitu kmenů s nízkým stupněm makrolidové rezistence [35]. Tento slibný předpoklad však vyvrátila studie kontrolované experimentální infekce citlivým kmenem C. jejuni u zdravého dobrovolníka léčeného pět dnů jednou denní dávkou 500 mg azitromycinu, z jehož stolice byl 9 dnů po léčbě izolován kmen C. jejuni s MIC erytromycinu a azitromycinu > 256 mg/l [36].
Tato studie poskytuje údaje o prevalenci druhů kampylobakterů izolovaných z klinických vzorků pacientů na území České republiky, a obsahuje první validní informace o frekvenci výskytu rezistence k nejvýznamnějším antibiotikům u C. jejuni a C. coli, získané standardní metodou pro vyšetření citlivosti k antibiotikům EUCAST. Získané výsledky podporují nezbytnost pravidelného provádění národní surveillance antibiotické rezistence k rozšířenému spektru strategicky významných antibiotik u humánních izolátů kampylobakterů a ostatních bakteriálních příčin alimentárních infekcí, a ukazují na potřebu opatrného používání antibiotik u zvířat i lidí.
Členové PSMR: Adámková V. (VFN Praha), Bartoníková N. (Krajská nemocnice T. Bati Zlín), Bártová M. (Thomayerova nemocnice Praha), Bergerová T. (FN Plzeň), Bohunová Z. (Krajská nemocnice Liberec), Drozenová J. (Synlab Czech Cube Praha), Glasnák M. (Nemocnice Rudolfa a Stefanie Benešov), Hanslianová M. (FN Brno), Hásková V. (ZU Ústí n. Labem-Hořovice), Heinigeová B. (Nemocnice Jindřichův Hradec), Hermanová N. (Středomoravská nemocniční Přerov), Horníková M. (Nemocnice České Budějovice), Horová B. (Nemocnice Na Bulovce Praha), Chmelařová E. (ZÚ Ostrava), Janečková J. (Litomyšlská nemocnice), Ježek P. (Oblastní nemocnice Příbram), Jindrák V. (Nemocnice Na Homolce Praha), Kohnová I. (Nemocnice Prostějov), Kolářová L. (ÚVN Praha), Kotalíková J. (Dia-gon Cheb), Krčková D. (Ifcor Brno), Kůrková V. (Nemocnice Písek), Machučová M. (P+R Lab Nový Jičín), Nedvědová H. (Klatovská nemocnice), Niemczyková J. (ZÚ Ostrava-Havířov), Nýč O. (FN Motol Praha), Ochvatová B. (Spadia Lab Ostrava), Ouertani A. (Euromedic Praha), Paterová P. (FN Hradec Králové), Pokorná Z. (Synlab Czech Brno), Pomykal J. (Oblastní nemocnice Kolín), Prusík F. (FNKV Praha), Rumlerová M. (Oblastní nemocnice Kladno), Sekáčová A. (Nemocnice Vsetín), Scharfen J. (Oblastní nemocnice Trutnov), Skačáni H. (Nemocnice Jihlava), Steinerová A. (Citylab Praha), Šabacká Z. (Uherskohradišťská nemocnice), Šimečková E. (Nemocnice Strakonice), Štolbová M. (ZU Ústí n. Labem), Tejkalová R. (FN U Sv. Anny Brno), Trojan L. (Nemocnice Třebíč), Typovská H. (P+R Lab Šternberk), Vašková L. (Omni Lab Praha), Veselá E. (Oblastní nemocnice Náchod), Zálabská E. (Pardubická krajská nemocnice), Zamazalová D. (Nemocnice Nové Město na Moravě), Záruba R. (Nemocnice Most), Železná J. (Synlab Czech Znojmo).
Poznámka: Termín antibiotika je v tomto textu používaný pro označení léčiv s účinkem na bakterie bez ohledu na jejich chemické složení nebo původ.
Do redakce došlo dne 28. 2. 2014.
Adresa pro korespondenci:
RNDr. Pavla Urbášková, CSc.
Na Bendov 210
387 069 Malenice
Zdroje
1. Vybrané infekční nemoci v ČR v letech 2004-2013. Zprávy Centra epidemiologie a mikrobiologie 2013;22 : 392–393. (dostupné také na http://www.szu.cz/publikace/data/vybrane-infekcni-nemoci-v-cr-v-letech-2003-2012-absolutne).
2. Blaser MJ, Taylor DN, Feldman RA. Epidemiology of Campylobacter jejuni infections. Epidemiol Rev, 1983;5 : 157–176.
3. Pigrau C, Bartolome R, Almirante B, et al. Bacteremia due to Campylobacter species: clinical findings and antimicrobial susceptibility patterns. Clin Infect Dis, 1997;25 : 1414–1420.
4. Taylor DN, Echeverria P, Pitarangsi C, et al. The influence of immunity and strain characteristics on the epidemiology of campylobacteriosis. J Clin Microbiol, 1988;26 : 863–868.
5. Allos BM, Blaser MJ. Campylobacter jejuni and related species. In: GL Mandell, JE Bennett, R Dolin (eds.). Mandell, Douglas and Bennett´s principles and practice of infectious diseases, Elsevier, 2010.
6. Ternhag A, Asikainen T, Giesecke J, et al. A meta-analysis on the effects of antibiotic treatment on duration of symptoms caused by infection with Campylobacter species. Clin Infect Dis, 2007;44 : 696–700.
7. Centers for Disease Control and Prevention. Campylobacter. General Information. Dostupné na: http://www.cdc.gov/nczved/divisions/dfbmd/diseases/campylobacter/
8. Bessède E, Solecki O, Sifré E, et al. Identification of Campylobacter species and related organisms by matrix assisted laser desorption ionization–time of flight (MALDI-TOF) mass spectrometry. Clin Microbiol Infect, 2011;17 : 1735–1739.
9. Urbášková, P. Rezistence bakterií k antibiotikům. Vybrané metody. Trios 1998.
10. European Committee on Antimicrobial Susceptibility Testing. Preparation of MH plates and broth (v.3,0, 2013). Dostupné na: http://www.eucast.org/antimicrobial_susceptibility_testing/media_preparation/
11. European Committee on Antimicrobial Susceptibility Testing. Breakpoint tables for interpretation of MICs and zone diameters. Dostupné na: http://www.eucast.org/clinical_breakpoints/
12. Lastovica AJ, Skirrow MB. Clinical significance of Campylobacter and related species other than Campylobacter jejuni and C. coli. In: I. Nachmkin and M. J. Blaser (ed.). Campylobacter, 2nd ed. American Society for Microbiology, Washington, DC; 2000 : 89–120.
13. McNulty CA. The treatment of Campylobacter infections in man. J Antimicrob Chemother, 1987;19 : 281–284.
14. Vanhoof R, Gordts B, Dierickx R, et al. Bacteriostatic and bactericidal activities of 24 antimicrobial agents against Campylobacter fetus subsp. jejuni. Antimicrob Agents Chemother, 1980;18 : 118–121.
15. Fliegelman RM, Petrak RM, Goodman LJ, Segreti J, Trenholme GM, Kaplan RL. Comparative in vitro activities of twelve antimicrobial agents against Campylobacter species. Antimicrob Agents Chemother, 1985;27 : 429–30.
16. Lariviere LA, Gaudreau CL, Turgeon FF. Susceptibility of clinical isolates Campylobacter jejuni to twenty-five antimicrobial agents. J Antimicrob Chemother, 1986;18 : 681–685.
17. Clinical and Laboratory Standards Institute. Methods for antimicrobial dilution and disk susceptibility testing of infrequently isolated or fastidious bacteria; approved guideline. CLSI Document M45-A. Clinical and Laboratory Standards Institute, USA, Pa, 2006.
18. Bardon J, Kolar M, Cekanova L, et al. Prevalence of Campylobacter jejuni and its resistance to antibiotics in poultry in the Czech Republic. Zoonoses Public Health, 2009;56 : 111–116.
19. Rautelin H, Renkonen OV, Kosunen TU. Emergence of fluorochinolone resistance in Campylobacter jejuni and Campylobacter coli in subjects in Finland. Antimicrob Agents Chemother, 1991;35 : 2065–2069.
20. Sjögren E, Kaijser B, Werner M. Antimicrobial susceptibilities of Campylobacter jejuni and Campylobacter coli isolated in Sweden: a 10-year follow-up report. Antimicrob Agents Chemother, 1992;36 : 2847–2849.
21. Engberg J, Aarestrup FM, Taylor DE, et al. Quinolone and macrolide resistance in Campylobacter jejuni and C. coli: resistance mechanisms and trends in human isolates. Emerg Infect Dis, 2001;7 : 24–34.
22. Endtz HP, Ruijs GJ, van Klingeren B, et al. Quinolone resistance in Campylobacter isolated from man and poultry following the introduction of fluoroquinolones in veterinary medicine. J Antimicrob Chemother, 1991;27 : 199–208.
23. Sáenz Y, Zarazaga M, Lantero M, et al. Antibiotic resistance in Campylobacter strains isolated from animals, foods, and humans in Spain in 1997-1998. Antimicrob Agents Chemother, 2000;44 : 267–271.
24. de Jong A, Thomas V, Simjee S, et al. Pan-European monitoring of susceptibility to human-use antimicrobial agents in enteric bacteria isolated from healthy food-producing animals. J Antimicrob Chemother, 2012;67 : 638–651.
25. Iovine NM, Blaser MJ. Antimicrobial resistance in Campylobacter [letter]. Emerg Infect Dis, 2004. Dostupné na: http://wwwnc.cdc.gov/eid/article/10/7/04-0580.htm
26. Piddock LJ, Ricci V, Pumbwe L, Everett MJ, Griggs DJ. Fluoroquinolone resistance in Campylobacter species from man and animals: detection of mutations in topoisomerase genes. J Antimicrob Chemother, 2003;51 : 19–26.
27. Charvalos E, Tselentis Y, Hamzehpour MM, Kohler T, Pechere JC. Evidence for an efflux pump in multidrug-resistant Campylobacter jejuni. Antimicrob Agents Chemother, 1995;39 : 2019–2022.
28. Lin J, Michel LO, Zhang Q. CmeABC functions as a multidrug efflux system in Campylobacter jejuni. Antimicrob Agents Chemother, 2002;46 : 2124–2131.
29. Beilei G, McDermott PF, White DG, Meng J. Role of efflux pumps and topoisomerase mutations in fluoroquinolone resistance in Campylobacter jejuni and Campylobacter coli. Antimicrob Agents Chemother, 2005;49 : 3347–3354.
30. Price LB, Lackey LG, Vailes R, Silbergeld E. The persistence of fluoroquinolone-resistant Campylobacter in poultry production. Environ Health Perspect, 2007;115 : 1035–1039.
31. Adler-Mosca H, Lüthy-Hottenstein J, Martinetti Lucchini G, Burnens A, Altwegg M. Development of resistance to quinolones in five patients with campylobacteriosis treated with norfloxacin or ciprofloxacin. Eur J Clin Microbiol Infect Dis, 1991;10 : 953–957.
32. Caldwell DB, Wang Y, Lin J. Development, stability, and molecular mechanisms of macrolide resistance in Campylobacter jejuni. Antimicrob Agents Chemother, 2008;52 : 3947–3954.
33. Lethopolku M, Kotilainen P, Haanper-Heikkinen M, et al. Ribosomal mutations as the main cause of macrolide resistance in Campylobacter jejuni and Campylobacter coli. Antimicrob Agents Chemother, 2011;55 : 5939–5941.
34. Gibreel N, Wetsch M, Taylor DE. Contribution of the CmeABC efflux pump to macrolide and tetracycline resistance in Campylobacter jejuni. Antimicrob Agents Chemother, 2007;51 : 3212–3216.
35. Luangtongkum T, Shen Z, Seng VW, et al. Impaired fitness and transmission of macrolide-resistant Campylobacter jejuni in its natural host. Antimicrob Agents Chemother, 2012;56 : 1300–1308.
36. Lindow JC, Poly F, Tribble DR, et al. Caught in the act: in vivo development of macrolide resistance to Campylobacter jejuni infection. J Clin Microbiol, 2010;48 : 3012–3015.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2014 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Věnování doc. MUDr. Heleně Hupkové, Ph.D. in memoriam
- Klinická a mikrobiologická charakteristika závažných infekcií spôsobených streptokokmi skupiny A
- Vplyv prípravkov určených na dezinfekciu kože, slizníc a rán na životaschopnosť biofilmovej formy rastu mikroorganizmov izolovaných od pacientov s katétrovými infekciami
- Enterohemoragické Escherichia coli jako původci průjmu v České republice (1965–2013)
- Rezistence k erytromycinu, ciprofloxacinu a k tetracyklinu u humánních izolátů Campylobacter spp. v České republice, vyšetřená standardní metodou EUCAST
- Výskyt a vlastnosti baktérií Staphylococcus aureus ve vepřovém mase
- Identifikace izolátů Mycobacterium spp. pomocí MALDI-TOF hmotnostní spektrometrie
- Profesionálna TBC na Slovensku a v Českej republike
- Infekce vyvoláné lidskými alfa herpetickými viry
- Protikladný vývoj trendů incidence kapavky a syfilis ve východočeském regionu – 30 let surveillance
- Avidita antifosfolipidových protilátek – naše současné znalosti
- Současný pohled na diagnostiku a léčbu amébózy ve světle vlastní kazuistické zkušenosti
- Výskyt a charakteristika termotolerantních kampylobakterů v potravinovém řetězci člověka
- Real time RT-PCR panel pro identifikaci dvanácti virů hemoragických horeček
- Význam očkování proti chřipce u osob s kardiovaskulárním onemocněním
- Zhodnocení významu ready-made spaceru s gentamicinem ve vztahu k bakteriologickým nálezům u pacientů s infekcí kloubní náhrady
- Q-horečka jako profesionální onemocnění vedoucí k invaliditě – kazuistika
- Návrat spalniček do Ústeckého kraje
- Vzpomínka na nedožité 90. narozeniny MUDr. Miroslava Přívory, CSc.
- Vzpomínka na nedožité 90. narozeniny prof. MUDr. Bohumila Ticháčka, DrSc.
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Současný pohled na diagnostiku a léčbu amébózy ve světle vlastní kazuistické zkušenosti
- Infekce vyvoláné lidskými alfa herpetickými viry
- Enterohemoragické Escherichia coli jako původci průjmu v České republice (1965–2013)
- Real time RT-PCR panel pro identifikaci dvanácti virů hemoragických horeček
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



