-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Infekce vyvoláné lidskými alfa herpetickými viry
Infections caused by human alpha herpes viruses
Varicella-zoster virus (VZV), herpes simplex virus one (HSV-1) and herpes simplex virus two (HSV-2) represent three out of the eight known human herpesviruses and belong to the subfamily of α-herpesviruses. These viruses are present worldwide and humans are their sole host and reservoir. After the primary infection, these viruses persist in the body throughout life. The period of latency may be interrupted by reactivation of infection due to various factors. Each virus can induce a wide spectrum of diseases. The primary infection is typical for children and otherwise healthy individuals are often asymptomatic. It is mainly immunocompromised patients who are at risk of developing severe disease or complications when infected by these viruses. However, even in otherwise healthy individuals an infection by a-herpesviruses can run a severe course and lead to death.
Keywords:
Herpes Simplex Virus 1 and 2 – Varicella Zoster Virus
Autoři: V. Boštíková 1
; M. Salavec 2; J. Smetana 1
; R. Sleha 1; M. Coufalová 1; M. Špliňo 1; P. Boštík 3,4
Působiště autorů: Katedra epidemiologie, FVZ UO, Hradec Králové 1; Klinika nemocí kožních a pohlavních, FN a LF UK, Hradec Králové 2; Klinika infekčních nemocí, FN a LF UK, Hradec Králové 3; Centrum pokročilých studií, FVZ UO, Hradec Králové 4
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 63, 2014, č. 3, s. 205-212
Kategorie: Souhrnná sdělení, původní práce, kazuistiky
Souhrn
Varicella-zoster virus (VZV), spolu s herpes simplex virem jedna (HSV-1) a herpes simplex virem dva (HSV-2) reprezentují 3 z 8 známých a patří do skupiny α-herpesvirů. Tyto viry jsou rozšířeny celosvětově a jejich jediným hostitelem a zároveň rezervoárem je člověk. Po primoinfekci nastává latentní fáze infekce a tyto viry perzistují v lidském organismu celoživotně. Období latence může být v důsledku působení různých faktorů přerušeno reaktivací infekce. Jednotlivé viry vyvolávají široké spektrum onemocnění. Primoinfekce jsou povětšinou typické pro dětský věk a u jinak zdravých jedinců mají často asymptomatický průběh. Závažná onemocnění a komplikace výrazně ohrožují imunokompromitované pacienty, nicméně nezřídka mohou vyvolat závažné onemocnění či dokonce úmrtí i u člověka původně zdravého.
Klíčová slova:
Herpes simplex virus 1 a 2 – Varicella zoster virusÚVOD
Čeleď Herpesviridae (herpei – v překladu z řečtiny plížit se) zahrnuje okolo 120 virů infikujících obratlovce – ryby, obojživelníky, plazy, ptáky a savce včetně člověka a minimálně jeden rod bezobratlých – ústřice [1].
Na základě molekulárně genetických analýz a fylogenetických rozborů se odhaduje, že herpetické viry se poprvé objevily na Zemi před zhruba čtyřmi sty milióny let [2]. Lidské herpetické viry řadíme do tří podčeledí, které měly jednoho společného předka. Na jejich rozdělení měly přímý vliv procesy delece, substituce a inserce nukleotidů, které modifikovaly jednotlivé virové geny [3]. Ukazuje se, že viry koexistovaly a vyvíjely se v úzkém vztahu se svými hostitely. Jejich rozšíření je celosvětové [4].
Všechny tyto viry jsou vysoce nakažlivé a nemají jiného než lidského hostitele. Člověk je pak zároveň i jejich jediným rezervoárem. Jedná se o velmi úspěšná infekční agens, která se buď přímým kontaktem, nebo respirační cestou rychle šíří v rámci populace od jednoho jedince k druhému. Jednotlivé viry se replikují v rozdílných cílových buňkách [1, 3].
Virion herpetických virů se skládá ze 4 strukturálních částí – obálky, tegumentu, kapsidy a jádra (obr. 1). Velikost virových částic se pohybuje mezi 200–240 nm. Obálka nese na svém povrchu glykoproteiny. Tegument je tvořen amorfním materiálem, který chrání a obklopuje virovou kapsidu. Kapsida o velikosti 100 až 110 nm se vyznačuje ikosohedralní symetrií a tvoří ji celkem 162 kapsomer. Jádro je tvořeno dvoušroubovicovou DNA. Velikost genomu se pohybuje v rozmezí od 125 do 245 kb [1,2,4,6].
Obr. 1. Schéma herpetického virionu [4] Fig. 1. Architecture of the herpes virion [4] ![Schéma herpetického virionu [4]
Fig. 1. Architecture of the herpes virion [4]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/51b5fc0c0d7a3869be7e8a38ab88f456.png)
Po primoinfekci hostitele přecházejí tyto viry do období latence, které může být v důsledku vlivu různých faktorů (imunosuprese, trauma, systémové onemocnění, expozice UV záření, stres, hypotermie, hypertermie, chirurgický stres) přerušena reaktivací. Je ovšem známo, že reaktivace může nastat i spontánně bez zjevné příčiny [7]. U imunokompromitovaných pacientů jsou velmi často popisovány rekurentní infekce, ke kterým dochází právě důsledkem reaktivace viru a které jsou v těchto případech velmi často život ohrožující [8, 9].
Primární onemocnění probíhají velmi často asymptomaticky nebo mají benigní průběh. Kromě „klasických“ infekcí je o některých herpetických virech známo, že mají onkogenní potenciál a podílejí se tudíž na patogenezi nádorových onemocnění [10].
Diagnózu je třeba kromě klinického vyšetření a epidemiologické anamnézy také podpořit laboratorními testy, převážně sérologickými a molekulárně genetickými (PCR, sekvenace, genotypizace). Tkáňové kultivace jsou možné, ale výsledky jsou známy až za několik dnů.
ALFAHERPESVIRIDAE
Tato skupina zahrnuje celkem tři známé lidské herpetické viry, a to HSV-1, HSV-2 a VZV. Obecně se viry této skupiny vyznačují rychlou replikací a šířením, stejně jako rychlým ničením cílových buněk a neurotropismem. Primoinfekce těmito viry začínají na kůži či sliznicích, ale v dalším průběhu jsou u nich často popisovány neuroinfekce. V latentní fázi tyto viry typicky perzistují – HSV-1 v Gaserském gangliu, HSV-2 v sakrálních gangliích a VZV ve gangliích spinálních. Při reaktivaci dochází k šíření virů z ganglií, a tudíž lokální symptomy se objevují v oblastech inervovaných z ganglií. Pro HSV-1 a VZV je typické promořování populace v raném věku.
Herpes simplex virus 1 a 2
Infekce viry herpes simplex jsou velmi časté a mívají chronicky-perzistující průběh a individuálně rozdílnou frekvenci a trvání recidiv (obr. 2).
Obr. 2. Schéma jednotlivých možných onemocnění vyvolaných HSV-1 a HSV-2 Fig. 2. Diseases caused by HSV-1 and HSV-2 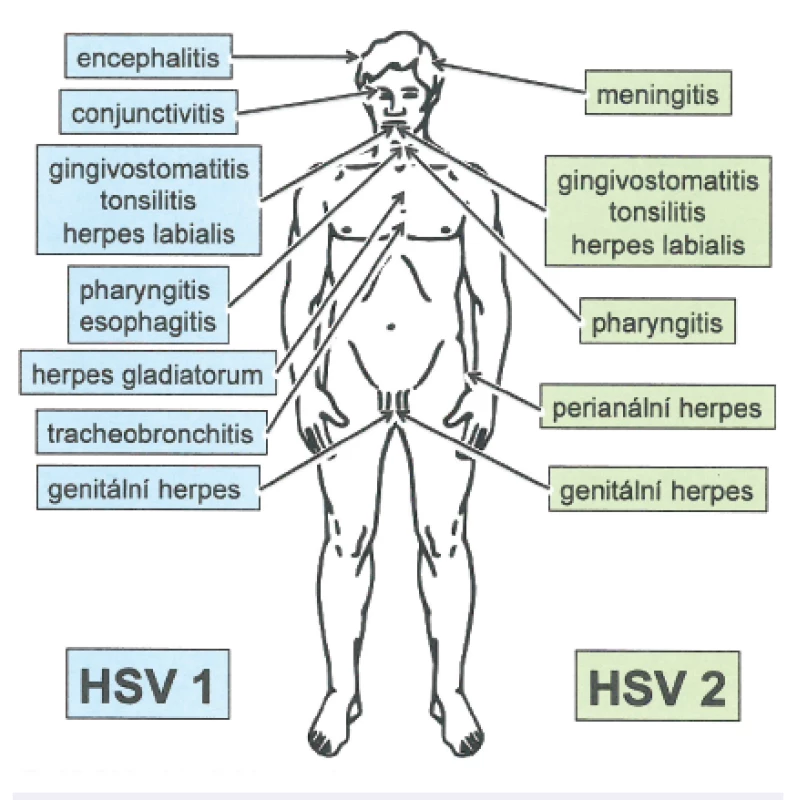
Tyto viry působí převážně mukokutánní onemocnění kůže či sliznic a méně často infekce centrálního nervového systému (CNS), které ale mohou mít život ohrožující průběh. Oba typy virů jsou rozšířeny celosvětově. Protilátky proti HSV-1 se objevují u více než 80 % světové populace, ve vyspělých průmyslových státech jsou prokazatelné protilátky proti HSV-2 u 20 % populace (v rizikových skupinách až u 60 %; typický je vzestup od puberty) [2, 6, 11].
HSV-1 působí onemocnění převážně v orofaciální oblasti, zatímco HSV-2 je dominantně odpovědný za genitální infekce. Nicméně některé studie prokazují výskyt HSV-1 až v 50 % klinických genitálních izolátů. Opačně ovšem tato situace z dosud neobjasněných příčin neplatí, takže HSV-2 je jen výjimečně izolován z orálních odběrů [11, 12].
Infekce HSV se šíří kapénkami a kontaktem se symptomatickým pacientem, ale jsou popsány i přenosy infekce při asymptomatickém vylučování viru. Inkubační doba se pohybuje okolo 6–8 dnů a pacienti jsou infekční po dobu zhruba týdne až deseti dnů, kdy je virus vylučován [12, 13].
Primoinfekce HSV-1 se typicky projevují jako gingivostomatitida, faryngitida, konjuktivitida, eczema herpeticum, 30 % pak představují infekce CNS. U většiny dospělé populace dochází minimálně jednou k HSV-1 nákaze a ve zhruba 45 % případů dochází k rekurencím onemocnění. Rekurence jsou přičítány stresu, teplotě, expozici UV záření [11, 12].
Pro primární herpetickou gingivostomatitidu je typický otok, erytrém, bolestivost a horečky. Objevují se vezikuly se zánětlivým lemem, lymfadenopatie, silné slinění a nechutenství. Jde o častý problem hlavně u dětí během prvních pěti let života. Inkubační doba se pohybuje okolo 4 dnů až týdne. Klinické projevy přetrvávají 2–3 týdny, včetně vysokých teplot. V závažných případech je třeba hospitalizace.
Pro herpetickou konjuktivitidu je typický edém víček, výskyt vezikul a fotofobie. HSV-1, může vyvolat záněty rohovky, eventuálně ve spojení se zánětem duhovky, vzácně může být pozorována i akutní retinální nekróza. Tyto symptomy mohou být doprovázeny výsevem puchýřů lokalizovaných na očních víčkách či tvářích [7].
Po reaktivaci se virus projevuje obvykle jako herpes labialis, keratitida, blefaritida, keratokonjunktivitida či opět infekce CNS.
Epidemiologická data týkající se výskytu herpetických encefalitid (HSV-1) hovoří o 1 případu nové infekce na 250–500 000 obyvatel/rok. Typicky se objevují hemoragické nekrózy temporálního laloku. I přes včasnou diagnózu a terapeutický zásah je v těchto případech mortalita vysoká (okolo 30% u pacientů po roční terapii). U přeživších pak zhruba v 50 % případů dochází ke středně těžkým až těžkým trvalým neurologickým následkům [11].
V prevalenci infekcí HSV-2 existují na území Evropy velké rozdíly, zejména mezi jižní a severní částí kontinentu. Ve Skandinávii je udávána séroprevalence mezi 15–35 %, ve Španělsku u věkové skupiny 14–17 let, případně 15–45 let pouze v rozsahu 2–6 % [11].
Infekce HSV-2 jsou častěji zjišťovány u žen (faktory ovlivňující infekce žen jsou nejasné). Primární infekce jsou řazeny mezi sexuálně přenášená infekční onemocnění (STI) a jejich typickou je herpes genitalis. Další možná postižení se projevují jako perianální či anální herpes nebo infekce CNS, zatímco reaktivace se typicky projevují jako genitální herpes.
Pravděpodobnost, že se zdravá žena infikuje od svého infekčního partnera se pohybuje na 80% hladině. Prostředí ženského genitálního traktu pravděpodobně napomáhá náchylnosti k infekci.
Genitální infekce HSV může probíhat pod obrazem herpes genitalis s vývojem drobných puchýřků a posléze erodovaných lézí, ale též asymptomaticky. Kromě typické genitální lokalizace lze výsevy pozorovat i v oblasti hýždí a v perianální krajině. Tyto infekce jsou charakterizovány významnou zánětlivou reakcí s diseminovanými, symetricky lokalizovanými erytémovými ložisky s následným vývojem puchýřků, pustulek, erozí až ulcerací. U více jak 2/3 pacientů zjišťujeme zvýšenou teplotu, bolesti svalstva a bolesti páteře. U žen s primární infekcí HSV se zjišťuje i výtok z vaginy a uretry, dysurické obtíže jako následek vývoje puchýřků v blízkosti meatus urethrae. Obtíže při močení mohou být vyvolány HSV indukovanou dysfunkcí autonomního nervového systému. U žen bývá pozorována i aseptická meningitida. U obou pohlaví jsou pozorovány parestezie a dysestezie v oblasti stehen a perinea, které jsou považovány za komplikaci. Primární perianální infekce HSV-2 a herpetické proktitidy bývají zjišťovány u homosexuálních mužů [11, 14].
Velmi nebezpečné jsou kongenitální infekce. K infekci plodu nebo novorozených dětí dochází asi v 5 % případů in utero, u 80 % během porodu a ve zbývajících 15 % po porodu. Dojde-li k nákaze během těhotenství, může dojít ke spontánnímu potratu. U 35 % onemocnění může dojít k rozvoji encefalitidy a u 25 % jsou zjišťovány diseminované infekce. Oba typy těchto komplikací jsou závažné a končí až v 65 % případů bez terapie fatálně. Jen 10 % neonatálně infikovaných dětí (s vlivem na CNS) se bude po narození vyvýjet normálně. Orgánová postižení se nejčastěji týkají CNS a plic. Infekce může být generalizovaná s typickou přítomností cytopenie. Rizikovým faktorem infekce novorozenců je přímý kontakt plodu s infekčním sekretem z genitálií matky v průběhu klasického porodu, při kterém dochází k infekci v 90 % případů. Tyto diagnózy se proto obvykle řeší císařským řezem [13].
V rámci diagnostiky představují problém recidivující infekce herpes genitalis. Podle některých autorů je správné diagnózy dosaženo pouze u každého 5. pacienta. Základem správné diagnózy je velmi pečlivé klinické vyšetření urogenitální krajiny včetně uretry, vaginy, cervixu, perianální krajiny a anální sliznice. Na primární herpes genitalis poukazují klinicky obustranně lokalizované bolestivé léze s trváním nejméně 7 dnů. U 2/3 pacientů se objevují i celkové symptomy jako horečka a bolesti hlavy [15, 16].
V laboratorní diagnostice je za hrubý ukazatel považována exfoliativní cytologie (Tzanckův test) s průkazem cytopatologií v epiteliálních buňkách při infekci herpetickými viry. Jde o jednoduchou a rychlou metodu, která vyžaduje Wrightovo-Giemsovo barvení stěru ze spodiny puchýře s průkazem balonovitých epiteliálních buněk, případně multinukleárních obrovských buněk světelným mikroskopem. Nevýhodou tohoto testu je nízká senzitivita a nemožnost vzájemného rozlišení HSV-1, HSV-2 a VZV infekcí.
Jedinou jistou diagnostickou metodou je průkaz viru, který je doporučován při nálezu orálně či genitálně lokalizovaných puchýřků a erozí a u diseminovaných či atypických erozivních eflorescencí. Ke kultivaci HSV v primárních buněčných kulturách je zapotřebí 3–5 dnů. Pro diagnostické účely je vhodná tekutina puchýře z čerstvých eflorescencí a stěry spodiny puchýřků.
Největší citlivost vykazuje polymerázová řetězová reakce (PCR), schopná rozlišit negativní a pozitivní klinické vzorky, včetně typu HSV a stanovení počtu kopií virové DNA ve vzorku. Je ale nutné poznamenat, že případy, kdy se na herpes simplex infekci podílejí oba dva typy virů, jsou stále častější. Výše popsaná technika průkazu antigenu se využívá při diagnostice infekcí v neurologii (vyšetření liquoru); pozitivní výsledky lze očekávat nejdříve po 2. dnu klinických příznaků. Pomocí metody hybridizace in situ ve tkáňových kulturách lze DNA herpes simplex virů prokázat přímo [17].
Sérologická diagnostika je problematická. Při sérokonverzi IgM protilátek lze diferenciálně diagnosticky odlišit primární a recidivující infekce HSV. Při nízkém počtu recidiv ale zpravidla nenacházíme ani IgM, ani vzestup IgG protilátek. Latentní, případně asymptomatické, infekce HSV-1 a HSV-2 lze diagnostikovat pomocí typově specifických protilátek. To může hrát významnou roli v diagnostice partnerů s herpes genitalis. Tato sérologická typizace je doporučována i HIV pozitivních pacientů a rizikových pacientů.
Nespecifická terapie manifestních infekcí HSV zahrnuje užití analgetik, antiflogistik (včetně derivátů kyseliny salicylové) a nesteroidních antirevmatik (NSAID). V lokální terapii užíváme antiseptika s jodovými deriváty, organickými barvivy. Indikací pro antivirovou terapii jsou klinicky manifestní HSV infekce.
Terapeutické cíle u primárních infekcí HSV jsou nezávisle na typu viru charakterizovány snížením replikace viru, zkrácením doby subjektivních obtíží (bolestivost) a zábranou systémových komplikací. Při včasné a správně dávkované léčbě jsou tyto cíle (užitím nukleotidových analogů acycloviru, u diagnózy genitálního herpes i valacycloviru a famcykloviru) dosažitelné. U recidivujících infekcí se terapií snažíme o snížení počtu recidiv. Při nasazení dnes užívaných typů protivirové terapie to však není vždy možné. I v klinických studiích při využití prostředků ovlivňujících imunitní odpověď nebyl počet recidiv významně ovlivněn. Léčebné cíle u recidivujících infekcí HSV jsou zkrácení doby vylučování viru, snížení rozsahu zánětlivých symptomů a rychlé odhojení herpetických lézí [18, 19].
U primárního herpes genitalis (obr. 3) je indikována systémová antivirová terapie za užití derivátů acycloviru, valacycloviru a famcycloviru. U recidivujících herpes genitalis lze ovlivnit stupeň závažnosti a délku perorální terapií. Předpokladem je včasné zahájení léčby. Doporučuje se i systémová epizodická terapie. Lokální terapie za použití antivirových extern nevede k přesvědčivým výsledkům. Perorální supresivní terapie podávaná po více měsíců je doporučována u více jak 6 recidiv za rok v genitální oblasti.
Obr. 3. Herpes genitalis (použito se svolením prof. MUDr. K. Pizingera, CSc.) Fig. 3. Herpes genitalis (used with permission of Prof. K. Pizinger, MD, PhD) 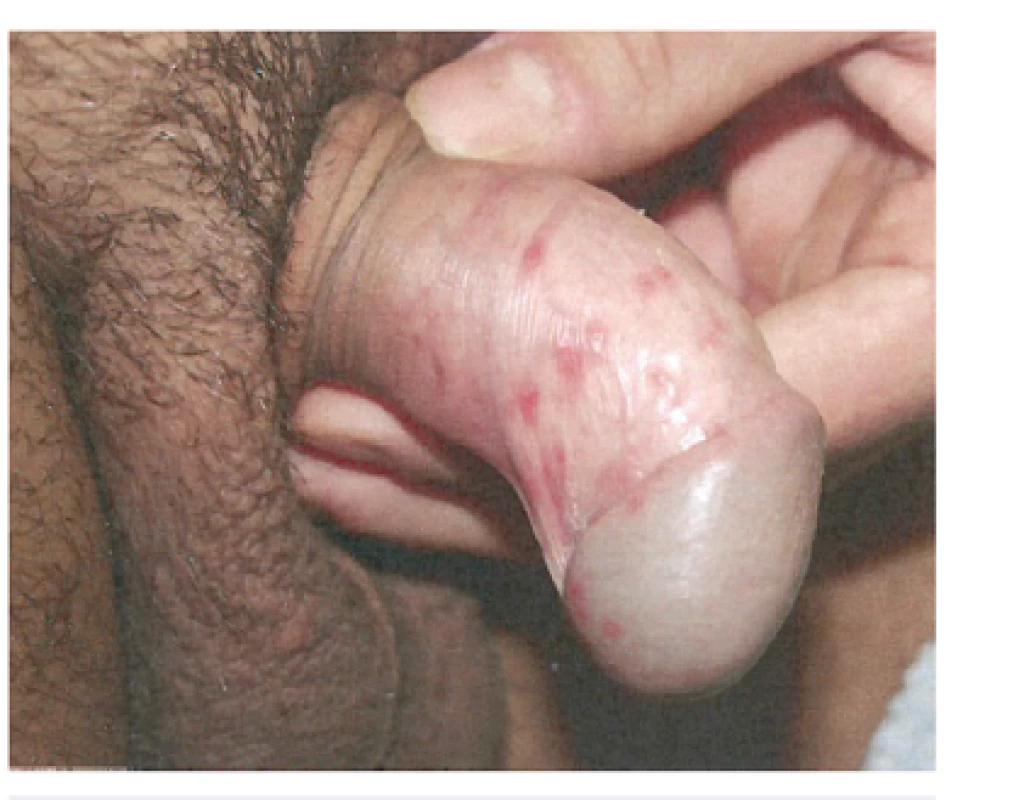
U imunosuprimovaných nebo u HIV pozitivních pacientů nedostatečně reagujících na terapii acyclovirem se doporučuje zvýšení dávky či nasazení Foscarnetu i. v. [10].
V časném těhotenství není indikována terapie acyclovirem. Principiálně je terapie acyclovirem v graviditě nasazována pouze při přísné indikaci, jako např. u primárního herpes genitalis, u HSV infekcí ohrožujících život matky a u manifestního herpes genitalis na počátku porodních stahů. Přesto přibývá případů preventivního nasazení acycloviru u recidivujících herpetických infekcí [10, 20].
Manifestní infekce HSV u novorozenců jsou indikací k okamžité terapii acyclovirem i. v. v dávkách 20–60 mg/kg tělesné hmotnosti po dobu nejméně 14–21 dnů. Základem této indikace je virologicky stanovená diagnóza. Orální či lokální virová terapie je v této indikaci neúčinná.
Sexuální partneři s klinickými příznaky by měli být léčeni stejně. U asymptomatických pacientů se doporučeje sérologické vyšetření.
U hlediska očkovacích látek je v běhu několik studií kandidátních vakcín, na různém stupni testování.
Varicella zoster virus
Varicella zoster virus (VZV) způsobuje vysoce nakažlivé onemocnění (obr. 4). Rozeznáváme dvě odlišné klinické jednotky – varicellu (plané neštovice) jako manifestaci primoinfekce a herpes zoster (pásový opar), který je manifestací reaktivace. Molekulárně genetická analýza nedávné současnosti pak potvrdila, že obě nemoci jsou skutečně projevem téhož viru [4, 21].
Obr. 4. Typický VZV v tkáňové kultuře, 10. den kultivace (foto V. Boštíková) Fig. 3. Typical VZV in tissue culture, day 10 of culture (photo by V. Boštíková) 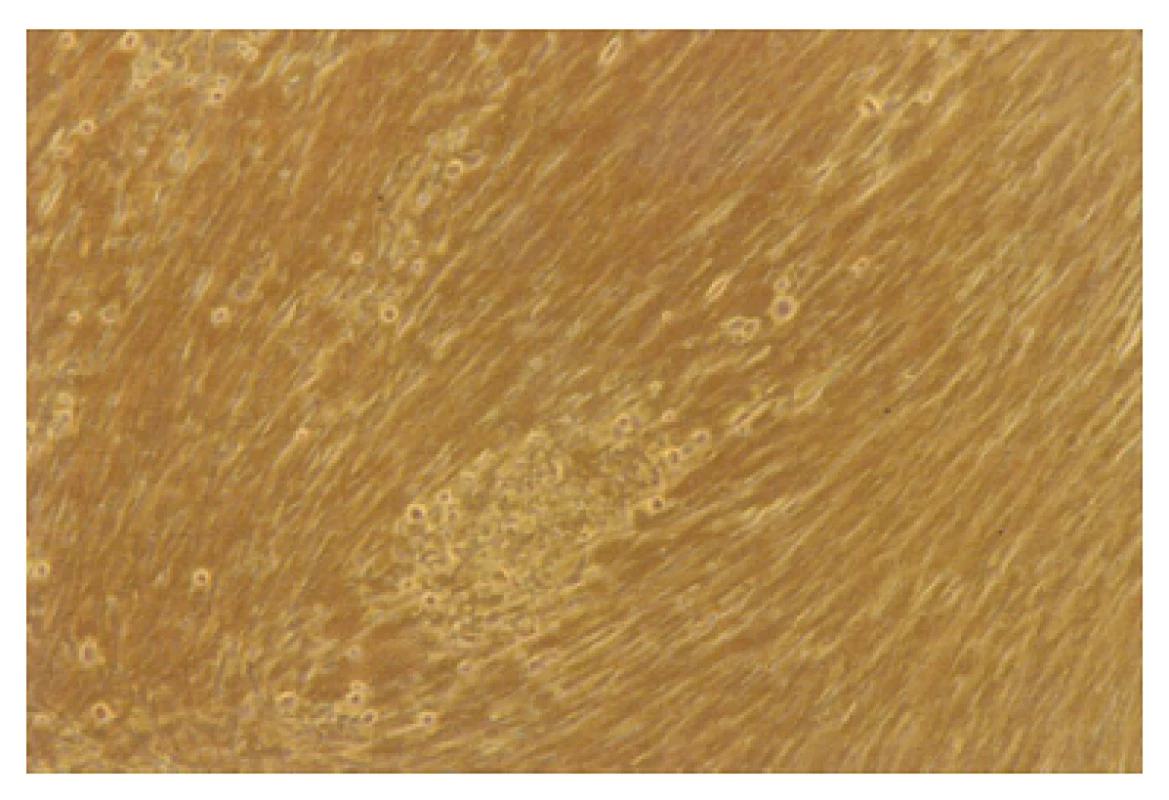
Plané neštovice jsou v podmínkách mírného pásu typicky sezonním exantémovým onemocněním převážně malých dětí do deseti let věku. U dětí toto onemocnění probíhá většinou bez komplikací, nicméně u starší populace je průběh těžší (asi ve 2 %). Vyrážka začíná na hlavě a na trupu a šíří se na končetiny, kde ale vynechává dlaně a chodidla. Dále postihuje i sliznici dutiny ústní, spojivky a genitál [22].
Přenos se děje hlavně vzdušnou cestou nebo přímým kontaktem s kožními eflorescencemi, kde jsou vstupní branou zejméne orofarynx a spojivky, ale možný je i transplancentární přenos. Nakažlivost u imunokompetentních pacientů začíná asi 2 dny před výsevem neštovic a trvá většinou 7 dnů do zaschnutí všech lézí [23, 24].
Nákaza varicellou v prvních měsících těhotenství může vzácně vést k vrozeným vadám končetin, lebky, mozku a rozsáhlým jizevnatým změnám na kůži plodu (kongenitální varicella). Naopak při infekci matky v posledních 2–3 týdnech těhotenství může virus transplacentárně nakazit plod (neonatální varicella), kdy se dítě s vyrážkou narodí, nebo se u něj projeví hned v prvních dnech života. Infekce u těchto dětí je mírněna mateřskými protilátkami a probíhá zpravidla lehce. Pokud matka onemocní varicellou v rozmezí od posledních 5 dnů před porodem do dvou dnů po porodu, nedojde k významnějšímu transplacentárnímu přenosu mateřských VZV protilátek. Průběh onemocnění u novorozence pak bývá těžký a často dochází i k tzv. viscerální varicelle, kdy jsou postiženy parenchymatózní orgány [25, 26, 27].
Mezi nejčastější komplikace varicelly patří sekundární bakteriální infekce, při které může vzácně dojít i k sepsi. V praxi málo viděnou komplikací mohou být krvácivé projevy podmíněné trombocytopenií nebo diseminovanou intravaskulární koagulací. Mezi další komplikace řadíme např. myokarditidu, perikarditidu, hepatitidu, glomerulonefritidu, orchitidu, artritidu, stejně jako možný výskyt meningoencefalitidy nebo pneumonie [27, 28, 29].
V rámci terapie se podávají obvykle antihistaminika a antipyretika, s výjimkou kyseliny acetylsalicylové, při jejímž podání hrozí zvýšené nebezpečí vývoje Reyeova syndromu. Acyklovir nebo valacyklovir je ordinován jen u komplikací a dále těhotným a imunosuprimovaným jedincům [30, 31].
Jedinou vhodnou prevencí VZV infekcí je očkování. V Evropě se používá vakcína Varilrix firmy GSK, tj. živá atenuovaná vakcína, která je cílena na skupinu dětí od 9. měsíců do 12. let, ale za určitých podmínek je možno očkovat i děti starší. Dále je k dispozici vakcína ProQuad firmy Merck – kombinovaná, opět živá očkovací látka proti spalničkám, zarděnkám, příušnicím a planým neštovicím (MMRV), schválená pouze pro skupinu dětí ve věku 1–12 let. Na trhu lze pak najít ještě obdobnou vakcínu od jiného výrobce – Priorix Tetra (GSK) [32].
V současnosti doporučené dvoudávkové aplikační schéma (ACIP, 2007) všech výše jmenovaných vakcín je výsledkem praktické aplikace dat získaných z randomizovaných klinických studií, které porovnaly jedno - a dvoudávkové schéma se závěrem, že signifikantně vyšší účinnost vakcíny (až 98%) byla dosažena u dvoudávkového schématu. Kromě toho bylo potvrzeno, že dvoudávkové schéma velmi efektivně ovlivňuje průběhy těžkých varicellových infekcí. V případě, že očkovaná osoba onemocní varicellou, průběh nemoci je obvykle slabý, představpvaný často výskytem pouze zvýšených teplot a rychlým nástupem rekonvalescence [33, 34].
Nicméně ve většině zemí světa je proočkovanost VZV vakcínou nízká. V evropských podmínkách se přitom opakovaně setkáváme v období od prosince, respektive ledna, až do května, respektive června, s menšími či většími epidemiemi planých neštovic (obr. 5). Živnou půdou jsou dětské kolektivy mateřských školek a prvního stupně základních škol [25, 27].
Obr. 5. Počet případů onemocnění planými neštovicemi na evropském kontinentu v roce 2010 (www.szu.cz). Fig. 5. Chickenpox cases in European countries in 2010 (www.szu.cz) 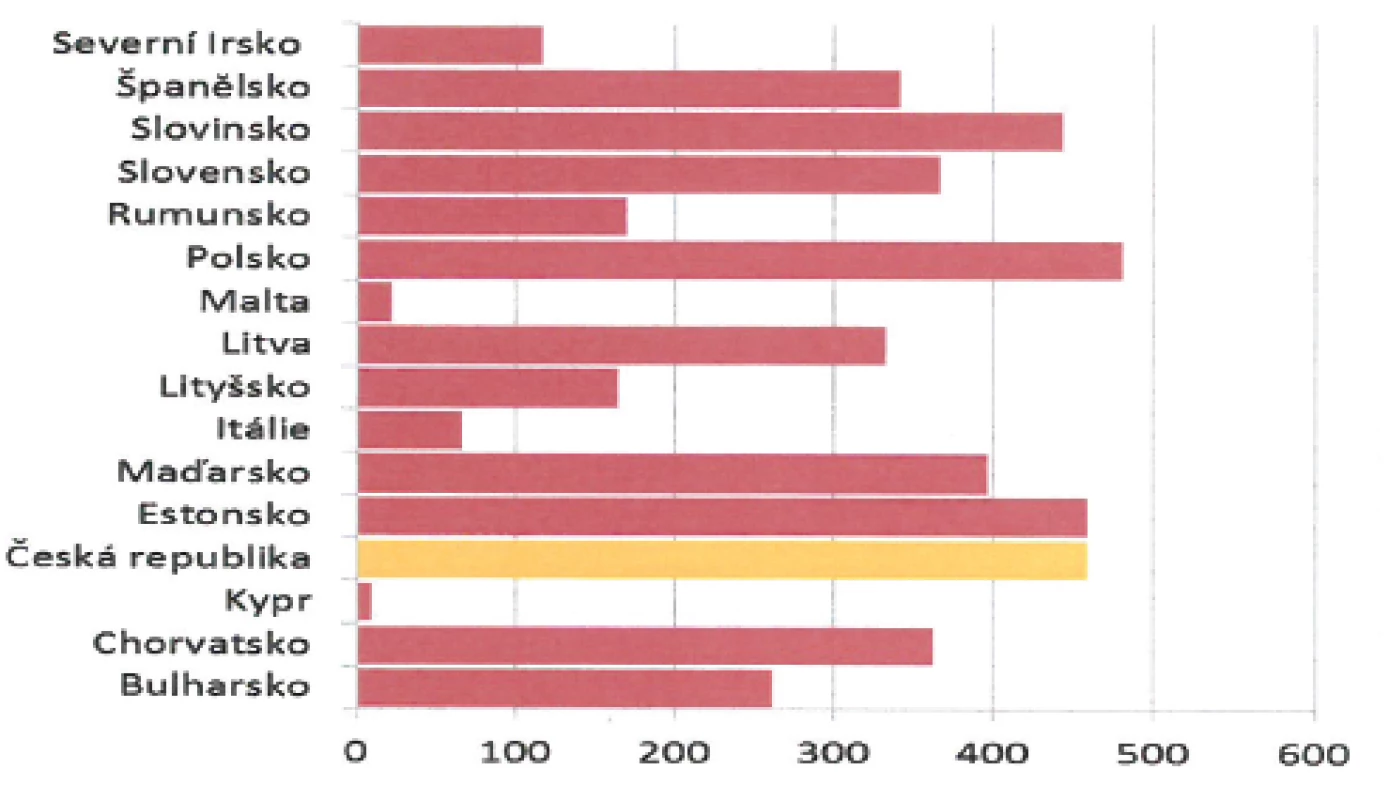
Plané neštovice jsou v České republice nejčastějším infekčním onemocněním podléhajícím povinnému hlášení v systému Epidat (www.szu.cz) – obrázek 6. V letech 1989–2009 se počet hlášených onemocnění pohyboval cca mezi 33 000–71 000 případů za rok, což odpovídá průměrné roční nemocnosti 439 případů/100 000 obyvatel. Obdobný výskyt varicelly byl zaznamenán v 50. a 60. letech minulého století, kdy průměrná roční incidence činila 476 případů/100 000 obyvatel. V následujícím období 70. a 80. let byl počet hlášených onemocnění vyšší, průměrná roční incidence vzrostla na 759 případů/100 000 obyvatel. Nejvyšší nemocnosti bylo dosaženo ve věkových skupinách 1–4 let a 5–9 let, kdy 41 % dětí prodělá varicellu během prvních 5 let života, dalších 47 % do 10. roku. Nemocnost mezi chlapci a dívkami se nijak významně neliší [35, 36, 37].
Obr. 6. Absolutní počty nemocných planými neštovicemi a pásovým oparem v České republice mezi lety 1958–2011 (www.szu.cz) Fig. 6. Absolute numbers of patients with chickenpox and herpes zoster in the Czech Republic in 1958–2011 (www.szu.cz) 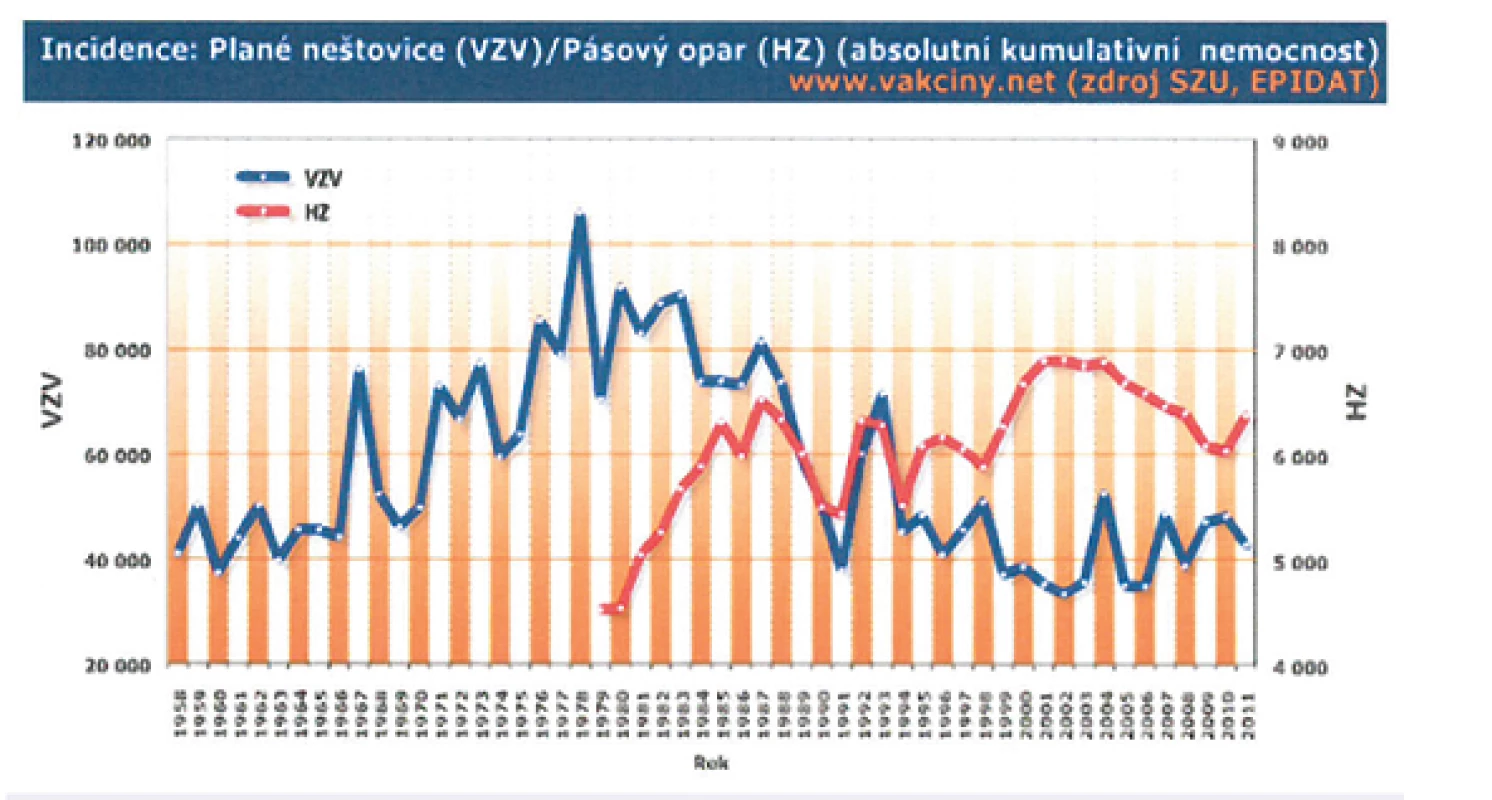
Epidemiologie onemocnění planými neštovicemi se různí v závislosti na geografických a klimatických podmínkách oblasti výskytu. Odlišnosti jsou nejvýraznější ve chvíli, kdy porovnáváme data ze zemí mírného a tropického pásu, kde v tropickém pásmu se maximum onemocnění varicellou objevuje ve výrazně vyšší věkové skupině (18–35 let). Velmi často v těchto oblastech chybí také sezonní průběh epidemií. Tento posun nebyl dosud uspokojivě vysvětlen (obr. 7), [38, 39].
Obr. 7. VZV séroprevalence (vyjádřená v %) v závislosti na věku v populacích zemí a oblastí (USA, Turecko, Filipíny, Singapur, ostrov sv. Lucie v karibské oblasti a Belgie) s odlišným podnebím (www.cdc.gov) Fig. 7. Age-specific VZV seroprevalence (expressed in %) for countries and regions (USA, Turkey, Philippines, Singapore, Saint Lucia Island in the Caribbean Sea, and Belgium) in different climatic zones (www.cdc.gov) 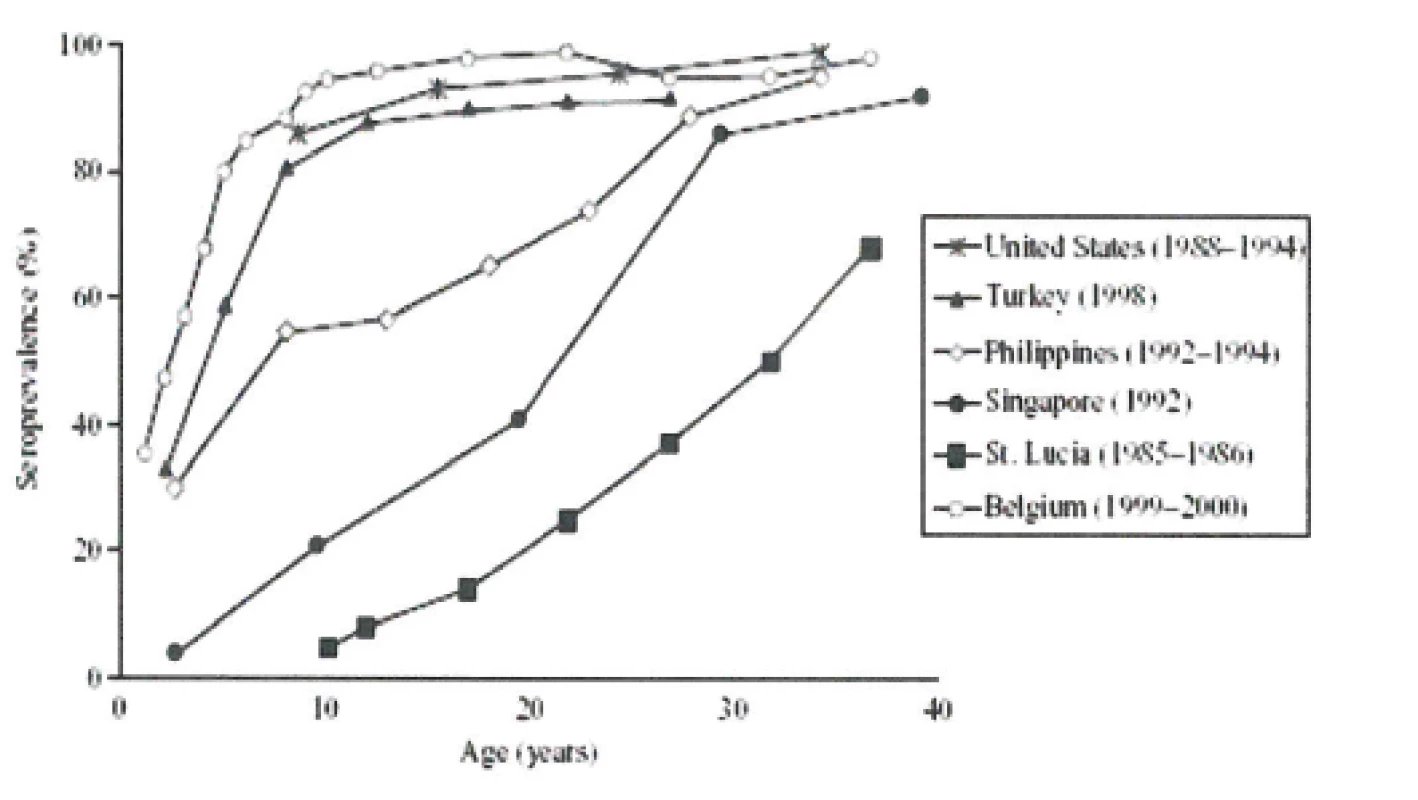
Po primární infekci varicellou dojde k navození latence a virus zůstává v dorzálních spinálních gangliích nebo v gangliu trigeminálním. Při reaktivaci, ať už v důsledku podnětu endogenního nebo exogenního charakteru, může dojít obvykle v pozdějším věku k rozvoji pásového oparu. Prodromální stadium od prvních příznaků možné reaktivace do plného rozvoje onemocnění je obvykle 7–12 dnů [40, 41].
Výsevu kožních puchýřků předchází bolest, eventuálně ztráta citlivosti v místě inervace nervem, v rámci kterého se virus šíří. Mezi typické oblasti těla, které bývají postiženy, patří obličej, šíje, krk a laterální části hrudníku. Vyrážka obvykle mizí po dvou až třech týdnech (obr. 8 a 9).
Obr. 8 a 9. Herpes zoster (foto doc. MUDr. M. Salavec, CSC) Fig. 8 and 9. Herpes zoster (Photo by Assoc. Prof.. M. Salavec, MD, PhD) 
Komplikace může způsobit výsev HZ v oblastech kolem očí a uší, a to až do takové míry, že dojde ke ztrátě zraku, obrně lícního nervu, eventuálně k virové encefalitidě. HZ ophtalmicus se vyskytuje přibližně u 15 % pacientů s postižením trigeminu. Typická je keratitis, conjunctivitis, scleritis, iritis a retinitis. Pokud není nasazena antivirová terapie, pak u 50–70 % pacientů nastanou oční komplikace [7].
Zosterová encefalitida je vzácná a je typická strnutím šíje, bolestí hlavy, fotofobií a meningismem. Pro její propuknutí je zásadním rizikovým faktorem věk pacienta a postižení druhé větve pátého kraniálního nervu. Zosterové encefalitidy se vyskytují s četností 0,2–0,5 % v rámci komplikovaných zosterových infekcí.
Pozornost si zaslouží vzácně se vyskytující zosterové infekce u dětí. Byla pozorována vyšší incidence HZ u malých dětí, které se setkaly s varicellou in utero, anebo onemocněly varicellou před dovršením druhého roku života. Je známo, že onemocnění planými neštovicemi během prvních dvanácti měsíců života dítěte zvyšuje významně možnost onemocnění HZ, pravděpodobně v důsledku nevyzrálé imunitní odpovědi k VZV. V roce 1965 publikovali Hope a Simpson studii, ukazující, že incidence HZ mezi dětmi mladšími deseti let je 74 případů na 100 000 osob/rok. Tato pravděpodobnost se 14krát zvyšuje pro skupinu osob ve věku 80–89 let (1 010 případů na 100 000 osob/rok) – obrázek 10, [44, 45].
Obr. 8. Incidence herpes zoster v závislosti na věku pacientů [52] Fig. 10. Age-specific incidence of herpes zoster [52] ![Incidence herpes zoster v závislosti na věku pacientů [52]
Fig. 10. Age-specific incidence of herpes zoster [52]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/8245f8b979439a72b1e100a7c9d2ddb0.png)
Až 20 % dětí onemocní HZ v případě, že byly postiženy kongenitálním varicellovým syndromem.
Podle českého informačního systému Epidat onemocní ročně v průměru v České republice pásovým oparem 6 295 osob (data za období 1990–2008). V české populaci je každoročně pozorován zhruba o třetinu vyšší výskyt HZ u žen než u mužů. Podobné nálezy byly publikovány ve studiích z Nizozemí či USA. V nizozemské populaci byl nárůst HZ u žen oproti mužům až 38 % [42, 43, 44].
U HIV pozitivních jedinců je průběh onemocnění velmi závažný a vede ke generalizaci projevů s recidivami. Infekce přetrvává více týdnů a vykazuje nedostatečnou odpověď na léčbu acyklovirem. Zoster může být i první manifestací HIV infekce. Popisován je i vztah zosteru a některých jiných infekčních onemocnění, jako např. pozdního stadia syfilis
Herpes zoster začíná a zpravidla i končí bolestivostí různé intenzity. Akutní bolestivost se objevuje před kožními výsevy a během kožních výsevů, chronické bolesti po odhojení kožních změn. Termínem postherpetická neuralgia (PHN) rozumíme přetrvávající bolesti po určitém časově definovaném interval [46, 47].
Akutní bolesti, nejčastěji popisované jako ostré či bodavé, jsou definovány jako bolesti objevující se před vznikem kožních změn či v jejich průběhu. Většina pacientů udává střední až silné akutní bolesti s trváním až do 1 měsíce. Příčinou těchto bolestí je akutní ganglionitis s fokální nekrózou a degenerací motorických a senzorických nervových kořenů. Během výsevu kožních změn dochází k zesílení akutní bolesti, poté bolest pomalu regreduje, většinou paralelně s odhojením kožních lézí [48].
Chronické PHN, které bývají na rozdíl od akutních typu bolestí popisovány jako pálící typ bolestí, se většinou objevují během kožního výsevu. Mohou se ale objevit až po odhojení kožních projevů. Definice PHN se u různých autorů liší: typicky jsou PHN typem bolestí přetrvávajících 3–6 měsíců či déle po akutní infekci. Jsou popsány případy, kdy bolest přetrvávala i několik let po odeznění kožních příznaků. Incidence PHN kolísá v závislosti na definici. Chronické bolesti se objevují nejčastěji u starších jedinců (více jak 50 let věku). Trvání se zosterem asociovaných bolestí není ovlivněno pohlavím či rasou, i když jsou v kategorii pacientů starších 50 let intenzivnější a zřetelně časově prodloužené u žen [46].
Motorické parézy se vyskytují u 1–5 % pacientů. Vykazují myelitidu, generalizovanou polyneuritidu a segmentální parézy, často v oblasti krční či lumbální. Až u 70 % pacientů dochází k úplné remisi.
U závažných průběhů, často při postižení 1. větve trigeminu. je prokazováno vyšší riziko rozvoje meningoencefalitidy či myelitidy s průkazem lymfocytární pleiocytózy (10–500 buněk/mm3) liquoru. K takovýmto komplikacím může docházet od 30 dnů před vznikem kožních projevů až do 2 měsíců po odhojení kožních změn [49].
Herpes zoster v graviditě a v perinatální periodě nepředstavuje riziko pro dítě. Ve srovnání s varicellou, u herpes zoster nedochází k virémii a novorozenci jsou chráněni mateřskými protilátkami. Při absenci protilátek je ale možný vznik varicelly přenosem z kožních lézí infekce herpes zoster. Infekce je doprovázena zvýšenou teplotou, komplikacemi mohou být hepatitida, respirační insuficience a encefalitida. Vezikulopustuly na erytémovém podkladu se vyskytují generalizovaně, méně často v herpetiformních skupinkách nebo v zosteriformním uspořádání. VZV může působit i kongenitální postížení, které je charakterizováno přítomností kožního jizvení a defektů skeletu, očí a nervového systému, ale i čerstvé infekční eflorescence u novorozence.
Pro léčbu herpes zoster se doporučují deriváty acycloviru (doporučené dávky 3krát 5–10 mg/kg tělesné hmotnosti i. v. na den nebo 5krát denně 800 mg per os), valacycloviru (3krát 1000 mg per os denně), famcycloviru (3krát 250 mg per os denně), Brivudinu (1krát 125 mg per os denně), Foscarnetu (3krát 50 mg/kg tělesné hmotnosti i. v. denně). Všechna virostatika zkracují akutní bolestivou fázi při srovnání s placebem. Rozdíly mezi jednotlivými preparáty spočívají ve vztahu k ovlivnění chronických PHN, ale i v množství, dávkování a v cenových relacích jednotlivých typů terapie [50].
Analgetická terapie je indikována u těžších forem onemocnění starších pacientů a u nemocných ohrožených infekcemi. Antibiotika brání vzniku sekundárních bakteriálních infekcí a omezují vznik nekrotizujících zánětlivých lézí. Řada studií prokázala, že terapie akutního herpes zoster virostatiky vykazuje příznivé efekty na chronickou bolestivost spojovanou s herpes zoster; terapie ovšem není schopná ji úplně odstranit. Nedojde-li v průběhu 3 týdnů k ústupu bolestí, doporučují se intervenční opatření, např. blokáda sympatiku či epidurální blokáda [51].
Očkování proti herpes zoster je poměrně novou záležitostí. V USA je převážně nabízena opět živá atenuovaná vakcína Zostavax (Merck), obsahující vyšší titr antigenu (zhruba 14krát) než vakcína proti varicelle. Zostavax je doporučován jako prevence proti herpes zoster osobám ve věku 50 let či starším. Studie efektivity ukázaly, že pouze 64 % osob ve věku 60–69 let, 41 % osob ve věku 70–79 let a 18 % osob ve věku 80 let a více vykázalo protektivní účinek vakcínou [52].
ZÁVĚR
Protilátky proti zmiňovaným lidským herpetickým virům jsou detekovány běžně u majority populace. To samo o sobě nepředstavuje zásadní problém. Vzhledem k možným onemocněním a komplikacím zvláště ve vybraných skupinách pacientů, jako jsou např. imunokompromitovaní, hraje důležitou roli prevence. V případě HSV-1 se doporučuje vyvarovat se přímým kontaktům s infikovanými (viditelné léze). U HSV-2 pozitivních je to zase používání kondomů. Imunkompromitovaní pacienti by měli být od lidí s HSV infekcemi izolováni. V případě těhotných žen a možnosti infekce plodu během porodu je specialisty často doporučován císařský řez. V případě VZV je možno situaci pokrýt očkováním, v Evropě povětšinou vyžádaným ze strany rodičů, v USA se jedná defacto o mandatorní požadavek (potvrzení o očkování proti varicella zoster viru je součástí přijímacího procesu dítěte do školy). Nejúčinější cestou boje proti lidským herpetickým virům je očkování, bohužel zdaleka ne proti všem, jsou v současnosti vakcíny dostupné (což je dáno složitým životním cyklem těchto virů).
Do redakce došlo dne 8. 7. 2013.
Adresa pro korespondenci:
Mgr. Radek Sleha
Katedra epidemiologie
Fakulta vojenského zdravotnictví
Univerzita obrany
Třebešská 1575
500 01 Hradec Králové
e-mail: radek.sleha@upce.cz
Zdroje
1. Norberg P. Diveregence and genotyping of human alpha herpesviruses: an overview. Infect Genet Evol, 2010;10 : 14–25.
2. Norberg P, et al. Diveregence and recombination of clinical herpes simplex virus type 2 isolates. J Virol, 2007; 81 : 13158–13187.
3. Norberg P, et al Complete-genome phylogenetic approach to VZV evolution. J Virol, 2006;80 : 9569–9576.
4. Arvin AM Chickenpox. Contrib Microbiol, 1999;3 : 6–110.
5.Weller TH Varicella-herpes zoster virus. In: Viral Infections of Humans: Epidemiology and Control. Evans AS, Kaslow RA, eds. New York: Plenum Press. 1997 : 865–892.
6. Norberg P, et al. Genotyping of clinical HSV1 isolates by use of restriction enzymes. J Clin Microbiol, 2006;44 : 4511–4514.
7. Hlinomazová Z. Herpetické onemocnění oka. Referátový výběr dermatovenerologie, 2013;5 : 14–19.
8. Gilden D, et al. Neurological disease produced by varicella zoster virus reactivation without rash. Curr Top Microbiol Immunol, 2010;342 : 243–253.
9. Tremolada S, et al Viral infections of the fetus and newborn infant. Pediatr Med Chir, 2008, 30 : 177–179.
10. Balfour HH. Antiviral drugs. N Engl J Med, 1999;340 : 1255–1268.
11. Zamora MR DNA viruses. Semin Respir Crit Care Med, 2011;32 : 454–470.
12. Kinchington PR et al. Herpes simplex virus and varicella zoster virus, the house guests who never leave. Herpesviridae, 2012;3 : 5.
13. Vanderpluym C, et al. Empiric acyclovir for neonatal herpes simplex virus infection. J Matern Fetal Neonatal Med, 2012;25 : 1278–1282.
14. Takeuchi S, et al. Herpes simplex virus encephalitis complicated by intracerebral hematoma. Neurol India, 2011; 59 : 594–596.
15. Mahy BWJ. Virology. 2011; Topley and Wilsons, USA.
16. Paticheep S, et al. Viral infection of CNS in children. J Med Assoc Thai, 2011;7 : 24–31.
17. Straus SS, et al. Biology, natural history, treatment and prevention. Ann Int Med, 1988; 108 : 221–237.
18. Griffiths PD. Herpesviruses and AIDS. J IHMF, 1994;1 : 5–11 .
19. Dworkin RH, et al. Advances in neuropathic pain: diagnosis, mechanisms, and treatment recommendations. Arch Neurol, 2000; 60 : 1524–1534.
20. Eckhardt K, et al. Treatment of chronic and neuropathic pain. Established amitriptyline and the new gabapentin. MMW. Fortschr Med, 2000;142 : 28–30 .
21. Davidson AJ, et al. The complete DNA sequenze of varicella-zoster virus. J Gen Virol, 2000;67 : 1759–1816.
22. Doerr HW, et al. Dermatotrope Herpesviren. Infektionsbiologie, Epidemiologie und Diagnostik, Chemotherapie, 1996;1 : 1–8 .
23. Gross G,. et al. Herpes zoster guideline of the German Dermatology Society (DDG). J Clin Virol, 2003;26 : 277–289.
24. Gross G Varicella-zoster Virus In: Plettenberg A, Meigel W. (Hrsg.) Dermatologische Infektiologie. Blackwell, 2003 : 110–123 .
25. Johnson RW, et al. Guidelindes for the management of shingles. Report of a working group of the British Society for the Study of Infection (BSSI). J Infection, 1995; 30 : 193–200.
26. La Russa P, et al. Varicella vaccine for immunocompromised children: results of collaborative studies in the United States and Canada. J Infect Dis, 1996;174 : 320–323 .
27. Liesegang TJ. Varicella zoster viral disease. Mayo Clin Proc, 1999;74 : 983–998.
28. Lilie HM, et al. Varicella-Zoster Virus, Kapitel: Shingles. Contrib Microbiol, 1999;3 : 111–128.
29. Lilie HM, et al. The role of antivirals in the management of neuropathic pain in the older patient with herpes zoster. Drugs Aging, 2003;20 : 561–570.
30. Lungu O, et al.Varicella-zoster virus, latency and reactivation. Contrib Microbiol, 1999; 3 : 61–75.
31. Arvin A. Varicella vaccine/genesis, efficacy, and attenuation. Virology, 2001; 284 : 153–158.
32. Boštíková V, et al. Atypicky se manifestující zosterová infekce vyvolaná neobvyklým divokým kmenem VZV. Vakcinologie, 2010;4 : 144–149.
33. Rothbart H, et al. Incorporation of VZV vaccination in childhood immunization schedules. Harefuah, 2008;147 : 693–697.
34. Levin MJ, et al. Herpes zoster with skin lesions and meningitis caused by two different genotypes of the Oka varicella-zoster vaccine. J Infect Dis, 2008;198 : 1444–1447.
35. Boštíková V, et al.Využití sekvenační analýzy divokých kmenů viru planých neštovic se zameřením na epidemiologickou situaci v České republice. Vakcinologie, 2009;2 : 55–59.
36. Boštíková V, et al. Problematika postvakcinačních komplikací u očkování proti viru varicella-zoster – popis klinického případu. Vakcinologie, 2011;1 : 6–9.
37. Boštíková V, et al. Molecular epidemiology of VZV. EMI, 2010;1 : 21–24.
38. Luman ET, et al. Uptake of varicella vaccination among young children in the United States: a success story in eliminating racial and ethnic disparities. Pediatrics, 2006;4 : 999–1008.
39. Loparev VN, et al. Identification of five major and two minor genotypes of varicella-zoster virus strains: a practical two-amplicon approach used to genotype clinical isolates in Australia and New Zealand. J Virol, 2007;81 : 12758–12765.
40. Crooks RJ, et al. Zoster-associated chronic pain. Scand J Infect, 1991;80 : 62–68.
41. Sauerbrei A. Virologische und serologische diagnostic des herpes zoster. In: PEG DVV, 2. Konsensus Konferenz zur Therapie und Diagnostik des HZ. 2002 : 64-78.
42. Drolet M, et al. A prospective study of the HZ severity of illness. Clin J Pain, 2010;26 : 656–666.
43. Levin MJ, et al. Veterans Affairs Cooperative Studies Program Shingles Prevention Study Investigators. VZV specific immune response in elderly recipients of a herpes zoster vaccine. J Infect Dis, 2008;197 : 825–835.
44. Schmader KE, et al. The impact of acute HZ pain and discomfort on functional status and quality of life in older adults. Clin J Pain, 2007;23 : 490–496.
45. Oxman MN, et al. A vaccine to prevent herpes zoster and postherpetic neuralgia in older adults. N Engl J Med, 2007;352 : 2271–2284.
46. Oxman MN. Immunization to reduce the frequency and severity of herpes zoster and its complications. Neurology, 1995;45 : 41 – 46.
47. Whitley RJ, et al. Disseminated HZ in the immunocompromised host: a comparative trial of acyclovir. J Infect Dis, 1992;165 : 450–455.
48. Pasqualucci A, et al. Prevention of post-herpetic neuralgia:acyclovir and prednisolone versus epidural local anesthetic and methylprednisolone. Acta Anaesthesiol. Scand, 2000;44 : 910–918.
49. Pervez A, et al. Concomitant bilaterall herpes zoster opthalmicus. Lancet Infect Dis,2002;2 : 699.
50. Huff JC, et al. Efficacy of oral acyclovir on pain resolution in herpes zoster: a reanalysis. J Med Virol, 1993;1 : 93–96.
51. Whitley RJ. Approaches to the treatment of VZV infections. In: VZV, molecular biology, pathogenesis and clinical aspects. Contrib Microbiol,1999;3 : 158–172.
52. Dworkin RH, et al. Recommendations for the managment of herpes zoster. Clin Infect Dis, 2007; 44 : 1–26.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2014 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Věnování doc. MUDr. Heleně Hupkové, Ph.D. in memoriam
- Klinická a mikrobiologická charakteristika závažných infekcií spôsobených streptokokmi skupiny A
- Vplyv prípravkov určených na dezinfekciu kože, slizníc a rán na životaschopnosť biofilmovej formy rastu mikroorganizmov izolovaných od pacientov s katétrovými infekciami
- Enterohemoragické Escherichia coli jako původci průjmu v České republice (1965–2013)
- Rezistence k erytromycinu, ciprofloxacinu a k tetracyklinu u humánních izolátů Campylobacter spp. v České republice, vyšetřená standardní metodou EUCAST
- Výskyt a vlastnosti baktérií Staphylococcus aureus ve vepřovém mase
- Identifikace izolátů Mycobacterium spp. pomocí MALDI-TOF hmotnostní spektrometrie
- Profesionálna TBC na Slovensku a v Českej republike
- Infekce vyvoláné lidskými alfa herpetickými viry
- Protikladný vývoj trendů incidence kapavky a syfilis ve východočeském regionu – 30 let surveillance
- Avidita antifosfolipidových protilátek – naše současné znalosti
- Současný pohled na diagnostiku a léčbu amébózy ve světle vlastní kazuistické zkušenosti
- Výskyt a charakteristika termotolerantních kampylobakterů v potravinovém řetězci člověka
- Real time RT-PCR panel pro identifikaci dvanácti virů hemoragických horeček
- Význam očkování proti chřipce u osob s kardiovaskulárním onemocněním
- Zhodnocení významu ready-made spaceru s gentamicinem ve vztahu k bakteriologickým nálezům u pacientů s infekcí kloubní náhrady
- Q-horečka jako profesionální onemocnění vedoucí k invaliditě – kazuistika
- Návrat spalniček do Ústeckého kraje
- Vzpomínka na nedožité 90. narozeniny MUDr. Miroslava Přívory, CSc.
- Vzpomínka na nedožité 90. narozeniny prof. MUDr. Bohumila Ticháčka, DrSc.
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Současný pohled na diagnostiku a léčbu amébózy ve světle vlastní kazuistické zkušenosti
- Infekce vyvoláné lidskými alfa herpetickými viry
- Enterohemoragické Escherichia coli jako původci průjmu v České republice (1965–2013)
- Real time RT-PCR panel pro identifikaci dvanácti virů hemoragických horeček
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



