-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Diagnostika a softwarová analýza u ischemických CMP
Autori: MUDr. Cimflová Petra 1,2; MUDr. Vinklárek Jan 3; MUDr. Haršány Michal 1,3; MUDr. Volný Ondřej, Ph.D. 1,3; prof. MUDr. Mikulík Robert, Ph.D. 1,3
Pôsobisko autorov: Mezinárodní centrum klinického výzkumu, FN u sv. Anny, Brno 1; Klinika zobrazovacích metod LF MU a FN U sv. Anny, Brno 2; I. neurologická klinika LF MU a FN u sv. Anny, Brno 3
Vyšlo v časopise: CMP jour., 2, 2019, č. 2, s. 11-18
Zobrazovací metody plní u akutního mozkového infarktu nezastupitelnou roli v rámci diagnostiky a managementu terapie (intravenózní trombolýza a/nebo mechanická trombektomie), která je v klinické praxi indikována na základě anamnestických údajů, klinického vyšetření a nálezu na vstupním zobrazení mozku a mozkových cév. V rámci akutní cévní mozkové příhody (CMP) představuje výpočetní tomografie (CT) mozku stále nejrozšířenější a nejvíce využívanou zobrazovací metodu.
Úvod
Pro relevantní hodnocení změn na CT je nezbytný nejen náběr dat v dostatečné kvalitě a zkušenost hodnotitele, ale i správné postprocesingové nastavení. V rámci následného zpracování dat máme v dnešní době možnost využití automatické softwarové analýzy, a to nejen u CT-perfuzního vyšetření, ale také pro automatické hodnocení časných ischemických změn na nativním CT nebo zhodnocení kvality kolaterálního řečiště v postižené oblasti z CT angiografie (CTA). Tyto softwarové nástroje by měly sloužit především k rychlé triáži pacientů v rámci akutního managementu a zároveň snížit variabilitu hodnocení mezi hodnotiteli [1, 2].
Indikace jednotlivých modalit CT vyšetření na základě dostupných poznatků závisí na čase od vzniku příznaků CMP. Pro podání intravenózní trombolýzy v čase do 4,5 hodiny od vzniku příhody je nezbytné provedení nativního CT vyšetření, které slouží k vyloučení krvácení nebo jiné nevaskulární patologie (např. tumoru). CTA je nezbytná u pacientů indikovaných k mechanické trombektomii, a to k lokalizaci tepenného uzávěru a zhodnocení anatomických poměrů extrakraniálně. Indikací k mechanické trombektomii za více než 6 hodin od vzniku příznaků je pak navíc potřebné zhodnocení ischemické penumbry (hypoperfundované, ale stále viabilní tkáně) na základě CT-perfuzní analýzy. Výsledky prezentované, ale zatím nepublikované studie ECASS IV ukazují, že je možné léčit pacienty intravenózní trombolýzou i po uplynutí 4,5 hodiny na základě průkazu penumbry analogicky, jako je tomu u mechanické trombektomie.
Nativní CT
Nativní CT je nezbytným zobrazením u všech pacientů s podezřením na akutní CMP, jednak k již zmiňovanému vyloučení jiné patologie (krvácení či tumor), která by pacienta vyřadila z reperfuzní terapie, a také k posouzení stáří, případně rozsahu ischémie. V prvních 2 hodinách nemusejí být patrné žádné změny na mozkové tkáni, následně dochází k rozvoji časných ischemických změn a nakonec k postupné demarkaci (vykreslení) ohraničené hypodenzní oblasti odpovídající mozkovému infarktu.
Pro spolehlivou identifikaci časných známek ischémie (early ischemic changes) je zapotřebí nastavení tzv. tvrdého mozkového okna pro zvýraznění i minimálních rozdílů denzity mozkové tkáně (WW 35–40 HU, WL 35–40 HU, oproti standardnímu mozkovému oknu WW 80 HU, WL 40 HU) (viz obr. 1). Časné ischemické změny se projevují setřením hranice v rozdílu denzity mezi šedou kůrou mozku a bílou hmotou mozkovou na podkladě rozvíjejícího se cytotoxického edému. V některých případech mohou být tyto časné změny vyjádřeny pouze jako vyhlazení gyrifikace nebo oploštění likvorových prostor na konvexitě mozku.
Obr. 1. Srovnání A) standardního mozkového okna (WW 80, WL 40) a B) tvrdého okna (WW40, WL 40) pro hodnocení časných ischemických změn, které jsou lépe detekovatelné v tvrdém mozkovém okně (označeno červeně). 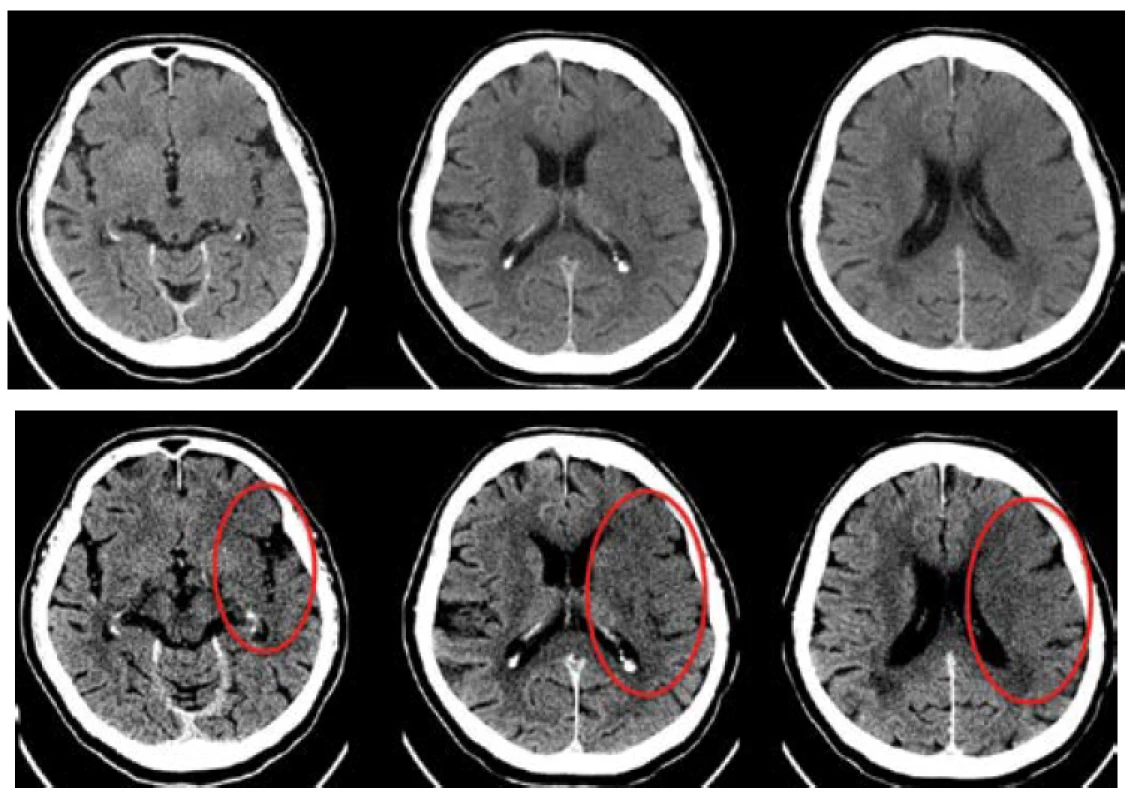
Typickým časným příznakem ischemických změn v povodí střední mozkové tepny (ACM – arteria cerebri media) je tzv. příznak inzuly [3]. Oblast inzuly bývá při uzávěru ACM postižena jako jedna z prvních z důvodu minimální kolateralizace oběhu v této lokalizaci. Obdobně dochází při proximálním uzávěru ACM k časnému postižení bazálních ganglií krevně zásobovaných z perforátorů odstupujících ze segmentu M1 ACM.
V běžné praxi je nejčastějším způsobem kvantifikace rozsahu ischemických změn skóre ASPECTS (Alberta Stroke Program Early CT Score). ASPECTS (viz obr. 2) je standardizovaná kvantitativní škála hodnotící rozsah časných ischemických změn mozkového parenchymu v teritoriu povodí ACM, které je rozděleno na 10 anatomických oblastí (regionů) a nabývá hodnot od 10 (žádné postižení v teritoriu ACM) po 0 (postižení kompletního teritoria ACM). Za každou postiženou oblast je od celkového 10bodového skóre odečítán 1 bod. Skóre ASPECT zahrnuje oblasti na úrovni bazálních ganglií [nucleus caudatus (C), nucleus lentiformis (L), capsula interna (IC)], oblast inzuly (I) a přilehlých kortikální oblasti M1–M3 a dále kortikální oblasti M4–M6 na úrovni stropu postranních mozkových komor (supraganglionární úroveň).
Obr. 2. Grafické znázornění skóre ASPECT pro hodnocení časných ischemických změn v povodí arteria cerebri media 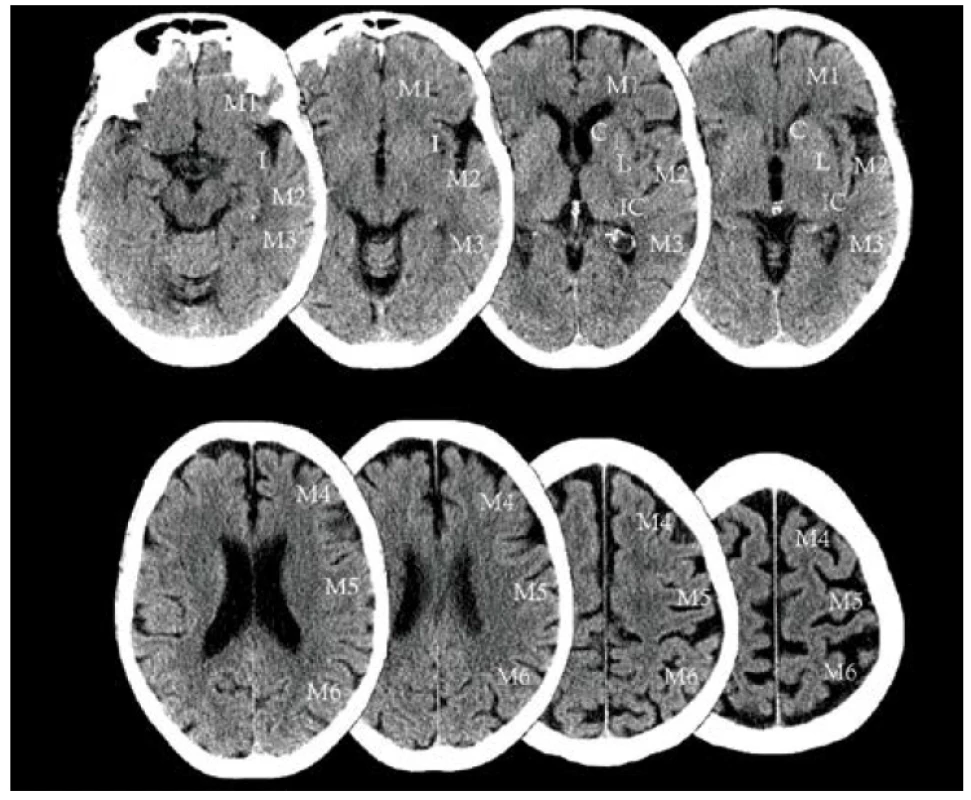
Pozn.: C – nucleus caudatus; I – inzula; IC – capsula interna; L – nuclus lentiformis; M1–M3 – kortikální oblasti v úrovni bazálních ganglií; M4–M6 – kortikální oblasti na úrovni stropu postranních mozkových komor (supraganglionární úroveň). Přestože ASPECTS vykazuje větší spolehlivost mezi hodnotiteli pro posouzení časných ischemických změn v povodí ACM než dříve používaná metoda postižení < 1/3 nebo > 1/3 povodí ACM [4], stále je toto hodnocení zatíženo subjektivní chybou hodnotitele a může se mezi jednotlivými hodnotiteli lišit až o 3 body, zejména v případech zobrazení velmi časně od vzniku příznaků, kdy jsou časné ischemické změny vyjádřeny jen velmi diskrétně [5, 6].
Právě subjektivita posouzení časných ischemických změn vedla k vývoji software pro automatické hodnocení časných ischemických změn na nativním CT (e-ASPECTS Brainomix, iSchemaView RAPID ASPECTS) vykazujícího poměrně vysokou spolehlivost srovnatelnou s hodnocením zkušenými hodnotiteli [1, 7]. Mezi hlavní výhody automatického zpracování patří téměř okamžitá dostupnost výsledků softwarové analýzy zasílaná na e-mail nebo do systému PACS, standardizace hodnocení a snížení variability v hodnocení časných ischemických změn ve srovnání s hodnotiteli s rozdílnou úrovní zkušeností. Cílem využití softwarového zpracování snímků není nahrazení vlastního hodnocení snímků zkušeným radiologem, ale mělo by být užitečným pomocníkem v klinické praxi a sloužit k urychlení triáže pacientů indikovaných k mechanické trombektomii [7].
Dalším užitečným vodítkem, které může pomoci v diferenciální diagnostice náhle vzniklého neurologického deficitu, je tzv. příznak denzní tepny (dense artery sign) (viz obr. 3). Příznak denzní tepny (příznak hyperdenzní ACM, příznak denzního vrcholu bazilární tepny) může být známkou tepenného uzávěru trombem. Na nativním CT mozku je patrná vyšší denzita v luminu tepny, která se pohybuje mezi 60 a 90 HU a je dána vyšším obsahem erytrocytů v trombu [8, 9]. Nicméně nepřítomnost příznaku nevylučuje přítomnost trombu v lumen, proto je nezbytné následné provedení CT angiografie k zobrazení defektu náplně mozkové tepny.
Obr. 3. Příznak denzní tepny: hyperdenzní lumen vrcholu pravé vnitřní krkavice(označeno bílou šipkou) 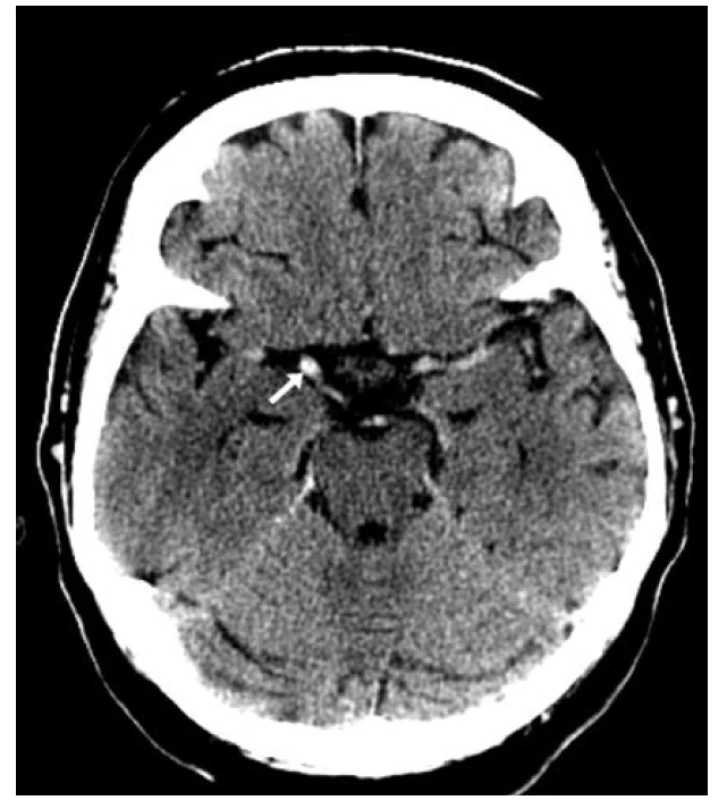
CT angiografie
Odhalení přítomnosti uzávěru velké mozkové tepny u náhle vzniklého neurologického deficitu představuje nezbytnou informaci pro indikaci neurointervenčního výkonu (mechanické trombektomie) [10]. Přítomnost a lokalizace akutního uzávěru (trombu) v mozkové tepně neovlivňuje rozhodnutí o podání intravenózní trombolýzy (IVT) – to by mělo v případě vysoce suspektní diagnózy mozkového infarktu následovat ihned po nativním CT mozku, pokud jsou tímto zobrazením vyloučeny kontraindikace k podání IVT.
V rámci protokolů CTA (jednofázové a vícefázové/dynamické) je doporučeno provést zobrazení tepen vždy od oblouku aorty až po vertex (tj. zachycující kompletní mozkovou cirkulaci), které přináší potřebné informace o morfologii extrakraniálních i intrakraniálních tepen včetně morfologie leptomeningeálních kolaterál. Takto získané informace z CTA mozkových tepen jsou klinicky důležité nejen v rámci diferenciální diagnostiky náhle vzniklého neurologického deficitu (CMP vs. stroke mimics), ale také v rámci indikace a následného naplánování mechanické trombektomie (např. aterosklerotické změny aorty, přítomnost extrakraniálních/intrakraniálních stenóz, abnormit a anomálií extrakraniálních tepen – významná tortuozita, přítomnost proximálních a distálních uzávěrů intrakraniálních tepen, eventuálně přítomnost tandemových okluzí) [11–13].
Kromě lokalizace uzávěru přináší CTA i neméně důležitou informaci o utváření leptomeningeálních kolaterál, arteriálních spojek mezi teritorii hlavních mozkových tepen. V klinické praxi se uplatňuje zejména hodnocení kolaterál v povodí ACM. Bylo prokázáno, že dobrý stav kolaterál významně souvisí s malým jádrem ischémie, s menší expanzí ischemické léze a s lepším klinickým výsledkem [14, 15]. Naopak pacienti s velmi chudým či žádným kolaterálním plněním mají prokazatelně větší mozkový infarkt než pacienti s dobrými kolaterálami [16].
Jedním z rizik hodnocení leptomeningeálních kolaterál ze standardní CTA je možnost jejich podhodnocení, jelikož kvůli rychlé akvizici dat moderních CT přístrojů ještě nedošlo k jejich dostatečnému naplnění kontrastní látkou a kvalitnímu zobrazení. Možností jak tomu předejít je využití dynamické CTA nebo tzv. multifázické CTA, která sestává ze tří fází náběru dat (časná arteriální, arteriovenózní a pozdní venózní fáze) [17].
Existují různé skórovací systémy pro hodnocení kolaterál z CTA, popis jednotlivých škál je však nad rámec zaměření tohoto článku. Pro příklad uvádíme Miteffovo skóre hodnotící míru retrográdní opacifikace cév v postiženém teritoriu ACM [14] nebo procentuální hodnocení plnění kolaterál v postiženém teritoriu ve srovnání s kontralaterální hemisférou [18]. Pro klinické využití v každodenní praxi je každopádně podstatná jednoduchost a snadná interpretace hodnocení kolaterál. Zjednodušené skóre bylo využito ve studii ESCAPE, kde byli pacienti indikováni k mechanické trombektomii na základě stavu kolaterál hodnoceného z multifázické CTA (dobré kolaterály = přítomnost kolaterál v oblasti > 50 % povodí ACM; chudé kolaterály = žádné nebo minimální kolaterály v oblasti > 50 % povodí ACM) [11].
V současné době je k dispozici i softwarová analýza kolaterálního řečiště. Brainomix e-CTA využívá procentuální srovnání kvality kolaterál postižené a zdravé strany s následným barevným značením (tepelná mapa) a číselným skóre od 0–3 (kde 0 značí absenci kolaterál v postiženém povodí = kolaterální plnění < 10 % ve srovnání s kontralaterální stranou; 3 potom značí excelentní kolaterály = kolaterální plnění > 90 % ve srovnání s kontralaterální stranou) [18]. RAPID e-CTA srovnává celkovou denzitu vaskularizace mezi hemisférami a na základě procentuálního rozdílu celkové denzity přiřadí postiženému povodí barevné označení (červená = denzita < 45 %; žlutá = denzita 45–60 % atd.). Přínos softwarového zpracování CTA tkví v rychlé orientaci v dané situaci, rychlé, zjištění lokalizace uzávěru a na základě stavu kolaterál vyhodnocení šance na dobrý klinický výsledek. Informace o stavu kolaterál vysvětluje perfuzní analýzu, kdy při dobrém kolaterálním řečišti lze očekávat malé jádro ischémie (tzv. pomalí progresoři) a naopak při absenci kolaterálního plnění rychlý rozvoj a nárůst ischemické léze (tzv. rychlí progresoři) [19].
CT perfuze (CTP)
CTP je funkčním vyšetřením mozkové tkáně, které charakterizuje stav mozkové perfuze a informuje tak o aktuálním funkčním stavu. Cílem perfuzní analýzy je odlišení jádra ischémie (core – představujícího nevratně poškozenou tkáň), ischemickou penumbru (viabilní, hypoperfundovanou mozkovou tkáň, jejíž rozsah je možné terapeuticky ovlivnit) a benigní oligémii (hypoperfundovanou tkáň, která nepodlehne ischémii ani v případě, že není dosaženo reperfuze).
Základními parametry, které se vyhodnocují v CTP analýze, jsou cerebral blood flow (CBF) vyjadřující průtok krve sledovaným objemem mozkové tkáně, cerebral blood volume (CBV) vyjadřující celkové množství (objem) krve ve sledovaném objemu mozkové tkáně, mean transit time (MTT) vyjadřující dobu průtoku kontrastní látky sledovanou oblastí a time to peak (TTP) vyjadřující dobu do dosažení maximální denzity (koncentrace) kontrastní látky ve sledované oblasti. V současnosti se do popředí dostal také parametr Tmax vyjadřující součet času od podání kontrastní látky do jejího přítoku (čas T0) do sledované oblasti a polovinu času MTT.
Vyhodnocení CTP skrývá několik úskalí. Jedním z nich je využití odlišných kombinací parametrů CTP k definici core a penumbry různými softwarovými balíčky nebo rozdílné matematické modely užité pro výpočet perfuzních parametrů. Tyto diskrepance vedou k rozdílnému vyhodnocení velikosti oblasti core a penumbry a mohou být zavádějící zejména pro vzájemné srovnání výsledné CTP analýzy a jejich klinickou intepretaci. Proto je v klinické praxi nezbytné používat standardizovaný a validovaný algoritmus CTP analýzy [20].
Na základě publikovaných výsledků pozitivních endovaskulárních studií EXTEND-IA, SWIFT-PRIME, DAWN a DEFUSE 3, jež indikovaly pacienty k mechanické trombektomii na základě CTP, se do širokého povědomí dostala moderní definice ischemického jádra a penumbry, kdy core je definováno jako CBF < 30 % hodnoty v kontralaterální hemisféře a oblast ischemické penumbry jako Tmax se zpožděním o > 6 s oproti kontralaterální hemisféře [21–24]. Mezní hodnota CBF pro jádro byla zvolena tak, aby nedocházelo k jeho významnému nadhodnocení, které by vedlo k nežádoucí selekci pacientů. Významné podhodnocení jádra by naopak zvýšilo riziko hemoragické transformace a zároveň snížilo pravděpodobnost dobrého klinického výsledku po úspěšné revaskularizaci [25]. Při zvolené mezní hodnotě pro velikost jádra CBF < 30 % dochází v průměru k podhodnocení jádra o 10–15 ml [22]. K nadhodnocení jádra dochází také u pacientů, kteří jsou vyšetřeni v prvních 60 minutách od vzniku příznaků (tzv. zlatá hodina). Pro tyto pacienty je výhodné využívat striktnější hodnotu CBF < 20 %.
Všechny výše zmíněné studie využívaly k analýze automatický software RAPID (iSchemiaView), jehož vysoká přesnost a správnost v predikci výsledné velikosti ischémie byly prokázány ve studii, která jej srovnávala s jinými dvěma komerčně dostupnými softwarovými aplikacemi pro zpracování perfuzních studií (Brain CT Perfusion Package, Philips Healthcare; Syngo Volume Perfusion CT Neuro, Siemens Healthcare) [20].
Dalším z automatických softwarů, jež se dostávají do povědomí v rámci uživatelských softwarových balíčků, je Olea Medical software (Brainomix), který vzhledem k rozdílnému algoritmu výpočtu perfuzních parametrů definuje jádro ischémie jako CBF < 40 % a současně zpoždění Tmax > 2 s, penumbra je definována jako zpoždění Tmax > 6 s. [26] Olea prezentuje jako jednu z výhod využití bayesovského algoritmu možnost snížení množství použité kontrastní látky na polovinu [27].
Automatické softwarové zpracování CTP (případně MRI perfuze) je také řešením relativní časové náročnosti manuálního vyhodnocení; výsledky automatické analýzy jsou dostupné během 3–4 minut od náběru zdrojových dat. V manuálním zpracování je navíc důležitým aspektem i zkušenost hodnotitele pro správné zvolení oblasti zájmu v přívodné arterii (arterial input function) a v odvodném splavu (venous output function) a interpretaci výsledků perfuzní analýzy.
Provedení CTP vyšetření je přínosné primárně v době mezi 6 a 24 hodinami od vzniku příznaků. Umožňuje identifkovat pacienty s přítomností viabilní, a tudíž terapeuticky ovlivnitelné mozkové tkáně – penumbry [23, 24]. Toto vyšetření je též klinicky přínosné u pacientů, u kterých nelze stanovit přesnou dobu vzniku (nejasná doba vzniku nebo probuzení se s příznaky CMP – wake-up stroke). V této situaci se péče neřídí podle časového okna (koncept time si brain), nýbrž podle tzv. tkáňového okna (koncept imaging is brain). Poslední výhodou je využití CTP k pozitivní diagnostice mozkového infarktu i v časných fázích. To se typicky týká situací, kdy pacienti mají malý neurologický deficit nebo se jedná o opakovanou CMP s předchozím reziduálním deficitem, případně je zde podezření na stroke mimics.
Závěr
CT vyšetření mozku hraje ústřední roli v managementu CMP a jeho různé modality mají zásadní, i když rozdílný přínos pro indikaci léčby a prognózu pacientů. V klinické praxi je tento význam často zaměňován a je shrnut v tab. 1 (pacienti s nálezem znamenajícím horší prognózu mají často větší prospěch z rekanalizační terapie než pacienti s nálezem znamenajícím dobrou prognózu).
Tab. 1. Význam jednotlivých modalit CT vyšetření mozku v managementu péče o pacienty s cévní mozkovou příhodou 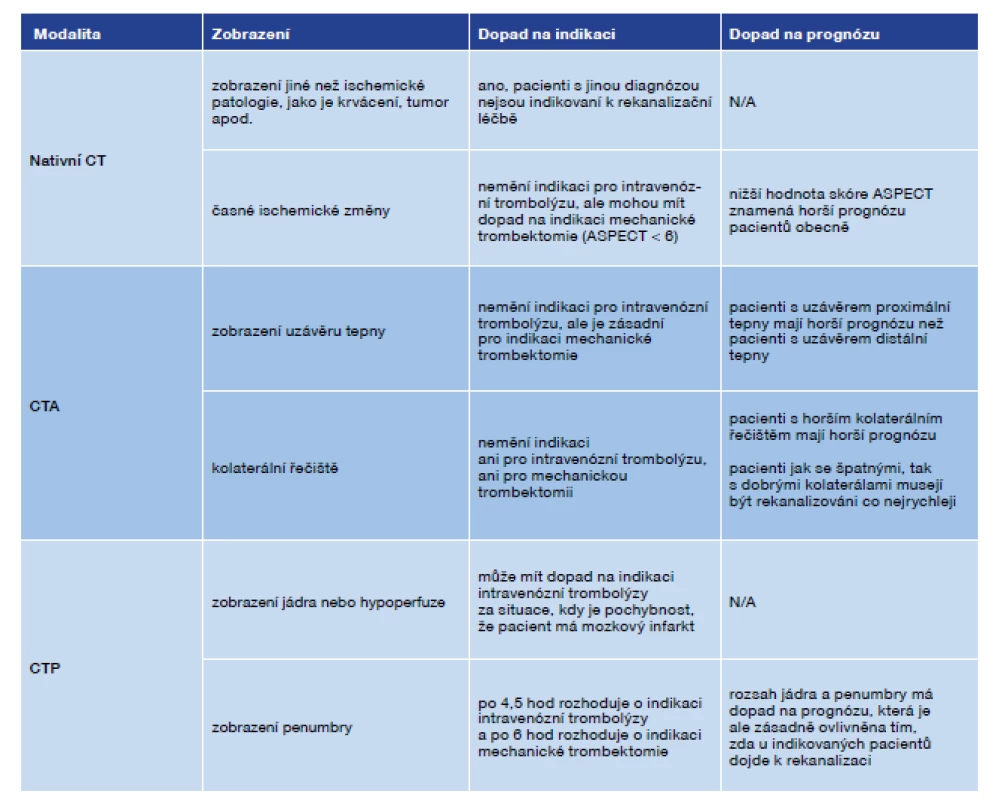
Pozn.: N/A – neaplikovatelné; CTA – CT angiografie; CTP – CT perfuze. Nativní CT mozku slouží jako rychlý diagnostický nástroj k detekci časných ischemických změn, krvácení či jiné intrakraniální patologie. CTA vyšetření od oblouku aorty po vertex představuje zlatý standard neinvazivního vyšetření mozkových cév. Proto by všichni pacienti s klinickým podezřením na CMP včetně TIA měli mít provedeno minimálně nativní CT mozku a CTA mozkových tepen. Pacienti s akutním ischemickým iktem více než 6 hodin od vzniku příznaků a s průkazem uzávěru velké mozkové tepny by měli být indikovaní k provedení CTP vyšetření k ozřejmení viabilní tkáně a dle výsledku eventuálně léčeni mechanickou trombektomií.
V současnosti je na trhu několik softwarových balíčků pro automatické vyhodnocení časných ischemických změn, stavu kolaterálního řečiště a zpracování CTP analýzy. Hlavním přínosem softwarového zpracování je snížení variability hodnocení a urychlení triáže pacientů indikovaných k mechanické trombektomii. Provedení CTP může rovněž výrazně pomoci v diagnostice tzv. stroke mimics, například u pacientů s náhle vzniklým neurologickým deficitem a nedetekovatelným uzávěrem velké mozkové tepny.
Aktualizovaná verze článku „Výpočetní tomografie u akutního mozkového infarktu“ publikovaného v odborném časopisu Neurologie pro praxi.
Zdroje
- Nagel S, Sinha D, Day D et al. e-ASPECTS software is non-inferior to neuroradiologists in applying the ASPECT score to computed tomography scans of acute ischemic stroke patients. Int J Stroke 2017; 12 : 615–622.
- Maegerlein C, Fischer J, Mönch S et al. Automated calculation of the Alberta Stroke Program Early CT Score: feasibility and reliability. Radiology 2019; 291(1): 141–148.
- Truwit CL, Barkovich AJ, Gean-Marton A et al. Loss of the insular ribbon: another early CT sign of acute middle cerebral artery infarction. Radiology 1990; 176 : 801–806.
- Barber PA, Demchuk AM, Zhang J, Buchan AM. Validity and reliability of a quantitative computed tomography score in predicting outcome of hyperacute stroke before thrombolytic therapy. ASPECTS Study Group. Alberta Stroke Programme Early CT Score. Lancet 2000; 355 : 1670–1674.
- Gupta AC, Schaefer PW, Chaudhry ZA et al. Interobserver reliability of baseline noncontrast CT Alberta Stroke Program Early CT Score for intra-arterial stroke treatment selection. Am J Neuroradiol 2012; 33 : 1046–1049.
- Naylor J, Churilov L, Rane N et al. Reliability and utility of the Alberta Stroke Program Early Computed Tomography Score in hyperacute stroke. J Stroke Cerebrovasc Dis 2017; 26 : 2547–2552.
- Herweh C, Ringleb PA, Rauch G et al. Performance of e-ASPECTS software in comparison to that of stroke physicians on assessing CT scans of acute ischemic stroke patients. Int J Stroke 2016; 11 : 438–445.
- Kucinski T. Unenhanced CT and acute stroke physiology. Neuroimaging Clin N Am 2005; 15 : 397–407.
- Puig J, Pedraza S, Demchuk A et al. Quantification of thrombus hounsfield units on noncontrast CT predicts stroke subtype and early recanalization after intravenous recombinant tissue plasminogen activator. Am J Neuroradiol 2012; 33 : 90–96.
- Menon BK, Campbell BC, Levi C, Goyal M. Role of imaging in current acute ischemic stroke workflow for endovascular therapy. Stroke 2015; 46(6): 1453–1461.
- Goyal M, Demchuk AM, Menon BK et al. Randomized assessment of rapid endovascular treatment of ischemic stroke. N Engl J Med 2015; 372(11): 1019–1030.
- Menon BK, d’Esterre CD, Qazi EM et al. Multiphase CT angiography: a new tool for the imaging triage of patients with acute ischemic stroke. Radiology 2015; 275 : 510–520.
- Menon BK, Demchuk AM. Computed tomography angiography in the assessment of patients with stroke/TIA. Neurohospitalist 2011; 1 : 187–199.
- Miteff F, Levi CR, Bateman GA et al. The independent predictive utility of computed tomography angiographic collateral status in acute ischaemic stroke. Brain 2009; 132 : 2231–2238.
- Menon BK, Smith EE, Modi J et al. Regional leptomeningeal score on CT angiography predicts clinical and imaging outcomes in patients with acute anterior circulation occlusions. Am J Neuroradiol 2011; 32 : 1640–1645.
- Souza LCS, Yoo AJ, Chaudhry ZA et al. Malignant CTA collateral profile is highly specific for large admission DWI infarct core and poor outcome in acute stroke. Am J Neuroradiol 2012; 33 : 1331–1336.
- Menon BK, d’Esterre CD, Qazi E et al. Multi-phase CTA: a new tool for the imaging triage of patients with acute ischemic stroke. Int J Stroke 2015; 10 : 307–308.
- Tan IYL, Demchuk AM, Hopyan J et al. CT angiography clot burden score and collateral score: correlation with clinical and radiologic outcomes in acute middle cerebral artery infarct. Am J Neuroradiol 2009; 30 : 525–531.
- Rocha M, Jovin TG. Fast versus slow progressors of infarct growth in large vessel occlusion stroke. Stroke 2017; 48 : 2621–2627.
- Austein F, Riedel C, Kerby T et al. Comparison of perfusion CT Software to predict the final infarct volume after thrombectomy. Stroke 2016; 47 : 2311–2317.
- Campbell BCV, Mitchell PJ, Kleinig TJ et al. Endovascular therapy for ischemic stroke with perfusion-imaging selection. N Engl J Med 2015; 372(11): 1009–1018.
- Saver JL, Goyal M, Bonafe A et al. Stent-retriever thrombectomy after intravenous t-PA vs. t-PA alone in stroke. N Engl J Med 2015; 372 : 2285–2295.
- Albers GW, Marks MP, Kemp S et al. Thrombectomy for stroke at 6 to 16 hours with selection by perfusion imaging. N Engl J Med 2018; 378 : 708–718.
- Nogueira RG, Jadhav AP, Haussen DC et al. Thrombectomy 6 to 24 hours after stroke with a mismatch between deficit and infarct. N Engl J Med 2018; 378 : 11–21.
- Mokin M, Levy EI, Saver JL et al. Predictive value of RAPID assessed perfusion thresholds on final infarct volume in SWIFT PRIME (Solitaire With the Intention for Thrombectomy as Primary Endovascular Treatment). Stroke 2017; 48 : 932–938.
- Uwano I, Sasaki M, Kudo K et al. Tmax determined using a bayesian estimation deconvolution algorithm applied to bolus tracking perfusion imaging: a digital phantom validation study. Magn Reson Med Sci 2017; 16 : 32–37.
- Nael K, Mossadeghi B, Boutelier T et al. Bayesian estimation of cerebral perfusion using reduced-contrast-dose dynamic susceptibility contrast perfusion at 3T. Am J Neuroradiol 2015; 36 : 710–718.
Štítky
Interné lekárstvo Kardiológia Neurochirurgia Neurológia Rádiodiagnostika Urgentná medicína
Článek Editorial
Článok vyšiel v časopiseCMP journal
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
-
Všetky články tohto čísla
- Diagnostika a softwarová analýza u ischemických CMP
- Monitorování rytmu po kryptogenní ischemické CMP – role telemedicínského centra
- Několik poznámek k rehabilitaci po cévních mozkových příhodách
- Neurolog po opakovaných CMP – deset let pacientem
- Péče o pacienty s CMP v České republice
- Editorial
- Embolizační ischemické cévní mozkové příhody z neurčeného zdroje – ESUS: 1. část
- CMP journal
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Neurolog po opakovaných CMP – deset let pacientem
- Několik poznámek k rehabilitaci po cévních mozkových příhodách
- Diagnostika a softwarová analýza u ischemických CMP
- Embolizační ischemické cévní mozkové příhody z neurčeného zdroje – ESUS: 1. část
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



