-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nedonošený novorozenec
Autori: P. Zoban
Pôsobisko autorov: Novorozenecké oddělení s JIRP, Gynekologicko-porodnická klinika UK 2. LF a FN Motol, Praha
Vyšlo v časopise: Čes-slov Pediat 2012; 67 (3): 203-208.
Kategória: Vybrané kapitoly z nové učebnice Klinická pediatrie
Nakladatelství Galén připravuje k vydání novou učebnici „Klinická pediatrie“, která bude určena jak pro pregraduální studium na lékařských fakultách, tak i v rámci postgraduálního vzdělávání pro přípravu na atestaci z dětského lékařství a z praktického dětského lékařství. Autoři věří, že učebnici ocení i dětští lékaři v praxi.
Ve spolupráci nakladatelství Galén a redakce Česko-slovenské pediatrie na stránkách našeho časopisu postupně uveřejňujeme jednotlivé stati z nové učebnice – a jako bonus také některé kapitoly, které se do nové učebnice už „nevešly“, protože učebnice má přesně stanovený rozsah.
Novorozenec porozený před dokončeným 37. týdnem těhotenství je nedonošený. Ve většině případů je jeho porodní hmotnost nižší než 2500 g. V ČR se před 37. týdnem ročně živě narodí přes 7 % novorozenců. Podobně je tomu i v ostatních zemích středoevropského regionu.
Nedonošení novorozenci jsou proti donošeným zatíženi vyšší mortalitou a morbiditou, která může vést k poruchám jejich dlouhodobého vývoje. Výskyt a závažnost problémů spojených s prematuritou klesá se stoupajícím gestačním věkem a zvyšující se porodní hmotností. Novorozenci porození na hranici viability, tj. mezi 23.–24. týdnem těhotenství, jsou ohroženi těžkou strukturální a funkční nezralostí všech orgánů a tkání. Jejich mortalita i pozdní morbidita jsou vysoké (až 90 %). Naopak, novorozenci porození po 32. týdnu gravidity mají při současné úrovni perinatální a neonatální péče prognózu z hlediska přežití i dlouhodobého vývoje velmi dobrou.
Hlavními faktory, určujícími prognózu velmi nezralých novorozenců (pod 30–32 týdnů gestace), jsou infekce, cerebrální morbidita (krvácení do CNS, leukomalacie) a respirační problémy (IRDS, pneumonie, bronchopulmonální dysplazie – BPD).
CELKOVÝ VZHLED
Nedonošení novorozenci mají typický vzhled (obr. 1, str. 207). Mívají protažený tvar lebky (dolichocefalii), sníženou elasticitu ušních boltců, čelo, horní část zad a ramena jsou pokryty lanugem, kůže je velmi tenká, sytě červená, transparentní, s prosvítajícími kapilárami. Není hmatná tkáň prsní žlázy, mamily jsou obtížně rozeznatelné, u chlapců nejsou sestouplá testes, u dívek labia majora nekryjí labia minora. V poloze na zádech mají predilekční držení hlavy na stranu (převážně doprava), končetiny jsou podle stupně nezralosti v semiextenzi nebo až v extenzi. Svalový tonus je povšechně snížený.
Zralost novorozence (gestační stáří) si lze po porodu ověřit podle polohy, kterou dítě zaujímá (postury), podle základních neurologických projevů a somatických znaků nezralosti.
Obr. 1. Extrémně nedonošený novorozenec. 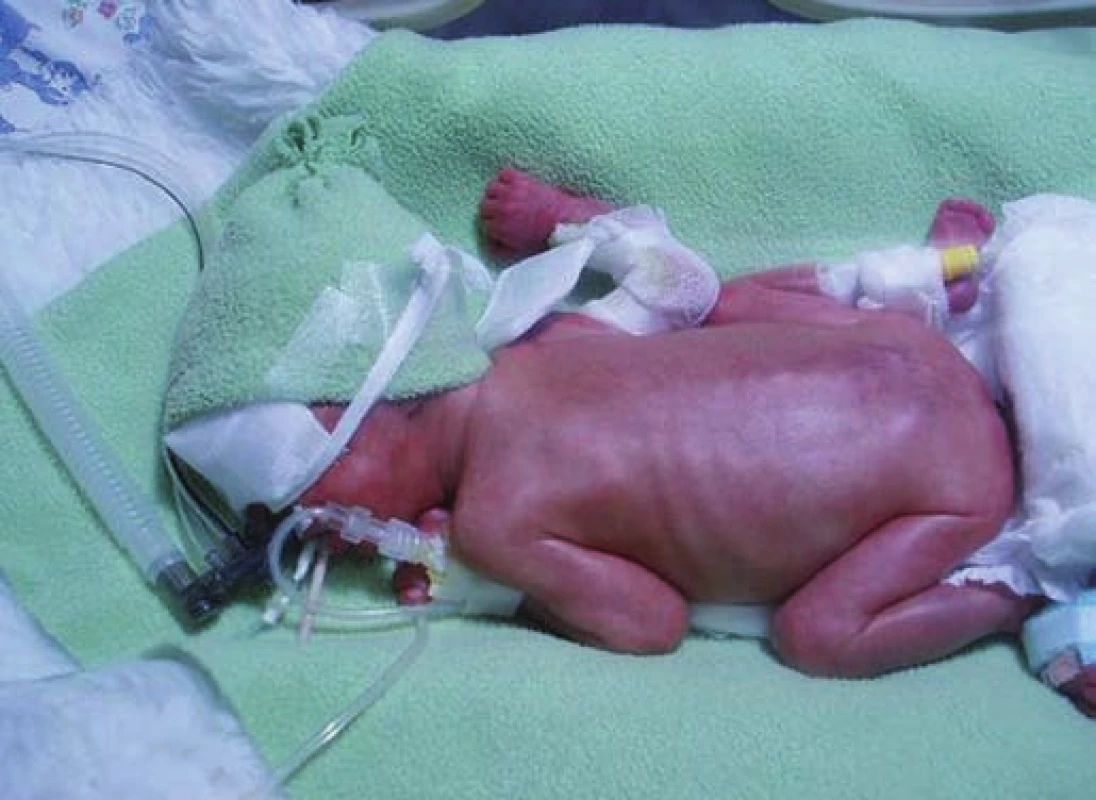
Tab. 1. Zdravotní problémy nedonošených dětí. 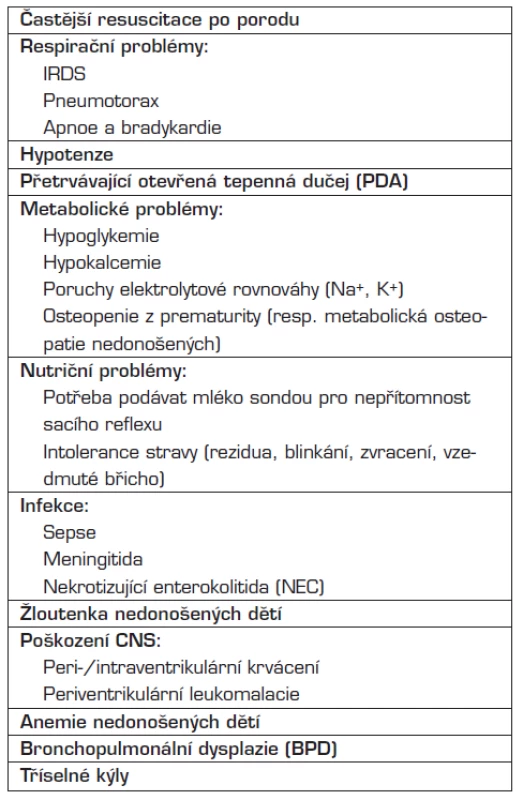
KONTROLA TĚLESNÉ TEPLOTY
Novorozenci mají větší tělesný povrch než starší děti. Kůže nedonošených dětí je nedokonale keratinizovaná, což hlavně v prvním týdnu života přispívá ke ztrátám tělesné vody a tepla.
Nedonošené děti nejsou schopné udržovat stabilní tělesnou teplotu. Spotřeba kyslíku se u novorozence zvyšuje v prostředí příliš chladném i příliš horkém. Nejnižší je v tzv. neutrálním teplotním prostředí, které je v případě donošeného novorozence definováno rozmezím 32–35 °C, u velmi nezralých dětí je vyšší. Potřebné teplotní prostředí lze zajistit v inkubátoru nebo na vyhřívaném lůžku. Je třeba pamatovat, že se zvyšováním teploty prostředí rostou vodní ztráty. Vodním ztrátám evaporací lze předcházet pomocí krytu s plastovou fólií, umístěného kolem dítěte, zvyšováním vlhkosti prostředí a parenterální dodávkou tekutin.
VODNÍ ROVNOVÁHA
Potřeba dodávky tekutin je u nedonošených novorozenců variabilní a mění se s gestačním stářím, zdravotním stavem a podle toho, zda je novorozenec ošetřován v uzavřeném inkubátoru nebo na otevřeném vyhřívaném lůžku, kde jsou vodní ztráty vyšší. První den po porodu se potřeba dodávky tekutin pohybuje kolem 60–80 ml/kg hmotnosti (u velmi nezralých dětí může být až 100 ml/kg a den) a postupně se zvyšuje cca o 30 ml/kg hmotnosti a den až do celkového objemu 150–180 ml/kg a den.
Aktuální dodávka tekutin se odvíjí od klinického stavu dítěte, koncentrace elektrolytů v plazmě, aktuální diurézy a tělesné hmotnosti.
VÝŽIVA
Nedonošený novorozenec má zvýšené nutriční požadavky, protože roste rychleji. Dítě porozené ve 28. týdnu těhotenství zdvojnásobí porodní hmotnost mezi 6–8 týdny věku a ztrojnásobí ji mezi 3.–4. měsícem po porodu, zatímco donošené dítě ji zdvojnásobí ve 4,5 měsících a ztrojnásobí ve 12 měsících věku.
Novorozenec porozený ve 35.–36. týdnu je natolik zralý, že je schopný sát a polykat mateřské mléko. Méně zralý novorozenec musí přijímat mléko pomocí sondy zavedené do žaludku. I u těžce nezralých novorozenců se enterální výživa, nejlépe mateřským mlékem, zahajuje co nejdříve (tj. již 1. nebo 2. den po porodu).
Při výživě mateřským mlékem bývá zapotřebí zvýšit obsah bílkovin a kalorický obsah podávaného mléka pomocí tzv. fortifikátorů. K dispozici jsou též speciálně připravená (formulovaná) mléka, splňující nutriční nároky nedonošených dětí.
Tab. 2. Mateřské mléko, kravské a formulované mléko (na 100 ml). 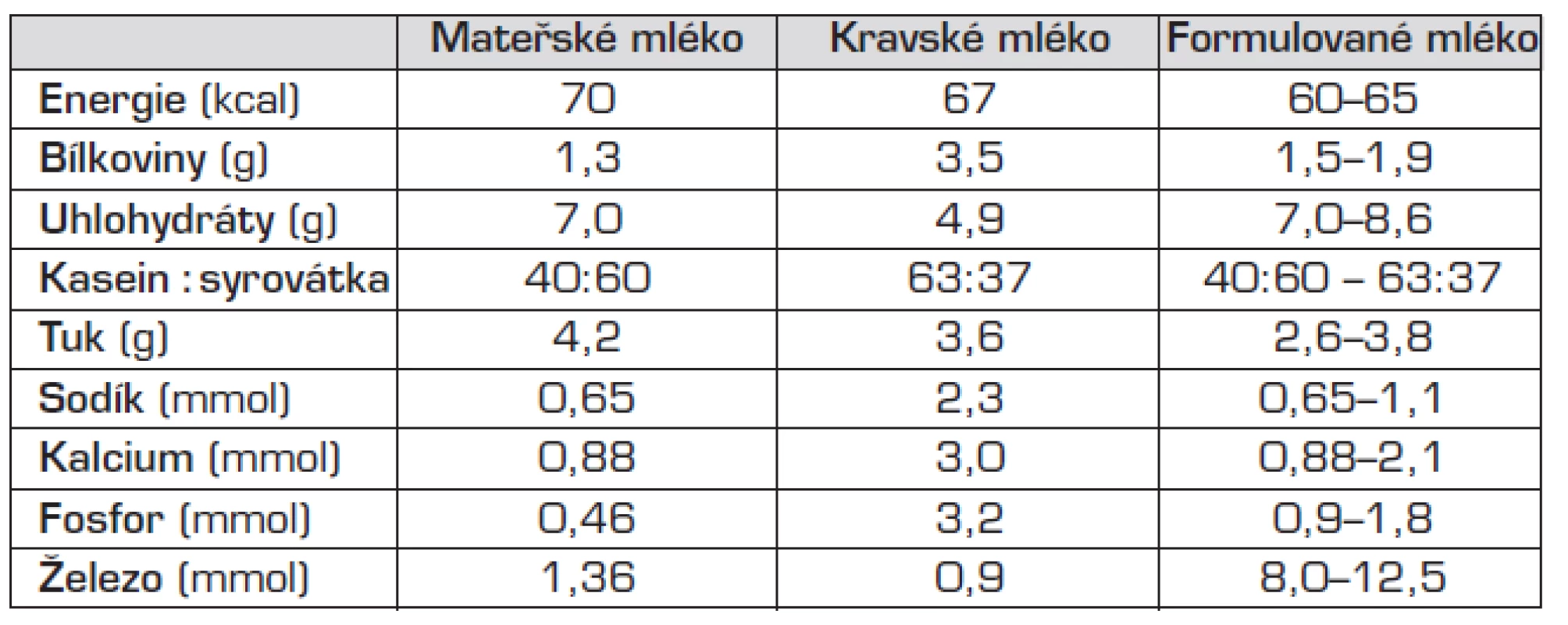
U velmi nezralých novorozenců (s gestačním stářím do 32 týdnů, resp. s porodní hmotností pod 1500 g) nebo u nemocných novorozenců bývá zapotřebí parenterální výživa s dodávkou roztoků L-aminokyselin, glukózy a tukových emulzí. Parenterální výživa se podává pomocí centrálních žilních katétrů, za přísného dodržování aseptických kautel při jejich zavádění, udržování a při výměně nutričních roztoků.
OSTEOPENIE A ANEMIE NEDONOŠENÝCH DĚTÍ
Nedostatečné mineralizaci kostí (osteopenie z prematurity), v minulosti u nedonošených novorozenců časté, lze předcházet dodávkou potřebného množství fosfátů, kalcia a vitaminu D.
Protože transplacentární dodávka železa pro plod probíhá během posledního trimestru, jsou jeho zásoby u nedonošených novorozenců nižší a s odstupem od porodu jim hrozí jeho nedostatek. Riziko anemizace je u nezralých novorozenců po porodu vyšší. Hlavními příčinami jsou časté odběry krve a pokles tvorby erytropetinu po porodu. Podávání rekombinantního lidského erytropoetinu nedonošeným novorozencům může přispět ke snížení počtu krevních transfuzí. Suplementace železem a kyselinou listovou by se měla u nedonošených dětí zahajovat ve věku kolem 4–6 týdnů.
SYNDROM DECHOVÉ TÍSNĚ (INFANT RESPIRATORY DISTRESS SYNDROM – IRDS)
Příčinou IRDS je anatomická a funkční nezralost plic se sníženou produkcí plicního surfaktantu (SF). SF je směs fosfolipidů a proteinů, kterou tvoří a uvolňují pneumocyty II. typu. SF snižuje povrchové napětí, přispívá k rovnoměrné vzdušnosti alveolů a udržuje expanzi plic na konci výdechu. U donošených novorozenců je deficit SF vzácný. Může se vyskytnout v souvislosti s těžkou hypoxií a acidózou, při hypotermii, nebo u novorozenců matek s diabetem.
Prenatálně podané glukokortikoidy matkám s hrozícím předčasným porodem před 34. týdnem stimulují tvorbu SF. Po porodu většinou následuje endotracheální podání exogenního SF, často již na porodním sále. Kombinace prenatální indukce plicní zralosti kortikoidy a podání SF po porodu výrazně snížila u nezralých novorozenců výskyt těžkých forem IRDS, hypoxického krvácení do CNS a úmrtnost na IRDS. Současně se také zkrátila délka mechanické ventilace plic a uspíšil se přechod na neinvazivní podporu dýchání pomocí n-CPAP (nosní aplikace kontinuálního tlaku do dýchacích cest).
Klasickými projevy IRDS jsou tachypnoe, dyspnoe (alární souhyb, zatahování nadklíčkových, podklíčkových, mezižeberních prostorů a oblasti úponu bránice), exspirační grunting (tzv. naříkavý výdech), tachykardie a cyanóza.
Léčba spočívá ve stabilizaci dýchání a oběhu a udržování normoxemie pomocí ventilační podpory a přívodu kyslíku. Důležitá je prevence infekčních komplikací a zajištění nutričních potřeb. Součástí léčby je individuální ošetřovatelská péče a monitorování vitálních funkcí a vnitřního prostředí novorozence, včetně pH, krevních plynů, iontů a glykemie, event. dalších potřebných laboratorních a zobrazovacích vyšetření.
Komplikacemi při léčbě IRDS plicní ventilací bývají barotraumata (poškození tlakem) nebo volutraumata (poškození objemem). Příkladem plicních traumat jsou intersticiální emfyzém plic, pneumomediastinum nebo tenzní pneumotorax. Ke komplikacím mechanické ventilace plic patří i snížení srdečního výdeje a následně nedostatečná perfuze mozku, nebezpečné jsou nozokomiální infekce.
APNOE A BRADYKARDIE
Epizody apnoí a bradykardií jsou častým problémem velmi nezralých novorozenců. Po dosažení 32 až 34 týdnů gestačního stáří jejich výskyt klesá. Apnoe s bradykardií se může objevit buď proto, že novorozenec přestane po určitou dobu dýchat (má apnoi), nebo proto, že dýchá proti zavřené glottis.
Diagnóza apnoí s bradykardiemi pro těžkou nezralost se stanoví per exclusionem, tj. vyloučením jiných příčin (např. hypoxie, infekce, anemie, hypoglykemie, aspirace nebo gastroezofageální reflux – GER).
Léčebně pomůže podávání léků stimulujících dýchání (metylxanthiny – teophyllin, kofein) nebo jemná taktilní stimulace. Pokud je odezva na taktilní nebo farmakologickou stimulaci dýchání nedostatečná, je třeba řešit opakující se apnoické pauzy z nezralosti pomocí n-CPAP, v krajním případě mechanickou ventilací plic.
OTEVŘENÁ TEPENNÁ DUČEJ
U řady nedonošených dětí zůstává tepenná dučej po porodu otevřená (PDA) nebo se může po přechodném uzavření z různých příčin znovu otevřít. Zkratování toku krve zleva doprava otevřenou dučejí je časté u velmi nedonošených novorozenců s IRDS. Zkratování krevního toku může být asymptomatické nebo vyvolávat apnoe s bradykardiemi, zvyšuje nároky na kyslík a prodlužuje ukončení ventilační podpory.
U novorozenců s PDA bývá viditelná pulzace prekordia, je hmatný zvýšeně plněný pulz, na bazi srdeční je slyšet systolický šelest. Při měření krevního tlaku lze zachytit výraznou systolicko-diastolickou diferenci. Zvýšení objemu plicní cirkulace může vyvolat příznaky srdečního selhávání. Objektivní posouzení hemodynamické závažnosti PDA umožňuje echokardiografické vyšetření.
Léčba PDA spočívá ve snížení objemu podávaných tekutin a v korekci anemie, pokud je přítomna. Dalším krokem je pokus o farmakologický uzávěr dučeje indometacinem (inhibitorem prostaglandin-syntetázy). Indometacin však má i nežádoucí účinky, jakými jsou snížení perfuze splanchnické oblasti včetně ledvin, pokles diurézy nebo snížení počtu trombocytů. Během léčby indometacinem se doporučuje přerušit enterální výživu. Alternativní volbou je podávání ibuprofenu, který významnější nežádoucí účinky nemá. Při neúspěchu farmakologického uzávěru je indikován chirurgický podvaz tepenné dučeje.
INFEKCE
Nedonošení novorozenci jsou ve zvýšené míře ohrožení perinatálními infekcemi. Prenatálně je plod infikován při bakteriemii nebo viremii matky, během porodu bakteriální flórou, viry nebo kvasinkami, které se nacházejí v porodních cestách nebo kolem rekta matky.
Po porodu se novorozenec nejčastěji infikuje nedokonale ošetřenýma rukama ošetřujícího personálu, při invazivních léčebných procedurách (při zavádění centrálních žilních katétrů, mechanické ventilaci plic nebo během dlouhodobé parenterální výživy) nebo kontaminovanou stravou. Zvlášť nebezpečné jsou pozdní, tj. nozokomiální infekce, většinou vyvolané značně rezistentními bakteriálními kmeny, mykotickým agens nebo viry.
CEREBRÁLNÍ MORBIDITA
Periventrikulární krvácení se pozoruje u 10 až 15 % novorozenců s velmi nízkou porodní hmotností. Typická lokalizace je v germinální matrix nad nucleus caudatus. Většina krvácení je rozsahem a velikostí nevýznamná. Větší krvácení se mohu rozšířit do postranních komor nebo do mozkového parenchymu. Ke krvácení zpravidla dochází během prvních 72 hodin po porodu. Periventrikulární krvácení se nejčastěji vyskytuje v souvislosti s porodní asfyxií, těžkým IRDS nebo infekcí. Dalším významným rizikovým faktorem vzniku je pneumotorax.
V důsledku krvácení do mozkových komor může dojít k jejich dilataci, kterou lze zachytit při ultrazvukovém vyšetření CNS. Dilatace se může zastavit nebo progredovat až do obrazu posthemoragického hydrocefalu. Pozdním projevem je rozestup lebních švů, napjatá velká fontanela a rychle rostoucí obvod hlavy spolu s abnormálními neurologickými projevy, včetně křečí. Lumbální nebo komorová odlehčovací punkce většinou přináší jen dočasné snížení nitrolební hypertenze a ústup klinických projevů. Konečným řešením je zavedení ventrikulo-peritoneálního zkratu.
Ultrazvuková detekce ischemických lézí CNS je na rozdíl od krvácení obtížnější. Na počátku lze zachytit echodenzní ložiska nebo drobné „vlající“ struktury v mozkové tkáni. Ty mohou ustoupit nebo se během několika týdnů objeví cystická projasnění. Objeví-li se v oblasti zadních rohů postranních komor mnohočetná cystoidní projasnění, hovoříme o cystické periventrikulární leukomalacii (cPVL). Prognóza psychomotorického a neurosenzorického vývoje dětí s cPVL je nepříznivá.
NEKROTIZUJÍCÍ ENTEROKOLITIDA (NECROTIZING ENTEROCOLITIS – NEC)
Jedná se o závažné infekční onemocnění střeva, postihující hlavně nedonošené novorozence (jen 20 % bývá donošených). Klinicky se projevuje v prvních týdnech po porodu. Příčinou je nezralost a ischemie střevní stěny spolu s infekcí. Infekční agens se z hemokultury identifikuje jen ve 20–30 % případů onemocnění (nejčastěji S. epidermidis, E. coli, Klebsiella sp., Clostridium sp.). Vznik NEC může urychlit přetížení střeva nadměrným množstvím podávané stravy.
Novorozenec přestane tolerovat stravu, rostou rezidua nestráveného mléka v žaludku, může být zvracení až biliárního charakteru. Břicho je vzedmuté a napjaté, ve stolici se objevuje příměs čerstvé krve. Dítě může rychle upadnout do šoku a pro ataky apnoických pauz nebo respirační selhávání vyžadovat ventilační a oběhovou podporu.
K charakteristickému obrazu při rtg nebo ultrazvukovém vyšetření břicha patří distenze střevních kliček, ztluštění stěny střevní, event. přítomnost vzduchu v portální oblasti. Konečným stadiem je perforace střeva, kterou prokáže rtg vyšetření s nálezem volného plynu v dutině břišní.
Léčba spočívá ve vysazení enterální a zahájení parenterální výživy, zavedení dekompresní žaludeční sondy a podávání širokospektrých antibiotik, pokrývajících aerobní a anaerobní mikroorganismy. Často je zapotřebí zajistit dýchání a stabilizovat cirkulaci. V případě perforace je indikována chirurgická revize. Úmrtnost na NEC je stále vysoká a pohybuje se kolem 20 %. Dlouhodobé následky zahrnují vznik stenóz nebo po rozsáhlé resekci střeva potíže v rámci syndromu krátkého střeva.
RETINOPATIE Z PREMATURITY (RETINOPATHY OF PREMATURITY – ROP)
Retinopatie nedonošených dětí postihuje vyvíjející se nezralou sítnici na rozhraní její vaskularizované a avaskulární části. Na rozhraní obou částí sítnice dochází k novotvoření cév s fibroproliferací, která může pokračovat až do stadia těžkých fibrotických změn s odchlípením sítnice a způsobit tak slepotu.
Etiopatogeneze onemocnění je dosud nejasná. Kromě nezralosti zde sehrávají svou roli acidóza, hyperkapnie, hypoxie, hyperoxie, kyslíkové radikály nebo proangiogenní růstové faktory. Na vzniku onemocnění se může podílet liberálně vedená oxygenoterapie.
V současnosti, i při pečlivém monitorování oxygenace, se ROP vyskytuje asi u 15–20 % převážně extrémně nezralých novorozenců (pod 28 gestačních týdnů). Záchyt prvních změn na sítnici bývá ve věku odpovídajícím 32–38 postkoncepčním týdnům.
Obr. 2. ROP – stadium 3+, kdy je indikována kryopexe nebo laserová fotokoagulace. 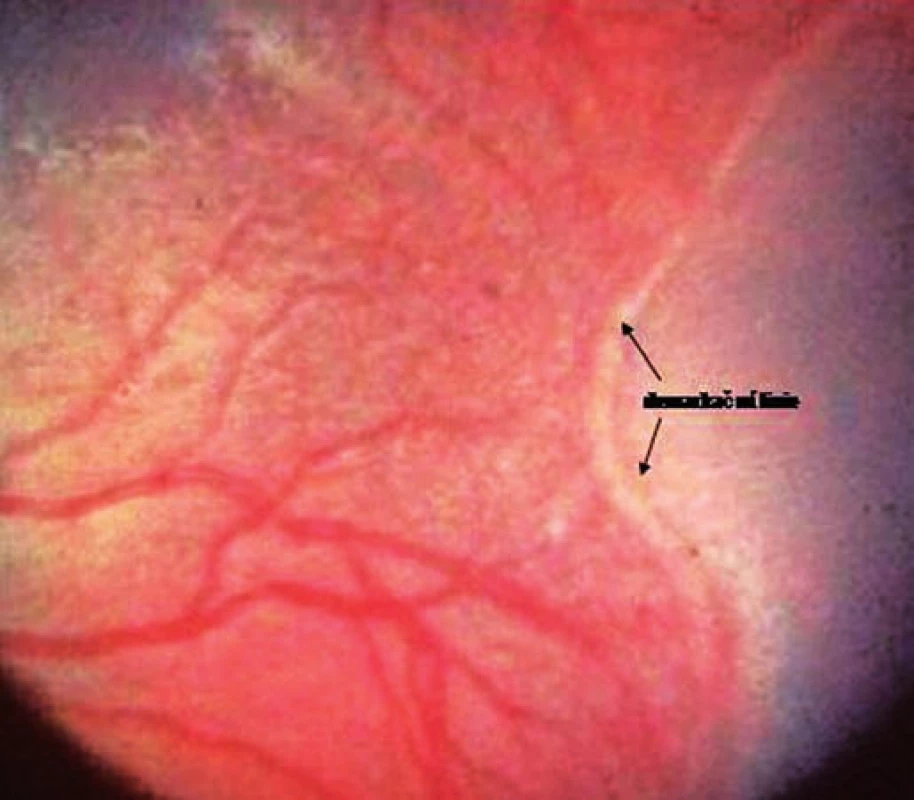
Screeningové vyšetření ROP provádí zkušený dětský oftalmolog u všech nedonošených dětí léčených kyslíkem. První oftalmologické vyšetření se provádí zpravidla ve věku 4–6 týdnů po porodu. Úvodní dvě stadia ROP jsou poměrně častá, obvykle mizí spontánně a nebývají spojena s poškozením vidění. Kryokagulace nebo laserová fotokoagulace jsou indikovány při progresi onemocnění do 3+ stadia. Včas a správně provedená kryo - nebo fotokoagulace zachová vizus až ve dvou třetinách případů s hrozící ztrátou zraku. Těžké poškození zraku pro ROP (refrakční vady, slabozrakost, zbytky zraku, nevidomost) se pozoruje asi u 1–2 % velmi nezralých dětí (pod 30 gestačních týdnů).
BRONCHOPULMONÁLNÍ DYSPLAZIE (BPD)
Nedonošení novorozenci (převážně s porodní hmotností pod 1500 g), kteří jsou dlouhodobě léčeni mechanickou ventilací plic s přívodem kyslíku, mohou mít BPD. BPD je definovaná závislostí na dodávce kyslíku ve věku 28 dnů po porodu nebo při dosažení 36 týdnů postkoncepčního věku.
Poškození plic vzniká v důsledku mechanického traumatu při umělé ventilaci plic, toxicity kyslíku, infekce a akumulace plicního sekretu. Na rtg snímku plic jsou vidět četná ložiska opacity plicního parenchymu, často s drobnými, cystoidními změnami. Některé děti s BPD vyžadují dlouhodobou plicní ventilaci. Většinu však lze převést na podporu dýchaní pomocí n-CPAP (nosní aplikace kontinuálního pozitivního tlaku) a následně na inhalační oxygenoterapii, v některých případech trvající týdny až měsíce. Ukázalo se, že kortikosteroidy (dexamethason, betamethason) mohou urychlit ukončení umělé plicní ventilace a pomoci redukovat nároky dítěte na dodávku kyslíku. Systémové podávání kortikosteroidů nezralým dětem však zpomaluje myelinizaci mozku a přispívá ke vzniku dětské mozkové obrny (DMO). Proto se jejich podávání rezervuje jen pro nejtěžší formy BPD, kde zlepšení funkce plic nelze dosáhnout jinak. Děti s BPD jsou v ponovorozeneckém období ohrožovány malnutricí pro intoleranci potřebného objemu stravy, poruchou růstu, psychomotorickou retardací a častými interkurentními infekty, pro které bývají opakovaně hospitalizovány.
Obr. 3. Extrémně nezralé dítě s bronchopulmonální dysplazií (BPD). a) novorozenec z 24. týdne s porodní hmotností 530 g b) totéž dítě ve věku 48 dnů s obrazem BPD 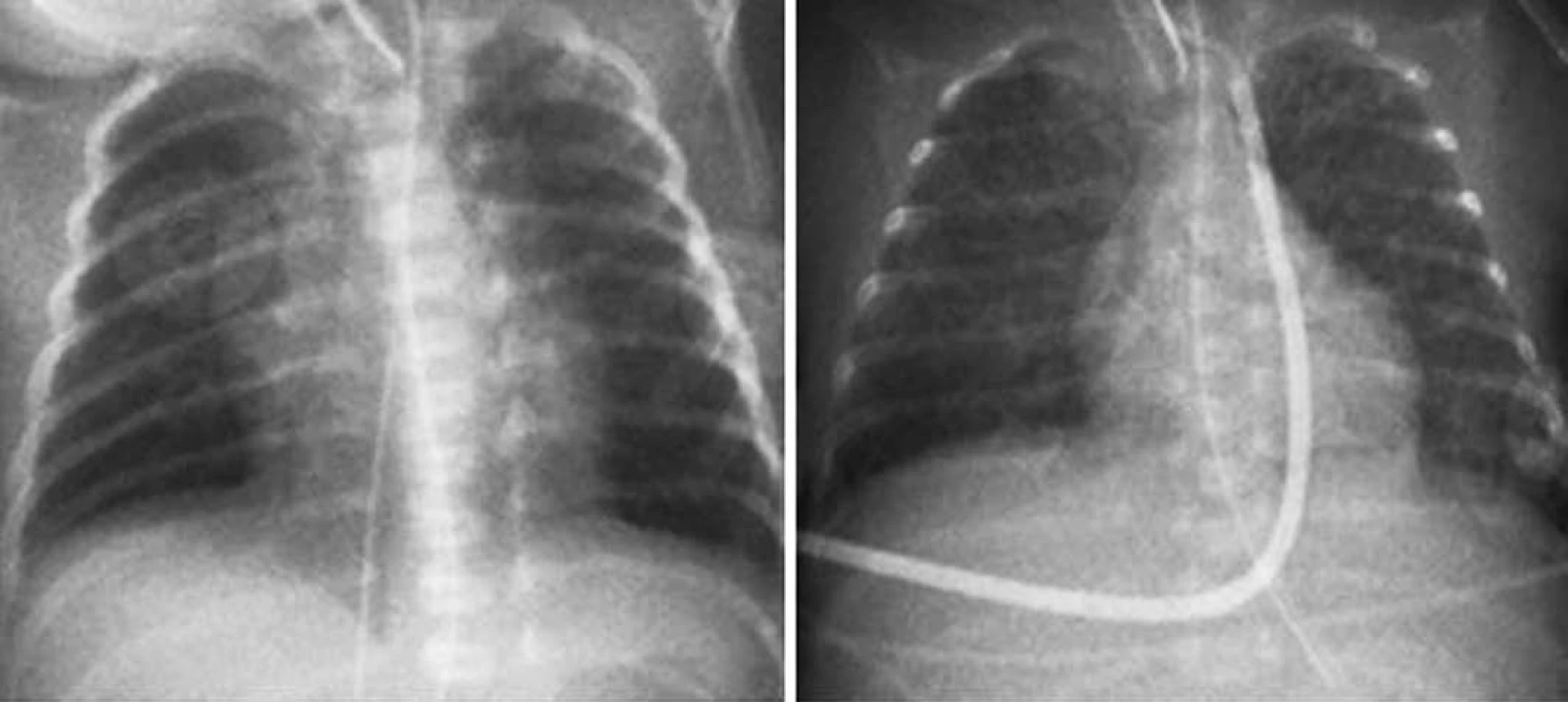
Léčba BPD je symptomatická a spočívá v udržování normoxemie, prevenci kardiorespirační insuficience, zajištění adekvátní výživy potřebné pro růst a somatický vývoj a v prevenci infekčních komplikací. Ke zkrácení hospitalizace a dřívějšímu propuštění přispívá možnost zajištění domácí oxygenoterapie s odborným lékařským dohledem.
Děti s BPD jsou zařazovány do sledování ve specializovaných poradnách pro perinatálně ohrožené děti. Klinické obtíže ustupují a plicní parenchym se remodeluje během několika měsíců, s úpravou mezi 12–18 měsíci věku. Děti s velmi těžkou formou BPD mohu zemřít na interkurentní infekci nebo pravostranné srdeční selhání.
VÝVOJ NEDONOŠENÝCH DĚTÍ PO PROPUŠTĚNÍ
Původně nedonošené děti dosahují v průměru menší tělesnou výšku a nižší hmotnost než donošení vrstevníci, a to přesto, že jejich výživa na jednotkách intenzivní péče je v současnosti podstatně kvalitnější než dříve. Opakované hospitalizace během prvního roku života jsou u nedonošených dětí až 4krát častější. Děti s BPD mají vysokou reaktivitu dýchacích cest a jsou náchylnější k opakujícím se bronchiolitidám a pneumoniím. Nejčastějším vyvolavatelem zánětů dýchacích cest a plic u dětí s BPD je RS virus. Proto se u dětí s těžkou BPD provádí pasivní imunizace monoklonální protilátkou proti RS viru – Synagisem. V prvních měsících života se hlavně u chlapců pozoruje častý výskyt tříselných kýl.
Nedonošené děti porozené před 32. týdnem gestace jsou v 5–10 % případů ohroženy poruchami psychomotorického a neurosenzorického vývoje. Jedná se především o poruchy neuromotorických funkcí (DMO), zraku, sluchu a mentálního vývoje, včetně poruch učení. V předškolním nebo raném školním věku se mohou objevit poruchy pozornosti, jemných motorických funkcí, opoždění vývoje řeči a poruchy chování. Riziko výskytu těchto projevů roste se snižujícím se gestačním věkem. Hrubé abnormity při ultrazvukovém vyšetření CNS a neurologickém vyšetření v době dosažení 40. postkoncepčního týdne ukazují na zvýšené ohrožení dlouhodobého vývoje těchto dětí.
Tab. 3. Pozdní morbidita extrémně nezralých dětí ve 3 letech života. 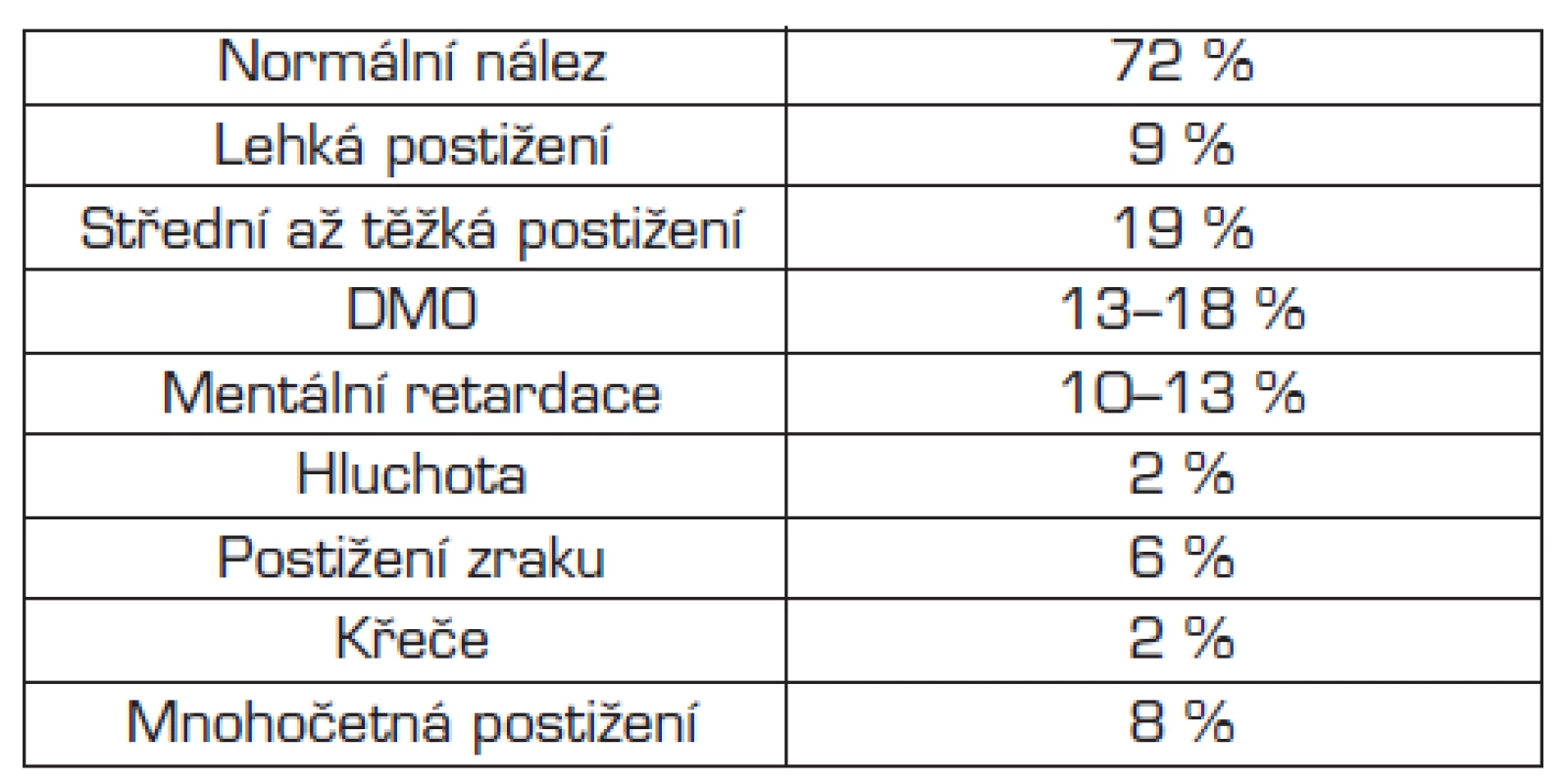
Všechny těžce nedonošené děti by měly být po propuštění dlouhodobě sledovány v ambulancích pro perinatálně ohrožené děti. Cílem dlouhodobého sledování je včas objevit vývojové poruchy a zahájit příslušné intervenční (rehabilitační) programy. V závislosti na základním postižení je indikováno konziliární sledování příslušnými specialisty (dětským pneumologem, neurologem, oftalmologem, audiologem apod.).
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článek Čtení o logopedii – 1. část
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2012 Číslo 3- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Gastroezofageální reflux a gastroezofageální refluxní onemocnění u kojenců a batolat
-
Všetky články tohto čísla
- Incidence dyslipidemií v populaci dětí s obezitou
- Deficit pyruvátkinázy v dětském věku
- Neobvyklé manifestace infekce parvovirem B19 u dětí
- Vyšetření sérové koncentrace prealbuminu a selenu ke sledování nutričního stavu pacientů s fenylketonurií a hyperfenylalaninemií
- Variabilita klinické manifestace norovirové infekce u novorozence – od perakutní nekrotizující enterokolitidy po asymptomatický průběh
- Benigní infantilní křeče asociované s norovirovou gastroenteritidou
- Současné užití léků blokujících adrenergní receptory beta u dětí se srdečním selháním
- Čtení o logopedii – 1. část
- Nedonošený novorozenec
- Poruchy vnitřního prostředí novorozenců
- Vzpomínky na budoucnost: Nefrologie na II. dětské klinice FDL UK a na Dětské klinice FN Pod Petřínem v Praze
- Primář MUDr. Petr Tax šedesátiletý
- VI. Martinské neonatologické dni
- X. český pediatrický kongres s mezinárodní účastí
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Nedonošený novorozenec
- Neobvyklé manifestace infekce parvovirem B19 u dětí
- Poruchy vnitřního prostředí novorozenců
- Deficit pyruvátkinázy v dětském věku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



