-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Co nového v léčbě systémového lupus erytematodes?
What is new in the treatment of Systemic Lupus Erythematosus?
Systemic lupus erythematosus treatment is targeted to achieve remission or low disease activity and protection from disease flares. A number of immunosupresive drugs in combination with glucocorticoids are used for this purpose and there is an increased possibility of the use of biologic treatment, especially of belimumab. Calcineurin inhibitor voclosporin is a novelty in lupus nephritis treatment. Another novelty is anifrolumab, a biologic drug which inhibits the activity of type I interferons. An integral part of care is the prevention of late disease complications, especially cardiovascular risk management.
Keywords:
Systemic lupus erythematosus – Lupus nephritis – voclosporin – belimumab – anifrolumab
Autori: Martina Skácelová
Pôsobisko autorov: III. interní klinika – nefrologická, revmatologická a endokrinologická, FN a LF UP Olomouc
Vyšlo v časopise: Vnitř Lék 2022; 68(5): 273-278
Kategória:
doi: https://doi.org/10.36290/vnl.2022.059Súhrn
Cílem léčby systémového lupus erytematodes je dosáhnout remise nebo alespoň nízké aktivity choroby a zabránit jejím opakovaným vzplanutím. K tomu je využívána celá řada imunosupresivních léků v kombinaci s glukokortikoidy, rozšiřují se i možnosti použití biologických léků, zejména belimumabu. Novinkou v léčbě lupusové nefritidy je kalcineurinový inhibitor voclosporin, z biologických léků je nově k dispozici anifrolumab, který blokuje aktivitu interferonů I. typu. Nedílnou součástí péče o pacienta se systémovým lupus erytematodes je i prevence pozdních komplikací choroby, zejména pak opatření vedoucí ke snížení rizika kardiovaskulárních komplikací.
Klíčová slova:
systémový lupus erytematodes – lupusová nefritida – voclosporin – belimumab – anifrolumab
Úvod
Systémový lupus erytematodes (SLE) je zánětlivé autoimunitní onemocnění charakterizované nadprodukcí řady orgánově nespecifických protilátek podílejících se na tvorbě imunokomplexů, které se ukládají ve tkáních a vedou k zánětlivé reakci a orgánovému postižení. Jedná se o velice heterogenní onemocnění s různým klinickým obrazem a průběhem. Prvními projevy choroby často bývají systémové příznaky, jako je únava, horečka a váhový úbytek. K nejčastějším projevům SLE patří zejména postižení kůže a kloubů, dále pak postižení glomerulů ledvin, kardiovaskulárního systému a plic, centrálního nervového systému a krvetvorby (1). Nová klasifikační EULAR/ACR (European League Against Rheumatism/American College of Rheumatology) kritéria pro SLE byla publikovaná v r. 2019 (2). Základním vstupním kritériem je pozitivita antinukleárních protilátek (ANA), bez nich nelze chorobu jako SLE stanovit. Pro splnění kritérií pro SLE musí dále nemocný splňovat alespoň jedno ze sedmi klinických kritérií a celkem ≥ 10 bodů ze skórovacího systému, jehož součástí jsou rovněž tři kritéria imunologická. Nemocný nemusí splňovat všechna kritéria současně, některá mohou být přítomna anamnesticky (2). Klasifikační kritéria EULAR/ACR jsou přehledně shrnuta v tabulce 1.
Tab. 1. Klasifikační kritéria EULAR/ACR pro SLE 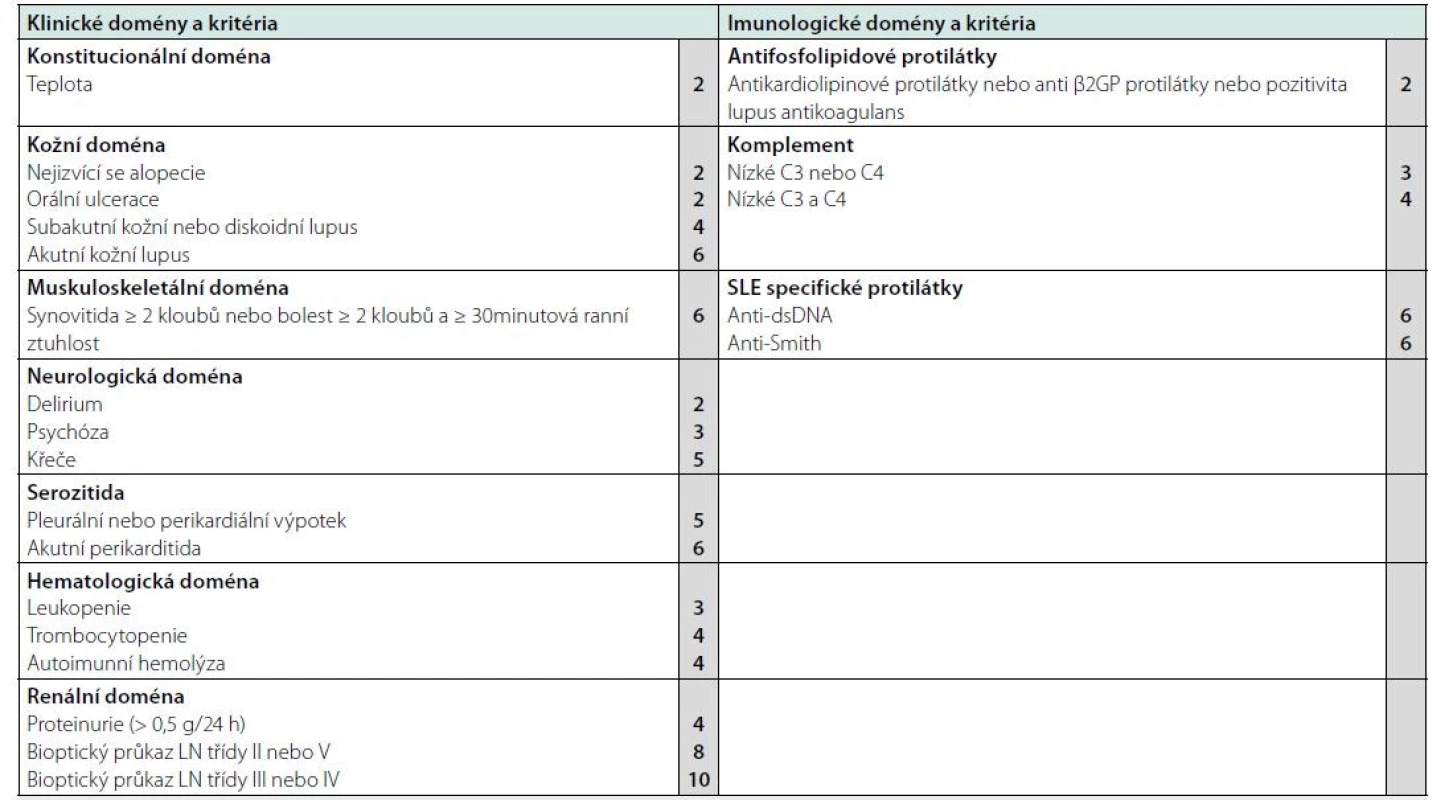
Vstupním kritériem je současná nebo anamnestická pozitivita antinukleárních protilátek (ANA) v titru ≥ 1 : 80. Do výsledné kalkulace se započítává kritérium s nejvyšší bodovou hodnotou v dané oblasti, pozitivita ostatních kritérií z dané oblasti se nekalkuluje. Přítomnost definitivní choroby se opírá o bodovou hodnotu ≥ 10, přičemž musí být přítomno alespoň jedno klinické a jedno laboratorní kritérium choroby. Doporučení EULAR pro léčbu systémového lupus erytematodes shrnují současný pohled na terapii nemoci, jejich poslední update byl publikován v roce 2019 (3), pro léčbu lupusové nefritidy jsou pak využívána samostatná Doporučení EULAR/ER‑EDTA (European Renal Association–European Dialysis and Transplant Association) publikovaná v roce 2020 (4). Algoritmus léčby vycházející z platných doporučení je i součástí doporučení České revmatologické společnosti pro léčbu nemocných se SLE (5).
Cílem léčby SLE je dosažení remise nebo alespoň nízké aktivity choroby, prevence orgánového postižení a minimalizace vedlejších účinků léčby, dále pak zlepšení dlouhodobého přežívání nemocných a optimalizace kvality života. Dosažení kompletní remise SLE (absence klinické aktivity choroby bez použití glukokortikoidů a imunosupresivních léků) je však poměrně vzácné, u většiny pacientů je tedy cílem léčby dosažení nízké aktivity onemocnění. Ta je definována jako SLEDAI ≤ 3 při terapii antimalariky nebo alternativně SLEDAI ≤ 4, PGA (physician global assessment, globální hodnocení lékařem) ≤ 1 a zároveň dávka glukokortikoidů ≤ 7,5 mg denně v kombinaci s dobře tolerovaným imunosupresivním lékem. Dosažení těchto cílů má podobný vliv na prevenci relapsů SLE a progresi orgánového poškození jako u kompletní remise (3).
U pacientů s lupusovou nefritidou (LN) je cílem léčby dosažení kompletní klinické odpovědi s cílovou proteinurií <0,5–0,7 g/24 hodin s normální glomerulární filtrací (GFR) v průběhu 12 měsíců léčby. Zlepšení proteinurie s normalizací/stabilizací GFR by mělo být patrné již po 3 měsících léčby a alespoň 50% redukce proteinurie (parciální klinická odpověď) v průběhu 6 měsíců. Je však nutno si uvědomit, že u pacientů s nefrotickou proteinurií bývá nástup klinické odpovědi pomalejší, plný efekt léčby lze očekávat později. V těchto případech je třeba vyčkat déle a vyvarovat se předčasných a unáhlených změn imunosupresivní léčby. Současným cílem léčby je rovněž dosažení remise nebo nízké aktivity v extrarenálních doménách (4).
Obecné principy léčby SLE
Strategie léčby SLE závisí na tíži a rozsahu postižení, léčba konvenčně užívanými léky (glukokortikoidy, antimalarika, imunosupresivní léky) je často doprovázena vysokým rizikem lékové toxicity, orgánového poškození, infekčních komplikací a možným rozvojem celé řady komorbidit. Část pacientů navíc zůstává i přes komplexní terapeutický přístup refrakterní na terapii. Cílem indukční léčby je rychlé dosažení kontroly nad aktivitou choroby (ať už nově diagnostikované či relapsu nebo nové orgánové manifestace), zastavení procesu tkáňového poškození, zlepšení funkce a indukce remise. Po zvládnutí akutního stavu následuje dlouhodobá udržovací terapie, jejímž cílem je udržení remise a prevence vzplanutí aktivity choroby.
Hydroxychlorochin by měl být součástí léčebného protokolu u všech pacientů se SLE. V průběhu léčby by měl být pravidelně prováděn screening retinální toxicity. Její riziko vzrůstá s délkou užívání a dávkou a je vyšší u pacientů s renální insuficiencí nebo s již preexistujícím makulárním či retinálním onemocněním. Při dávce nižší než 5 mg/kg je však riziko toxicity velmi nízké, u pacientů v dlouhotrvající remisi onemocnění je možno dávky postupně snižovat (6).
Dávka glukokortikoidů závisí na aktivitě choroby, u pacientů s život ohrožujícími orgánovými manifestacemi (postižení ledvin, CNS apod.) se v úvodní terapii využívá léčba vysokodávkovanými intravenózními pulzy glukokortikoidů. Po dosažení kontroly nad onemocněním by měla být dávka postupně minimalizována na ≤ 7,5 mg/den s cílem jejich úplného vysazení.
Volba imunosupresivního léku záleží zejména na charakteru a tíži orgánového postižení, dále pak i na věku pacienta a reprodukčních okolnostech. V potaz je vždy nutno vzít i bezpečnostní profil léků. U pacientů s mírnější symptomatologií, hlavně kožně‑kloubní, může být použit metotrexát nebo azathioprin. Pokud není dosaženo cíle léčby nebo v případě závažnějšího orgánového postižení je doporučováno nasazení mykofenolát mofetilu, který má dobrou účinnost u pacientů se závažnými formami SLE včetně postižení ledvin, naopak nebyl prokázán vliv na neuropsychiatrické manifestace choroby. Podávání cyklofosfamidu je indikováno u pacientů se závažnými manifestacemi (renální, kardiovaskulární, neuropsychiatrické) nebo jako záchranná medikace u onemocnění refrakterního na léčbu.
U pacientů s lupusovou nefritidou je doporučeno provést renální biopsii k ozřejmění histologického typu postižení. Imunosupresivní terapie je indikována v případě aktivní LN III. a IV. třídy s/bez histologických známek chronicity. U pacientů s čistou LN V. třídy je imunosupresivní léčba indikována v případě nefrotické proteinurie; naopak při postižení II. třídy není terapie imunosupresivy nutná (4).
U lupusové nefritidy III/IV třídy se v iniciální terapii využívá podávání mykofenolát mofetilu (MMF) v dávce 2–3 g denně dle tolerance a event. nežádoucích účinků nebo nízkodávkovaného (500 mg co 14 dnů v 6 dávkách) intravenózně podávaného cyklofosfamidu, u pacientů s nedostatečnou odpovědí by mělo být zváženo jeho podání ve vyšších dávkách (0,5–0,75 g/m2 měsíčně po dobu 6 měsíců). V úvodu léčby se podávají intravenózní glukokortikoidy v celkové dávce 500–2500 mg, následná perorální dávka by měla být 0,3–0,5 mg/kg s postupnou redukcí na ≤ 7,5 mg/den v průběhu 3–6 měsíců. Další možností je podání kalcineurinových inhibitorů (CNI), ať už samotných, nebo v kombinaci s MMF. Používá se zejména tacrolimus, méně často cyklosporin. Při průkazu LN V. třídy je lékem první volby mykofenolát mofetil, při nedostatečném efektu lze přidat kalcineurinové inhibitory (4).
Udržovací terapie by měla být dlouhodobá, její trvání je individuální. V případě proliferativní lupusové nefritidy by měla trvat minimálně 36 měsíců (7), k relapsům lupusové nefritidy však často může dojít i po této době. U pacientů po indukční terapii cyklofosfamidem se doporučuje pokračovat dále v terapii mykofenolát mofetilem nebo azathioprinem, který může být s výhodou použit zejména u žen plánujících graviditu. V případě indukční terapie MMF se doporučuje v této terapii nadále pokračovat, převedení pacienta na azathioprin s sebou nese vyšší riziko relapsu LN. U pacientů, kteří dosáhli kompletní klinické odpovědi, může být léčba velmi pozvolna redukována. První se doporučuje redukovat dávky glukokortikoidů, až následně je možné redukovat dávky imunosupresiv, jejichž opatrné vysazení je možné v případě dlouhotrvající remise.
U pacientů s LN refrakterní na léčbu se doporučují léky používané v indukční terapii – MMF, cyklofosfamid, CNI (zejména tacrolimus) ve vyšších dávkách či v kombinační terapii. V indikovaných případech lze použít rituximab, jeho nástup účinku však může být velmi variabilní. Rovněž tak může být použit i belimumab, který však zatím nemá oficiální indikaci pro léčbu LN, ale v post hoc analýze randomizovaných studií BLISS -52 a BLISS-76 prokázal v kombinaci s MMF efekt na redukci proteinurie a snížení rizika relapsu LN (8), rovněž tak jsou k dispozici i první data o jeho účinnosti u pacientů s biopticky potvrzenou aktivní lupusovou nefritidou (9). V literatuře jsou i zmínky o použití kombinace rituximabu s belimumabem v léčbě refrakterní lupusové nefritidy (10). Ve výjimečných případech, zejména při kontraindikaci vysokých dávek glukokortikoidů nebo imunosupresiv, lze podat intravenózní imunogloubuliny; zcela výjimečně je indikováno provedení výměnných plazmaferéz (zejména v případě hemolyticko uremického syndromu/trombotické trombocytopenické purpury, katastrofické formy antifosfolipidového syndromu).
Nová imunosupresiva v léčbě SLE
V lednu 2021 schválila FDA (Food and Drug Administration) pro léčbu lupusové nefritidy nový kalcineurinový inhibitor voclosporin. Jedná se o molekulu strukturálně podobnou cyklosporinu, která však má větší vazbu na kalcineuriny. Snižuje proliferaci lymfocytů, blokuje imunitní odpověď mediovanou T buňkami a zvyšuje integritu podocytů v ledvině. Jeho farmakokinetický profil a biologická dostupnost při perorálním podání je více konzistentní než u jiných kalcineurinových inhibitorů, při jeho podávání odpadá monitorace hladin léčiva. Rovněž tak u něj nebyly popsány lékové interakce s mykofenolát mofetilem. Lék má příznivý efekt na lipidové spektrum a glykemický profil (11).
Jeho účinnost u lupusové nefritidy při podávání v dávce 23,7 mg dvakrát denně v kombinaci s mykofenolát mofetilem a s glukokortikoidy byla potvrzena již ve studii II. fáze AURA‑LV (12). Ve studii III. fáze AURORA-1 (Aurinia Renal Response in Active Lupus With Voclosporin) byl sledován efekt kombinační terapie voclosporinu s mykofenolát mofetilem a glukokortikoidy s rychlou detrakcí dávek oproti placebu v kombinaci se standardní terapií MMF plus glukokortikoidy. Do klinického hodnocení bylo zařazeno celkem 357 pacientů s aktivní lupusovou nefritidou třídy III, IV nebo V (i v kombinaci), která byla prokázána biopticky nejdéle dva roky před zařazením do studie. Primárním cílem studie hodnoceným v 52. týdnu byla kompletní renální odpověď, která zahrnovala poměr protein/kreatinin v moči (UPCR) ≤ 0,5 mg/mg; dále stabilní renální funkce definované jako GFR ≥ 60 ml/min/1,73 m2 nebo bez většího než 20% poklesu; stav bez podání záchranné medikace; a maximální povolenou dávkou kortikosteroidů definovanou protokolem. Primárního cílového ukazatele se podařilo dosáhnout významně častěji u pacientů léčených voclosporinem (u 73 [41 %] ze 179 pacientů) než při podávání placeba (40 [23 %] ze 178 pacientů; OR, 2,65; 95 % confidence interval [CI], 1,64–4,27; P < 0,0001) (12). Bezpečnostní profil léku byl velmi příznivý, závažné nežádoucí příhody byly pozorovány u 37 (21 %) pacientů léčených voclosporinem a u 38 (21 %) pacientů v placebové skupině. Z infekčních komplikací se nejčastěji jednalo o pneumonii, která se vyskytla v průběhu sledování u 7 (4 %) pacientů v aktivní skupině a u 8 (4 %) pacientů ve skupině placebové (13).
Současné možnosti použití biologických léků v léčbě SLE
Prvním oficiálně registrovaným biologickým lékem pro léčbu SLE je belimumab. Jedná se o plně humánní rekombinantní IgG1λ monoklonální protilátku, která blokuje vazbu solubilního stimulátoru B lymfocytů (B lymphocyte stimulator, BLyS) na B lymfocyty, které hrají klíčovou roli v patogenezi SLE. Jeho účinnost a bezpečnost byla prokázána ve studiích I. a II. fáze a dále potom zejména ve dvou velkých studiích III. fáze v délce trvání 52 a 76 týdnů (14, 15); v současné době jsou k dispozici již více než 13letá bezpečnostní a účinnostní data u pacientů léčených belimumabem (16).
Studie BLISS-52 byla placebem kontrolovaná studie III. fáze, ve které byli pacienti s aktivním SLE randomizováni k léčbě belimumabem v dávce buď 1 nebo 10 mg/kg nebo k léčbě placebem (14). Primárním cílem pak bylo zlepšení SRI skóre (the Systemic Lupus Erythematosus Responder Index) v 52. týdnu sledování charakterizované jako pokles o ≥ 4 body v SELENA‑SLEDAI skóre, žádné A a maximálně jedno B skóre při hodnocení orgánového postižení podle BILAG (British Isles Lupus Assessment Group) a žádné zhoršení (< 0,3 zvýšení) v PGA hodnocení (Physician’s Global Assessment). Celkem bylo zařazeno 867 pacientů (289, 290, 287 v jednotlivých skupinách), přičemž signifikantně vyšší SRI odpovědi bylo v týdnu 52 dosaženo ve skupinách léčených belimumabem 1 mg/kg (51 %, OR 1,55 [95 % CI 1,10–2,19]; p = 0,0129) a 10 mg/kg (58 %, 1,83 [1,30–2,59]; p = 0,0006) než ve skupině placebové (44 %). Signifikantní rozdíly ve prospěch léčby belimumabem pak byly pozorovány i při posuzování SELENA‑SLEDAI, BILAG a PGA. Bezpečnostní profil belimumabu byl dobrý, výskyt nežádoucích příhod byl srovnatelný s placebem (14).
Design studie BLISS-76, ve které bylo sledováno celkem 819 pacientů, byl obdobný (15), přičemž v týdnu 52 bylo dosaženo ve skupině léčené belimumabem v dávce 10 mg/kg k signifikantně vyššímu zlepšení SRI oproti placebu (43,2 % versus 33,5 %; p = 0,017). Ve skupině léčené dávkou 1 mg/kg bylo zlepšení SRI pozorováno u 40,6 % pacientů (p = 0,089). Léčebná odpověď v týdnu 76 byla 32,4 % v placebové skupině, 39,1 % ve skupině léčené belimumabem 1 mg/kg a 38,5 % při dávce 10 mg/kg (15).
V současné době jsou již k dispozici výsledky více než 13letého sledování pacientů užívajících belimumab podávaný intravenózně ve čtyřtýdenních intervalech v kombinaci se standardní terapií SLE, přičemž medián délky expozice belimumabu byl 3 334 dnů (260–4 332 dnů), celková expozice belimumabu činila 2 294 patiento‑roků, a medián počtu infuzí 115,5 (7–155). Více než jedna třetina sledovaných pacientů pokračovala v terapii déle než 10 let, po celou dobu sledování byl pozorován stabilní počet nežádoucích příhod včetně infekcí nebo se časem jejich počet snižoval. Podíl pacientů, kteří dosáhli SRI léčebné odpovědi, postupně narůstal z 32,8 % v prvním roce sledování až k 75,6 % pacientů v roce 12. Nízké aktivity onemocnění (SELENA‑SLEDAI ≤ 2 a dávka prednisonu ≤ 5 mg/den) dosáhlo v prvním roce léčby 14 % pacientů, ve 13. roce léčby to bylo již 57 % léčených pacientů. Dlouhodobá léčba belimumabem rovněž umožnila postupné snižování dávek glukokortikoidů (16).
V souladu s doporučeními pro léčbu SLE je místo pro léčbu belimumabem zejména u pacientů s extrarenálním postižením, u kterých přes standardní terapii, kterou je většinou kombinace glukokortikoidů s hydroxychlorochinem a dalšími imunosupresivními léky, přetrvává aktivita choroby nebo dochází k jejím opakovaným vzplanutím (3). Z léčby belimumabem mají prospěch především pacienti s kožním a muskuloskeletálním postižením s vysokou aktivitou choroby (SLEDAI > 10) užívající vyšší dávky glukokortikoidů (> 7,5 mg/den) se serologicky aktivním onemocněním (nízké hladiny C3 a/nebo C4 složky komplementu a vysoké titry anti dsDNA protilátek) (17, 18).
Účinnost belimumabu u pacientů s biopticky potvrzenou aktivní lupusovou nefritidou potvrdily výsledky multicentrické, dvojitě zaslepené, placebem kontrolované studie studie III. fáze BLISS‑LN, která porovnávala efekt belimumabu v dávce 10 mg/kg i.v. přidaného ke standardní terapii LN (mykofenolát mofetil nebo cyklofosfamid/ azathiopirin) oproti placebu (9). Primárním cílem studie bylo dosažení renální odpovědi charakterizované jako poměr močový protein/kreatinin ≤ 0,7 a pokles odhadované glomerulární filtrace (eGFR) maximálně o 20 % ve srovnání s výchozími hodnotami nebo GFR ≥ 60 ml/min/1,73 m2 a nepoužití záchranné medikace. Hlavním sekundárním cílem pak bylo dosažení kompletní renální odpovědi (poměr protein/kreatinin < 0,5, zhoršení eGFR max. o 10 % nebo ≥ 90 ml/min/1,73 m2 a nepoužití záchranné medikace). Z celkového počtu 448 pacientů (224 léčeno belimumabem, 224 placebem) bylo po 104 týdnech sledování dosaženo renální odpovědi signifikantně častěji ve skupině léčené belimumabem (43 % vs. 32 %; OR 1,6; 95 % CI, 1,0–2,3; p = 0,03), rovněž tak i kompletní renální odpověď byla častější ve skupině léčené belimumabem (30 % vs. 20 %; OR 1,7; 95 % CI, 1,1–2,7; p = 0,02). Bezpečnostní profil belimumabu byl konzistentní s předchozími studiemi (9).
Rituximab (RTX) je chimérická monoklonální protilátka proti CD20 povrchovému antigenu B lymfocytů. Lék nemá oficiální registraci pro použití v léčbě SLE, v současných doporučeních pro léčbu SLE však místo má a je v této indikaci poměrně široce používán. Rituximab může být podáván v monoterapii nebo jako add‑on terapie u pacientů se závažným renálním nebo extrarenálním (zejména hematologickým nebo neuropsychiatrickým) postižením refrakterním na léčbu imunosupresivními léky a/nebo belimumab nebo u pacientů, kteří mají kontraindikace k jejich použití (3). I přes dobré zkušenosti z klinické praxe jsou však výsledky použití RTX v klinických studiích u pacientů se SLE negativní. Studie EXPLORER (The Exploratory Phase II/III SLE Evaluation of Rituximab) sledovala účinnost a bezpečnost léčby RTX oproti placebu u pacientů se střední až vysokou aktivitou SLE s extrarenálním postižením. Po léčbě rituximabem nebyl pozorován rozdíl v dosažení BILAG odpovědi mezi jednotlivými skupinami (19). Rovněž tak ve studii III. fáze LUNAR (Lupus Nephritis Assessment with Rituximab), kde byl porovnáván rituximab oproti placebu u pacientů s lupusovou nefritidou třídy III a IV, nebyla prokázána v 52. týdnu sledování superiorita RTX oproti placebu v dosažení renální odpovědi (20). Nicméně post‑hoc publikovaná metaanalýza této studie potvrdila, že dosažení kompletní deplece B buněk při léčbě rituximabem bylo asociováno s kompletní remisí LN v 78. týdnu sledování a lék dosahoval signifikantní účinnosti v podskupinách se závažnějším renálním postižením či u Afroameričanů (21).
V imunopatogenezi SLE hraje důležitou roli aktivace interferonů 1. typu. Anifrolumab je plně humánní IgG1κ monoklonální protilátka proti IFNAR1 (Interferon Alpha And Beta Receptor Subunit 1), která byla v srpnu 2021 schválena FDA pro léčbu středně těžkého a těžkého SLE. Anifrolumab prokázal účinnost ve studiích II. a III. fáze u pacientů se SLE. Ve studii II. fáze (22) byl porovnáván efekt anifrolumabu v dávce 300 mg i.v. každé 4 týdny oproti placebu na kožní raš a artritidu u pacientů se středně těžkým a těžkým SLE. Ke zlepšení kožních projevů hodnocených pomocí SLEDAI-2 K (SLE Disease Activity Index 2000) došlo u 44,3 % pacientů v léčené skupině ve srovnání s 14,8 % pacientů v placebové skupině (OR (90 % CI) 4,56 (2,48–8,39), p < 0,001; zlepšení v BILAG (British Isles Lupus Assessment Group) u 58,5 % versus 28,2 % pacientů (OR (90 % CI) 3,59 (2,08–6,19), p < 0,001; a ≥ 50 % zlepšení v mCLASI (modified Cutaneous Lupus Erythematosus Disease Area and Severity Index) u 62,0 % versus 33,7 % pacientů (OR (90 % CI) 3,31 (1,97–5,55), p < 0,001. Při hodnocení artritidy bylo u většího podílu pacientů léčených anifrolumabem pozorováno zlepšení ve SLEDAI-2 K ve srovnání s placebem: 56,7 % versus 42,4 % (OR (90 % CI) 1,88 (1,16–3,04), p = 0,032; a v BILAG 69,1 % versus 49,5 % pacientů (OR (90 % CI) 2,47 (1,48–4,12), p = 0,003; při hodnocení počtu oteklých a bolestivých kloubů byla při léčbě anifrolumabem pozorována vyšší průměrná redukce (SD) počtu postižených kloubů: -5,5 (6,3) versus -3,4 (5,9), p = 0,004 (22).
Ve dvojitě zaslepené, placebem kontrolované studii fáze III TULIP-1 nebylo sice dosaženo primárního cíle, kterým byla SRI-4 (SLE responder index-4) odpověď, bylo však dosaženo významných sekundárních cílů studie včetně možnosti redukce dávek glukokortikoidů a lepší odpovědi hodnocené pomocí CLASI a BICLA (the British Isles Lupus Assessment Group‑based Composite Lupus Assessment) ve skupině pacientů léčené anifrolumabem (23). Pacienti se středně těžkým a těžkým SLE užívající standardní léčbu byli randomizováni v poměru 2 : 1 : 2 k léčbě placebem či anifrolumabem v dávce 150 nebo 300 mg i.v. každé 4 týdny po dobu 48 týdnů. V 52. týdnu sledování bylo dosaženo SRI-4 odpovědi u podobného počtu pacientů léčených anifrolumabem v dávce 300 mg (36 %) a placebem (40 %): rozdíl -4,2 [95 % CI -14,2 – 5,8], p = 0,41 (23). Ve studii TULIP-2 byly původně sekundární cíle ze studie TULIP-1 použity jako primární cíl. Celkem 362 pacientů se SLE bylo randomizováno v poměru 1 : 1 k podávání anifrolumabu v dávce 300 mg i.v. co 4 týdny nebo k placebu. Primárním cílem studie bylo v tomto případě dosažení terapeutické odpovědi hodnocené pomocí BICLA. Ve skupině léčené anifrolumabem dosáhlo léčebné odpovědi 47,8 % pacientů, ve skupině placebové 31,5 % pacientů (rozdíl 16,3, 95 % CI, 6,3–36,3; p = 0,001) (24). Příznivý bezpečnostní profil anifrolumabu potvrdila poolovaná data z výše uvedených studií (celkem 925 pacientů), lék byl dobře tolerován, nejčastějším nežádoucím účinkem byly respirační infekce a zejména zvýšené riziko infekce herpes zoster (6,1 % vs. 1,3 % v placebové skupině; EAIR risk difference (95 % CI) 5,4 (2,8–8,4) (25).
Nežádoucí účinky léčiv
Farmakoterapie SLE je zatížena řadou vedlejších účinků užívaných léků. V případě glukokortikoidů je to zejména dobře známé riziko rozvoje sekundárního Cushingova syndromu, vzniku osteoporózy, diabetu, obezity, katarakty, ale také riziko infekcí, trombembolické choroby či akcelerace aterosklerózy. Hydroxychlorochin je spojený s možností rozvoje retinopatie či kardiotoxicity. Imunosupresivní léky všeobecně zvyšují rizika myelosuprese, infekcí, mnohé z nich jsou teratogenní (cyklofosfamid, methotrexát, mykofenolát), mohou mít onkogenní potenciál. Kalcineurinové inhibitory mohou přispívat ke zhoršení renálních funkcí či vzniku hypertenze. Biologické léky zvyšují náchylnost k bakteriálním, virovým i mykotickým infekcím, v případě rituximabu včetně progresivní multifokální leukoencefalopatie. Z toho vyplývá nutnost pečlivé monitorace všech nasazených léků.
Další doporučení pro management pacientů se SLE
Jak již bylo zmíněno, pacienti se SLE mají zvýšené riziko kardiovaskulárních komplikací, jejich prevence je proto důležitou součástí managementu léčby. Podle současných doporučení EULAR publikovaných v letošním roce se doporučuje zejména důsledná korekce hypertenze, která zásadním způsobem zvyšuje riziko koronárních příhod a ischemických cévních mozkových příhod u pacientů se SLE. Optimální cílovou hodnotou jsou hodnoty TK < 130/80 mm Hg. U pacientů s lupusovou nefritidou je při poměru močový protein/kreatinin > 500 mg/g nebo přítomné hypertenzi doporučeno podávání ACEi (inhibitory angiotenzin konvertujícího enzymu) nebo ARB (blokátory receptorů pro angiotenzin II). Dalším důležitým rizikovým faktorem je dyslipidemie, její léčba se řídí doporučeními platnými pro obecnou populaci. Na základě individuálního kardiovaskulárního rizika lze u některých skupin pacientů doporučit preventivní podávání kyseliny acetylsalicylové, zejména pak u pacientů se sekundárním antifosfolipidovým syndromem. Prediktorem kardiovaskulárních komplikací je i samotná aktivita SLE; dosažení nízké aktivity choroby a také použití nejnižších možných dávek glukokortikoidů vede k redukci CV rizika. Rovněž tak i podávání hydroxychlorochinu, který by měl být podáván všem pacientům se SLE, je doporučeno i ke snížení kardiovaskulárního rizika. Naopak neexistuje specifická imunosupresivní terapie, jejíž podání by toto riziko zásadním způsobem snižovalo (26).
V prevenci osteoporózy u pacientů se SLE se doporučují nefarmakologická opatření, jako je pravidelné cvičení a udržení optimální tělesné hmotnosti v kombinaci s adekvátní suplementací kalcia a vitaminu D. U pacientů s osteoporózou nebo s vysokým rizikem osteoporotické zlomeniny je indikováno zahájení terapie (bisfosfonáty, denosumab, v indikovaných případech teriparatid).
U pacientů se SLE je zvýšené riziko infekčních komplikací vyplývající jak z aktivity onemocnění, tak i z dlouhodobého podávání glukokortikoidů a imunosupresivních léků. V souladu s doporučeními EULAR pro vakcinaci pacientů s autoimunními chorobami se doporučuje očkování neživými vakcínami. Pacienti by měli být pravidelně očkováni proti sezónní chřipce a pneumokokové infekci, rovněž tak je doporučena vakcinace proti SARS‑CoV - 2. Měla by být zvážena i vakcinace proti herpes zoster; podle dostupných dat má v tomto případě i živá atenuovaná vakcína přijatelný bezpečnostní profil a může být zvážena zejména u pacientů s méně intenzivní imunosupresí (27).
Závěr
Přístup k pacientovi se SLE by měl být vždy komplexní, základem by měla být zejména včasná a komplexní diagnostika choroby s identifikací rozsahu a závažnosti orgánového poškození. K tomu je často vzhledem k rozmanitosti klinických manifestací choroby potřeba mezioborová spolupráce, lékařem rozhodujícím o strategii léčby bývá často revmatolog či nefrolog. Volba správné imunosupresivní terapie pak záleží na typu a tíži postižení, neméně důležitá je však i prevence komplikací choroby, zejména rozvoje kardiovaskulárních chorob a infekcí. Portfolio léků užívaných v terapii se v posledním roce rozšířilo o nový kalcineurinový inhibitor voclosporin, který prokázal dobrou účinnost v léčbě lupusové nefritidy, z biologických léků určených pro léčbu SLE je třeba zmínit belimumab, rituximab a nově také anifrolumab. Nadále probíhá intenzivní vývoj celé řady nových molekul, které by mohly v budoucnu umožnit bezpečnou a dlouhodobou kontrolu nad aktivitou závažného autoimunního onemocnění, kterým SLE bezesporu je. Slibná jsou první data o účinnosti ustekinumabu (inhibice IL-12/23), probíhají klinická hodnocení s dalšími blokátory interferonu 1, inhibicí kostimulace T buněk či s inhibitory Janusových kináz (baricitinib, filgotinib) a inhibitory proteazomu (bortezomib).
Podpořeno MZ ČR RVO FNOL-0098892 a grantem IGA_LF_2022_003.
KORESPONDENČNÍ ADRESA AUTORKY:
MUDr. Martina Skácelová, Ph.D.
III. interní klinika – nefrologická, revmatologická a endokrinologická, FN a LF UP Olomouc
I. P. Pavlova 6, 725 00 Olomouc
Cit. zkr: Vnitř Lék. 2022;68(5):273-278
Článek přijat redakcí: 24. 5. 2022
Článek přijat po recenzích: 17. 6. 2022
Zdroje
1. Horák P, Skácelová M, Schubertová M. Život ohrožující projevy systémového lupusu a antifosfolipidového syndromu ve vnitřním lékařství. Vnitř Lék 2018;64(2):136-145.
2. Aringer M, Costenbader K, Daikh D et al. 2019 European League Against Rheumatism/ American College of Rheumatology Classification Criteria for Systemic Lupus Erythematosus. Arthritis Rheumatol. 2019 Sep;71(9):1400-1412. doi: 10.1002/art.40930. Epub 2019 Aug 6. PMID: 31385462; PMCID: PMC6827566.
3. Fanouriakis A, Kostopoulou M, Alunno A et al. 2019 update of the EULAR recommendations for the management of systemic lupus erythematosus. Annals of the Rheumatic Diseases. 2019;78 : 736-745.
4. Fanouriakis A, Kostopoulou M, Cheema K et al. 2019 Update of the Joint European League Against Rheumatism and European Renal Association–European Dialysis and Transplant Association (EULAR/ERA–EDTA) recommendations for the management of lupus nephritis. Annals of the Rheumatic Diseases. 2020;79 : 713-723.
5. Horák P, Tegzová D, Závada J et al. Doporučení ČRS pro léčbu nemocných se SLE. Čes Revmatol. 2013;21 : 110-122.
6. Ruiz‑Irastorza G, Ramos‑Casals M, Brito‑Zeron P et al. Clinical efficacy and side effects of antimalarials in systemic lupus erythematosus: a systematic review. Ann Rheum Dis. 2010;69 : 20–8.doi:10.1136/ard.2008.101766.
7. Yap DYH, Chan TM. What is the ideal duration of maintenance therapy for lupus nephritis? Expert Rev Clin Immunol. 2022 Mar 19. doi: 10.1080/1744666X.2022.2056020. Epub ahead of print. PMID: 35306959.
8. Sciascia S, Radin M, Yazdany J et al. Efficacy of belimumab on renal outcomes in patients with systemic lupus erythematosus: a systematic review. Autoimmun Rev 2017;16 : 287–93. doi:10.1016/j.autrev.2017. 01. 010 pmid:http://www.ncbi.nlm.nih.gov/pubmed/28147262.
9. Furie R, Rovin BH, Houssiau F et al.Two‑year, randomized, controlled trial of belimumab in lupus nephritis. N Engl J Med. 2020;383 : 1117-1128
10. Kraaij T, Kamerling SWA, de Rooij ENM et al. The NET‑effect of combining rituximab with belimumab in severe systemic lupus erythematosus. J Autoimmun 2018;91 : 45 - 54.doi:10.1016/j.jaut.2018. 03. 003.
11. van Gelder T, Huizinga RB, Lisk L, Solomons N. Voclosporin: a novel calcineurin inhibitor with no impact on mycophenolic acid levels in patients with SLE. Nephrol Dial Transplant. 2022 Apr 25;37(5):917-922. doi: 10.1093/ndt/gfab022.
12. Rovin BH, Solomons N, Pendergraft WF 3rd et al. A randomized, controlled double - ‑blind study comparing the efficacy and safety of dose‑ranging voclosporin with placebo in achieving remission in patients with active lupus nephritis. Kidney Int. 2019;95 : 219-231.
13. Rovin BH, Teng YKO, Ginzler EM, Arriens C et al. Efficacy and safety of voclosporin versus placebo for lupus nephritis (AURORA 1): a double‑blind, randomised, multicentre, placebo ‑ controlled, phase 3 trial. Lancet. 2021 May 29;397(10289):2070-2080. doi: 10.1016/ S0140-6736(21)00578-X. Epub 2021 May 7. Erratum in: Lancet. 2021 May 29;397(10289):2048. PMID: 33971155.
14. Navarra SV, Guzmán RM, Gallacher AE et al. BLISS-52 Study Group. Efficacy and safety of belimumab in patients with active systemic lupus erythematosus: a randomised, placebo ‑ controlled, phase 3 trial. Lancet. 2011;377 : 721-731.
15. Furie R, Petri M, Zamani O et al. A phase III, randomized, placebo ‑ controlled study of belimumab, a monoclonal antibody that inhibits B lymphocyte stimulator, in patients with systemic lupus erythematosus. BLISS-76 Study Group. Arthritis Rheum. 2011;63 : 3918-3930.
16. Wallace DJ, Ginzler EM, Merrill JT et al. Safety and Efficacy of Belimumab Plus Standard Therapy for Up to Thirteen Years in Patients With Systemic Lupus Erythematosus. Arthritis Rheumatol. 2019 Jul;71(7):1125-1134. doi: 10.1002/art.40861. Epub 2019 Jun 5. PMID: 30771238; PMCID: PMC6617785.
17. Iaccarino L, Andreoli L, Bocci EB et al. Clinical predictors of response and discontinuation of belimumab in patients with systemic lupus erythematosus in real life setting. Results of a large, multicentric, nationwide study. J Autoimmun. 2018;86 : 1–8.doi:10.1016/j. jaut.2017. 09. 004
18. van Vollenhoven RF, Petri MA, Cervera R et al. Belimumab in the treatment of systemic lupus erythematosus: high disease activity predictors of response. Ann Rheum Dis. 2012;71 : 1343-9.doi:10.1136/annrheumdis-2011-200937
19. Merrill JT, Neuwelt CM, Wallace DJ et al. Efficacy and safety of rituximab in moderately‑to‑severely active systemic lupus erythematosus: the randomized, double‑blind, phase II/III systemic lupus erythematosus evaluation of rituximab trial. Arthritis Rheum. 2010 Jan;62(1):222-33. doi: 10.1002/art.27233. PMID: 20039413; PMCID: PMC4548300.
20. Rovin BH, Furie R, Latinis K et al. Efficacy and safety of rituximab in patients with active proliferative lupus nephritis: the Lupus Nephritis Assessment with Rituximab study. Arthritis Rheum. 2012 Apr;64(4):1215-26. doi: 10.1002/art.34359. Epub 2012 Jan 9. PMID: 22231479.
21. Gomez Mendez LM, Cascino MD, Garg J et al. Peripheral blood B cell depletion after rituximab and complete response in lupus nephritis. Clin J Am Soc Nephrol. 2018;13 : 1502-9.
22. Merrill JT, Furie R, Werth VP et al. Anifrolumab effects on rash and arthritis: impact of the type I interferon gene signature in the phase IIb MUSE study in patients with systemic lupus erythematosus. Lupus Sci Med. 2018 Nov 26;5(1): e000284. doi: 10.1136/lupus - 2018-000284. PMID: 30588322; PMCID: PMC6280909.
23. Furie RA, Morand EF, Bruce IN et al. Type I interferon inhibitor anifrolumab in active systemic lupus erythematosus (TULIP-1): a randomised, controlled, phase 3 trial. Lancet Rheumatol. 2019;1(4):E208.
24. Morand EF, Furie R, Tanaka Y et al. Trial of Anifrolumab in Active Systemic Lupus Erythematosus. N Engl J Med. 2020;382(3):211. Epub 2019 Dec 18.
25. Tummala R, Abreu G, Pineda L et al. Safety profile of anifrolumab in patients with active SLE: an integrated analysis of phase II and III trials. Lupus Sci Med. 2021 Feb;8(1):e000464. doi: 10.1136/lupus-2020-000464. PMID: 33597205; PMCID: PMC7893670.
26. Drosos GC, Vedder D, Houben E et al. EULAR recommendations for cardiovascular risk management in rheumatic and musculoskeletal diseases, including systemic lupus erythematosus and antiphospholipid syndrome. Ann Rheum, DiS. 2022 Jun;81(6):768-779. doi: 10.1136/annrheumdis-2021-221733. Epub 2022 Feb 2. PMID: 35110331.
27. Furer V, Rondaan C, Heijstek MW et al. 2019 update of EULAR recommendations for vaccination in adult patients with autoimmune inflammatory rheumatic diseases. Ann Rheum, DiS. 2020 Jan;79(1):39-52. doi: 10.1136/annrheumdis-2019-215882. Epub 2019 Aug 14. PMID: 31413005.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2022 Číslo 5- Pleiotropní účinky statinů na kardiovaskulární systém
- Nová klasifikace vnímání rizikových faktorů a etiologie kardiovaskulárních onemocnění
- Zástava srdce u pacienta se střelnými ranami – kazuistika
- Genetický výzkum potvrdil asociaci mezi autismem a střevními obtížemi
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
-
Všetky články tohto čísla
- Hlavní téma – Aktuality v revmatologii
- Léčba obrovskobuněčné arteriitidy – současnost a otevírající se možnosti
- Co nového v léčbě systémového lupus erytematodes?
- Novinky v léčbě axiálních spondyloartritid
- Časná diagnostika systémové sklerodermie
- Difuzní alveolární hemoragie jako život ohrožující manifestace nově diagnostikované granulomatózy s polyangiitidou navazující na infekci covid-19 – kazuistika
- Co je nového v doporučeních ESC 2021 pro kardiovaskulární prevenci?
- Proč brát vážně orgánové poškození u hypertenze?
- Zánět a vaskulární onemocnění
- Time in range: nový parametr v diabetologii
- Co je nového v Doporučených postupech ESC 2020 pro diagnostiku a léčbu akutních koronárních syndromů bez ST elevací?
- Diferenciální diagnostika bolestí zad
- Entresto (sakubitril-valsartan) získalo prestižní mezinárodní Galénovu cenu za nejlepší farmaceutický produkt pro rok 2022
- XXXIX. dny mladých internistů v Martině
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Diferenciální diagnostika bolestí zad
- Časná diagnostika systémové sklerodermie
- Co je nového v doporučeních ESC 2021 pro kardiovaskulární prevenci?
- Co nového v léčbě systémového lupus erytematodes?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



