-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Diagnostika hypovolemie a hypervolemie: od klinického vyšetření po moderní metody
Diagnosing hypovolemia and hypervolemia: from clinical examination to modern methods
In acutely ill patients, disturbances of circulating blood volume and water homeostasis are frequently encountered. In order to choose adequate treatment strategy a well based diagnostics of these disturbance sis necessary, because fluid therapy possess the potential not only to help but also to worsen patient’s state. Currently we have at hand several possibilities to diagnose hypovolemia or hypervolemia: besides standard clinical assessment novel approaches as dedicated laboratory markers or sonography. Tests of fluid responsiveness are other mean how to ensure that the acutely ill patient will receive just the right amount of fluids. In this review article we will present the current view of the circulating blood volume pathophysiology as well as contemporary diagnostic tools.
Keywords:
fluid challenge – fluid responsiveness – infusion therapy
Autoři: MUDr. Jan Beneš 1,2
Působiště autorů: Klinika anesteziologie, resuscitace a intenzivní medicíny LF UK a FN Plzeň 1; Biomedicínské centrum LF UK Plzeň 2
Vyšlo v časopise: Vnitř Lék 2019; 65(3): 170-176
Kategorie: Přehledné referáty
Souhrn
U nemocných v akutním stavu se velmi často setkáváme s poruchami cirkulujícího objemu a vodního hospodářství. Ke správnému vedení terapie je potřeba tyto odchylky dobře diagnostikovat, neboť nesprávně vedená infuzní terapie může potenciálně pacientův stav dále zhoršit. V současné době máme k dispozici vedle klasických postupů klinického vyšetření i řadu sofistikovanějších metod (laboratorní diagnostika, sonografie) jak odhalit skrytou hypovolemii či hypervolemii. Testy tekutinové reaktivity jsou další z možných postupů jak zajistit, aby akutně nemocný dostal adekvátní množství tekutin. V tomto přehledovém článku jsou probrány základní aspekty patofyziologie odchylek centrální volemie a současné možnosti jejich diagnostiky.
Klíčová slova:
infuzní terapie – tekutinová reaktivita – tekutinová výzva
Úvod
U nemocných v akutním stavu se velmi často setkáváme s poruchami vodního hospodářství a cirkulujícího objemu. Důvodem pro tyto odchylky od normálního stavu jsou jednak primární poruchy příjmu (nízký nebo žádný perorální příjem), nebo zvýšené ztráty (zvracení, polyurie). Dále mohou vznikat v důsledku patofyziologických poruch vnitřní regulace nebo v důsledku poruchy orgánů či orgánových soustav vyvolané primárním onemocněním či dysregulovanou imunitní odpovědí. Nemalý podíl na výchylkách hydratace a cirkulujícího objemu má i vlastní léčba. Intravenózní podání roztoků je jedním z nejčastějších úkonů jak na standardních odděleních, tak v intenzivní péči akutních stavů. Infuzní terapie je s intenzivní péčí tak mentálně spojena, že pacient, který nemá rozepsanou „infuzi“, je často vnímán jako „neadekvátně léčený“ a to i ve stavech, při nichž objektivně trpí hypervolemií, nebo jeho celkový denní příjem v důsledku parenterální suplementace výživy a podaných léčiv převyšuje běžnou potřebu. Schopnost zhodnotit míru volemie a tudíž adekvátně upravit množství podaných tekutin je z tohoto pohledu jedním z důležitých úkolů klinika u lůžka akutně nemocného.
Hydratace, volemie a koncept tekutinové responzivity
V rámci diskuse o tekutinové homeostáze se často setkáváme s promiskue používanými pojmy hydratace (hyperhydratace či hypohydratace/dehydratace) a volemie (hypervolemie, hypovolemie, normovolemie či euvolemie). Z patofyziologického pohledu je nicméně nutné tyto pojmy důsledně oddělovat. Pojem hydratace se vztahuje k problematice odchylek celkové tělesné vody (tedy ve všech kompartmentech včetně intracelulárního a intersticiálního), zatímco volemie pouze k objemu cirkulujících tekutin (tedy kompartment intravaskulární).
Lidský organizmus se fyziologicky sestává z asi 60 % z vody rozdělené do 3 hlavních kompartmentů: největšího – intracelulárního, který zaujímá asi 40 %, intersticiálního tvořícího asi 15 % a intravaskulárního s přibližně 5 % celkové hmotnosti. Mezi těmito prostory je přestup vody a iontů úzkostlivě hlídán pomocí membrán a aktivních nebo pasivních transportních mechanizmů. Na intracelulární/extracelulární úrovni je v naprosté většině případů dominantní silou rozdíl v množství osmoticky aktivních látek uvnitř buňky a v intersticiu. Na rozhraní intravaskuárním-extravaskulárním podle nejnovějších poznatků převládá vliv endotelu a vrstvy endoteliální glykokalyx – výstelky složené z vysoce onkoticky aktivních proteoglykanů. Tato vrstva pravděpodobně významně alteruje klasický Starlingův zákon o vlivu hydrostatických a onkotických tlaků na míru přestupu tekutin v kapiláře [1]. Do jaké míry současné experimenty ospravedlňují předpoklad nulové zpětné filtrace z intersticia přímo do kapilárního řečiště a evakuaci intersticia cestou lymfatické drenáže, zatím není vyjasněno. Důkazy o negativním vlivu různých patofyziologických stavů (septikemie, systémová zánětová odpověď organizmu/systemic inflammatory response syndrome – SIRS, hypervolemie) na sílu vrstvy endoteliální glykokalyx (a tedy její bariérovou funkci) se ale jeví dostatečně přesvědčivě a vysvětlují zvýšení permeability kapilár a vznik intersticiálních otoků v těchto situacích [2]. Z těchto poznatků vyplývá, že tělo disponuje pouze omezenými možnostmi, jak regulovat množství tekutin v jednotlivých kompartmentech za předpokladu, že dojde k porušení některé z membrán nebo k významné změně objemu tekutin v některém z prostorů. Přičemž oba směry odchýlení od fyziologické normovolemie jsou spojeny s rizikem vzniku komplikací. V literatuře se můžeme setkat s tzv. Bellamyho „U“ křivkou, která popisuje právě vztah mezi rizikem vzniku komplikací a volemií (schéma 1) [3].
Schéma 1. Bellamyho „U“ křivka znázorňující vztah mezi cirkulujícím objemem a rizikem vzniku komplikací. Křivky 1 a 2 znázorňují schematicky rozdíly mezi pacientem se špatnou (1) a dobrou (2) tolerancí kardiovaskulárního systému ke změnám cirkulujícího objemu 
Základním následkem rozvoje centrální hypovolemie je pokles žilního návratu, a tedy srdečního předtížení, a následný pokles srdečního výdeje v důsledku interakce s kontraktilními schopnostmi srdce popsanými individuální Frankovou-Starlingovou křivkou (schéma 2). Snaha organizmu udržet dostatečný krevní průtok do životně důležitých orgánů aktivací kompenzačních mechanizmů může sama významně zhoršit průběh onemocnění. V důsledku snížení srdečního výdeje dochází k aktivaci sympatického systému a dalších neurohumorálních kaskád s následným nárůstem systémové vaskulární rezistence a poklesem průtoku do oblasti periferie a splanchniku. Zatímco v periferní cirkulaci dochází v důsledku hypoperfuze k rozvoji ischemicko-reperfuzního postižení s následnou potenciací endoteliální dysfunkce a aktivace zánětlivé odpovědi, v oblasti splanchniku se jako zásadní jeví ztráta bariérové funkce trávicího traktu s následnou splanchnickou bakteriemií a aktivací zánětlivé kaskády hlavně v jaterní tkáni [4]. Díky tomu se oběhová instabilita a kompenzační mechanizmy stávají nikoli jen následkem vyvolávajícího stavu, ale zároveň významným promotorem následného celkového zhoršení.
Tab. 1. Schéma 2. Integrované znázornění Guytonova (čárkované křivky) a Frankova-Starlingova (plné křivky) modelu. Body 1 a 3 znázorňují počáteční stav, body 2 a 4 (a příslušné šipky) znázorňují změny v hemodynamických parametrech po podání objemu u pacienta preload responzivního (2) a neresponzivního (4) 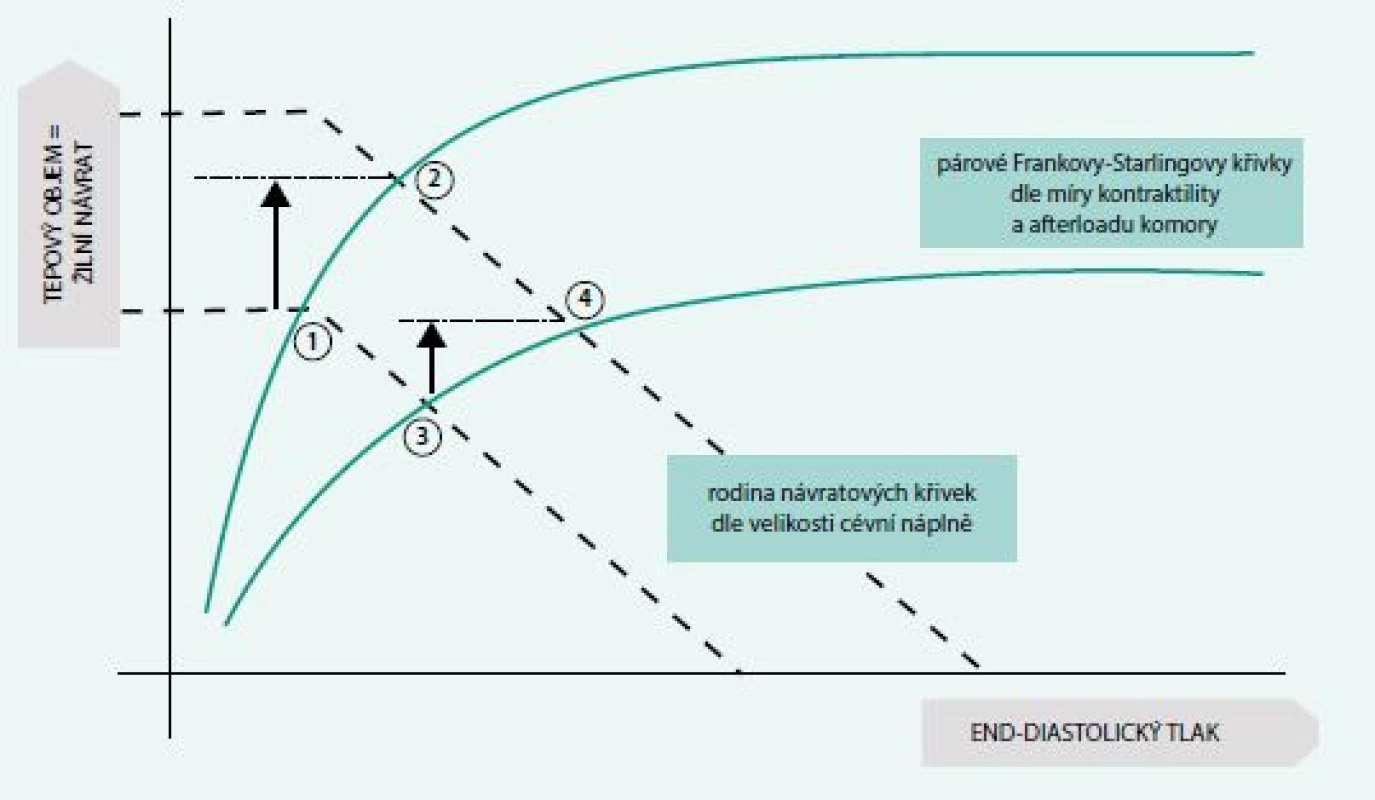
Hypervolemie je naopak (zvlášť u nemocných se zvýšenou permeabilitou endotelu) spojena s celou škálou patofyziologických změn vedoucích k navýšení postkapilárních tlaků, žilnímu městnání, tvorbě intersticiálních otoků, prodloužení difuzní dráhy pro kyslík a v konečném důsledku ke zhoršení funkce mnoha orgánů. Navíc zvýšená přítomnost tekutin v intersticiu zhoršuje mechanické vlastnosti některých tkání (plíce, srdce) a u orgánů s pevným pouzdrem potom vede k rozvoji různých kompartmentových syndromů [5]. Pro stav multiorgánového selhání v důsledku intersticiálních otoků se vžilo označení polykompartmentový syndrom [6]. V současné době máme k dispozici přesvědčivé důkazy o asociaci mezi kumulací tekutin, tekutinovým přetížením (anglicky fluid overload – nárůst hmotnosti o > 10 %) a nárůstem mortality [7–9]. Je nutno podotknout, že fylogeneticky je naše tělo mnohem lépe připraveno kompenzovat hypovolemii než tekutinové přetížení.
Tekutinová reaktivita (TR, někdy responzivita, z angl. fluid responsiveness) je pojem, který se začal v akutní medicíně objevovat v nedávné době spolu s novým (tzv. dynamickým) pohledem na monitoraci a léčbu stavů spojených s oběhovou nestabilitou [10]. Při zhodnocení TR se snažíme o posouzení schopnosti kardiovaskulárního systému (hlavně srdce jako celku) navýšit množství krve přečerpané do systémové cirkulace (srdeční výdej). Tekutinová reaktivita se tedy vztahuje spíše než k míře srdečního předtížení (preloadu) k poloze na individuální Frankově-Starlingově křivce (schéma 2). Pacient, jehož kardiovaskulární aparát se pohybuje na vzestupné části křivky, je schopen po podání infuze zvýšit srdeční výdej, a tudíž perfuzi orgánů (situace 1 ’ 2, schéma 2). Nemocní, u nichž je tato rezerva vyčerpána (situace 3 ’ 4, schéma 2), z podání tekutiny neprofitují, naopak ve zvýšené míře hrozí projevy a komplikace z hypervolemie.
Je nutno podotknout, že jistá míra tekutinové reaktivity je přirozeným stavem. Lidský organizmus má totiž evolučně vytvořené mechanizmy, jak v případě akutní potřeby zvýšit cirkulující objem. První možností je změna vaskulárního tonu pomocí aktivace sympatiku, což vede ke změně přerozdělení mezi tzv. „unstressed“ a „stressed“ objemem ve venózní cirkulaci a organizmus zvýší žilní návrat. Tato funkční žilní rezerva se normálně nalézá v řečišti splanchnické cirkulace a dolních končetin a její objem bývá odhadován (viz dále test pasivního zvednutí nohou) na 300–500 ml. Druhou možností je schopnost tzv. autotransfuze z intersticia, ke které může dojít při prudkém poklesu postkapilárních hydrostatických tlaků [1]. Opačným směrem, tedy k vyrovnání se s akutně vzniklou hypervolemií, organizmus reagovat příliš nedokáže (mj. proto, že tato možnost v přírodě není příliš reálná). Oba zmíněné postupy lze sice obrátit – tedy zvýšit míru stagnace v žilním řečišti a extravazaci do intersticia, ale vzhledem k limitované kapacitě již často za cenu nárůstu intesticiálních otoků se všemi patofyziologickými konsekvencemi.
Možnosti diagnostiky volemie
Základem každé snahy zhodnotit volemii nemocného je samozřejmě klinické vyšetření. Při něm se zaměřujeme na celkový habitus, hodnotíme suchost rtů, jazyka a sliznice dutiny ústní, kožní turgor (přetrvávání kožní řasy u dehydratovaných). Součástí aktivace zpětnovazebných humorálních mechanizmů k udržení cirkulujícího objemu se dostavuje u nemocného významný pocit žízně. Důležité je také zhodnocení kožního koloritu: bledost spojivek, případně i aker a celého těla nasvědčuje pro anemizaci jakožto možném podkladu centrální hypovolemie. Významným nálezem jsou příznaky tzv. centralizace oběhu, tedy redistribuce cirkulujícího objemu do vitálních orgánů, jakožto kompenzatorního mechanizmu při progredující hypovolemii. Prokrvení kůže je v tomto případě jedním z prvních „oken“ do cirkulace: test kapilárního návratu je oblíbenou a rychlou diagnostickou pomůckou, je ale zatížen velikou chybou v důsledku zevních příčin (podchlazení atd). Také je často prováděn chybně a nejednotně – publikované práce doporučují provedení testu u dospělé populace kompresí celého distálního článku ukazováčku na 15 s, přičemž čas k dosažení normální kapilární náplně a barvy nehtového lůžka je 2,3–4,5 s [11]. S hypoperfuzí kůže, a tedy oběhovými parametry srdečního výdeje velmi dobře koreluje plocha mramoráže dolních končetin (schéma 3) [12]. Oligurie je často užívanou známkou hypoperfuze orgánů, je ovšem nutno přihlédnout i k jiným příčinám (např. rozvoj akutního poškození ledvin, pooperační stavy). V případě městnání v žilním řečišti může v důsledku vzniku kompartment syndromů retroperitonea a ledviny dojít k paradoxnímu poklesu funkce ledvin a oligurii v terénu hypervolemie [13].
Otoky dependentních oblastí jsou typickou známkou subakutně či chronicky běžící hyperhydratace. U ležících pacientů je důležité zhodnocení otoků nikoli jen na dolních končetinách, ale i v oblasti beder, sakra, případně hýždí a rukou. Významnou mírou hypervolemického postižení je přítomnost vlhkých poslechových fenoménů symetricky nejčastěji při bazích obou plic. Při významném nálezu nicméně mohou být vlhké fenomény difuzně i v apikálních partiích a dorzální partie již mohou být zcela neslyšné. Zvýšená náplň krčních žil je dalším příznakem zvýšeného centrálního žilního tlaku.
K základnímu vyšetření pacienta patří samozřejmě také monitorace vitálních parametrů, nízký systémový tlak v kombinaci s kompenzatorní tachykardií je jedním z možných obrazů centrální hypovolemie, nejedná se ale vůbec o obraz specifický. Šokový index (poměr srdeční frekvence a systolického tlaku) > 0,9 se ukazuje být jednoduchým prediktorem rizika dekompenzace. Stejně tak nový vznik poruch rytmu (hlavně fibrilace síní) může být spojen jak s hypovolemií, tak hypervolemií. Tachypnoe může být u hypovolemických součástí celkové adrenergní aktivace, v koincidenci se symetrickým poslechovým nálezem vlhkých fenoménů a hypoxemií (pulzní oxymetrie – SpO2) je relativně specifickou známkou přetížení oběhu. I v tomto případě ovšem často není základním vyvolávajícím faktorem nárůst cirkulujícího objemu, ale akutní dysfunkce myokardu. V rámci rozšířených monitorací se ve vztahu k centrální volemii často využívá zhodnocení centrálního žilního tlaku (Central Venous Pressure – CVP). Zde je nutno podotknout, že vztah mezi hodnotou CVP a velikostí srdečního výdeje je velmi volný. Z tohoto pohledu je jen obtížně obhajitelné cílení tekutinové léčby k absolutním hodnotám CVP, jak jsme byli svědky v nedávné minulosti a stále je zakořeněno v běžné klinické praxi [14]. Co je ale u akutních stavů prokazatelné, je asociace vysokých hodnot CVP s mortalitou [15]. Z fyziologického pohledu je totiž nutno na vysokou hodnotu CVP nahlížet spíše jako na indikátor inkompetence pravé komory srdeční vyrovnat se s aktuálním žilním návratem.
Všechny tyto klinické známky tedy jsou relativně senzitivní ve smyslu poruchy normovolemie, jejich specificita je ale velmi nízká. Pro základní diferenciálně diagnostické uvažování je proto nutno tato vyšetření rozšířit o laboratorní markery a hlavně zobrazovací vyšetření. V některých případech je nutné po této iniciální rozvaze přikročit k invazivnějším metodám monitorace hemodynamiky, nicméně je vhodné toto rozhodnutí podložit právě dobrým iniciálním vyšetřením. V oblasti laboratorních markerů není k dispozici látka, která by jasně určovala velikost či míru poruchy volemie. Parametry krevního obrazu (koncentrace hemoglobinu, počet erytrocytů případně trombocytů, hematokrit), základní iontogram, koncentrace bílkovin a albuminu, hladina urey a kreatininu jsou běžně užívané a velmi důležité parametry, opět ale s relativně malou specificitou. K posouzení míry selhávání myokardu je vhodný odběr kardiospecifických enzymů a B typu natriuretického faktoru (či jeho prekurzorů). Prostý předozadní snímek hrudníku a plic umožní posoudit míru oběhového přetížení při hypervolemii – nález intersticiálního plicního otoku, Kerleyho linie, případně dilatace srdečního stínu a zesílení plicních arterií jsou vše poměrně specifické, leč pozdní příznaky. Všechna tato vyšetření je ale nutno zvažovat v širším kontextu (tab) [9].
Tab. Soubor příznaků a vyšetření 
CVP – centrální žilní tlak/Central Venous Pressure – DDŽ – dolní dutá žíla ECHO – echokardiografie LVEDA – end-diastolická plocha levé komory/ Left Ventricular End Diastolic Area RTG – rentgenogram USG – ultrasonografie Na řadu těchto základních klinických otázek nám může dát odpověď rychlé ultrasonografické vyšetření. Jeho cílem by mělo být základní zhodnocení srdce, dolní duté žíly (DDŽ) a plic. Dostupnost sonografického vyšetření je čím dál tím větší napříč obory akutní a interní péče, tato základní vyšetření by tedy neměla být pouze doménou lékařů rentgenologie/sonografie či echokardiografie. Orientační echokardiografické vyšetření srdečních oddílů u pacienta v akutním stavu je zaměřeno na několik relativně jasných patologií, jejichž odhalení by měl být schopen i méně zkušený lékař [16]. Jemné nuance odhadu/výpočtu systolické či diastolické funkce a morfologie chlopenního aparátu – to vše již přísluší do rukou zkušeného echokardiografisty, vyslovit podezření na příslušnou dysfunkci již ale můžeme i z orientačního vyšetření.
Za nejdůležitější parametry cévní náplně a myokardiální funkce považujeme orientační zhodnocení náplně levé komory; hlavně vyloučení tzv. kissing ventrikle fenoménu, svědčícího pro významnou hypovolemii [17]. Další z hrubých parametrů snadno dostupných k posouzení centrální volemie je sledování průměru dolní duté žíly ze subxyfoidální projekce (obr). Zde platí, že průměr < 1,5 cm s kolapsem > 50 % při spontánním inspiriu nasvědčuje hypovolemii, naopak průměr > 2,5 cm bez naznačené respirační variability svědčí pro hypervolemii [16]. Dilatovanou DDŽ ovšem nalézáme i za jiných okolností – při plicní embolizaci, tamponádě – i s těmito patologiemi ovšem může orientační echokardiografické vyšetření napomoci. Sonografie plic je relativně novou technikou, která nalezla hlavní účel právě v posouzení kritických stavů. Při jejím provádění většinou následujeme některé z doporučených protokolů: Basic Lung Ultrasound Evaluation (BLUE) případně jeho kombinaci v Fluid Administration limited by Lung Sonography (FALLS) – oba protokoly byly navrženy Lichtensteinem [18]. Pravděpodobně nejakceptovatelnější je ale tzv. RUSH protokol (Rapid Ultrasound for Shock and Hypotension) [19], který navíc rozšířením sonografického vyšetření na břišní dutinu umožní rychle vyloučit přítomnost nitrobřišní tekutiny jako případného podkladu hypovolemie.
Obr. 3. Skóre mramoráže dolní končetiny. Upraveno podle [12] ![Obr. 3. Skóre mramoráže dolní končetiny.
Upraveno podle [12]](https://pl-master.mdcdn.cz/media/image/6717f95f4f7c2395d66ec7332096a9b1.jpeg?version=1557746432)
Obr. Dolní dutá žíla při sonografickém vyšetření ze subxyfoidální projekce 
Zhodnocení tekutinové reaktivity v akutním stavu
U pacientů, u nichž jsou přítomny známky hypoperfuze orgánů, je přítomna oběhová nestabilita a všechny klinické ukazatele jednoznačně poukazují na centrální hypovolemii, asi není potřeba provádět sofistikované testy tekutinové reaktivity. Nicméně i v této situaci je vhodné vést infuzní terapii postupně, nikoli formou jednoho nárazového podání (např. 30 ml/kg, jak zaznívá v aktuálních doporučeních léčby septického šoku [20]), což umožní podat právě jen tolik tekutin, kolik bude potřeba k odstranění známek hypoperfuze. Ještě komplikovanější je situace u nemocných po iniciální tekutinové resuscitaci, u kterých v důsledku porušené cévní permeability dochází k pokračujícímu úniku cirkulujícího objemu do intersticia. Podání infuze takovémuto centrálně hypovolemickému pacientovi s progredující intersticiální hyperhydratací a otoky je vždy dobré opakovaně zvážit [14]. Provedení testů TR je jednou z vhodných podmínek, které nám umožní posoudit, zda uvažovaná infuze bude mít žádoucí efekt na kardiovaskulární systém. Nikdy bychom ale neměli uvažovat naopak a podávat infuze pacientovi jen proto, že je test TR pozitivní! Podrobné rozebrání jednotlivých testů TR je k dispozici v nedávno publikovaném českém přehledovém článku [21].
Z literatury jasně vyplývá, že parametry, které mají nejvyšší výpovědní hodnotu v posouzení TR, jsou mechanickou ventilací indukované změny tepového objemu, pulzního tlaku či toku měřeného dopplerometricky ve výtokovém traktu (a řada dalších odvozených parametrů) [22,23]. Bohužel, mezi nutné podmínky užití patří řízená ventilace dostatečným dechovým objemem, z toho vyplývající potřeba sedace a případně i svalové relaxace, pravidelný srdeční rytmus – vše podmínky, se kterými se setkáváme v intraoperační péči a v některých velmi řídkých případech resuscitační péče. Pro běžné užití v akutních stavech interních oborů jsou tyto parametry často nedostupné. Podobně je to i s testem end-exspirační okluze [24], který taktéž lze provádět pouze u pacienta na mechanické ventilaci.
Pravděpodobně nejužitečnějším testem TR je pasivní zvednutí nohou (Passive Leg Raising – PLR). Při PLR aktivně změníme polohu nemocného z polosedu do lehu se zvednutými dolními končetinami – optimálně pomocí polohovacího lůžka. Tím dojde k mobilizaci krve z žilních pletení v objemu asi 300–500 ml; pozitivní test je při změně srdečního výdeje (nebo jeho ekvivalentů hodnocených echokardiograficky) ≥ 10 % [25]. Podle této nedávno publikované metaanalýzy je prediktivní schopnost PLR velmi vysoká (plocha pod reciever operating characteristic curve 0,94–0,95). K nevýhodám testu patří horší tolerance napolohování některými pacienty, nutnost rychlého zhodnocení změny hemodynamických parametrů (optimálně za kontinuální hemodynamické monitorace nebo pomocí echokardiografie). Přesné provedení včetně základních limitací je velmi dobře popsáno v článku Monneta a Teboula [26].
Chování DDŽ včetně jejích rozměrů již bylo popsáno, sledování respirační variability (kolaps > 50 % u spontánně ventilujících nebo distenze > 20 % u mechanicky ventilovaných) je obecně taktéž považován za dynamický test TR. Poměrně specifickým parametrem je stanovení korigovaného času toku krve (Flow Time corrected – FTc) ať už v aortě (stanoveno např. jícnovým dopplerovským vyšetřením) nebo na karotidách. Stanovování FTc na karotidě je poměrně nový parametr, jehož přesná specifika ještě neznáme, nicméně s ohledem na snadnou dostupnost se může do budoucna jednat o parametr velmi slibný [27].
Posledním testem TR je faktické podání infuze. V případě nejistoty lze podat iniciálně bolus malý (60–100 ml) za současného sledování změny srdečního výdeje nebo toku nad aortální chlopní/ve výtokovém traktu (pozitivní test je při nárůstu alespoň 5–6 %) [28]. Případně podání celých 500 ml ve formě tzv. tekutinové výzvy. Pečlivé sledování hemodynamických/echokardiografických parametrů před podáním a po podání tekutinové výzvy je nedílnou součástí testu a je potřebné k odhadnutí případné další reakce [29,30]. U pacientů, u nichž dojde k navýšení srdečního výdeje o > 10–15 %, považujeme tekutinovou výzvu za pozitivní, a pokud přetrvávají známky orgánové hypoperfuze, je možno výzvu opakovat. V opačném případě nelze počítat s tím, že další podávání tekutin přinese pacientovi benefit a měli bychom hledat jiná řešení.
Závěr
Infuzní terapie je jedním ze zásadních léčebných postupů současné medicíny akutních stavů. Pečlivé posouzení centrální volemie může napomoci v rozhodnutí, zda pacientovi tekutiny podat. V klinické praxi dnes máme celou škálu diagnostických modalit počínajících klinickým vyšetřením a konče užitím sofistikovaných testů a monitorace srdečního výdeje. Tekutinová bilance by ale neměla být ponechána bez úzkostlivého sledování, neboť iatrogenní hypervolemie a hyperhydratace jsou stavy spojené s vyšší mortalitou našich pacientů.
Tento článek vznikl za finanční podpory výzkumného projektu Univerzity Karlovy Q39 PROGRES a za podpory programového projektu Ministerstva zdravotnictví ČR s reg. č. 15–31881A.
doc. MUDr. Jan Beneš, Ph.D.
Klinika anesteziologie, resuscitace a intenzivní medicíny LF UK a FN Plzeň
Doručeno do redakce 3. 6. 2018
Přijato po recenzi 28. 1. 2019
Zdroje
-
Levick JR, Michel CC. Microvascular fluid exchange and the revised Starling principle. Cardiovasc Res 2010; 87(2): 198–210. Dostupné z DOI: <http://dx.doi.org/10.1093/cvr/cvq062>.
-
Cerny V, Astapenko D, Brettner F et al. Targeting the endothelial glycocalyx in acute critical illness as a challenge for clinical and laboratory medicine. Crit Rev Clin Lab Sci 2017; 54(5): 343–357. Dostupné z DOI:<http://dx.doi.org/10.1080/10408363.2017.1379943>.
-
Bellamy M. Wet, dry or something else? Br J Anaesth 2006; 97(6): 755–757. Dostupné z DOI: <http://dx.doi.org/10.1093/bja/ael290>.
-
Mythen MG. Postoperative Gastrointestinal Tract Dysfunction. Anesth Analg 2005; 100(1): 196–204. Dostupné z DOI: <http://dx.doi.org/10.1213/01.ANE.0000139376.45591.17>.
-
Prowle JR, Echeverri JE, Ligabo EV et al. Fluid balance and acute kidney injury. Nat Rev Nephrol 2010; 6(2): 107–115. Dostupné z DOI: <http://dx.doi.org/10.1038/nrneph.2009.213>.
-
Malbrain MLNG, Roberts DJ, Sugrue M et al. The polycompartment syndrome: a concise state-of-the-art review. Anaesthesiol Intensive Ther 2014; 46(5): 433–450. Dostupné z DOI: <http://dx.doi.org/10.5603/AIT.2014.0064>.
-
Acheampong A, Vincent J. A positive fluid balance is an independent prognostic factor in patients with sepsis. Crit Care 2015; 19 : 251. Dostupné z DOI: <http://dx.doi.org/10.1186/s13054–015–0970–1>.
-
Benes J. Cumulative Fluid Balance. Crit Care Med 2016; 44(10): 1945–1946. Dostupné z DOI: <http://dx.doi.org/10.1097/CCM.0000000000001919>.
-
Claure-Del Granado R, Mehta RL. Fluid overload in the ICU: evaluation and management. BMC Nephrol 2016; 17(1): 109. Dostupné z DOI: <http://dx.doi.org/10.1186/s12882–016–0323–6>.
-
Monnet X, Marik PE, Teboul JL. Prediction of fluid responsiveness: an update. Ann Intensive Care 2016; 6(1): 111. Dostupné z DOI: <http://dx.doi.org/10.1186/s13613–016–0216–7>.
-
Lima A, Bakker J. Noninvasive monitoring of peripheral perfusion. Intensive Care Med 2005; 31(10): 1316–1326. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–005–2790–2>.
-
Ait-Oufella H, Bourcier S, Alves M et al. Alteration of skin perfusion in mottling area during septic shock. Ann Intensive Care 2013; 3(1): 31. Dostupné z DOI: <http://dx.doi.org/10.1186/2110–5820–3-31>.
-
Di Nicolò P. The dark side of the kidney in cardio-renal syndrome: renal venous hypertension and congestive kidney failure. Heart Fail Rev 2018; 23(2): 291–302. Dostupné z DOI: <http://dx.doi.org/10.1007/s10741–018–9673–4>.
-
Marik P, Bellomo R. A rational approach to fluid therapy in sepsis. Br J Anaesth 2016; 116(3): 339–349. Dostupné z DOI: <http://dx.doi.org/10.1093/bja/aev349>.
-
Boyd JH, Forbes J, Nakada T et al. Fluid resuscitation in septic shock: A positive fluid balance and elevated central venous pressure are associated with increased mortality. Crit Care Med 2011; 39(2): 259–265. Dostupné z DOI: <http://dx.doi.org/10.1097/CCM.0b013e3181feeb15>.
-
Boyd JH, Sirounis D, Maizel J et al. Echocardiography as a guide for fluid management. Crit Care 2016; 20 : 274. Dostupné z DOI: <http://dx.doi.org/10.1186/s13054–016–1407–1>.
-
J. Romero-Bermejo F, Ruiz-Bailen M, Guerrero-De-Mier M et al. Echocardiographic Hemodynamic Monitoring in the Critically Ill Patient. Curr Cardiol Rev 2011; 7(3): 146–156.
-
Lichtenstein DA. BLUE-Protocol and FALLS-Protocol: Two applications of lung ultrasound in the critically ill. Chest 2015; 147(6): 1659–1670. Dostupné z DOI: <http://dx.doi.org/10.1378/chest.14–1313>.
-
Seif D, Perera P, Mailhot T et al. Bedside Ultrasound in Resuscitation and the Rapid Ultrasound in Shock Protocol. Crit Care Res Pract 2012; 2012 : 503254. Dostupné z DOI: <http://dx.doi.org/10.1155/2012/503254>.
-
Rhodes A, Evans LE, Alhazzani W et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Intensive Care Med 2017; 43(3): 304–377. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–017–4683–6>.
-
Beneš J. Predikce odpovědi na podání tekutiny – tekutinová reaktivita. Prediction of fluid responsiveness. Anesteziol a Intenziv Med 2017; 28(1): 57–63.
-
Marik PE, Cavallazzi R, Vasu T et al. Dynamic changes in arterial waveform derived variables and fluid responsiveness in mechanically ventilated patients: A systematic review of the literature. Crit Care Med 2009; 37(9): 2642–2647. Dostupné z DOI: <http://dx.doi.org/10.1097/CCM.0b013e3181a590da>.
-
Bentzer P, Griesdale DE, Boyd J et al. Will this hemodynamically unstable patient respond to a bolus of intravenous fluids? JAMA 2016; 316(12): 1298–1309. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2016.12310>.
-
Georges D, de Courson H, Lanchon R et al. End-expiratory occlusion maneuver to predict fluid responsiveness in the intensive care unit: an echocardiographic study. Crit Care 2018; 22(1): 32. Dostupné z DOI: <http://dx.doi.org/10.1186/s13054–017–1938–0>.
-
Monnet X, Marik P, Teboul JL. Passive leg raising for predicting fluid responsiveness: a systematic review and meta-analysis. Intensive Care Med 2016; 42(12): 1935–1947. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–015–4134–1>.
-
Monnet X, Teboul JL. Passive leg raising: five rules, not a drop of fluid! Crit Care 2015; 19 : 18. Dostupné z DOI: <http://dx.doi.org/10.1186/s13054–014–0708–5>.
-
Jalil B, Thompson P, Cavallazzi R et al. Comparing Changes in Carotid Flow Time and Stroke Volume Induced by Passive Leg Raising. Am J Med Sci 2018; 355(2): 168–173. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjms.2017.09.006>.
-
Biais M, De Courson H, Lanchon R et al. Mini-fluid Challenge of 100 ml of Crystalloid Predicts Fluid Responsiveness in the Operating Room. Anesthesiology 2017; 127(3): 450–456. Dostupné z DOI: <http://dx.doi.org/10.1097/ALN.0000000000001753>.
-
Messina A, Longhini F, Coppo C et al. Use of the Fluid Challenge in Critically Ill Adult Patients. Anesth Analg 2017; 125(5): 1532–1543. Dostupné z DOI: <http://dx.doi.org/10.1213/ANE.0000000000002103>.
-
Cecconi M, Hofer C, Teboul JL et al. Fluid challenges in intensive care: the FENICE study: A global inception cohort study. Intensive Care Med 2015; 41(9): 1529–1537. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–015–3850-x>. Erratum in Erratum to: Fluid challenges in intensive care: the FENICE study: A global inception cohort study. [Intensive Care Med. 2015].
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Syndrom akutní dechové tísněČlánek Výživa v akutní fázi nemoci
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2019 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Akutní stavy v interní medicíně
- Nestabilní nemocný při prvním kontaktu s lékařem v nemocnici: jak rozpoznat riziko?
- Diagnostika hypovolemie a hypervolemie: od klinického vyšetření po moderní metody
- Význam ultrasonografického vyšetření v diagnostice akutních stavů
- Tekutinová léčba u akutních stavů pro neintenzivisty
- Syndrom akutní dechové tísně
- Úvodní antibiotická léčba závažných bakteriálních infekcí
- Hemoragický šok a léčba masivního krvácení
- Výživa v akutní fázi nemoci
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Hemoragický šok a léčba masivního krvácení
- Tekutinová léčba u akutních stavů pro neintenzivisty
- Syndrom akutní dechové tísně
- Diagnostika hypovolemie a hypervolemie: od klinického vyšetření po moderní metody
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



