-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Ph-negativní myeloproliferativní onemocnění s trombocytemií ve světle účinku léčby přípravkem Thromboreductin® v datech registru ke konci roku 2013
Ph-negative myeloproliferative diseases with thrombocythemia in the context of Thromboreductin® treatment, data from registry 2013
Czech Working Group for Ph-negative Myeloproliferative diseases (CZEMP) recommends anagrelid (Thromboreductin®) for the treatment of Ph-negative chronic myeloproliferative disease (MPO) with thrombocythemia accompanying. To evaluate the efficacy of this treatment, the patient registry with essential thrombocythemia and/or thrombocytosis accompanying other Ph-negative myeloproliferative diseases was established. The beginnings of data collection go back to 2001, registry itself is maintained from 2005 and the aim is to archive the medical records with detailed physical and laboratory examination, safety patient profile included. The longest follow-up monitors 150 months period. Registry database contained 1,325 patients in the end of 2013, with an annual increase of anagrelid therapy as a drug of first choice in accordance with CZEMP guidelines approved by the Czech Society of Hematology of Czech Medical Association of J. E. Purkyne. Indication criteria contribute to this trend as anagrelid is the first choice agent in 65 years old patients, instead previous 60 years of age. Often, we can observe the combined treatment, especially, in older patients and in patients with primary myelofibrosis and polycythemia vera. There have been founded 543 thrombotic events in 413 patients and 63 bleeding events in 58 patients of study group by the end of 2013. During treatment, thrombosis was diagnosed 225 times in 171 patients and bleeding was observed 139 times in 104 patients. The therapeutic response is achieved after 3 months in 77% and after 6 months in 83% of subjects, but after 12 months, the treatment still fails in 12,5% of patients. It might be caused by slow titration of Thromboreductin®. One of the most important indicators of treatment success is the effect on clinical symptoms presentation, especially the occurrence of thrombotic events. The proof of a good treatment efficacy is demonstrated by 1.8 fold decrease in arterial thrombosis, more than 1.5 fold decrease in microvascular thrombosis and even 6.2 fold decrease in venous thromboembolism events. Bleeding is observed in about double more patients in comparison to the period before inclusion in the systematic monitoring, but the bleedings are clinically insignificant.
Key words:
anagrelid (Thromboreductin®) – Ph-myeloproliferative diseases – registry – thrombosis
Autoři: Miroslav Penka 1; Jiří Schwarz 2; Petra Ovesná 3; Libor Červinek 4; Petr Dulíček 5
; Dagmar Pospíšilová 6; Jarmila Kissová 1; Tomáš Pavlík 3; Kolektiv České Pracovní Skupiny Pro Ph-Negativní Myeloproliferativní Onemocnění (czemp)
Působiště autorů: Oddělení klinické hematologie FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Miroslav Penka, CSc. 1; Ústav hematologie a krevní transfuze Praha, ředitel prof. MUDr. Petr Cetkovský, Ph. D., MBA 2; Institut biostatistiky a analýz MU Brno, ředitel doc. RNDr. Ladislav Dušek, CSc. 3; Interní hematologická a onkologická klinika LF MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Mayer, CSc. 4; IV. interní hematologická klinika LF UK a FN Hradec Králové, přednosta doc. MUDr. Pavel Žák, CSc. 5; Dětská klinika LF UP a FN Olomouc, přednosta prof. MUDr. Vladimír Mihál, Ph. D. 6
Vyšlo v časopise: Vnitř Lék 2014; 60(Suppl 2): 58-68
Kategorie: 70. narozeniny prof. MUDr. Jiřího Vorlíčka, CSc.
a kolektiv České pracovní skupiny pro Ph-negativní myeloproliferativní onemocnění (CZEMP)
Souhrn
Česká pracovní skupina pro Ph-negativní myeloproliferativní onemocnění (CZEMP) doporučuje k léčbě trombocytemie provázející Ph-negativní chronické myeloproliferativní onemocnění (MPO) pro nemocné anagrelid (Thromboreductin®). K vyhodnocení efektivity této léčby byl vytvořen Registr pacientů s diagnózou esenciální trombocytemie nebo trombocytemie provázející jiné Ph-negativní myeloproliferativní onemocnění. Počátky sběru výsledků sahají do roku 2001 a registr sám je veden od roku 2005 a od počátku je jeho cílem střádání záznamů podrobného klinického, laboratorního a bezpečnostního profilu nemocných. Doba sledování u nejdéle sledovaných nemocných činí 150 měsíců. V databázi Registru jsou ke konci roku 2013 údaje o 1 325 nemocných, přičemž každým rokem vzrůstá podíl pacientů léčených anagrelidem jako lékem první volby v souladu s doporučenými postupy CZEMP schválenými Českou hematologickou společností České lékařské společnosti J. E. Purkyně. Přispívá k tomu také posun věkové hranice pro léčbu nemocných anagrelidem jako lékem první volby z 60 na 65 let. Častěji se lze rovněž setkat s kombinovanou léčbou, zejména u starších nemocných a u pacientů s primární myelofibrózou a pravou polycytemií. Do konce roku 2013 bylo všech trombotických projevů ve sledované skupině nemocných zjištěno v anamnéze 543 u 413 nemocných, krvácivých projevů bylo dokladováno 63 u 58 pacientů. V průběhu léčby byla trombóza diagnostikována 225krát u 171 pacienta a krvácení bylo ve sledovaném souboru zjištěno 139 u 104 nemocných. Léčebné odezvy dosahujeme po 3 měsících u 77 % a po půl roce u 83 % sledovaných, přesto však po 12 měsících nedosahuje odezvy ještě něco přes 12,5 % pacientů. Podíl na tom může mít i relativně pomalu navyšovaná dávka přípravku Thromboreductin®. Jedním z nejvýznamnějších ukazatelů úspěšnosti léčby je ovlivnění výskytu klinické symptomatologie, především výskytu trombotických projevů. O úspěšnosti léčby, resp. komplexní péče o nemocné, svědčí 1,8násobný pokles arteriální trombózy, více než 1,5násobný pokles mikrovaskulární trombózy a dokonce 6,2násobný pokles příhod žilního tromboembolizmu. Krvácení je zjišťováno u asi u 2násobně vyššího počtu pacientů v porovnání s dobou před zařazením do systematického sledování, jedná se přitom o krvácení klinicky nevýznamná.
Klíčová slova:
anagrelid (Thromboreductin®) – Ph-myeloproliferativní onemocnění – registr – trombózaÚvod
Ph-negativní myeloproliferace se staly od roku 2001 předmětem pozornosti, která nakonec vedla k vytvoření České pracovní skupiny pro Ph-negativní myeloproliferativní onemocnění (CZEMP). Vzhledem k tomu, že dominantní zájem poutala od počátku trombocytóza, byl v rámci hodnocení tohoto klinicko-laboratorního fenoménu v roce 2005 ustaven Registr nemocných s diagnózou esenciální trombocytemie a trombocytemií provázejících jiné myeloproliferativní onemocnění léčených přípravkem Thromboreductin® (dále jen Registr). Tato databáze se rozrostla do širokého spektra údajů a za léta sledování pochopitelně i co do objemu nastřádaných dat.
Diagnostika myeloproliferativních chorob prošla, podobně jako i jiné skupiny chorob, v důsledku vývoje poznatků a diagnostických možností řadou klasifikací – PVSG [24], WHO z roku 2001 [12], ECMP z roku 2007 [23] a WHO z roku 2008 [42]. Vývoj klasifikací byl usměrňován požadavkem co nejpodrobnější charakterizace onemocnění, včetně odhalení rozhodujících rozdílů mezi hraničními případy jednotlivých chorob. Zásadní rozdíl je přitom spatřován zejména v odlišnosti histologických nálezů kostní dřeně [2,41]. Až poslední klasifikace využívají širší dostupnosti komplexní diagnostiky, která zahrnuje vedle histologie kostní dřeně [42] i molekulárně biologické vyšetření, především stanovení JAK2 mutace V617F, případně další (např. exon 12 genu JAK2, MPL, TET2, CBL, ASXL1, EZH2) [11,33]. V současné době se tedy do popředí pozornosti dostává vyšetření molekulárně biologické, především mutace JAK2V617F, která je nalézána až u 95 % případů PV, u 34–67 % případů PMF a u 23–57 % ET, přičemž JAK2 mutace je, jak se ukazuje, sekundární aberací a dochází k jejímu vzniku při klonální hematopoéze [13,16,17]. Při sekvenaci celého genomu DNA granulocytů nemocných s Ph - myeloproliferací se v poslední době – a u JAK2V617F negativních případů – zjišťuje mutace genu pro kalretikulin – CALR a jedná se přitom o delece nebo inzerce v exonu 9 [15]. Jak se následně ukázalo, je s tímto nálezem spojen výskyt vyšších hodnot krevních destiček, současně však nižší výskyt trombóz [34].
Zvýšený počet krevních destiček jako jeden z významných znaků zjišťovaný v souvislosti s Ph-negativními myeloproliferacemi, především u nemocných s esenciální trombocytemií, může být provázen trombotickými či krvácivými projevy [4,10]. K jejich vzniku vede řada důvodů: samotná výše krevních destiček, vrozená nebo získaná trombofilní/krvácivá zátěž nebo vyšší kardiovaskulární riziko. Mezi významné trombotické dispozice patří již zmíněná mutace JAK2 [36,37], z obecných pak obezita, hypertenze, kouření. Podrobnějšímu vyšetření trombofilní dispozice se věnujeme z důvodu indikace cílené antitrombotické, méně často protikrvácivé profylaxe [20].
U nemocných s trombocytemií přesahující 1 000 × 109/l, nebo pokud dochází k nárůstu počtu trombocytů do 2 měsíců o více než 200 × 109/l nebo při výskytu jiného rizikového faktoru či více faktorů souběžně, volíme dle doporučení CZEMP [30,38] léčbu vedoucí ke snížení, resp. normalizaci počtu destiček, tedy léčbu anagrelidem [32,39,40], interferonem [6] či hydroxyureou [26,36]. Především u mladších nemocných (< 65 let) je lékem první volby anagrelid, s průměrnou dávkou anagrelidu při zavedené léčbě asi 2,0–2,5 mg denně [28], případně interferon, který je jedinou alternativou léčby např. u těhotných pacientek.
Léčbu lze ve vybraných případech také kombinovat – anagrelid s interferonem [6] nebo s hydroxyureou [5], čímž se dosáhne možnosti redukce dávky obou léků proti dávce léku při monoterapii každým z nich při současné vyšší účinnosti léčby. V některých případech je vhodné kombinovat léčbu cytoreduktivní, resp. tromboreduktivní, s protidestičkovou léčbou – nejčastěji s kyselinou acetylsalicylovou (ASA) [18]. Jedná se o případy s počtem destiček do 1 000, popř. 1 200 × 109/l, kdy je současně přítomno vyšší riziko trombózy nebo o případy zvýšeného kardiovaskulárního rizika s nebezpečím vzniku tepenné, příp. mikrovaskulární trombózy. Některé výsledky ale naznačují, že léčba ASA může mít vliv u nemocných s myeloproliferací provázenou trombocytemií i na snížení výskytu žilní trombózy [19].
V případech podávání protidestičkové léčby (ASA) je nutno vyloučit současně se vyskytující prokrvácivou dispozici. Ta může jako funkční porucha krevních destiček (trombocytopatie) provázet myeloproliferativní chorobu samotnou nebo je náchylnost ke krvácení spojena s výskytem jiné choroby či patologického stavu (např. von Willebrandova choroba nebo získaný von Willebrandův syndrom [22]). Požadavek opatrnosti při současném podávání ASA či jiných antitrombocytárních léků (tienopyridiny, nesteroidní antiflogistika apod) je spojen s možnou funkční poruchou krevních destiček, a tedy i krvácením, tehdy, kdy trombocytemie přesahuje 1 200 destiček × 109/l. Tento fenomén popisuje velmi trefně známý Michielsův model „doutníku a klínu“ [22,37].
Cílem tohoto sdělení je zhodnocení vlivu komplexní péče na vznik trombotických projevů.
Soubor nemocných
V současné době jsou k dispozici hodnotitelná data od 1 325 nemocných, z nich 513 s ET (51,0 %), 286 s PMF (28,5 %), 140 s PV (13,9 %) a 66 (6,6 %) s jinou diagnózou dle WHO klasifikace při zahájení léčby anagrelidem. Diagnózu dle WHO klasifikace nemělo stanovenou při zahájení léčby 320 nemocných. V souboru je 798 (60,2 %) žen a 527 (39,8 %) mužů s mediánem věku 52 let (3–91 let) v době určení diagnózy; v době hodnocení souboru byl pak medián 60 let (graf 1).
Graf 1. Popis souboru pacientů (n = 1 325) 
V databázi Registru jsou shromažďovány údaje o základních laboratorních ukazatelích, rizikových dispozicích žilního tromboembolizmu a kardiovaskulárního rizika. Data od jednotlivých pacientů jsou zaznamenávána ve čtvrtletních intervalech, v 1. pololetí jednou za měsíc. Medián doby sledování od zařazení do Registru činí 39 a celková doba sledování již 150 měsíců. Míra vyplněnosti záznamů o přítomnosti rizikových faktorů dosahuje rozmezí 61 až 100 %.
Metoda
Klinické vyšetření zahrnuje záznamy trombotických a krvácivých projevů v anamnéze a dále v době sledování nemocného, dále údaje o hypertenzi, diabetes mellitus, nadváze a kouření. Z hlediska léčby se vedou záznamy o podávaných cytoreduktivních a antitrombotických lécích a jejich dávce.
Součásti laboratorního vyšetření jsou: základní hematologický soubor: krevní obraz a fibrinogen; biochemický soubor: cholesterol, triglyceridy, homocystein, ukazatele jaterních a renálních funkcí. Speciální hematologické vyšetření obsahuje inhibitory krevního srážení: antitrombin, protein C, protein S, stanovení trombofilních mutací – faktor V Leiden (FVL), a mutace genu protrombinu (PT G20210A), lupus antikoagulans (LA) a antifosfolipidové protilátky, hladina faktoru VIII (F VIII) a v neposlední řadě vyšetření JAK2 mutace. Všechna vyšetření byla prováděna klasickými běžně používanými metodami.
Statistické zpracování
K sumarizaci kategoriálních dat byly použity frekvenční tabulky. Vzhledem k tomu, že jeden pacient může prodělat více událostí (různých typů), byl kromě počtu pacientů s událostí prezentován i počet zaznamenaných událostí.
Vztah trombotických dispozic k trombotickým událostem (v anamnéze nebo při léčbě přípravkem Thromboreductin®) je hodnocen zvlášť pro jednotlivé rizikové faktory pomocí MV χ2 testu. Dále byly vytvořeny modely pro predikci výskytu trombóz v závislosti na všech potenciálně významných faktorech pomocí vícerozměrné logistické regrese. Do modelu byly vloženy všechny faktory s p-hodnotou < 0,1 v jednorozměrném modelu, a ty byly vzájemně porovnány vzhledem ke svému trombotickému potenciálu. Získané OR vyjadřuje zvýšení (OR > 1) či snížení (OR < 1) šance pro vznik trombotické události při přítomnosti sledovaného rizikového faktoru.
Srovnání četnosti podání antiagregancií před zaznamenanou událostí s průměrným podáním ve všech zbývajících záznamech bez výskytu této události bylo provedeno binomickým testem. Srovnání incidencí událostí před a po zahájení léčby anagrelidem bylo provedeno dvouvýběrovým binomickým testem. Ke srovnání (spojitých) hodnot krevního obrazu před zaznamenanou událostí s celkovým mediánem získaným ze všech záznamů bez výskytu události byl použit Wilcoxonův test.
Výsledky
V analyzovaném souboru bylo zaznamenáno celkem 606 příhod trombózy nebo krvácení u 446 pacientů před jejich zařazením do sledování, což činí 33,6 % z celkového počtu hodnocených pacientů (graf 2). V průběhu sledování (léčby) byla jakákoliv příhoda, tedy trombóza či krvácení, diagnostikována 364krát u 243 – tedy u 18,3 % z celkového počtu sledovaných nemocných (graf 2 a 3). Zatímco všech trombotických projevů bylo ve sledované skupině nemocných zjištěno v anamnéze 543 u 413 pacientů, krvácivých projevů bylo dokladováno 63 u 58 nemocných. V průběhu léčby byla trombóza diagnostikována 225krát u 171 pacientů. Krvácivých projevů bylo ve sledovaném (a lépe již podchyceném) souboru zjištěno více, a to 139 u 104 nemocných (tab. 1). Co do samotného výskytu zmíněných příhod dosahuje jejich počet poloviny z celkového počtu příhod zjištěných u sledovaných nemocných v jejich anamnéze, což je lepší výsledek nežli v minulých letech. Navíc se výrazně snižuje celkový počet pacientů, kteří utrpěli trombotickou příhodu.
Tab. 1. Incidence trombóz při léčbě přípravkem Thromboreductin® (n = 1 325) 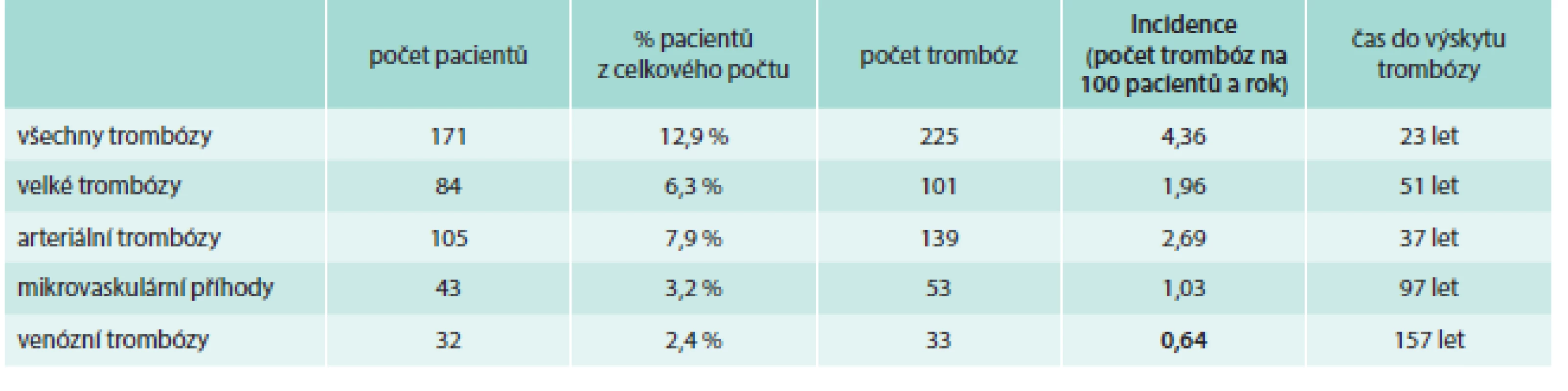
Celková délka sledování při léčbě přípravkem Thromboreductin®em byla dohromady u všech pacientů 5 166 let. Během této doby byl sledován výskyt trombóz a ze zaznamenaných údajů byla vypočítána incidence (tj. počet trombóz na 100 pacientů a rok) a čas do výskytu trombózy (tj. průměrný časový interval, ve kterém se vyskytne jedna trombóza u jednoho pacienta). K podrobnějšímu hodnocení trombotických příhod byly tyto události rozděleny na velké tepenné a žilní trombózy, malé tepenné a žilní trombózy a mikrotrombózy. Velikost příhody byla dána velikostí okludované cévy.
Graf 2. Incidence trombotických a krvácivých komplikací v anamnéze a během léčby přípravkem Thromboreductin<sup>®</sup> 
Graf 3. Výskyt trombotických a krvácivých komplikací dle počtu rizikových faktorů (n = 1 325) 
Tepenná trombóza byla zjištěna 249krát před zařazením do sledování (tedy jako anamnestického údaje), 139krát v průběhu sledování a léčby (graf 2). Rozdíl mezi údajem o výskytu tepenné trombózy v anamnéze a údajem o výskytu tepenné trombózy z období léčby byl statisticky významný na vysoké hladině statistické významnosti, podobně jako výskyt dalších trombotických událostí (mikrovaskulárních 88 proti 53 a žilních 206 proti 33!), ale i výskytu krvácivých projevů, leč v obrácené závislosti (63 vs 139), graf 2.
Zajímavý je v souvislosti s trombotickou diatézou i údaj o průměrném časovém intervalu pro vznik trombotické příhody. Zatímco ke vzniku arteriální trombózy by byla u léčených nemocných nutná doba 37 let, pak pro vznik žilní trombózy činí propočet 157 let (tab. 1).
S trombózou je spjata celá řadu stavů, které lze považovat za trombotickou dispozici, či za trombofilní stav. Z námi sledovaných trombofilních dispozic je jedním z nejvýznamnějších kauzálních ukazatelů údaj o prodělané trombóze v anamnéze. Tato souvislost se týká především tepenné trombózy (tab. 2). Tepenná trombóza se statisticky významně častěji vyskytuje u nemocných s vyšším věkem (nad 65 let), u nemocných s vysokým tlakem a u kuřáků (tab. 3).
Tab. 2. Vliv rizikových parametrů na vznik trombotických událostí při léčbě přípravkem Thromboreductin® (n = 1 325) 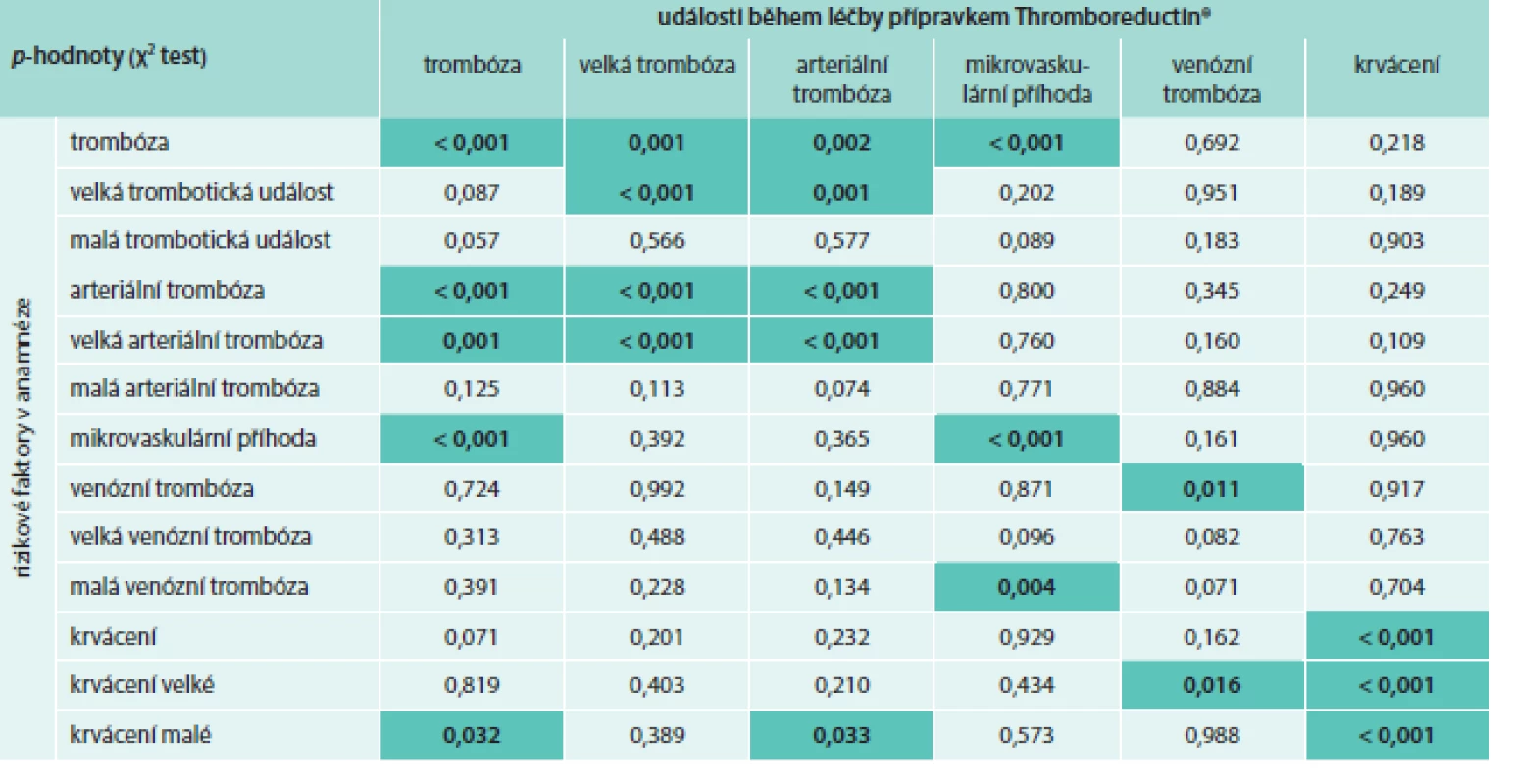
THR – Thromboreductin® Tabulka uvádí p-hodnoty, které přísluší rozdílům v četnosti vaskulárních komplikací během léčby přípravkem Thromboreductin® mezi pacienty, kteří měli a kteří neměli komplikaci v anamnéze (χ2 test). Tab. 3. Výskyt arteriálních trombóz v závislosti na rizikových faktorech 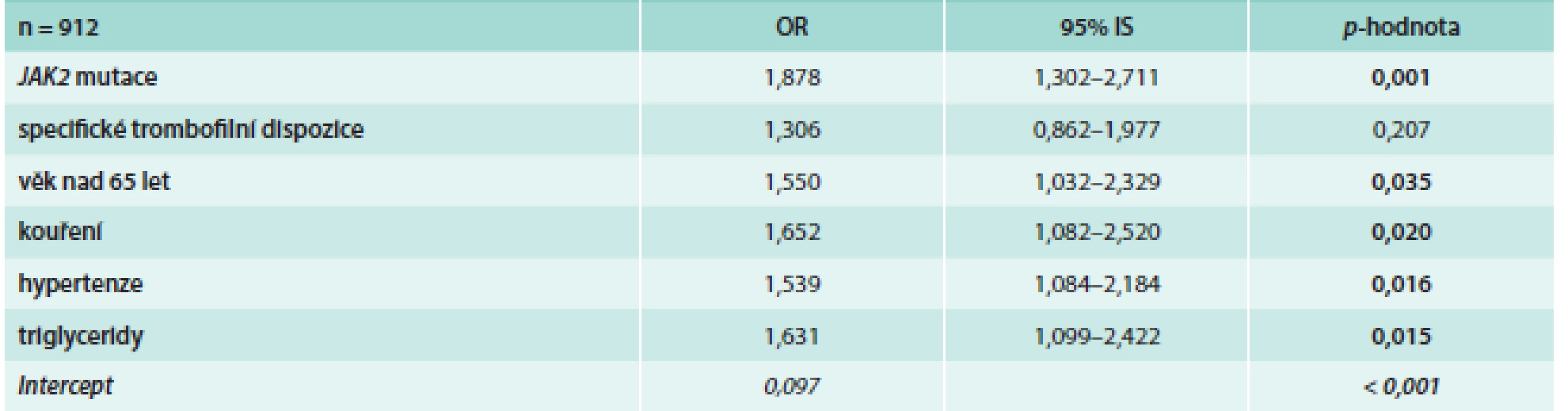
Specifické trombofilní dispozice – přítomný kterýkoli z faktorů: deficit proteinu C, deficit proteinu S, deficit AT, mutace genu protrombinu, faktor V Leiden Dalším významným faktorem přispívajícím ke vzniku trombózy (a potvrzuje to i náš rozbor) je statisticky významná role JAK2 mutace pro všechny typy trombózy (graf 4).
Graf 4. Trombóza v anamnéze nebo během léčby přípravkem Thromboreductin® ve vztahu k JAK2V617F mutaci (n = 1 061*) 
*uvedené n je sníženo o pocet pacientu, u kterých chybel údaj o trombóze v anamnéze a o prítomnosti JAK2 mutace Především u žilní trombózy se jako významné dispozice uplatňují přítomnost FVL, defektu PC a antifosfolipidových protilátek a zvýšená hladina Faktoru VIII (tab. 4).
Tab. 4. Vliv rizikových parametrů na vznik trombotických událostí (n = 1 325) 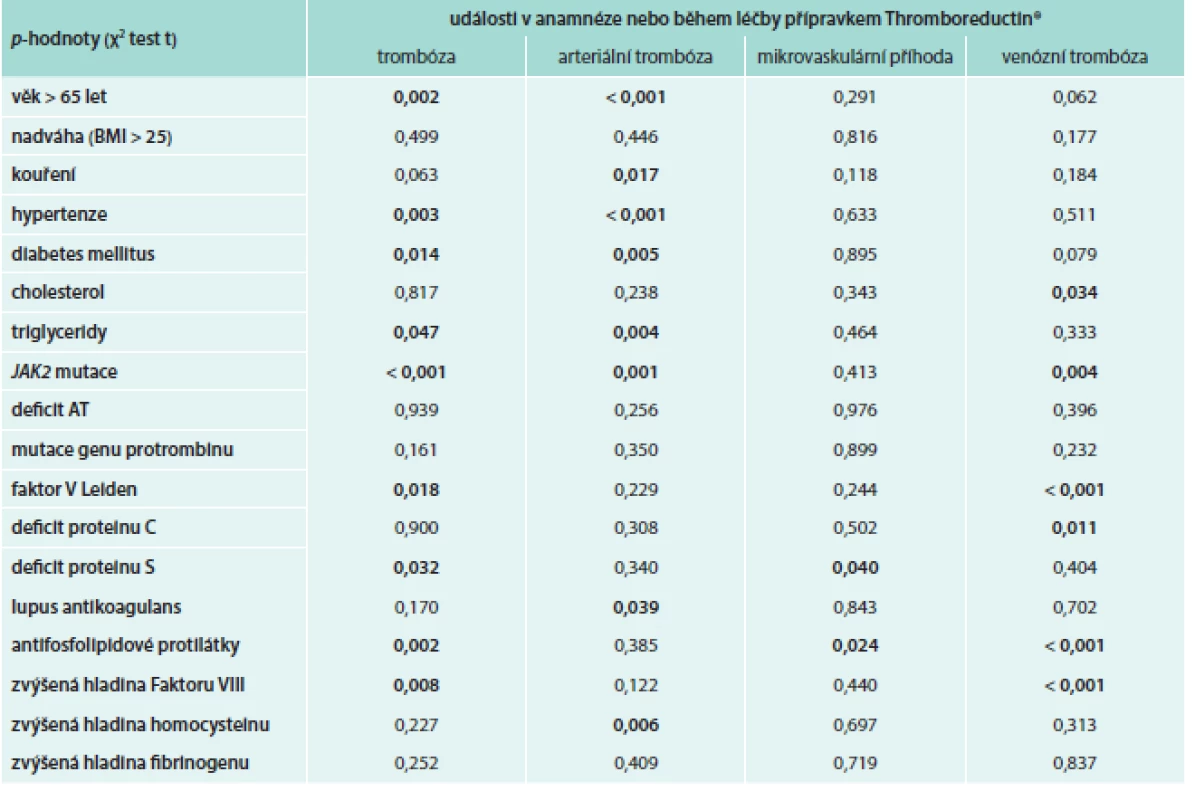
Význam vyššího počtu krevních destiček a jeho role pro snazší vznik trombózy (především žilní) je rovněž patrný a je předmětem intenzivního studia CZEMP. Na rozdíl od leukocytů se týká statisticky významné zvýšení destiček výskytu všech typů trombózy (tab. 5).
Parametrem, jenž je z hlediska výskytu tromboembolických komplikací v současné době velmi studován, je leukocytóza [10,41]. V našem souboru se celkový počet bílých krvinek v průměru pohybuje po celou dobu sledování v normálních nebo nadnormálních hodnotách nepřesahujících 13,3 × 109/l, nicméně statisticky významné spojitosti s arteriálními a mikrovaskulárními příhodami nakonec vykazuje (tab. 5).
Tab. 5. Výskyt venózních trombóz v závislosti na rizikových faktorech 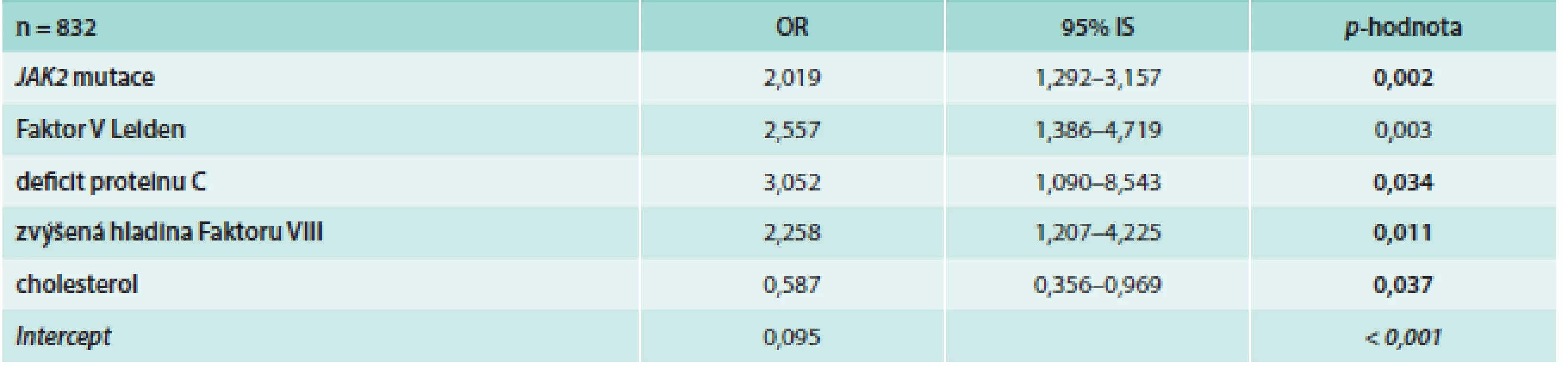
Léčebné odezvy se u sledovaných nemocných dosahuje co do poklesu počtu krevních destiček vcelku rychle (graf 5). Po 3 měsících léčby je dosahováno léčebné odezvy (pod 600 × 109/l) u 77 % pacientů a z toho kompletní odezvy – tedy poklesu počtu destiček u nemocných s vysokým rizikem < 400 × 109/l, jak je dáno doporučením CZEMP, u 35,3 % pacientů. Po jednom roce terapie se dosahuje léčebné odezvy u 87,5 % nemocných, z toho kompletní u 49 % nemocných s rizikem.
Graf 5. Počet trombocytů v čase (n = 1 325) 
Antitrombotická, resp. protidestičková léčba byla u pacientů, kteří v době sledování prodělali arteriální trombózu, podávána před vznikem 84 z celkového počtu 139, resp. 132 hodnotitelných příhod (63,6 %), což nebylo statisticky významné ve srovnání s podáváním protidestičkové léčby u pacientů, kteří tuto příhodu na antiagregační léčbě neprodělali. Po proběhlé události již statistickou významnost ve prospěch léčených pacientů hodnocení již však, jak se dalo očekávat, získalo. U nemocných na protidestičkové léčbě, kteří prodělali 23 příhod žilní trombózy, nejsou tyto rozdíly statisticky významné ani před vznikem této události ani po prodělané žilní trombóze (tab. 6).
Tab. 6. Vliv rizikových parametrů na vznik trombotických událostí (N = 1 325) 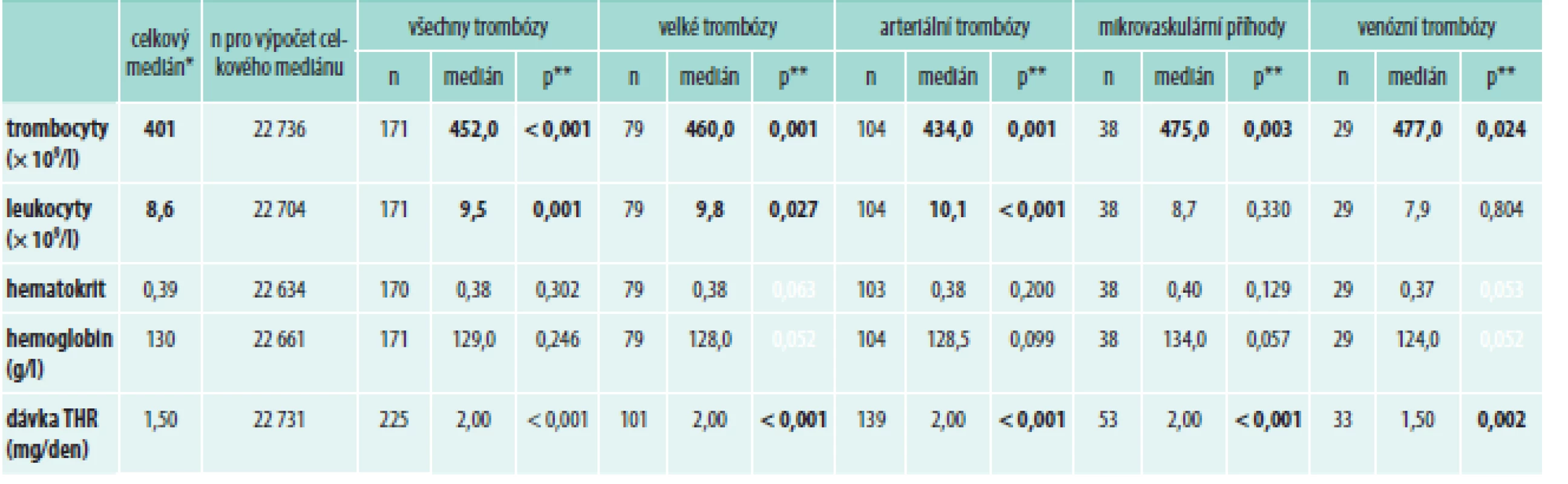
* medián vypočítaný ze všech záznamů bez výskytu komplikace během léčby přípravkem Thromboreductin ** p-hodnota Wilcoxonova testu THR – Thromboreductin® Diskuse
Podrobná diagnostika onemocnění má značnou důležitost pro jeho adekvátní léčbu. Zatímco u nemocných asymptomatických a bez vyjádřené hrozby vzniku klinické symptomatologie je běžné použití metody pozorování a vyčkávání, pak u symptomatických nemocných nebo nemocných rizikových, je indikována cytoredukční léčba. K ní se používá řada různých prostředků, jejichž podávání není zcela bez rizika, je proto nutné jejich uvážlivé použití.
Za velmi významné je třeba považovat posouzení hrozby vzniku klinických příznaků a komplikací, a to především na základě posouzení rizikového profilu nemocných.
Vedle pozitivní anamnézy výskytu trombózy je jedním z velmi důležitých rizikových ukazatelů a koneckonců i kritériem diagnózy průkaz JAK2 mutace. Významná je ale pochopitelně ale i sama hodnota zvýšených počtů krevních elementů, které mohou hrát významnou roli při vzniku jak trombózy, tak – při extrémním zvýšení krevních destiček spíše paradoxně – ke vzniku krvácení. Někdy se symptomy těchto dvou protilehlých projevů kombinují.
Jako dispoziční faktory k trombóze jsou z laboratorních ukazatelů nejčastěji zjišťovány JAK2 mutace, FVL, defekt proteinu C a zvýšení koncentrace faktoru VIII plazmatického systému krevního srážení. Významným faktorem je i přítomnost antifosfolipidových protilátek. Jak bylo poukázáno, v našich výsledcích se také potvrzuje, že v souvislosti nejspíše s tvorbou leukocytárně-trombocytárních agregátů, může být i leukocytóza rizikovým faktorem. Jak vysoká se leukocytóza jako rizikový faktor uplatní, je studováno [9]. Podobně i změny červených parametrů – vlivem na reologické vlastnosti krve a její proudění – mohou vznik trombózy také ovlivnit.
Problémem poruchy krevního srážení a vznikem klinické symptomatologie se u nemocných s Ph-negativními myeloproliferacemi zabýváme opakovaně [26–29]. V jedné z prvních analýz Registru [27] jsme publikovali význam přítomnosti JAK2 mutace z hlediska trombofilní dispozice a potvrdili jsme i v našem souboru, co se objevovalo v literatuře [5]. Již tehdy byly velmi široce ve světovém písemnictví diskutovány aspekty protrombotických faktorů, ale nebyly jasně pojmenovány žádné další klinicky relevantní dispozice k trombóze než obecně přijímané nespecifické faktory – vyšší věk, obezita, hypertenze, kouření, a to především v souvislosti s tepennou trombózou. Nakonec ale Finazzi a Barbui [7] doporučují v roce 2005 terapii stratifikovanou dle rizika trombózy se zaměřením na využití cytoredukční léčby u nemocných pouze s vysokým rizikem. K cytoredukci doporučují hydroxyureu. Leukemogennímu či kancerogennímu účinku [8,14] ani u mladších nemocných pozornost nevěnují.
Prognostické faktory analyzoval také Passamonti et al [25] a ve své práci z roku 2008 při vyšetření souboru 605 nemocných s přepočtem na 4 596 pacientoroků za nejvýznamnější rizikový faktor pro vznik trombózy udává vyšší věk (nad 60 let) a anamnestický údaj o již prodělané trombóze.
Definici trombotického rizika poskytuje i Vianello et al [44] a těžiště problému nachází v interakci trombocytů, leukocytů, endotelia, selektinů, NO a konstatuje, že leukocytóza a nález JAK2 mutace budou mít z hlediska léčby v předcházení tromboembolickým komplikacím klíčový význam.
Reilly [35] poskytuje přehled cytoredukční léčby u nemocných ET v 9 evropských zemích a konstatuje, že její indikací je prevence vzniku především tromboembolických či trombohemoragických příhod. Rizikové faktory sice zmiňuje ale bez návrhu dalších navazujících opatření.
Dá se tedy konstatovat, že většina prací se zabývá spíše indikací léčby z obecných principů, i když je právě tromboembolická symptomatologie vždy zmiňována. Barbui v roce 2012 [3] zaměřuje svoji pozornost na tento fenomén a podrobuje hodnocení rizikové faktory trombózy, za něž je považován věk nad 60 let a výskyt trombózy v anamnéze a zmiňuje kontroverzní roli diabetu, hypertenze, kouření a snad i JAK2 mutace v literatuře. Vyslovuje přitom domněnku, že relativní hodnocení rizika postrádá svou možnost posuzovat individuální riziko hrozby trombózy a že k ní je třeba mnohočetné analýzy. Skupina v návaznosti na předchozí doporučení Barbuiho [1] vyvinula diskriminativní Mezinárodní prognostické skóre (International Prognostic Score – IPS) k odhadu rizika trombózy analýzou 891 striktně dle WHO diagnostikovaných ET a autor je nazval IPSET-thrombosis. Jedná se zde o multivariační Cox regresní analýzu, v níž hodnotí 4 prvky: věk, trombózu v anamnéze, kardiovaskulární riziko a přítomnost JAK2 mutace. Riziko rozděluje na 3 stupně – nízké (0–1), střední (2) a vysoké (3), které přinášejí signifikantně rozdílné výsledky ve výskytu trombózy. Je doporučeno tento systém využívat v rutinní praxi.
Sami tento přístup velmi vítáme, protože se daným směrem léta zbýváme posuzováním významu trombofilních dispozic a můžeme říci, že oprávněnost cesty potvrzují i výsledky našich analýz. Lze konstatovat, že se po praktické stránce jedná o skutečně rozhodující položky, které jsme právě z hlediska „kardiovaskulárního“, včetně trombofilního, rizika individuálně rozebrali a používáme k nastavení léčebných režimů, i když nebyly shrnuty do skórovacího systému, jak je jednoduše, a tím i velmi efektivně využil Barbui. Nicméně význam jednotlivých položek z našeho spektra analyzovaných prvků má ambice a schopnost individualizovat riziko tromboembolických příhod v konkrétních případech.
Pro to, že se jedná o racionální přístup a patřičné nastavení komplexní péče o nemocné, svědčí v našem souboru 1,7násobný pokles arteriální trombózy, více než 1,5násobný pokles mikrovaskulární trombózy a dokonce 6,2násobný pokles příhod žilního tromboembolizmu po převzetí nemocných do péče, které jsou již dlouhodobým trendem [27–30]. Krvácení je ve sledovaném souboru zaznamenáno u asi o polovinu vyššího počtu pacientů v porovnání s údaji před zařazením do sledování se střádáním dat (graf 6). Tento výsledek lze však pokládat rovněž spíše za příznivý údaj, vezmeme-li v úvahu, že se jedná o systematičtější podchycení všech krvácivých komplikací včetně těch skrytých, tedy také podchycení jakéhokoli krvácení, ve srovnání s obdobím předcházejícím zařazení nemocných do sledování, aniž by se v jakémkoliv případě jednalo o závažně krvácení.
Graf 6. Relativní incidence událostí před zahájením léčby a při léčbě přípravkem Thromboreductin (n = 1 325) 
THR – Thromboreductin® Léčba je tedy nastavována dle odpovídajících doporučení CZEMP [30,38] schválených Českou hematologickou společnosti.
Analýza, kterou jsme zpracovali, poskytuje v našem souboru doporučení k léčbě těch nemocných, kteří jsou z hlediska výskytu dispozic k trombóze významně ohrožení. Jestliže se prokáže některý z rizikových faktorů, je třeba nemocným snížit riziko vzniku trombotické komplikace zajištěním komplexní léčby. Ta potom sestává jak z cytoredukčních opatření, tak i léčby antitrombotické – v souladu s doporučeními CZEMP [30,38]. K ní je teoretickou indikací každá trombofilní dispozice. I když se daří velmi příznivě ovlivňovat trombotickou symptomatologii onemocnění, zůstávají stále rezervy zejména u nemocných, u nichž se požadované odezvy nedosahuje.
Cytoredukční léčba má vést u nemocných s trombofilním či kardiovaskulárním rizikem ke snížení počtu destiček do mezí odpovídajících kompletní léčebné odezvě (dle doporučených postupů CZEMP [30,31,38]) k hodnotám nepřesahujícím počet destiček 400 × 109/l, zároveň se snahou komplexní péče o eliminaci rizikových faktorů, které lze odstranit – kouření, obezita, hypertenze a podávání specifických léků k dosažení zmíněného efektu. Souběžně se také podávají antiagregancia – v zátěžových situacích nebo vyžaduje-li to celkový stav nemocného, i dlouhodobě. Naopak u nemocných, jimž nejsou zmíněné léky indikovány, je nepodáváme. U nemocných bez trombofilního či kardiovaskulárního rizika se lze spokojit s tzv. parciální odezvou, tedy s korekcí počtu krevních destiček pod 600 × 109/l.
U nemocných s leukocytózou se nabízí možnost podávat léky, které ji snižují, což je např. v celulární fázi primární či sekundární myelofibrózy, kde je součástí nebo základním lékem onemocnění hydroxyurea, a u polycythemia vera, u níž je řešením podávání léku s antiproliferativním účinkem – interferonu alfa. Léčebné možnosti lze ale pochopitelně i kombinovat, což je výhodné především z hlediska možnosti použití nižších dávek léků.
V případě dominantního zvýšení červených krevních elementů je výhodné a v současné době opět ve středu zájmu použití zmíněného interferonu alfa nejlépe v pegylované a lépe snášené formě, a doplňkem i podávání antiagregační léčby, která vede, jak ukázaly některé studie (ECLAP [19]), k významnému snížení rizika trombotické diatézy.
Během rozboru údajů o léčbě je zjišťován rozpor mezi určením rizika nemocného a dosahováním léčebné odezvy, která mnohdy riziku neodpovídá nebo je nereflektuje. Proč není léčba upravována v případech, v nichž se nedosahuje požadované odezvy, je dáno řadou faktorů. Důvodem nedosažení odezvy nebo odezvy mohou být vedlejší účinky (13,1 % sledovaných), nedostatečná odezva i při použití nejvyšší povolené dávky (v našem souboru celkem 20 případů – 1,5 %). Může jím být i dočasné přerušení terapie, či nedostatečné využití možností léčby a snahy dosáhnout požadované úrovně léčebné odezvy. Nicméně setrvání nemocných na léčbě je v našem souboru značně vysoké a dosahuje i po 6 letech dle diagnózy vysokého procenta (72 měsíců 71,8 % nemocných).
Všechny důvody nedostatečné léčebné odezvy jsou pochopitelně analyzovány, aby bylo učiněno vše pro dosažení léčebného efektu i s hledáním řešení, které vyplývá z možnosti velmi detailního individuálního posouzení každého případu [43].
Shrneme-li po praktické stránce úsilí dané systematickým uplatňováním diagnostických a terapeutických doporučených postupů CZEMP, pak jeho výsledkem vycházejícím z údajů Registru je, jak bylo shora uvedeno, 1,8násobný pokles arteriální trombózy, více než 1,5násobný pokles mikrovaskulární trombózy a dokonce 6,2násobný pokles příhod žilního tromboembolizmu.
prof. MUDr. Miroslav Penka, CSc.
m.penka@fnbrno.cz
Oddělení klinické hematologie FN Brno
www.fnbrno.cz
Doručeno do redakce 1. 9. 2014
Přijato po recenzi 17. 9. 2014
Zdroje
1. Barbui T, Barosi G, Grossi A et al. Practice guidelines for the therapy of essential thrombocythemia. A statement from the Italian Society of Hematology, the Italian Society of Experimental Hematology and Italian Group for Bone Marrow Transplantation. Haematologica 2004; 89(2): 215–232.
2. Barbui T, Thiele J, Passamonti F et al Survival and disease progression in essential thrombocythemia are significantly influenced by accurate morphologic diagnosis: an international study. J Clin Oncol 2011; 29(23): 3179–3184.
3. Barbui T. Development of a new multiple variables model to predict thrombosis in Essential Thrombocythemia. ESH International Conference on Myeloproliferative Neoplasma Vienna, Austria, October 4–6, 2012.
4. Brière JB. Essential thrombocythemia. Orphanet J Rare Dis 2007; 2 : 3. Dostupné z WWW: <http://www.ojrd.com/content/2/1/3>.
5. Cortelazzo S, Finazzi G, Ruggeri M et al. Hydoxyurea for patients with Essential Thrombocythemia and a high risk of thrombosis. N Engl J Med 1995; 332(17): 1132–1136.
6. Elliott MA, Tefferi A. Interferon-alfa therapy in Polycythemia Vera and essential Thrombocythemia. Semin Thromb Hemost 1997; 23(5): 463–472.
7. Finazzi G, Barbui T. Risk-adapted therapy in essential trombocythemia and polycythemia vera. Blood Rev 2005; 19(5): 243–252.
8. Fruchtman SM, Petitt RM, Gilbert HS et al. Anagrelide Study Group: Anagrelide: analysis of long-term efficacy, safety and leukemogenic potential in myeloproliferative disorders. Leuk Res 2005; 29(5): 481–491.
9. Gangat N, Wolanskyj AP, Schwager SM et al. Leukocytosis at Diagnosis and the Risk of Subsequent Thrombosis in Patients With Low-Risk Essential Thrombocythemia an Polycythemia Vera. Cancer 2009; 115(24): 5740–5745.
10. Gisslinger H, Gotic M, Holowiecki J et al. ANAHYDRET Study Group. Anagrelide compared with hydroxyurea in WHO-classified essential thrombocythemia: the ANAHYDRET Study, a randomized controlled trial. Blood 2013; 121(10): 1720–1728.
11. Hoffman R, Prchal JT, Samuelson S et al. Philadelphia chromosome-negative myeloproliferative disorders: biology and treatment. Biol Blood Marrow Transplant 2007; 13(1 Suppl 1): S64-S72.
12. Jaffe ES, Harris NL, Stein H et al. World health organization classification of tumours. Pathology and genetics of tumours of haematopoietic and lymphoid tissues. IARC Press: Lyon 2001.
13. Kaushansky K. The chronic myeloproliferative disorders and mutation of JAK2: Damesek´s 54 year old speculation comes of age. Best Pract Res Clin Haematol 2007; 20(1): 5–12.
14. Kissová J, Ovesná P, Penka M et al. Second malignancies in philadelphia-negative myeloproliferative neoplasms-single-center experience. Anticancer Res 2014; 34(5): 2489–2496.
15. Klampfl T, Gisslinger H, Harutyunyan AS et al. Somatic mutations of calreticulin in myeloproliferative neoplasms. N Engl J Med 2013; 369(25): 2379–2390.
16. Kralovics R, Passamonti F, Buser AS et al. A Gain-of-Function Mutation of JAK2 in Myeloproliferative Disorders. N Engl J Med 2005; 352(17): 1779–1790.
17. Kralovics R, Skoda RC. Molecular pathogenesis of Philadelphia chromosome negative myeloproliferative disorders. Blood Rev 2005; 19(1): 1–13.
18. Landolfi R, Rocca B, Patrono C Bleeding and thrombosis in myeloproliferative disorders: mechanism and treatment. Crit Rev Oncol Hematol 1995; 20(3): 203–222.
19. Landolfi R, Marchioli R, Kutti J et al. Efficacy and safety of low-dose aspirin in polycythemia vera. N Engl J Med 2004; 350(2): 114–124.
20. Michiels JJ, Kutti J, Stark P et al. Diagnosis, pathogenesis and treatment of the myeloproliferative disorders essential thrombocythemia, polycythemia vera and essential megakaryocytic granulocytic metaplasia and myelofibrosis. Neth J Med 1999; 54(2): 46–62.
21. Michiels JJ, Barbui T, Finazzi G et al. Diagnosis and treatment of Polycythemia Vera and possible future study designs of the PVSG. Leuk Lymphoma 2000; 36(3–4): 239–253.
22. Michiels JJ, Thiele J Clinical and pathological criteria for the diagnosis of essential thrombocythemia, polycythemia vera and idiopathic myelofibrosis (agnogenic myeloid metaplasia). Int J Hematol 2002; 76(2): 133–145.
23. Michiels JJ, DeRaeve H, Hebeda K et al. WHO bone marrow features and European clinical, molecular, and pathological (ECMP) criteria for the diagnosis of myeloproliferative disorders. Leukemia Res 2007; 31(8): 1031–1038.
24. Murphy S, Peterson P, Iland H et al. Experience of the Polycythemia Vera Study Group with essential thrombocythemia: a final report on diagnostic criteria, survival, and leukemic transition by treatment. Semin Hematol 1997; 34(1): 29–39.
25. Passamonti F, Rumi E, Arcaini L et al. Prognostic factors for thrombosis, myelofibrosis, and leukemia in essential thrombocythemia: a study of 605 patients. Haematologica 2008; 93(11): 1645–1651.
26. Penka M, Schwarz J, Pytlík R et al. Doporuèený postup diagnostiky a terapie esenciální trombocytemie a trombocytemie provázející jiné myeloproliferativní choroby. Vnitř Lék 2005; 51(6): 741–751.
27. Penka M, Schwarz J, Pavlík T et al. Esenciální trombocytemie a další myeloproliferace s trombocytemií v údajích registru pacientů léčených Thromboreductinem® do konce roku 2007. Vnitř Lék 2008; 54(6): 775–782.
28. Penka M, Schwarz J, Pavlík T et al. Výsledky léčby nemocných s esenciální trombocytemií a dalšími myeloproliferacemi provázenými trombocytemií – zpráva z registru pacientů léčených Thromboreductinem. Vnitř Lék 2009; 55(11): 1–12.
29. Penka M, Schwarz J, Ovesná P et al. Esenciální trombocytemie a jiné myeloproliferace s trombocytemií léčené Thromboreductinem. Výstupy z databáze Registru k prvnímu čtvrtletí roku 2010. Vnitř Lék 2010; 56(6): 503–512.
30. Penka M, Schwarz J, Ovesná P et al. kolektiv České pracovní skupiny pro myeloproliferativní choroby (CZEMP): Účinnost léčby anagrelidem u nemocných s Ph-negativními myeloproliferativními chorobami: ovlivnění výskytu trombózy ve výstupech Registru pacientů s diagnózou esenciální trombocytemie a trombocytemie provázející jiné myeloproliferativní onemocnění léčených Thromboreductinem® ke konci roku 2012. Vnitř Lék 2013; 59(6): 516–531.
31. Penka M, Schwarz J, Ovesná P et al. kolektiv České pracovní skupiny pro myeloproliferativní choroby (CZEMP) Shrnutí doporučení České pracovní skupiny pro Ph-negativní myeloproliferativní onemocnění (CZEMP) České hematologické společnosti ČLS JEP pro diagnózu a terapii BCR/AB“ – negativních myeloproliferací. Vnitř Lék 2012; 58(2): 163–168.
32. Petrides PE. Anagrelid: decade of clinical experiences with its use for the treatment of primary thrombocythaemia. Expert Opin Pharmacother 2004; 5(8): 1781–1798.
33. Puigdecanet E, Spinet B, Villa O et al. Detection of abnormalities of PRV-1, TPO, and c-MPL genes detected by fluorescence in situ hybridization in essencial thrombocythemia. Cancer Genet Cytogenet 2006; 167(1): 39–42.
34. Rumi E, Pietra D, Ferretti V et al. Associazione Italiana per la Ricerca sul Cancro Italiano Malattie Myeloproliferative investigators. JAK2 or CALR mutation status defines subtypes of essential thrombocythemia with substantially different clinical course and outcomes. Blood 2014; 123(10): 1544–1551.
35. Reilly JT. Current treatment practices for essential thrombocythemia: survey results from European hematologist/oncologists. Hematology 2012; 17(4): 187–192.
36. Schwarz J, Hrachovinova I, Vorlova Z et al. Thromboembolism in thrombocythemia patients with an additional thrombophilic state. Hematol J 2004; 5(Suppl 2): S321. Abstract 974.
37. Schwarz J, Penka M, Doubek M et al. JAK2 mutation and an additional thrombophilic state are major prothrombotic risk factors in myeloproliferations with thrombocythemia – data from a registry of anagrelide-treated patients. 13th Congress of the European Hematology Association, Kopenhagen, Denmark, June 12–15, 2008. Haematologica – Hematol J 2008; 93(Suppl 1). Abstract 0144.
38. Schwarz J, Penka M, Campr V et al. Diagnostika a léčba bcr/abl-negativních myeloproliferativních onemocnění – principy a východiska CZEMP. Vnitř Lék 2011; 57(2): 189–213.
39. Silverstein MN, Tefferi A. Treatment of Essential Thrombocythemia with anagrelid. Semin Hematol 1999; 36(1 Suppl 2): S23-S25.
40. Steurer M, Gastl G, Jedrzejczak W et al. Anagrelide for Thrombocytosis in myeloproliferative disorders: a prospective study to assess efficacy and adverse event profile. Cancer 2004; 101(10): 2239–2246.
41. Thiele J, Kvasnicka HM, Vardiman J. Bone marrow histopathology in the diagnosis of chronic myeloproliferative disorders: a forgotten pearl. Best Pract Res Clin Haematol 2006; 19(3): 413–437.
42. Tefferi A, Thiele J, Orazi A et al. Proposals and rationale for revision of the World Health Organization diagnostic criteria for polycythemia vera, essential thrombocythemia, and primary myelofibrosis: recommendations from an ad hoc international expert panel. Blood 2007; 110(4): 1092–1097.
43. Tsimberidou MA, Colburn DE, Welch MA et al. Anagrelide and imatinib mesylate combination therapy in patients with chronic myeloproliferative disorders. Cancer Chemother Pharmacol 2003; 52(3): 229–234.
44. Vianello F, Battisti A, Cerlla G et al. Defining the Thrombotic Risk in Patients with Myeloproliferatove Neoplams. Scientific World Journal 2011; 11 : 1131–1137.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2014 Číslo Suppl 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Co dělat při intoleranci statinů?
-
Všetky články tohto čísla
- Dispenzarizace nemocných po léčbě karcinomu prsu, kolorekta a prostaty
- Diferenciální diagnostika eozinofilie
- Vývoj a současná funkčnost informační základny české onkologické péče
- Moje setkávání s profesorem MUDr. Jiřím Vorlíčkem, CSc.
- O bolesti trochu jinak
- Nové antibiotiká: potrebujeme nové molekuly, alebo nové stratégie?
- Geriatrický nemocný v onkologii
- Nové náhledy na roli lidského papilomaviru v léčbě nádorů hlavy a krku
- Ph-negativní myeloproliferativní onemocnění s trombocytemií ve světle účinku léčby přípravkem Thromboreductin® v datech registru ke konci roku 2013
- Diabetes mellitus a zhoubné nádory
- Paliativní medicína a dobrá smrt
- Testikulární zhoubné nádory – jsme snad u konce cesty?
- Klinické hodnocení nových léčiv u vzácných diagnóz v onkologii – současná situace v Evropě a u nás
- Paliativní péče a chronické srdeční selhání
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Diferenciální diagnostika eozinofilie
- Paliativní medicína a dobrá smrt
- Dispenzarizace nemocných po léčbě karcinomu prsu, kolorekta a prostaty
- Ph-negativní myeloproliferativní onemocnění s trombocytemií ve světle účinku léčby přípravkem Thromboreductin® v datech registru ke konci roku 2013
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



