-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Dyspeptický syndrom při antidiabetické léčbě
Dyspeptic syndrome associated with antidiabetic therapy
Dyspeptic syndrome is a common complication of treatment with antidiabetic drugs. This may be a trivial as well as a very serious complication. Nauzea, vomiting, diarrhoea, abdominal pain, loss of appetite and taste disturbances are the most common symptoms of dyspeptic problems in patients treated with metformin. They rarely are a reason for treatment discontinuation. Dyspeptic syndrome is a common complication in patients treated with acarbose, this may be prevented by reduced intake of sucrose. Pneumatosis cystoides intestinalis is a rare complication in acarbose-treated patients. Antiobesity agent orlistat is frequently associated with dyspeptic symptoms, particularly if fat intake is not reduced. Treatment with drugs affecting the incretin system (dipeptidyl peptidase-4 inhibitors and glucagon-like peptide-1 receptor agonists) is very rarely complicated by acute pancreatitis. Glucagon-like peptide-1 receptor agonists may cause dyspeptic symptoms (nausea, vomiting, diarrhoea) at the beginning of treatment. These complaints usually cease and the treatment usually does not need to be discontinued.
Key words:
metformin – acarbose – orlistat – incretin treatment – upper dyspeptic syndrome – lower dyspeptic syndrome – pancreatitis – pneumatosis cystoides intestinalis
Autoři: A. Šmahelová
Působiště autorů: Diabetologické centrum Kliniky gerontologické a metabolické Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Luboš Sobotka, CSc.
Vyšlo v časopise: Vnitř Lék 2011; 57(4): 391-395
Kategorie: 12. celostátní diabetologické sympozium „Diabetes a gastroenterologie“, Hradec Králové, 4.–5. června 2010
Souhrn
Dyspeptický syndrom je běžnou komplikací léčby antidiabetiky. Může jít o komplikace banální i velmi závažné. K nejčastějším projevům dyspeptických potíží u léčby metforminem patří nevolnost, zvracení, průjem, bolesti břicha, ztráta chuti k jídlu, změny chuti. Jen zřídka jsou důvodem k přerušení léčby. Dyspeptický syndrom je běžnou komplikací léčby akarbózou, prevencí je nižší příjem sacharózy. Vzácnou komplikací léčby akarbózou je tzv. pneumatosis cystoides intestinalis. Antiobezitikum orlistat vede často k dyspeptickým obtížím, zejména pokud není snížen příjem tuku. Velmi vzácnou komplikací terapie léky ovlivňujícími inkretinový systém (inhibitory dipeptidylpeptidázy 4 a agonisté receptoru pro glukagon like peptid 1) je akutní pankreatitida. Agonisté receptoru pro glukagon like peptid 1 mohou na počátku léčby vyvolávat dyspeptické potíže (nauzea, zvracení, průjem). Většinou potíže odezní a spíše ojediněle je nutno léčbu ukončit.
Klíčová slova:
metformin – akarbóza – orlistat – inkretinová léčba – horní dyspeptický syndrom – dolní dyspeptický syndrom – pankreatitis – pneumatosis cystoides intestinalisÚvod
Dyspeptický syndrom je souhrnné označení souboru různorodých trávicích potíží, které jsou většinou projevem chorob trávicího traktu, vyskytují se však i jako průvodní jev při onemocnění jiných orgánů. Rozlišuje se dyspeptický syndrom horního typu a dolního typu. Horní typ se projevuje bolestí nebo dyskomfortem (pocit tlaku, plnosti, předčasné sytosti, říhání, nechutenství, odpor k jídlu, zvracení, nauzea, pálení žáhy, kyselá regurgitace) v horní polovině břicha. U dolního typu dominují bolesti v břiše nejspíše spastického rázu, obvykle související s pasáží tráveniny (pocit plnosti nebo nadmutí s nadměrnou flatulencí nebo bez ní, škroukání, sklon k průjmu/zácpě/střídavé stolici, změny v kvalitě a vzhledu stolice).
Dyspeptické potíže jsou jako nevýhoda, prokázaná na základě poznatků medicíny založené na důkazech, uvedeny v přehledu antidiabetik, používaných v léčbě diabetu 2. typu, u metforminu, inhibitorů α-glukosidáz a agonistů hormonu GLP 1 [1].
Dyspeptický syndrom a klasická antidiabetika
Metformin je lékem první volby a dnes je doporučován k zařazení do léčby ihned při zjištění diagnózy diabetu 2. typu. Podle doporučení Americké diabetologické asociace [2] je vhodný i u prediabetu, který představuje významně zvýšené riziko kardiovaskulárních komplikací. Metformin by tedy měl být použit i u osob s prediabetem, u nichž je přítomen ještě alespoň jeden další rizikový faktor aterosklerózy (věk mladší než 60 let, BMI 35 kg/m2 a více, diabetes u prvostupňových příbuzných, zvýšené triglyceridy, snížený HDL-cholesterol, arteriální hypertenze, glykovaný hemoglobin – HbA1c vyšší než 6,0 % DCCT (4,3 % IFCC)). S ohledem na další postupně prokazované příznivé efekty metforminu [3] (např. antionkogenní efekt a vliv na imunitu) je jasné, že metformin má široké využití. U některých pacientů se mohou vyskytnout, zejména na počátku léčby, dyspeptické potíže. Účinně jim lze předcházet nižší terapeutickou dávkou na začátku léčby (500 mg 1–2krát denně, s důrazným upozorněním na těsnou vazbu na jídlo – po snídani a po večeři), případně 850 mg v jedné tabletě, nejlépe těsně po večeři. Po 5 až 7 dnech je vhodné dávku zvýšit na 850 mg nebo 1 000 mg 2krát denně a dále na potřebnou terapeutickou dávku. K nejčastějším projevům dyspeptických potíží patří nevolnost, zvracení, průjem, bolesti břicha, ztráta chuti k jídlu, změny chuti. Dyspeptické potíže mohou limitovat definitivní dávku, většinou však spontánně odezní. Mohou být mírnější při medikaci metforminem XR s postupným uvolňováním účinné látky, někteří pacienti využívají i formy prášku.
Akarbóza patří k inhibitorům α-glukosidáz. Tyto léky snižují postprandiální hyperglykemii zpomalením absorpce glukózy v zažívacím traktu, přičemž neovlivňují utilizaci glukózy ani sekreci inzulinu. Nevýhodou jsou časté vedlejší účinky – průjem, bolesti břicha, nauzea. Může se objevit ale i zvracení a ileózní stav. Z hlediska možných vedlejších účinků v trávicím traktu je akarbóza kontraindikována u pacientů s nespecifickými střevními záněty a gastroparézou [4]. Vzácnou komplikací je pneumatosis cystoides intestinalis. Tento stav je charakterizován mnohočetnými cystami s plynovým obsahem ve střevní stěně, submukóze nebo subserózní vrstvě stěny střeva. Jestliže jde o nález v tlustém střevě, označuje se termínem pneumatosis cystoides coli (synonymum pro pneumatosis cystoides intestinalis v tenkém střevě). Tento nález sekundárně provází řadu gastrointestinálních poruch i onemocnění jiných orgánů, může být ale i vzácnou komplikací léčby inhibitory α-glukosidáz.
V literatuře bylo popsáno několik případů této vzácné komplikace při léčbě inhibitory α-glukosidáz, a to po akarbóze (tab. 1) i voglibóze, která se u nás nepoužívá.
Tab. 1. Kazuistiky pneumocystis cystodies intestinalis (PCI) spojené s léčbou akarbózou. Podle [6]. ![Kazuistiky pneumocystis cystodies intestinalis (PCI) spojené s léčbou akarbózou. Podle [6].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/8539eac97ba82690dcf1c653f29c9e9d.jpg)
V roce 2009 byl například popsán případ 65leté ženy, u které byla provedena hemikolektomie po 12 letech léčby akarbózou v denní dávce 150 mg. 3 měsíce před přijetím do nemocnice si stěžovala na bolest v levé polovině břicha. Byla diagnostikována polyposis coli a divertikulóza. Při koloskopickém a tomografickém vyšetření byla v ascendentní části tlustého střeva zjištěna pneumatosis cystoides, v sigmoideu divertikulóza. Při histologickém vyšetření byl popsán vzorek střevní mukózy. Akarbóza byla vysazena a při kontrolní koloskopii po 3 měsících nebyly žádné polypózní útvary nalezeny. Pneumatosis cystoides může být zdrojem diagnostických rozpaků a měli bychom na ni pomýšlet hlavně u pacientů s mnohočetnými střevními polypózními lézemi, zejména u diabetiků s autonomní neuropatií, projevující se zpomalením střevní motility, kteří užívají akarbózu nebo kortikoidy [5].
V roce 2008 byl popsán případ 69letého muže, u kterého byla v roce 2004 diagnostikována myasthenia gravis a užíval kortikoidy. Od roku 2005 byl léčen na diabetes sulfonylureovým antidiabetikem, o rok později byla do medikace přidána akarbóza a v roce 2007 došlo k diagnostice pneumatosis cystoides intestinalis [6].
Tablety akarbózy se mají polykat těsně před jídlem vcelku a zapíjet malým množstvím tekutiny. Účinnou prevencí dyspeptických potíží může být i rozžvýkání tablety s prvními sousty jídla. Frekvenci a závažnost dyspeptických projevů zvyšuje nedodržování dietních omezení a také současná medikace neomycinu. Při léčbě akarbózou je nutné upravit příjem sacharózy, protože zvýšená fermentace cukrů v tlustém střevě způsobuje často střevní dyskomfort nebo průjem.
Orlistat
Lipáza štěpí triglyceridy na monoglyceridy a volné mastné kyseliny. Monoglyceridy a volné mastné kyseliny se slučují se žlučovými kyselinami a vytvářejí micely, které procházejí do střevního lumen. V enterocytech se znovu tvoří triglyceridy a ty jsou střevem vylučovány. Orlistat je látka, kterou lze označit jako inhibitor vstřebávání živin, v tomto případě tuku. Tato látka se využívá při snižování nadváhy u obézních diabetiků 2. typu a lze ji kombinovat se všemi dnes dostupnými antidiabetiky s výjimkou akarbózy. Léčba orlistatem bývá často provázena nepříjemnými vedlejšími gastrointestinálními účinky. V randomizované studii XENDOS s orlistatem byla většina gastrointestinálních potíží popsána jako mírná a provázela zejména 1. fázi léčby. Během 1. roku léčby se vyskytl alespoň jeden gastrointestinální příznak u 91 % pacientů léčených orlistatem vs 65 % u pacientů léčených placebem, během 4 let to bylo 36 % vs 23 % pacientů. Podobně tomu bylo i u závažných gastrointestinálních příhod (32,2 % s orlistatem vs 32,2 % s placebem) [7].
V randomizované studii s orlistatem, provedené u 539 obézních dětí a mladistvých ve věku 12–16 let (BMI 35,6 kg/m2), byly gastrointestinální účinky mírné a léčba musela být přerušena u pouhých 2 % pacientů, cholelitiáza s cholecystektomií vedla k přerušení léčby orlistatem u 3 % obézních pacientů[8].
V klinické praxi si pacienti stěžují na průjem, olejnatou stolici, flatulenci, meteorizmus, ale i bolesti břicha a další projevy dyspepsie. Pravděpodobnost výskytu těchto obtíží stoupá u diety s vysokým obsahem tuku (větší než 30% podíl tuku, např. 67 g tuku v dietě s energetickým obsahem 2 000 kcal/den). Velmi účinnou prevencí dyspeptických projevů je snížení příjmu tuku v dietě.
Dyspeptický syndrom a léky ovlivňující inkretinový systém
V diabetologii je dnes používána nová skupina léků, ovlivňující inkretinový systém. Patří sem inhibitory dipeptidylpeptidázy 4 (DPP 4) – perorální gliptiny a injekční agonisté receptoru glukagon like peptidu – 1 (GLP 1) – exendiny (exenatid, lixisenatid) nebo analoga GLP-1 (liraglutid). Jsou vázány pouze na předpis diabetologa, případně internisty, a zatím je možno je využít pouze v kombinační léčbě [9]. Tyto nové léky mají podobný antihyperglykemický efekt jako dosavadní antidiabetika (snižují hodnotu HbA1c přibližně o 1–2 %), ale bez rizika hypoglykemie a s významným metabolickým efektem. To se týká především exenatidu a liraglutidu, ale i gliptinů. Inkretinová mimetika významně snižují hmotnost, gliptiny – sitagliptin, vildagliptin a saxagliptin – jsou váhově neutrální. Exenatid, liraglutid a vildagliptin rovněž prokazatelně snižují krevní tlak. Agonisté GLP 1 receptoru mají pravděpodobně i kardioprotektivní efekt, ovlivňují endoteliální dysfunkci, snižují vazokonstrikci a působí protektivně na myokard. Nová farmaka mají jasně vymezené indikace, kontraindikace i vedlejší účinky, k nimž patří i dyspeptické potíže a diskutované riziko pankreatitidy.
GLP 1 kromě glukózodependentního zvýšení sekrece inzulinu a snížení sekrece glukagonu zpomaluje vyprazdňování žaludku a sekreci žaludeční kyseliny, a tím zpomaluje absorpci živin z trávicího traktu [10–13].
Hlavním efektem je snížení hyperglykemie spojené s absorpcí potravy. Delší setrvání potravy v žaludku v důsledku zpomaleného vyprazdňování může navodit pocit sytosti, a tím snížit energetický příjem. GLP 1 receptory jsou přítomny i v oblastech mozkového kmene (area postrema, subfornikální orgán), které jsou považovány za klíčové v pocitu navození sytosti bez závislosti na přítomnosti potravy v žaludku. To je další možná příčina snížení energetického příjmu. Tyto efekty lze pozorovat i při léčbě agonisty GLP 1 receptoru.
Při léčbě exenatidem má část pacientů nauzeu, pocity plnosti, může se objevit i průjem. V klinických studiích jsou tyto potíže popisovány až v 50 % a byly nejčastějším důvodem přerušení léčby u 2–4,6 % pacientů (tab. 2) [14–16].
Tab. 2. Gastrointestinální poruchy při léčbě exenatidem v dlouhodobých kontrolovaných studiích fáze 3. Podle SPC Byetta. 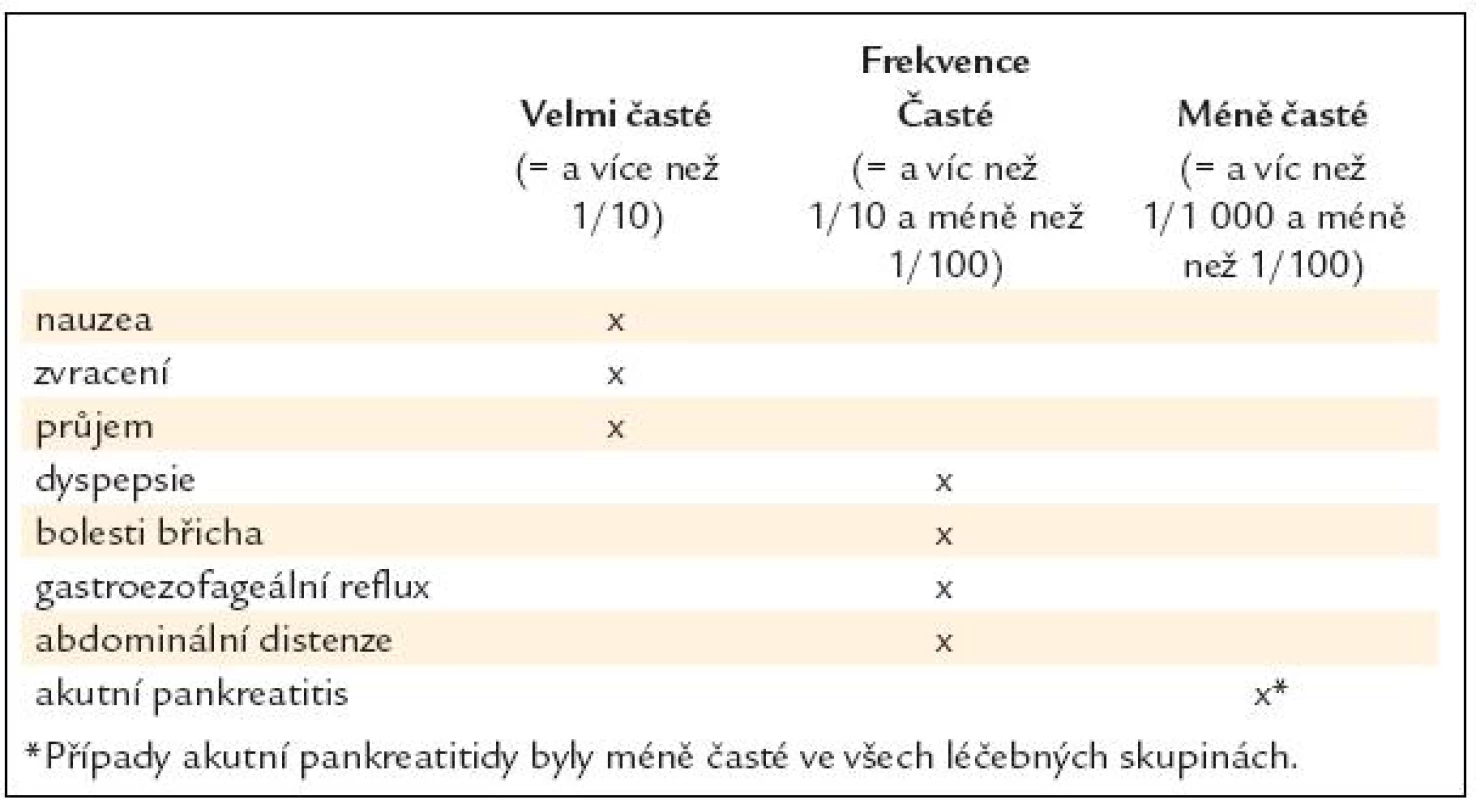
Postupně přibývají zkušenosti s exenatidem v klinické praxi a ukazuje se, že výskyt zmíněných dyspeptických účinků je při správné indikaci, a zejména při správném poučení pacientů, mnohem nižší. Důležitá je také správná titrace dávek a dodržení časového intervalu (tedy během 60 min před jídlem). U liraglutidu jsou nauzea a zvracení ještě méně časté (tab. 3) a objevují se jen krátce na začátku léčby [17,18]. I v klinických studiích, které nyní probíhají s dalším GLP 1 agonistou, lixisenatidem, je výskyt dyspeptických potíží (převažuje nauzea, případně zvracení nebo průjem) nízký a příznaky jsou mírné [19]. Důležité je, že hmotnostní úbytek není u exenatidu ani liraglutidu vázán na dyspeptické projevy [20].
Tab. 3. Výskyt nauzey při léčbě liraglutidem v klinickém programu LEAD [18]. ![Výskyt nauzey při léčbě liraglutidem v klinickém programu LEAD [18].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/abd5dbdbf9db6099266d8f2bd304472f.jpg)
U gliptinů se dyspeptické potíže prakticky nevyskytují. U vildagliptinu je např. v SPC uváděna pouze nevolnost, a to u dávky 100 mg v kombinaci s metforminem, a zácpa v případě dávky 50 mg v kombinaci se sulfonylureou [21].
Při léčbě inkretinovými léky byl také zaznamenán výskyt pankreatitid. Při úvahách o její patogenezi se uvažuje o idiosynkrazii, výsledky experimentů ale nejsou přesvědčivé (málo zvířat, krátký čas, není provedeno histologické vyšetření) [22]. U pacientů s diabetem 2. typu je vyšší výskyt faktorů (žlučové kameny, hypertriglyceridemie), které zvyšují riziko pankreatitidy. Metaanalýza z roku 2009 uvádí 2,83krát vyšší výskyt akutní pankreatitidy u diabetiků 2. typu než u nediabetiků [23]. Ani srovnání výskytu akutní pankreatitidy při různém typu antidiabetické léčby z let 2004–2008 neukázalo vyšší výskyt pankreatitidy u inkretinových léků (exenatid vs metformin s glibenclamidem a sitagliptin vs metformin s glibenclamidem) [24]. V metaanalýze z roku 2010, v které byly hodnoceny 2. a 3. fáze klinických studií s exenatidem, liraglutidem, albiglutidem, taspoglutidem a postmarketingová hlášení americkému FDA (Food and Drug Administration), je zaznamenáno 8 případů pankreatitid v souvislosti s léčbou exenatidem v klinických studiích a 36 případů z postmarketingového sledování, u liraglutidu 4 případy [25]. Podle informací pro léčbu exenatidem (Byetta) musí být pacienti informováni o charakteristických projevech akutní pankreatitidy, tedy vytrvalé a silné bolesti břicha. Při podpůrné léčbě bylo pozorováno odeznění známek pankreatitidy. Pokud vznikne podezření na pankreatitidu, léčba má být ukončena. Při anamnéze pankreatitidy nebo přítomnosti rizikových faktorů jejího vzniku není vhodné zahajovat léčbu exenatidem, ale ani dalšími inkretinovými léky.
Zpráva FDA z 25. 9. 2009 eviduje v postmarketingovém sledování výskyt 88 pankreatitid (z toho 2 hemoragické/nekrotizující) při léčbě sitaglitpinem [26]. SPC pro sitagliptin bylo doplněno o doporučení monitorovat pečlivě pacienty ohledně rozvoje pankreatitidy a případně včas přerušit léčbu. Riziko pankreatitidy u pacientů s pankreatitidou v anamnéze není známo, ale vždy je nutné pečlivé monitorování klinického stavu. Metaanalýza preklinických a 19 klinických studií (10 264 pacientů, léčených sitagliptinem až 2 roky) ukázala, že u pacientů léčených sitagliptinem, není riziko pankreatitidy vyšší (0,08 pankreatitidy na 100 pacientů se sitagliptinem za rok vs 0,10 případů na 100 pacientů neléčených sitagliptinem za rok) [27]. Dosud nevyřešenou otázkou je možný vývoj chronické pankreatitidy u diabetiků léčených látkami ovlivňujícími receptor pro GLP 1. Mechanizmus vzniku případné chronické pankreatitidy je nejasný. Uvažuje se o poruše mikroanatomie systému acinárních a duktálních buněk. Enzymy mohou vyvolat lokální zánět, více odumírají acinární buňky, cytokiny indukují chronickou duktální proliferaci a dochází k deformaci a obstrukci duktů pankreatu. Podle některých názorů by mohly inkretinové léky aktivovat regeneraci duktů [28], replikaci duktů (nejčastěji při mírné chronické pankreatitidě jako případném rizikovém faktoru adenokarcinomu pankreatu) [29,30]. U obézních osob a diabetiků 2. typu byla zjištěna zvýšená replikace pankreatických duktálních buněk [31]. Metformin může proliferaci buněk duktálních vývodů v pankreatu bránit [32].
Závěr
Výskyt dyspeptického syndromu jako nežádoucího účinku při antidiabetické léčbě je nízký. Gastrointestinální nežádoucí účinky se mohou vyskytnout při léčbě metforminem, akarbózou, orlistatem a inkretinovými léky.
Pankreatitis je jako komplikace léčby inkretinovými léky zaznamenána jen vzácně, její průběh je většinou mírný. U pacientů s diabetem 2. typu je výskyt pankreatitidy obecně vyšší a při léčbě analogy GLP 1 receptoru je srovnatelný. Pravděpodobnost vzniku pankreatitidy lze zmírnit současnou medikací metforminem. Další získané zkušenosti s inkretinovými léky tyto závěry v budoucnu ověří.
Při hodnocení dyspeptických potíží pacienta s diabetem je nutné počítat i s možnou alterací vnímání bolesti. Dyspeptickým potížím lze většinou předejít správnou volbou dávek léku s postupným titrováním dávek a správnou vazbou na jídlo.
doc. MUDr. Alena Šmahelová, Ph.D.
www.lfhk.cuni.cz
e-mail: smahelov@lfhk.cuni.czDoručeno do redakce: 21. 2. 2011
Zdroje
1. Schernthaner G, Barnett AH, Betteridge DJ et al. Is the ADA/EASD algorithm for the management of type 2 diabetes (January 2009) based on evidence or opinion? A critical analysis. Diabetologia 2010; 53 : 1258–1269.
2. Nathan DM, Davidson MB, DeFronzo RA et al. American Diabetes Association. Impaired fasting glucose and impaired glucose tolerance: implications for care. Diabetes Care 2007; 30 : 753–759.
3. Svačina Š. Postavení metforminu jako antidiabetika první olby. Vnitř Lék 2010; 56 : 1225–1227.
4. eMC. SPC Glucobay 50 mg tablets. http://www.medicines.org.uk/emc/medicine/19972/SPC/Glucobay+50mg+tablets/.
5. Vogel Y, Buchner NJ, Szpakowski M et al. Pneumatosis cystoides intestinalis of the ascending colon related to acarbose treatment: a case report. J Med Case Reports 2009; 3 : 9216.
6. Tsujimoto T, Shioyama E, Moriya K. Pneumatosis cystoides intestinalis following alpha-glucosidase inhibitor treatment: a case report and review of the literature. World J Gastroenterol 2008; 14 : 6087–6092.
7. Torgerson JS, Hauptman J, Boldrin MN et al. XENical in the prevention of diabetes in obese subjects (XENDOS) study: a randomized study of orlistat as an adjunct to lifestyle changes for the prevention of type 2 diabetes in obese patients. Diabetes Care 2004; 27 : 155–161.
8. Chanoine JP, Hampl S, Jensen C et al. Effect of orlistat on weight and body composition in obese adolescents: a randomized controlled trial. JAMA 2005; 293 : 2873–2883.
9. Šmahelová A. Nová farmaka v léčbě diabetu a s čím se může dnes praktický lékař setkat. In: Léčba diabetika v praxi V. Praha: JS Partner, s.r.o. 2009.
10. Kieffer TJ, Habener JF. The glucagon-like peptides. Endocr Rev 1999; 20 : 876–913.
11. Flint A, Raben A, Astrup A et al. Gucagon-like peptide 1 promotes satiety and suppresses energy intake in humans. J Clin Invest 1998; 101 : 515–520.
12. Wettergren A, Schjoldager B, Mortensen PE et al. Truncated GLP-1 (proglucagon 78-107-amide) inhibits gastric and pancreatic functions in man. Dig Dis Sci 1993; 38 : 665–673.
13. During MJ, Cao L, Zuzga DS et al. Glucagon-like peptide-1 receptor is involved in learning and neuroprotection. Nat Med 2003; 9 : 1173–1179.
14. Klonoff DC, Buse JB, Nielsen LL et al. Exenatide effects on diabetes, obesity, cardiovascular risk factors and hepatic biomarkers in patients with type 2 diabetes treated for at least 3 years. Curr Med Res Opin 2008; 24 : 275–286.
15. Gallwitz B. Exenatide in type 2 diabetes: treatment effects in clinical studies and animal study data. Int J Clin Pract 2006; 60 : 1654–1661.
16. Barnett AH, Burger J, Johns D et al. Tolerability and efficacy of exenatide and titrated insulin glargine in adult patients with type 2 diabetes previously uncontrolled with metformin or a sulfonylurea: a multinational, randomized, open-label, two-period, crossover noninferiority trial. Clin Ther 2007; 29 : 2333–2348.
17. Buse JB, Rosenstock J, Sesti G et al. LEAD-6 Study Group. Liraglutide once a day versus exenatide twice a day for type 2 diabetes: a 26-week randomised, parallel-group, multinational, open-label trial (LEAD-6). Lancet 2009; 374 : 39–47.
18. Garber A, Henry R, Ratner R et al. LEAD-3 (Mono) Study Group. Liraglutide versus glimepiride monotherapy for type 2 diabetes (LEAD-3 Mono): a randomised, 52-week, phase III, double-blind, parallel-treatment trial. Lancet 2009; 373 : 473–481.
19. Christensen M, Knop FK, Holst JJ et al. Lixisenatide, a novel GLP-1 receptor agonist for the treatment of type 2 diabetes mellitus. IDrugs 2009; 12 : 503–513.
20. Vilsbøll T, Zdravkovic M, Le-Thi T et al. Liraglutide, a long-acting human glucagon-like peptide-1 analog, given as monotherapy significantly improves glycemic control and lowers body weight without risk of hypoglycemia in patients with type 2 diabetes. Diabetes Care 2007; 30 : 1608–1610
21. SPC Galvus 50 mg tablets. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/000771/WC500020327.pdf.
22. Butler PC, Matveyenko AV, Dry S et al. Glucagon-like peptide-1 therapy and the exocrine pancreas: innocent bystander or friendly fire? Diabetologia 2010; 53 : 1–6.
23. Noel RA, Braun DK, Patterson RE et al. Increased risk of acute pancreatitis and biliary disease observed in patients with type 2 diabetes: a retrospective cohort study. Diabetes Care 2009; 32 : 834–838.
24. Dore DD, Seeger JD, Arnold Chan K. Use of a claims-based active drug safety surveillance system to assess the risk of acute pancreatitis with exenatide or sitagliptin compared to metformin or glyburide. Curr Med Res Opin 2009; 25 : 1019–1027.
25. Anderson SL, Trujillo JM. Association of pancreatitis with glucagon-like peptide-1 agonist use. Ann Pharmacother 2010; 44 : 904–909.
26.http://www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/DrugSafetyInformationforHeathcareProfessionals/ucm183764.htm
27. Engel SS, Williams-Herman DE, Golm GT et al. Sitagliptin: review of preclinical and clinical data regarding incidence of pancreatitis. Int J Clin Pract 2010; 64 : 984–990.
28. Stoffers DA, Kieffer TJ, Hussain MA et al. Insulinotropic glucagon-like peptide 1 agonists stimulate expression of homeodomain protein IDX-1 and increase islet size in mouse pancreas. Diabetes 2000; 49 : 741–748.
29. Landi S. Genetic predisposition and environmental risk factors to pancreatic cancer: A review of the literature. Mutat Res 2009; 681 : 299–307.
30. Jura N, Archer H, Bar-Sagi D. Chronic pancreatitis, pancreatic adenocarcinoma and the black box in-between. Cell Res 2005; 15 : 72–77.
31. Butler PC, Matveyenko AV, Dry S et al. Glucagon-like peptide-1 therapy and the exocrine pancreas: innocent bystander or friendly fire? Diabetologia 2010; 53 : 1–6.
32. Matveyenko AV, Dry S, Cox HI et al. Beneficial endocrine but adverse exocrine effect of Sitagliptin in the human islet amyloid polypeptide transgenic rat model of type 2 diabetes, interactions with metformin. Diabetes 2009; 58 : 1644–1645.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2011 Číslo 4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Úvodní slovo
- Diabetes mellitus a dutina ústní
- Xerostomie, hyposialie, sicca syndrom – kvantitativní poruchy salivace
- Gastroduodenální vředová choroba u diabetika
- Poruchy motility a evakuace žaludku u diabetika. Současné možnosti diagnostiky a léčby
- Současné možnosti chirurgické léčby ložiskového postižení jater a pankreatu
- Steatóza a steatohepatitida u diabetika
- Diabetes mellitus a jaterní cirhóza
- Akutní pankreatitida u diabetika
- Celiakie a diabetes
- Kolorektální karcinom a diabetes
- Analoga amylinu, inhibitory α-glukosidáz a trávicí systém v regulaci homeostázy
- Autonomní neuropatie gastrointestinálního traktu
- Dyspeptický syndrom při antidiabetické léčbě
- Metabolická chirurgie – nejúčinnější léčba diabetu
- Metabolická chirurgie – nový směr v léčbě některých onemocnění
- Inkretinové hormony
- Léčba diabetes mellitus 2. typu GLP-1 agonisty
- Inkretinová léčba a metabolický syndrom
- K životnímu jubileu prof. MUDr. Zdeňka Plachety, DrSc. (1931)
- Předseda České angiologické společnosti, MUDr. Karel Roztočil, CSc., se dožívá 70 let
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Xerostomie, hyposialie, sicca syndrom – kvantitativní poruchy salivace
- Léčba diabetes mellitus 2. typu GLP-1 agonisty
- Autonomní neuropatie gastrointestinálního traktu
- Diabetes mellitus a jaterní cirhóza
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



