-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Pneumologická problematika pacientů s diabetes mellitus
Pneumology problems of patients with diabetes mellitus
Diabetes mellitus is a system disease, which can result in a multiorgan dysfunction. The most serious pulmonary complications of diabetes mellitus are the lower respiratory tract infections developing under immunity dysfunction and under structural and functional pulmonary or extrapulmonary changes. Non–cardiogenic edema can occur as a complication of acute diabetic status such as ketoacidosis or hypoglycemic coma. Immunity dysfunction in diabetic patients seems to have even more complicated consequences according to a previously published study showing lower incidence of ARDS in diabetic patients with septic shock compared to nondiabetics. The question is whether the immunity dysfunction, particularly that of polymorphonuclear cells impairing the resistance against infections, does not reduce the risk of ARDS development.
Key words:
diabetes mellitus – pulmonary function – immunity dysfunction – pneumonia – ARDS
Autoři: H. Bartáková; doc. MUDr. Ludmila Brunerová, Ph.D.; M. Anděl
Působiště autorů: II. interní klinika 3. lékařské fakulty UK a FN Královské Vinohrady, Praha, přednosta prof. MUDr. Michal Anděl, CSc.
Vyšlo v časopise: Vnitř Lék 2005; 51(5): 566-577
Kategorie: Přehledné referáty
Souhrn
Diabetes mellitus má ve svých důsledcích charakter systémového onemocnění, které může vyústit v multiorgánové poškození. Klinicky nejzávažnějšími plicními komplikacemi diabetes mellitus jsou infekce dolních cest dýchacích rozvíjející se v podmínkách zhoršené obranyschopnosti organizmu a strukturálních a funkčních změn plicních i mimoplicních. Jako komplikace akutních diabetických stavů, ketoacidotického a hypoglykemického kómatu se může rozvinout nekardiální plicní edém. Poruchy imunitních funkcí u diabetiků se jeví ve složitějších souvislostech po uveřejnění studie, která u těchto nemocných prokázala nižší incidenci syndromu akutní dechové tísně (ARDS) v rámci septického šoku než u nediabetiků. Je otázkou, zda postižení imunitních funkcí, zvláště polymorfonukleárů, které na jednu stranu negativně ovlivňuje obranyschopnost vůči infekcím, není současně faktorem, který snižuje riziko rozvoje ARDS.
Klíčová slova:
diabetes mellitus – plicní funkce – porucha imunity – pneumonie – ARDSÚvod
Z praktického hlediska jsou infekce dolních cest dýchacích plicní komplikací, s níž se u diabetiků setkáváme nejčastěji. Kromě odlišností v incidenci a závažnosti některých infekcí je potřeba připomenout i určité specifické okolnosti, které u diabetiků přispívají k rozvoji infekcí dolních cest dýchacích. Jsou to kromě poruch imunitních funkcí také strukturální a funkční plicní i mimoplicní změny.
1. Strukturální a funkční změny respiračního systému
Mikroangiopatie plicních kapilár
Většina výzkumných prací zabývajících se diabetickou mikroangiopatií je vzhledem k závažnosti diabetické nefropatie, retinopatie, postižení myokardu a trofických defektů na dolních končetinách zaměřena na změny v systémovém řečišti. Pro diabetickou mikroangiopatii je charakteristické zvláště ztluštění bazální membrány kapilár a její zvýšená propustnost pro plazmatické bílkoviny, především albumin. Za rozhodující patogenetický mechanizmus v rozvoji změn charakteristických pro diabetickou mikroangiopatii je považována neenzymatická glykace bílkovin (NEG), proces, který probíhá v podmínkách chronické hyperglykemie, při němž dochází k patologickým, nedisulfidickým, intermolekulárním vazbám. V průběhu NEG bílkovin dochází k jejich strukturálním změnám a snížení počtu elektronegativních sulfidických skupin. V důsledku NEG bílkovin bazální membrány tak dochází k narušení její funkce elektronegativní bariéry, a tím ke zvýšené propustnosti pro negativně nabité molekuly, např. albumin [13,19]. Glykovaný kolagen je navíc rezistentní vůči kolagenáze a ve zvýšené míře interaguje s ostatními složkami extracelulární matrix, např. proteoglykany. V přítomnosti tzv. advanced glycated end-products (AGE), neenzymaticky glukózou modifikovaných bílkovin, jsou makrofágy stimulovány k sekreci cytokinů – TNF-α, IL-1 a insulin like growth factor 1, dochází k proliferaci fibroblastů a zvýšené syntéze extracelularní matrix [9,10,51].
Přítomnost plicní mikroangiopatie a ztluštění bazální membrány alveolů byla prokázána u pacientů s diabetes mellitus 1. typu (DM 1) a experimentálních zvířat [19,29,48,50]. Experimentální práce se zvířaty s diabetem vyvolaným alloxanem prokázaly zvýšení celkového množství kolagenu, zvláště typu III [15]. Nodulární depozita kolagenu v alveolární stěně, tzv. nodulární fibróza, byla zjištěna ve 44 % plicních autopsií u diabetiků [16]. Některým autorům se však přítomnost plicní mikroangiopatie, resp. sníženou difuzní kapacitu plic (DLCO), která by na její přítomnost mohla poukazovat, nepodařilo u diabetiků prokázat [6].
Kromě samotné existence diabetické plicní mikroangiopatie se řada prací zabývá otázkou případného ovlivnění plicních funkcí či průběhu interkurentních onemocnění – tedy klinickým významem těchto změn. Bylo např. prokázáno, že mechanické nároky na inspirační svaly při stejné hladině ventilace jsou u diabetiků 1. typu signifikantně vyšší oproti kontrolní nediabetické skupině [58].
Diabetická mikroangiopatie se sníženou poddajností cévní stěny je zvažována jako příčina poklesu DLCO u diabetiků při změně vertikální polohy v horizontální [19,61]. Ostatně snížení DLCO je jedna z poruch plicních funkcí, o níž referuje většina autorů, kteří se tímto tématem zabývali [48,52]. Zajímavé výsledky přinesla studie, která prokázala bezprostřední efekt inzulinu na zlepšení DLCO u diabetiků 2. typu dosud léčených dietou a perorálními antidiabetiky. Po analýze výsledků měřených parametrů došli autoři k závěru, že ke zlepšení DLCO došlo pozitivním vlivem inzulinu na prostupnost alveolokapilární membrány pro plyny, nikoli ovlivněním ventilace či hemodynamiky [23].
Prospektivní studie porovnávající transbronchiální biopsie u pacientů s plicní tuberkulózou a DM prokázala častější výskyt těžších fibrokavernózních forem tuberkulózy u pacientů s těžšími formami plicní mikroangiopatie [29].
Je otázkou, zda hyperglykemie, NEG bílkovin, přítomnost AGE, sekrece cytokinů stimulovanými makrofágy a zvýšená produkce extracelulární matrix se může uplatňovat jako patofyziologický mechanizmus při rozvoji plicní fibrózy. V tomto směru až na ojedinělou retrospektivní studii, která u pacientů s idiopatickou plicní fibrózou neléčených kortikosteroidy prokázala 2,4krát vyšší incidenci diabetes mellitus 2. typu (DM 2) v porovnání s ostatní populací, nenacházíme literární údaje [54].
V souvislosti s uvažovanými poruchami vaziva je třeba zmínit ještě jeden potenciální mechanizmus snížení plicních funkcí. V důsledku diabetické kolagenopatie může dojít k omezené pohyblivosti kloubů s následnou rigiditou hrudní stěny. K tomuto závěru došli autoři studie, kteří prokázali restrikční ventilační poruchu u pacientů s inzulindependentním DM a výrazně omezenou kloubní pohyblivostí [53].
Autonomní neuropatie
Autonomní neuropatie je považována za příčinu sníženého bazálního tonu průdušek, snížené dráždivosti ke kašli experimentálně doložené po inhalaci kyseliny citrónové a nižší bronchiální reaktivity po inhalaci studeného vzduchu nebo metacholinu [5,46,49]. Důsledkem těchto změn je zhoršená bronchiální reaktivita, což je zvláště při vyšším riziku aspirací u diabetiků nepříznivým faktorem v rozvoji infekcí dolních cest dýchacích. Autonomní neuropatie a snížená bronchiální reaktivita může být i faktorem podílejícím se na nižší incidenci bronchiálního astmatu, která je uváděna u pacientů s DM 1. Za rozhodující je zde považován převládající Th1 fenotyp pacientů s DM 1, který činí jeho nositele do jisté míry rezistentním vůči alergickým projevům [24].
Centrální regulační poruchy
Experimentálně prokázaná snížená ventilační odpověď na hyperkapnii u pacientů s DM 1 [58,59] a častější výskyt spánkové apnoe u diabetiků může svědčit i o poruše centrálních chemoreceptorů.
U pacientů s DM je předpokládaná a v některých případech i studiemi podložená přítomnost dalších strukturálních změn, které mohou negativně ovlivňovat plicní regulaci, ventilaci či difuzi. Jsou to např. neuropatie bráničního nervu, myopatie dýchacích svalů nebo změny ve složení surfaktantu (tab. 1) [60].
Tab. 1. Strukturální a funkční změny v dýchacím systému u diabetes mellitus. 
Poruchy motility horní části gastrointestinálního traktu, vznikající na podkladě autonomní neuropatie, jsou mimoplicními komplikacemi DM, které nepříznivě ovlivňují respirační funkce. Diabetická gastroparéza představuje zvýšené riziko aspirací, zvláště při kolonizaci žaludku G – bakteriemi, k níž dochází ve vyšší míře při užívání H2-blokátorů [32]. U diabetiků se signifikantně častěji vyskytuje gastroezofageální reflux [31,36], jsou popisovány abnormality v jícnové manometrii, prodloužení evakuace žaludku [1] na podkladě poruchy bazálního elektrického rytmu a kompliance fundu [27]. Zvýšené riziko pneumonií rovněž představují stavy spojené se zvýšenou extravaskulární plicní tekutinou (extravascular lung water – EVLW). Jde např. o levostranné srdeční selhávání nebo převodnění v rámci renální insuficience. Přestože se u DM 1. a 2. typu jedná etiologicky o různá onemocnění, při dlouhodobé dekompenzaci je jejich společným jmenovatelem chronická hyperglykemie a orgánové změny, které jsou jedním z podpůrných faktorů při rozvoji infekcí dolních cest dýchacích. Dalším významným rizikovým faktorem jsou poruchy imunitních funkcí, které do značné míry závisí i na aktuální kompenzaci DM (schéma 1).
Schéma 1. Interaktivní působení infekcí a diabetes mellitus. 
2. Poruchy imunity
Dosavadní výzkumy v oblasti poruch imunitních funkcí u diabetiků nasvědčují tomu, že v důsledku DM jsou více postiženy buněčné a humorální složky vrozené imunity než adaptivní procesy.
Studie zaměřené na monocytomakrofágový systém prokázaly snížený počet cirkulujících periferních monocytů, snížení fagocytární kapacity a chemotaktické odpovědi u diabetiků [30,32].
Bylo zjištěno snížení aktivity tzv. „lectin-like“ receptorů na povrchu monocytů. Jedná se o receptory, které se uplatňují při rozpoznávání nejrůznějších potenciálních patogenů a jsou důležitou součástí první obranné linie [21].
Studie zaměřené na produkci cytokinů mononukleáry periferní krve a izolovanými monocyty přinášejí výsledky, které je možno chápat v širších souvislostech – jednak ve vztahu ke zhoršené obranyschopnosti vůči infekcím a za druhé – s ohledem na roli cytokinů v průběhu ARDS – mohou mít odchylky v produkci cytokinů u diabetiků vliv i na incidenci ARDS u těchto pacientů. Sledování produkce cytokinů se liší podle toho, zda se jedná o klidovou či stimulovanou sekreci. Klidové hodnoty TNF-α, IL-6 a IL-8 byly zjištěny vyšší u diabetiků v porovnání se zdravými jedinci. Naopak po stimulaci monocytů lipopolysacharidem byly zjištěny nižší koncentrace IL-1 a IL-6 u diabetiků než zdravých jedinců, koncentrace TNF-α se nelišila od kontrol. Produkci IL-1 a IL-6 se nepodařilo zvýšit ani přidáním glukózy, ani inzulinu, což svědčí o poruše samotných monocytů. Jako možné vysvětlení odlišností v produkci některých cytokinů u diabetiků za klidových podmínek a po stimulaci je navození tolerance. Zatímco klidová produkce cytokinů je zvýšená, stimulace nevyvolává další zvýšení sekrece. Kromě samotné glukózy jsou za vyšší klidovou sekreci cytokinů potenciálně odpovědny AGE. Experimentálně byla prokázána vyšší produkce cytokinů nediabetickými buňkami po expozici AGE [20].
Poruchy funkce polymorfonukleárů (PMN) zahrnují postižení chemotaktických funkcí, fagocytózy, produkci superoxidu a baktericidní aktivity [41].
Poruchu chemotaktických funkcí se in vitro nepodařilo zlepšit přidáním glukózy či inzulinu, ale pokud byly PMN inkubovány s glukózou a inzulinem současně, došlo k normalizaci chemotaxe. Restituci chemotaktických funkcí lze vysvětlit pozitivním zásahem do metabolických procesů PMN.
Přestože výsledky dosud prováděných sledování fagocytózy PMN u DM nejsou jednoznačné, převládají závěry, že u diabetiků je snížená fagocytární kapacita PMN. Postižení fagocytózy dle některých autorů negativně koreluje s hladinou glykovaného hemoglobinu (HbA1C) a je do jisté míry reverzibilní po navození normoglykemie [32,38].
Fagocytóza je významným stimulem k tvorbě volných kyslíkových radikálů PMN. Oxidativní potenciál PMN je důležitým předpokladem jejich antimikrobiální aktivity. Během chemických reakcí, při nichž dochází k tvorbě volných kyslíkových radikálů, dochází k chemiluminiscenci, kterou je možné měřit a použít jako měřítko oxidativního potenciálu. U PMN diabetiků byla zjištěna vyšší chemiluminiscence za klidových podmínek ve srovnání s kontrolami, po stimulaci je tomu naopak [14].
Rozporuplná data se týkají baktericidní aktivity PMN. Všechny studie, v nichž byl použitým mikroorganizmem Staphylococcus aureus, potvrdily poruchu zabíječské funkce („killing“) PMN u diabetiků. K této shodě nedospěly práce, v nichž byla použita Candida albicans [20].
Kromě dosud uvedených poruch jsou zmiňovány další odchylky nespecifické imunity, které se mohou podílet na snížené obranyschopnosti vůči infekcím.
Dosud nezodpovězenou zůstává otázka významu snížené hladiny zinku, která byla zjištěna v některých studiích u DM 1 a 2 [33]. In vitro byly popsány různé poruchy imunokompetentních buněk u diabetiků v nepřítomnosti zinku, např. porucha funkce lymfocytů a chemotaxe PMN. U nediabetiků byla in vitro zjištěna zvýšená produkce prozánětlivých cytokinů monocyty jako odpověď na stimulaci lipopolysacharidem po přidání zinku [20].
Experimentálně byl prokázán inhibiční účinek AGE na endogenní antibakteriální proteiny, jako je lyzozym a laktoferrin, které jsou obsaženy v granulích PMN a mají bakteriostatické a baktericidní vlastnosti [56].
Jak již bylo řečeno, poruchy vrozené imunity jsou u diabetiků považovány za hlavní příčinu snížené obranyschopnosti. Pokud jde o poruchy získané imunity, byla u pacientů se špatně kontrolovaným DM a u dětí s ketoacidózou popsána snížená mitogenní odpověď lymfocytů. Naopak nejsou známy poruchy specifické humorální imunity. Hladiny imunoglobulinů v séru jsou normální a účinnost vakcinace např. pneumokokovou nebo influenza B vakcínou je účinná [32].
Dosud byly zmíněny poruchy imunitních funkcí obecně. Sledování funkce alveolárních makrofágů a lymfocytů z bronchoalveolární laváže bylo prováděno u pacientů s plicní tuberkulózou s DM a nediabetiků. U diabetiků byla zjištěna nižší aktivita alveolárních makrofágů, zatímco rozdíly v počtu T–lymfocytů, poměru CD4/CD8 a počtu CD25 mezi oběma skupinami pacientů nebyly prokázány. Mezi diabetiky bez tuberkulózy a zdravými jedinci nebyl v aktivitě alveolárních makrofágů a v počtu a aktivitě T-lymfocytů zjištěn rozdíl [57]. Pozorování tedy podpořilo úvahu, že zvýšené riziko tuberkulózy u pacientů s DM je důsledkem poruchy funkce alveolárních makrofágů, resp. jejich schopnosti aktivovat se v přítomnosti mykobakteria. Vzhledem k primární roli alveolárních makrofágů v lokální obranyschopnosti vůči mykobakteriím a dalším převážně intracelulárním mikrobům se jedná o podstatné zjištění.
Hyperglykemie se uplatňuje v rozvoji infekce nejen negativním působením na imunitní funkce, ale i ovlivněním některých vlastností mikroorganizmu. Sama hyperglykemie poskytuje dobré podmínky pro množení mikroorganizmu [39]. Navíc na povrchu některých mikroorganizmů dochází k receptorovým změnám, které zhoršují opsonizaci a usnadňují adherenci mikroba ke sliznici [20].
3. Respirační infekce
Je známo, že infekce včetně zánětu dolních cest dýchacích u diabetiků se vyskytují častěji než v ostatní populaci. Dat týkajících se incidence respiračních infekcí v diabetické populaci je však překvapivě málo. Jednou z překážek provedení takovýchto studií je mj. obtížné stanovení kontrolní skupiny při poměrně intenzivní péči, která je věnována diabetikům v terénu, a pro jejich častější hospitalizace z řady příčin. Připomeňme, že prevalence primárního DM (tj. DM 1, 2, a tzv. MODY – maturity-onset diabetes of the young) v populaci je 6 %, z toho diabetici 1. typu tvoří 10 %, 2. typu 80–90 %, MODY asi 5 %. Z prospektivního sledování pacientů, u nichž byla během hospitalizace zjištěna bakteriemie, vyplynulo, že z 1 000 pacientů s bakteriemií byly 2/3 diabetici [12]. Pacienti s komplikovanými pneumoniemi jsou v 10–15 % diabetici [11]. Studie zaměřená na prevalenci DM u pacientů hospitalizovaných pro akutní exacerbaci chronické obstrukční plicní nemoci (CHOPN) prokázala 15% výskyt DM, u inzulinodependentních pacientů signifikantně delší hospitalizaci a v 52 % výskyt Gram-negativních (G–) bakterií ve sputu (ve skupině nediabetiků 27 %) [37].
Dle dostupné literatury se pneumonie vyvolané určitými patogeny u diabetiků vyskytují častěji, jiné mají častěji komplikovaný průběh a vyšší mortalitu, než je tomu u nediabetické populace (tab. 2).
Tab. 2. Vyvolavatelé infekcí dolních cest dýchacích u pacientů s diabetes mellitus, které se vyskytují častěji nebo mají závažnější průběh v porovnání s nediabetickou populací. 
Staphylococcus aureus je u diabetiků častým původcem infekcí kůže a měkkých tkání, které mohou být zdrojem pneumonie hematogenního původu. Další riziko představuje častější kolonizace nosní sliznice stafylokoky u diabetiků v porovnání se zdravou populací (30 % vs 11 %) [35]. Stafylokové pneumonie mají typicky lobární či segmentární rozsah, mohou se však vyvinout v plicní absces či abscedující pneumonii, ev. Komplikovanou rozvojem empyému. Vzhledem k výše uvedeným okolnostem se stafylokokové pneumonie vyskytují jako nozokomiální i komunitní, i když obecně jsou považovány spíše za nemocniční. Závažným problémem mohou být infekce vyvolané methicilin rezistentními kmeny Staphylococus aureus (MRSA), jejichž mortalita je vysoká. Před zahájením léčby je třeba přihlédnout k místní prevalenci MRSA.
Obr. 1. Abscedující pneumonie v horním laloku levé plíce a měkkých tkání hrudní stěny v.s. metastatického původu u pacienta s 20letou anamnézou DM v.s. sekundárního léčeného inzulinem. 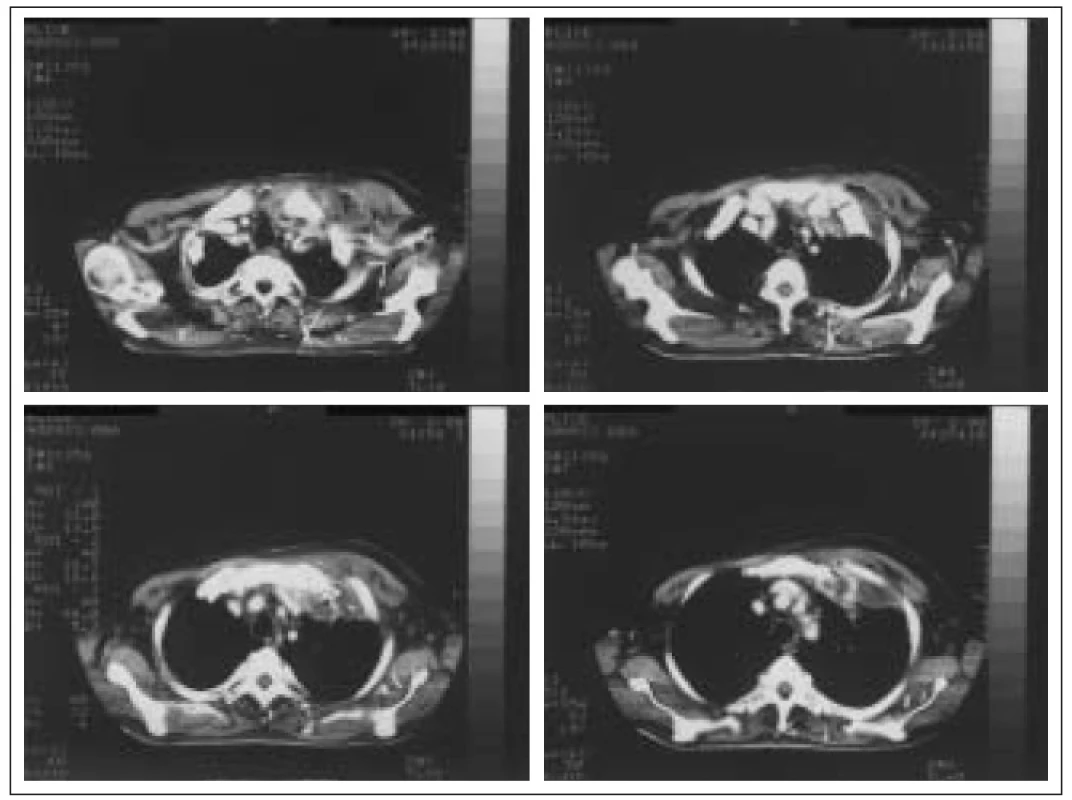
Rozvoji pneumonie předcházel před 4 měsíci úraz hrudníku a břicha, postupně došlo k rozvoji podkožního abscesu na přední straně hrudníku vpravo, mnohočetným kožním ulceracím a levostranné abscedující pneumonii s postižením pleury a hrudní stěny. Bakteriologicky vykultivován Staphylococcus aureus Po drenáži podkožního abscesu a aplikaci Oxacillinu došlo k regresi zánětlivých infiltrátů. V 90. letech 20. století byl zaznamenán závažný nárůst výskytu vankomycin rezistentních stafylokoků (VRS). V léčbě VRS je antibiotikem volby teikoplanin, senzitivita však rovněž není 100%. V léčbě VRS připadá v úvahu rovněž kombinace rifampicinu s dalšími antistafylokokovými antibiotiky. Řada nových chemoterapeutik se zavádí do klinické praxe nebo je ve stadiu klinických zkoušek. Jsou to např. streptograminy (quinupristin + dalfopristin, Synercid), oxazolidinony, nové glykopeptidy a fluorochinolony (clinafloxacin) [45].
G–bakterie (Escherichia coli, Enterobacter, Klebsiella, Proteus, Serratia, Pseudomonas, Haemophilus influenzae) jsou častějším původcem pneumonií a exacerbací CHOPN u diabetiků. Častější kolonizace orofaryngu ev. i žaludku G – bakteriemi je zvláště v přítomnosti diabetické gastroparézy, sníženého bronchiálního tonu a snížené dráždivosti ke kašli rizikem rozvoje pneumonií aspiračního původu. Riziko se zvyšuje s použitím nazogastrické sondy (i tenké) a při endotracheální intubaci. Častější invazivní výkony jsou důvodem hematogenních infekcí.
DM je považován za rizikový faktor rozvoje tuberkulózy (TBC), ovšem jednotlivé literární zdroje se liší v údajích, kolikrát častěji se vyskytuje TBC u diabetiků než v ostatní populaci. Obvykle se hovoří o 2–4krát vyšší incidenci [40], některé zdroje uvádějí až 11krát vyšší výskyt. Pravidelné snímkování pacientů diabetologických poraden bylo součástí dispenzarizační péče a bylo by jistě zajímavé vědět, jaká byla incidence plicní tuberkulózy v této skupině pacientů. Požadavek rentgenového vyšetření v rámci screeningu je u diabetiků o to naléhavější, že vzhledem k popisovaným poruchám buněčné imunity není zřejmé, jakou výpovědní hodnotu má tuberkulinový test.
Obecně se u pacientů s DM vyskytují těžší formy TBC, je zde horší terapeutická ovlivnitelnost a vyšší mortalita. Častější lokalizace specifických lézí v dolních polích, resp. dolních a středních lalocích, u pacientů s DM v porovnání s nediabetiky je další odlišností [40,43]. Jednotlivé studie se však značně liší v četnosti záchytu tuberkulózních lézí v dolních polích jak u pacientů s DM, tak nediabetiků. K rozvoji TBC ve středních a dolních lalocích dochází nejspíše peribronchiální perforací kaseifikované hilové lymfatické uzliny. Etiopatogeneticky se jedná o časnou postprimární či progresivní primární infekci. Nejčastěji jsou léze zjišťovány v apikálních segmentech dolních laloků, k rozpadu a tvorbě kaverny dochází dříve než při lokalizaci v horních lalocích [7]. Diabetes mellitus se ukazuje být i rizikovým faktorem rozvoje multirezistentní tuberkulózy [3]. Při léčbě TBC je potřeba věnovat zvláštní pozornost vedlejším účinkům antituberkulotik s ohledem na preexistující diabetické komplikace. Vzhledem k vysokému neurotoxickému účinku izoniazidu (INH) je potřeba pacienty, kteří jej užívají, dobře monitorovat a důsledně jim předepisovat pyridoxin. Optimální kompenzace diabetu je nezbytnou podmínkou i za cenu přechodné aplikace inzulinu.
U diabetiků je uváděn častější výskyt primárních mykotických infekcí, jejichž původcem jsou Mucor spp., Aspergilus spp., Coccidoides immitis a Cryptococcus neoformans.
Plicní mukormykóza může být fatální komplikací u pacienta s dlouhodobě dekompenzovaným DM a mnohočetnými orgánovými komplikacemi. Jedná se o fulminantně probíhající mykózu s invazí mycet do bronchiální sliznice, velkých cév a tvorbou abscedujících plicních infiltrátů. Průběh onemocnění může být natolik rychlý, že pacient umírá dříve, než je stanovena diagnóza. Při podezření na mukormykózu je potřeba provést co nejrychleji mikroskopické vyšetření odebraného materiálu, neboť kultivační vyšetření trvá příliš dlouho a má nízkou senzitivitu. Kromě účinné antimykotické léčby je třeba zvážit chirurgické řešení [4,32].
Plicní aspergilóza se může vyskytovat jako vysoce agresivní akutní nebo subakutní invazivní plicní aspergilóza nebo jako chronická forma – apergilom.
Zřídka, ale častěji než v ostatní populaci, je uváděn výskyt kokcidioidomykotických a kryptokokových infekcí.
Poměrně překvapivé je, že ani literární zdroje, ani naše klinické zkušenosti nevypovídají o častějším výskytu kandidových pneumonií, přestože orální a urogenitální kandidóza je častou komplikací u diabetiků. Problém diagnostiky plicní kandidózy spočívá především v tom, že kromě histologického vyšetření neexistuje metoda, která by spolehlivě odlišila infekci od kolonizace. Nález kandidy v respiračních sekretech musí být tedy uvážlivě korelován s klinickými okolnostmi a doplněn o vyšetření hemokultury [47]. Většinou se přistupuje k léčbě antimykotiky z důvodu pneumonie nereagující na antibakteriální antibiotika. Lékem první volby je v současné době flukonazol. Vzhledem k možné rezistenci vůči flukonazolu, zvláště v případě infekce C. krusei, je vhodné u pozitivních kultivací doplnit i vyšetření citlivosti.
Obr. 2. Mnohočetné abscesy levé plíce komplikované multilokulárním empyemem u 65letého muže s 15letou anamnézou DM 2 léčeného dietou a PAD. 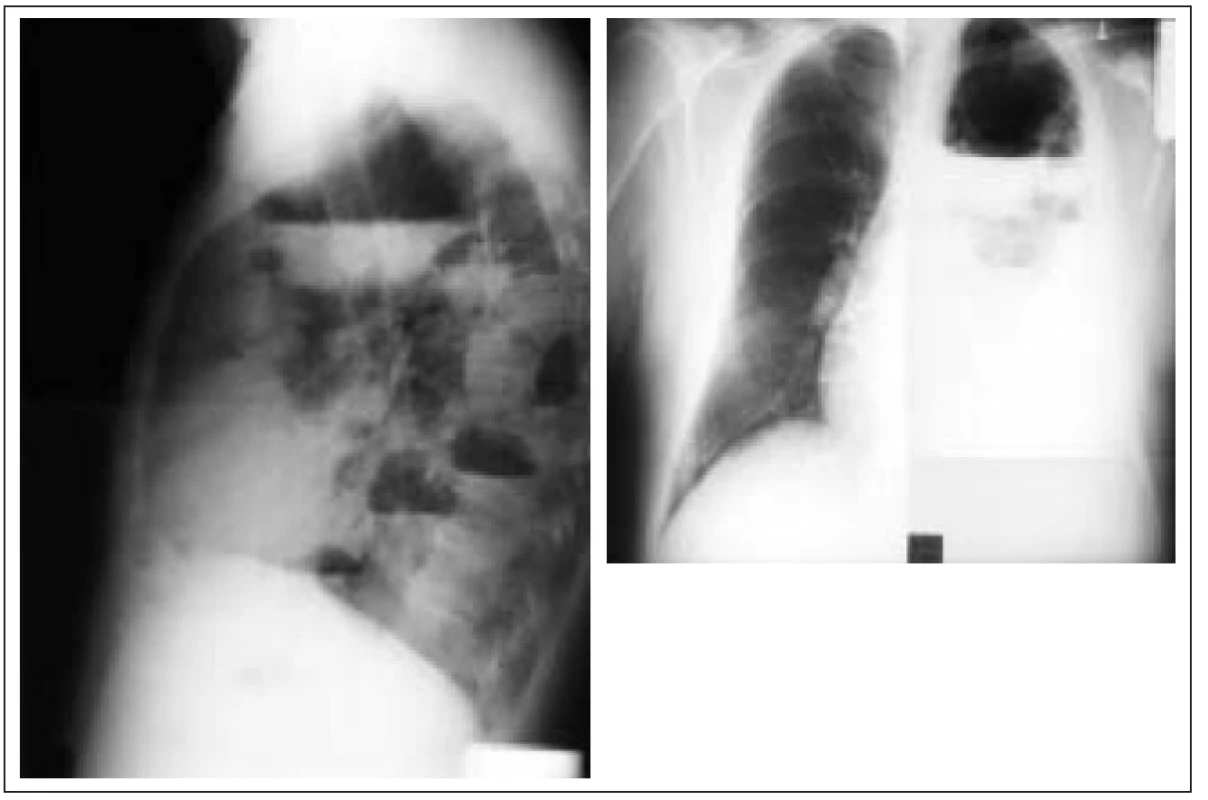
14 dní před přijetím byla diagnostikována levostranná komunitní pneumonie, která progredovala do multifokálního plicního abscesu. Přechodná drenáž a antibiotika vedla ke klinické stabilizaci a téměř úplné rentgenové regresi nálezu. O výskytu pneumocystové pneumonie, která je v poslední době považovaná za mykózu, není u diabetiků dostatek informací.
Není rovněž podložena vyšší incidence parazitárních pneumonií.
Následující plicní infekce mají u diabetiků v porovnání s nediabetiky více komplikací a vyšší mortalitu (tab. 2).
Pneumokokové pneumonie jsou u diabetiků častěji komplikovány bakteriemií a mají vyšší mortalitu. Je zde ovšem možnost účinné prevence ve vakcinaci pneumokokovou vakcínou.
K rozvoji anaerobních pneumonií jsou náchylní zvláště pacienti s častějšími aspiracemi orofaryngeálních sekretů a porušenými očistnými mechanizmy průdušek z důvodů vegetativní neuropatie. Riziko představují rovněž poruchy vědomí v důsledku akutních diabetických stavů. U anaerobních infekcí je riziko rozvoje nekrotizující pneumonie, plicního abscesu a empyému.
Obr. 3. Levostranný empyém vzniklý jako komplikace chronického pleurálního výpotku a parciální atelektáza levého dolního laloku u 61letého muže s 15letou anamnézou DM 2 s retinopatií, nefropatií, ICHS, st.p. infarktu myokardu. 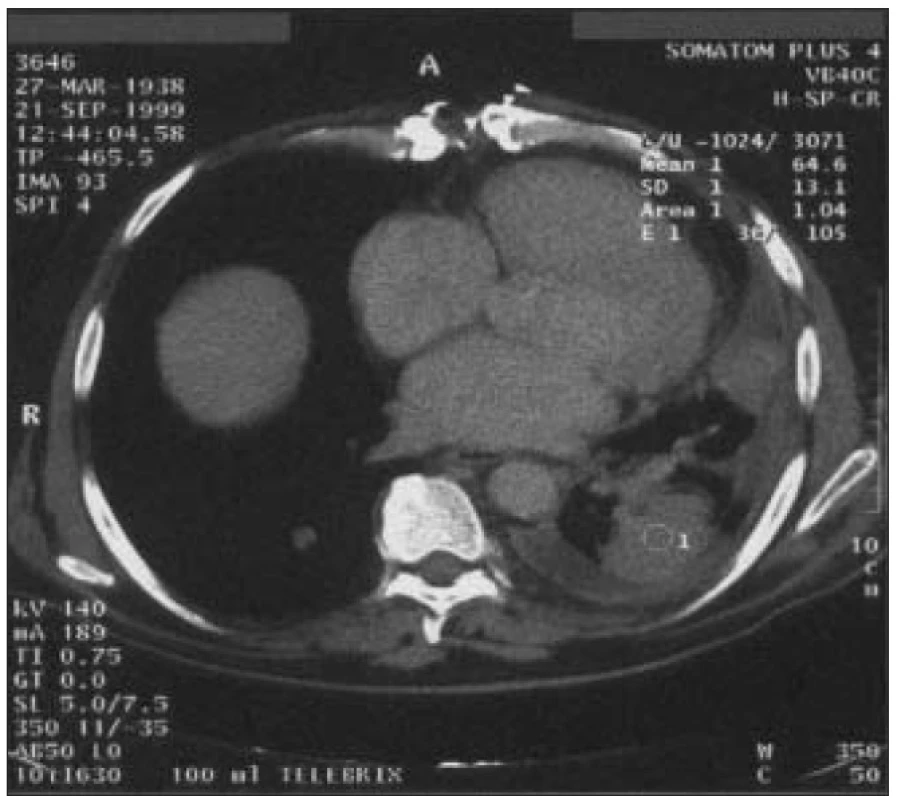
Pacient před 2 roky podstoupil aortokoronární bypass. Pooperační průběh byl komplikován dehiscencí sterna, mediastinitidou a recidivujícími pleurálními výpotky. Přes opakované hrudní drenáže přetrvává částečná atelektáza levého dolního laloku. Dekortikaci levé plíce nebylo možné indikovat pro celkově špatný stav pacienta. Zvláště u pacientů s renální insuficiencí je vyšší riziko rozvoje legionelové pneumonie, nozokomiální i komunitní, jejichž mortalita je vysoká. V léčbě jsou účinné makrolidy, rifampicin a fluorochinolony.
Během chřipkových epidemií výrazně vzrůstá mortalita diabetických pacientů na infekce dolních cest dýchacích. Zvláště rizikovou skupinou jsou pacienti s kardiovaskulárními komplikacemi. V důsledku virových pneumonií dochází často k následné superinfekci S. Aureus s mortalitou až 30 % [62]. Efektivní prevencí proti chřipce je každoroční vakcinace, která by měla být diabetikům zvláště s kardiovaskulárními komplikacemi doporučována.
V důsledku vyšší incidence infekcí v různých lokalizacích, zvláště kůže, měkkých tkání a urogenitálního traktu, se u diabetiků častěji setkáváme s metastatickými infekcemi plic, případně i záněty šířícími se per continuatem z okolí. Naopak plicní infekty jsou u diabetiků častěji zdrojem bakteriemie ametastatických infekcí s vysokou mortalitou.
Obr. 4. Osteomyelitis a osteochondritis pravého sternoklavikulárního kloubu s infiltrací horního mediastina, plicní tkáně a pravých pektorálních svalů u 54letého muže s 10letou anamnézou DM 2 léčeného PAD, st.p. vysoké amputaci dolní končetiny a amputaci prstů druhé nohy pro diabetickou gangrénu. 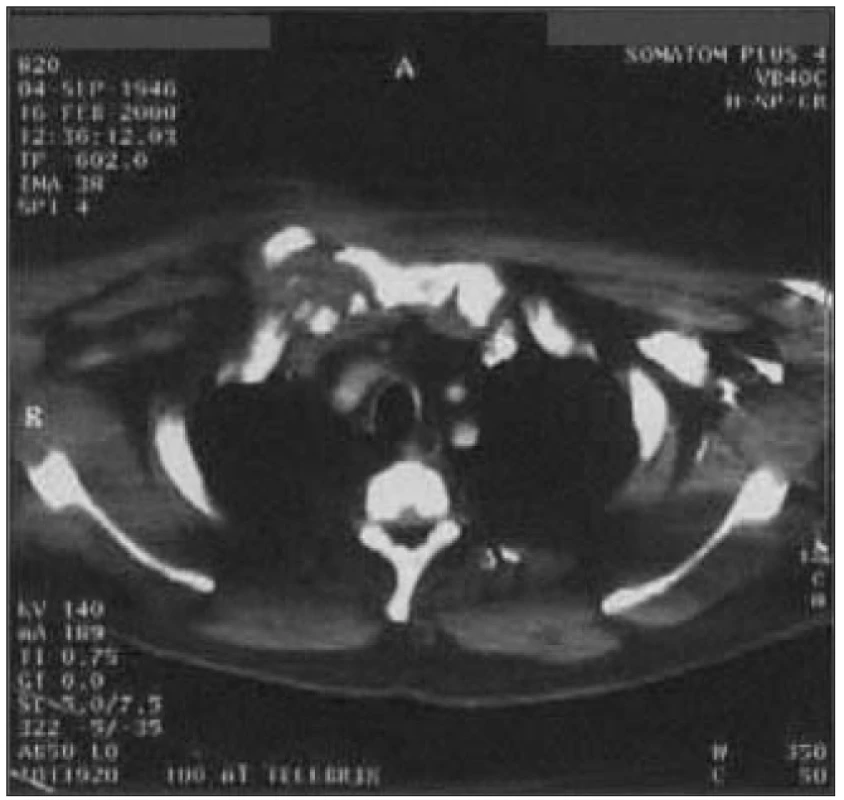
Byla provedena incize s evakuací nekrotických hmot, bakteriologicky byl zjištěn Staphylococcus aureus. Pooperační průběh byl komplikován vznikem hnisavé píštěle, takže následovala resekce s odstraněním mediálního konce klíční kosti a přilehlých měkkých tkání. Za 4 měsíce bylo nutné pro přetrvávající hnisavou píštěl přistoupit k široké excizi pravé klíční kosti a části sterna (vykultivován Streptococcus viridans a Corynebacterium spp.). Defekt byl plasticky překryt okrajem pektorálního svalu. Obr. 5. Opouzdřený pravostranný empyém v.s. parapneumonický. 65letý pacient s DM 2 na dietě by přijat do nemocnice pro týden trvající subfebrilie, suchý kašel a bolest pravého hemitoraxu. 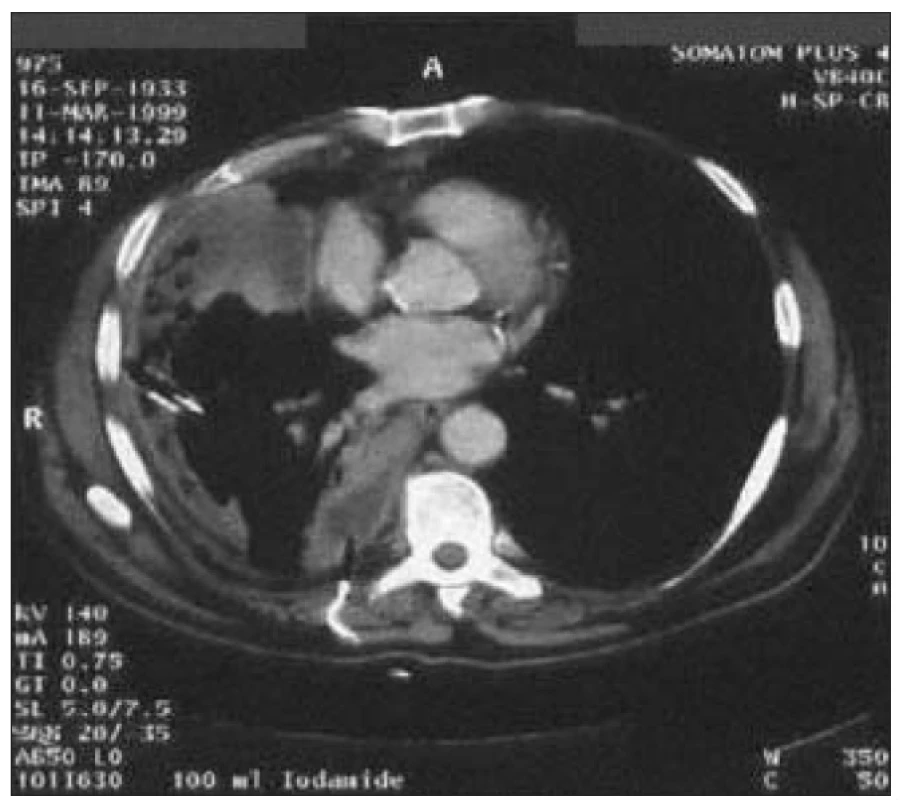
Na CT byly zjištěny 2 opouzdřené empyémy, kultivačně byl prokázán hemolytický streptokok. Byla zavedena dvojitá pleurální drenáž a pacient byl léčen Augmentinem. Před propuštěním došlo k regresi obou empyémů. V diagnostice pneumonií u diabetiků můžeme narážet na jistá úskalí, neboť klinické příznaky i rentgenové nálezy mohou být modifikovány přítomností diabetických komplikací, zvláště srdeční či renální insuficiencí. V léčbě je potřeba dbát na co nejlepší kompenzaci DM, ev. Přechodně aplikovat léčbu inzulinem, a vyváženou vodní bilanci. Při výběru antibiotik je potřeba mít na mysli možné okolnosti vzniku respiračního infektu a nežádoucí účinky jednotlivých preparátů s ohledem na přidružené orgánové komplikace.
Vzájemný vztah DM a infekcí názorně shrnuje schéma 1. Požadavek normoglykemie vyplývá z rizika rozvoje orgánových komplikací a imunitních poruch u diabetiků, jejichž důsledkem je náchylnost diabetiků k infekcím. Včasná a adekvátní léčba infekcí je naopak podmínkou co nejlepší kompenzace DM.
Vzhledem k pneumologickému zaměření tohoto přehledu se chceme na závěr této kapitoly zcela krátce zmínit o DM u pacientů s cystickou fibrózou (CF) – CFRD (cystic fibrosis related diabetes mellitus) a poukázat na jeho význam pro prognózu pacientů.
Rozvoj CFRD má více příčin, z nichž hlavní je rozvoj fibrózy a tukové infiltrace pankreatu, při níž dochází k zániku ostrůvků a změnám jejich buněčného složení. Výsledkem je mj. snížení počtu β-buněk secernujících inzulin. Na etiopatogenezi CFRD má podíl i vyšší produkce kontraregulačních hormonů a některých cytokinů v průběhu infekce s následnou hyperglykemií. Výskyt CFRD u pacientů vzrůstá s věkem. Zatímco pacienti s CF do 19 let mají v 34–38 % poruchu glukózové tolerance a v 9–26 % CFRD, u třicetiletých a starších se porucha glukózové tolerance vyskytuje v 27 % a CFRD ve 43 %.
Negativním důsledkem CFRD je především zhoršování celkového nutričního stavu pacienta při deficitu inzulinu, který je významným anabolickým hormonem.
Nepříznivý vliv CFRD na prognózu pacientů s CF dokládá retrospektivní studie 448 pacientů provedená v Centru pro cystickou fibrózu na University of Minnesota, kde bylo porovnáno procento pacientů s CF s DM a nediabetiků, kteří se dožili 30. roku života. V případě CF bez DM se tohoto věku dožilo 60 % pacientů, ve skupině pacientů s CFRD pouze 25 % [42].
Klinická pozorování rovněž prokázala, že po zahájení inzulinoterapie dochází postupně ke zlepšování nutričního stavu a restituci plicních funkcí [34,42].
4. Syndrom akutní respirační tísně u pacientů s DM
První téma této kapitoly – syndrom akutní respirační tísně (acute respiratory distress syndrome – ARDS) u diabetiků – je spíše inspirací k zamyšlení než přehledné sdělení. Přináší totiž zprávu o dosud ojedinělé studii zabývající se rozvojem ARDS u pacientů s DM v septickém šoku.
ARDS je klinický syndrom charakteristický dechovou tísní, hypoxemií, typickým rentgenovým obrazem bilaterálních difuzních infiltrátů a sníženou plicní poddajností, který se rozvíjí jako komplikace řady patologických stavů a okolností (sepse, polytrauma, akutní pankreatitida, opakované transfuze, aspirace žaludečního obsahu, inhalace toxických plynů, atd). Z hlediska patologického lze v průběhu ARDS dle morfologického nálezu odlišit fázi exsudativní, proliferativní a fibrotickou. Výzkumné práce zaměřené na etiopatogenezi jsou nejčastěji prováděny u ARDS vzniklého v průběhu sepse, což je také nejčastěji se vyskytující rizikový faktor. ARDS je zde důsledkem systémového zánětu, který v plicích vyvolává kaskádu reakcí, jež ústí v poškození alveolokapilární membrány, plicní edém, ev. rozvoj plicní fibrózy. Rozhodující úlohu při rozvoji ARDS mají neutrofily, které se v plicích akumulují, adherují k endoteliálním buňkám, přestupují do intersticia a alveolárních prostorů, uvolňují kyslíkové radikály a proteolytické enzymy. Proces je řízen celou řadou látek regulační povahy. Na počátku endotoxinem stimulované makrofágy uvolňují TNF-α, což vyvolá uvolnění IL-1-β endoteliálními buňkami. TNF-α a IL-1-β mají výrazně prozánětlivý efekt s permisivními účinky na sekvestraci a degranulaci neutrofilů a chemotaxi makrofágů. Další prozánětlivé cytokiny, které se uplatňuji v průběhu ARDS, jsou IL-8 a distální IL-6 [17,22,26].
Obr. 6. Absces v pravém dolním laloku, PCR a kultivačně BK pozitivní. 20letá žena s 8letou anamnézou DM 1 s opakovanými pyodermiemi, léčena inzulinem aplikovaným inzulinovou pumpou byla přijata pro těžkou hyperglykemii s ketoacidózou, jejímž důvodem bylo zneprůchodnění kanyly. 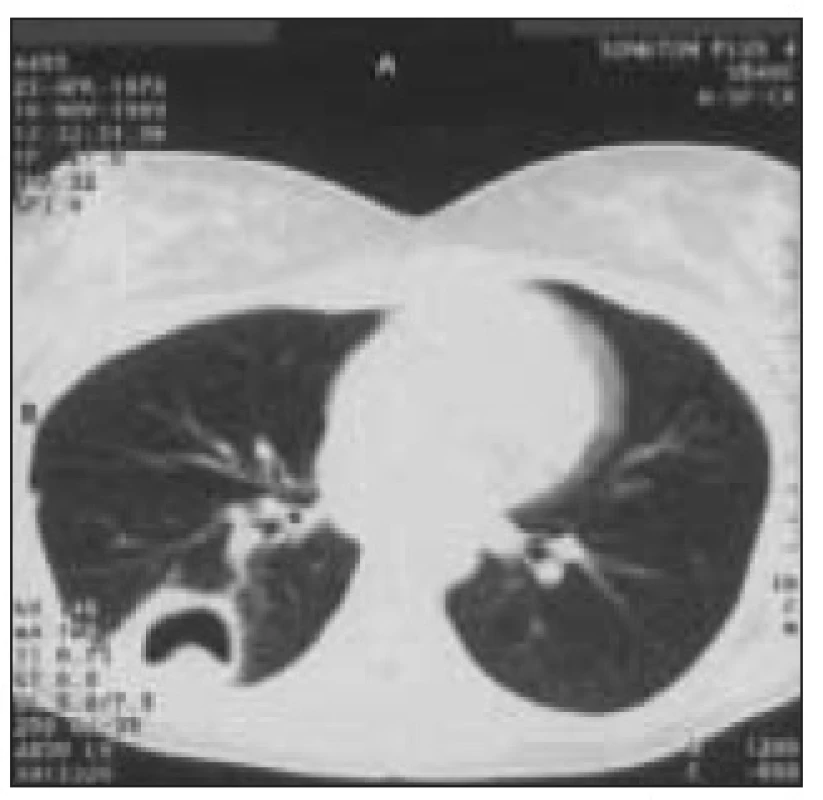
Za 3 dny po přijetí byl na skiagramu patrný infiltrát v apikálním segmentu dolního laloku vpravo, který se později vyvinul v absces. Vzhledem k pyodermiím byl etiologicky zvažován stafylokok a byl nasazen Oxacillin. Při této léčbě nedošlo k regresi abscesu, byla provedena BAL s pozitivním PCR na Mycobacterium tbc., mikroskopicky byla BAL BK negativní. BK pozitivita byla prokázána i kultivačně a pacientka byla přeléčena antituberkulotiky. Na základě již zmíněné poruchy imunitních funkcí neutrofilů a monocytů včetně jejich snížené produkce cytokinů se nabízí otázka, zda tyto odchylky mohou hrát protektivní roli při rozvoji ARDS u diabetiků. Ojedinělou prací, která se snažila zodpovědět tuto otázku, je prospektivní, multicentrická studie porovnávající incidenci ARDS u pacientů v septickém šoku mezi diabetiky a nediabetiky. Pacienti byli zařazeni do studie, pokud splňovali vstupní kritéria vyplývající z definice septického šoku dle American College of Chest Physicians/Society of Critical Care Medicine. Diagnóza ARDS byla stanovena dle kritérií z roku 1994 vytvořených The American - European Consensus Conference of ARDS, pokud se symptomy objevily do 5 dnů od rozvoje septického šoku. Pacienti byli klasifikováni jako diabetici, pokud v předchorobí užívali inzulin nebo perorální antidiabetika. Incidence ARDS ve skupině diabetiků byla 25 %, zatímco u nediabetiků 47 % (p = 0,03). I po provedení multivariantní analýzy při zohlednění rozdílu ve věku, zdroje infekce a cirhózy v anamnéze byl rozdíl v incidenci ARDS mezi oběma skupinami signifikantní. Pacienti byli rovněž rozděleni do skupin dle vstupní glykemie bez ohledu na anamnézu DM. Ve skupině se vstupní glykemií ≥ 6,7 mmol/l byla zaznamenána nižší incidence ARDS (33 % vs 51 %), která však nedosáhla statistické významnosti (p = 0,06). Zařazení pacientů do skupiny diabetiků na základě údaje o předchozí farmakologické léčbě DM i následná stratifikace podle přítomnosti vstupní hyperglykemie jsou jistě diskutabilní. Tato kritéria by byla vhodná korelovat např. se vstupní hodnotou glykovaného hemoglobinu [18].
Výsledky studie prokázaly vysoké riziko septického šoku u diabetiků, který byl ovšem méně často než v nediabetické populaci komplikován ARDS. Zajímavé však bylo zjištění, že v mortalitě nebyl mezi pacienty s DM a nediabetiky signifikantní rozdíl jak ve skupině s ARDS, tak bez něj. Nabízí se tedy otázka, zda a z jakých příčin jsou v rámci septického šoku plíce diabetiků méně náchylné k zánětlivé reakci než ostatní kompartmenty. V diskusi autoři uvádějí jako možnou příčinu nižší incidence ARDS v průběhu septického šoku u diabetiků již zmíněné poruchy funkcí neutrofilů, navíc poukazují i na možný vliv nižší produkce leukotrienu B4 neutrofily u diabetiků [44]. Je možné uvažovat i o protektivním vlivu hyperglykemie a hyperosmolarity séra a zvláště o specifických lokálních interakcích na úrovni neutrofily – endotel – alveolokapilární membrána [18].
Z jedné práce jistě nelze vyvozovat obecné závěry, lze ji však chápat jako podnět k získání více dat týkajících se koincidence DM – septický šok – ARDS a ke studiu zánětlivých procesů u diabetiků.
ARDS vzniklý v souvislosti s diabetickou ketoacidózou je tématem řady kazuistik. Toto téma není dosud zpracováno systematicky retrospektivní či prospektivní studií a etiopatogeneza ARDS při ketoacidóze není jednoznačná. Je sporné, zda lze hledat přímou paralelu mezi mozkovým či obličejovým edémem a ARDS v průběhu diabetické ketoacidózy. Edém se může vyskytovat izolovaně v jednotlivých lokalizacích, aniž by byla kongescí postižena jiná místa.
Za možnou mechanickou příčinu rozvoje ARDS v průběhu ketoacidózy je považováno snížení pleurálního tlaku při zvýšené dechové frekvenci a zachovalém dechovém objemu. Za těchto okolností může docházet ke zvýšení transkapilárního přestupu tekutin podobně jako při akutní obstrukci horních cest dýchacích [25].
Další potenciální příčinou je příliš rychlá a masivní rehydratace s následným poklesem intravaskulárního osmotického tlaku v úvodu léčby hyperglykemického ketoacidotického kómatu. Kromě poklesu osmotického tlaku může rychlá rehydratace a příliš agresivní inzulinoterapie způsobit hypokalemii, hypomagnezemii, hypokalcemii a hypofosfatemii s následnou svalovou hypotonií prohlubující dysfunkci dýchacích svalů.
V etiopatogenezi ARDS a hypoxemie je zvažován i efekt hyperlipidemie. V průběhu ketoacidózy totiž dochází ke kumulaci triglyceridů v játrech, z nichž některé jsou inkorporovány do lipoproteinů o velmi nízké hustotě (very low density lipoproteins – VLDL) a uvolňovány do oběhu. Tento prudký vzestup VLDL může mít podobný účinek jako rychlá infuze lipidových emulzí, tj. může dojít k mikroembolizaci do plicního řečiště s rozvojem syndromu dechové tísně.
Přesto, že ARDS v průběhu ketoacidózy je relativně málo častou a z etiopatogenetického hlediska málo známou komplikací, zdá se, že vzniká odlišným mechanizmem než ARDS u septického šoku.
V prevenci a léčbě této poměrně vzácné komplikace se doporučuje především důsledné dodržování pravidel plynulé a pomalé rehydratace a inzulinoterapie.
Jako vzácnější komplikace ketoacidózy je popisováno pneumomediastinum, v jehož patogenezi se uvažují rovněž změny intratorakálního tlaku v průběhu hyperventilace. Jeho prognóza je příznivá, spontánně regreduje po kompenzaci hyperglykemie a acidózy [4].
Vzácným problémem je také plicní edém v důsledku aspirace sladké tekutiny v rámci léčby hypoglykemických stavů [28] či obstrukce dýchacích cest hlenovou zátkou v ketoacidóze [8].
Pro úplnost uvádíme ještě spíše historickou poznámku týkající se nekardiálního plicního edému v průběhu hypoglykemie. Ve 30. letech minulého století bylo popsáno několik případů rozvoje plicního edému u psychiatrických pacientů léčených inzulinovými šoky. Experimentální studie na zvířatech podpořily hypotézu, že příčina plicního edému u hypoglykemického kómatu je neurogenní. Jedná se nejspíše o důsledek kontraregulačního masivního vyplavení katecholaminů, která vede jednak k masivní systémové vazokonstrikci a přesunu krve do nízkotlakého plicního řečiště, posléze i ke snížení poddajnosti levé komory se vzestupem tlaku v levé síni. Zvýšením tlaku v plicních kapilárách může dojít až k rozvoji plicního edému [55].
5. Závěr
V průběhu DM je respirační systém postižen strukturálními a funkčními změnami, o nichž není známo, že by samy o sobě vedly k jeho selhání. Spolu s imunitními poruchami a postižením dalších orgánů však přispívají ke zvýšené incidenci zánětů dolních dýchacích cest, s častějšími komplikacemi a vyšší mortalitou. O incidenci a etiopatogenezi akutní respirační insuficience, resp. ARDS v průběhu akutních diabetických stavů, je dosud relativně málo informací. Se zvědavostí lze očekávat další výzkumy týkající se systémových zánětlivých procesů a jejich odpovědi v plicích.
Jedná se o aktualizovaný a rozšířený text, který původně vyšel v časopise Diabetologie, metabolismus, endokrinologie, výživa [2]. Otištěno se souhlasem redakce DMEV a nakladatelství Tigis spol. s r. o., Praha.
Zkratky v textu:
AGE – advanced glycated end-products, neenzymaticky glukózou modifikované bílkoviny; ARDS – acute respiratory distress syndrome, syndrom akutní dechové tísně; BAL – bronchoalveolární laváž; BK – Kochův bacil; CF – cystická fibróza; CFRD – cystic fibrosis related diabetes, diabetes asociovaný s cystickou fibrózou; DLCO – difuzní kapacita pro kysličník uhelnatý; DM 1, 2 – diabetes mellitus 1., 2. typu; EVLW – extravascular lung water, extravaskulární plicní tekutina; G – – Gram negativní; G+ – Gram pozitivní; HbA1C – glykovaný hemoglobin; CHOPN – chronická obstrukční plicní nemoc; IL – interleukin; INH – hydrazid kzseliny isonikotinové; MODY – maturity – onset diabetes of the young, diabetes dospělých vzniklý v mládí; MRSA – methicilin rezistentní Staphylococcus aureus; NEG – neenzymatická glykace bílkovin; PMN – polymorfonukleáry; PCR – polymerase chain reaction, polymerázová řetězová reakce; TBC – tuberkulóza; TNF-alfa – tumor necrosis factor alfa; VLDL – very low density lipoproteins, lipoproteiny o velmi nízké hustotě; VRS – vankomycin rezistentní stafylokok
MUDr. Hana Bartáková
www.fnkv.cz
e-mail: bartakov@yahoo.com
Doručeno do redakce: 5. 2. 2004
Přijato po recenzi: 23. 9. 2004
Zdroje
1. Annese V, Bassoti G. Gastrointestinal motor dysfunction, symptoms and neuropathy in NIDDM. J Clin Gastroenterol 1999; 29 : 171–177.
2. Bartáková H, Anděl M. Plicní komplikace diabetes mellitus. Diabetologie, metabolismus, endokrinologie, výživa 1998; 4 : 173–179.
3. Bashar M, Alcabes P, Rom WN et al. Increased incidence of multidrug-resistant tuberculosis in diabetic patients on the Bellevue Chest Service 1987–1997. Chest 2001; 120(5): 1514–1519.
4. Baum GL, Wolinsky E. Textbook of pulmonary diseases. Vol. II. Boston: Little Brown 1994 : 1649–1652.
5. Behera D, Das S, Dash RJ et al. Cough reflex in diabetes mellitus with and without autonomic neuropathy. Respiration 1995; 62(5): 263–268.
6. Benbassat CA, Stern E, Karmer M et al. Pulmonary function in patients with diabetes mellitus. Am J Med Sci 2001; 322(3): 127–132.
7. Berger HW, Granada MG. Lower lung field tuberculosis. Chest 1974; 65(5): 522–526.
8. Brandstetter LD, Tamarin FM. Ocult mucous airway obstruction in diabetic ketoacidosis. Chest 1987; 91 : 575–578.
9. Brownlee M. Glycation products and the pathogenesis of diabetic complications. Diabetes care 1992; 15 : 1835–1843.
10. Brownlee M, Vlassara H, Cerami A. Nonenymatic glycosylation and the pathogenesis of diabetic complications. Annals of Internal Medicine 1984; 101 : 527–537.
11. Bryan C, Reynolds K. Bacteremic nosocomial pneumonia. Am Rev Respir Dis 1984; 129 : 668–671.
12. Carton JA, Maradona JA, Nuno FJ et al. Diabetes mellitus and bacteraemia: A comparative study between diabetic and non–diabetic patients. Eur J Med 1992; 1 : 281–287.
13. Dahl-Jorgensen, K.: Diabetic microangiopathy. Acta Paediatr 1998; 425 (Suppl):, 31–34.
14. Delamaire M, Maugendre D, Moreno M et al. Impaired leukocyte functions in diabetic patients. Diabetic Medicine 1997; 14 : 29–34.
15. Djavani M, Yenice S, Kirkali G et al. Interstitial collagens isolated from lung of rabbits with alloxan-induced diabetes mellitus. Biochemical Society Transactions 1993; 21 : 274.
16. Farina J, Furio V, Fernandez-Acenero MJ et al. Nodular fibrosis of the lung in diabetes mellitus. Virchows Arch 1995; 427 : 61–63.
17. Fein AM, Calalang–Colucci MG et al. Acute lung injury and acute respiratory distress syndrome in sepsis and septic shock. Critical Care Clinics 2000; 16(2): 289–317.
18. Frank JA, Nuckton TJ, Matthay MA. Diabetes mellitus: A negative predictor for the development of acute respiratory distress syndrome from septic shock. Critical Care Medicine 2000; 28(7): 2645–2646.
19. Fuso L, Cotroneo P, Basso S et al. Postural variations of pulmonary diffusing capacity in insulin-dependent diabetes mellitus. Chest 1986; 110(4): 1009–1013.
20. Geerlings SE, Hoepelman AIM. Immune dysfunction in patients with diabetes mellitus. Immunology and Medical Microbiology 1999; 26 : 259–265.
21. Glass E, Stewart J, Matthews D et al. Impairment of monocyte „lectin-like“ receptor activity in Type I (insulin-dependent) diabetic patients. Diabetologia 1987; 30 : 228–231.
22. Groeneveld AB. Vascular pharmacology of acute lung injury and acute respiratory distress syndrome. Vascul Pharmacol 2002; 39(4–5): 247–256.
23. Guazzi M, Oreglia I, Guazzi MD. Insulin improves alveolar-capillary membrane gas conductance in type 2 diabetes. Diabetes Care 2002; 25(10): 1802–1806.
24. Huang S. Asthma and diabetes. The Lancet 1999; 354 : 515.
25. Christian JL, Brun-Buisson M, Bonnet F et al. Recurrent high-permeability pulmonary edema associated with diabetic ketoacidosis. Crit Care Med 1985; 13(1): 55–57.
26. Ingbar DH. Mechanism of repair and remodeling following acute lung injury. Clinics in Chest Medicine 2000; 21(3): 589–616.
27. Jian R. Disorders of gastric emptying. Presse Med 1992; 21 : 1072–1078.
28. Kaneki T, Koyama S, Wada S et al. Acute pulmonary edema caused by accidental aspiration of sweetened water in two cases of diabetes mellitus. Intern Med 1998; 37 : 969–972.
29. Karačunskij MA, Panasek IA, Filippov VP. Legočnaja mikroangiopatia pri tuberkuleze legkich, razvivšemsia u bolnych sacharnym diabetom. Probl Tuberk 1996; 6 : 50–52.
30. Katz S, Klein B, Elian I. Phagocytic activity of monocytes from diabetic patients. Diabetes Care 1983; 6 : 479–482.
31. Kinekawa F, Kubo F, Matsuda K et al. Relationship between esophageal dysfunction and neuropathy in diabetic patients. Am J Gastroenterol 2001; 96 : 2026–2032.
32. Koziel H, Koziel MJ. Pulmonary complications of diabetes mellitus. Infectious Disease Clinics of North America 1995; 9 : 65–90.
33. Krausová Z, Pavlík Z, Anděl M et al. Sérové hladiny a močové vylučování zinku u nemocných s inzulin dependentním diabetem. Časopis lékařů českých 1990; 129 : 945–949.
34. Lang S, Thorsteinsson B, Nerup J et al. Diabetes mellitus in cystic fibrosis: effect of insulin therapy on lung function and infections. Acta Pediatr 1992; 151 : 684–687.
35. Lipsky BA, Pecoraro RE, Chen MS. Factors affecting staphylococcal colonization among NIDDM outpatients. Diabetes Care 1987; 10 : 483–486.
36. Lluch I, Ascaso JF, Mora F et al. Gastroesophageal reflux in diabetes mellitus. Am J Gastroenterol 1999; 94 : 919–924.
37. Loukides S, Polyzogopoulos D. The effect of diabetes mellitus on the outcome of patients with chronic obstructive pulmonary disease exacerbated due to respiratory infections. Respiration 1996; 63 : 170–173.
38. Marhoffer W, Stein M, Maeser E et al. Impairment of polymorphonuclear leukocyte function and metabolic control of diabetes. Diabetes Care 1992; 15 : 256–260.
39. Marinos E. Changing concepts of nutrient requirements in disease: implications of artificial support. Lancet 1995; 345 : 1279–1284.
40. Marvisi M, Marani G, Brianti M et al. Pulmonary complications in diabetes mellitus. Recenti Prog Med 1996; 87(12): 623–627.
41. McMahon MM, Bistrian BR. Host defenses and susceptibility of infection in patients with diabetes mellitus. Infectious Disesase Clinics of North America 1995; 9 : 1–9.
42. Moran A, Doherty L, Wang X et al. Abnormal glucose metabolism in cystic fibrosis. J. Pediatr. 1998; 133(1): 10–16.
43. Morris JT, Seaworth BJ, Mc Alister CK. Pulmonary tuberculosis in diabetics. Chest 1992; 102 : 539–541.
44. Moss M, Guidot DM, Steiberg KP et al. Diabetic patients have a decreased incidence of acute respiratory distress syndrome. Crit Care Med 2000; 28(7): 2187–2192.
45. Paradisi F, Corti G, Messeri D. Antistaphylococcal (MSSA, MRSA, MSSE, MRSE) antibiotics. Medical Clinics of North America 2001; 1(85): 1–17.
46. Piccioni M, Manfrini S. Bronchial responsiveness to methacholine in insulin–dependent diabetic patients with autonomic neuropathy. Chest 1994 : 105(2); 644–645.
47. Ravel A. Clinical Laboratory Medicine. 6th ed. Philadephia: Mosby-Year Book 1995.
48. Sandler M, Bunn AE, Stewart RI. Cross section study of pulmonary function in patients with insulin-dependent diabetes mellitus. Am Rev Respir Dis 1987; 135 : 223–229.
49. Santos e Fonseca CM, Manco JC, Gallo Junior L et al. Cholinergic bronchomotor tone and airway caliber in insulin-dependent diabetes mellitus. Chest 1992; 101(4): 1038–1043.
50. Shernthaner G, Haber P, Kummer F et al. Lung elasticity in juvenile onset diabetes mellitus. Am Rev Resp Dis 1977; 116 : 544–554.
51. Schleider ED, Wagner E, Uerlich AG. Increased accumulation of the glycoxidation product N (epsilon) – (carboxymethyl) lysine in tissues in diabetes and aging. J Clin Invest 1997; 99(3): 457–468.
52. Schnack C, Festa A, Schwarzmaier D et al. Pulmonary dysfunction in type 1 diabetes in relation to metabolic longterm control and to incipient diabetic nephropathy. Nephron 1996; 74 : 395–400.
53. Schnapf BM, Banks RA, Silverstein JH et al. Pulmonary function in insulindependent diabetes mellitus with limited joint mobility. Am Rev Respir Dis 1984; 130(5): 930–932.
54. Suga T, Sugiyama Y, Kitamura S. Clinical study of patients with idiopathic interstitial pneumonia accompanied by diabetes mellitus. Nippon Kyobu Shikkan Gakkai Zashi 1994; 32(12): 1131–1135.
55. Theodore J, Robin ED. Pathogenesis of neurogenic pulmonary oedema. The Lancet 1975; 18 : 749–751.
56. Vlassara H. Advanced glycation endproducts and atherosclerosis. Annals of Medicine 1996; 28 : 419–426.
57. Wang CH, Yu CT, Lin HC et al. Hypodense alveolar macrophages in patients with diabetes mellitus and active pulmonary tuberculosis. Tuber Lung Dis 1999; 79(4): 235–242.
58. Wanke T, Formanek D. Mechanical load in the inspiration muscles during exercise hyperpnoe in patients with 1. type diabetes mellitus. Diabetologia 1992; 35 : 425–428.
59. Wanke T, Abrahamian H, Lahrmann H et al. No effect of naloxone on ventilatory response to progressive hypercapnia in IDDM patients. Diabetes 1993; 42 : 282–287.
60. Wanke T, Paternostro–Sluga T, Grisold W et al. Phrenic nerve function in type 1 diabetic patients with diaphragm weakness and peripheral neuropathy. Respiration 1992; 59 : 233–237.
61. Weir DC, Jennings PE, Hendy ML et al. Transfer factor for carbon monoxide in patients with diabetes with and without microangiopathy. Thorax 1988; 43 : 725–726.
62. Woodhead M, Mac Farlane J, McCracken J. Prospective study of the aetiology and outcome of pneumonia in the community. Lancet 1987; 1 : 671–674.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2005 Číslo 5- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Katetrová ablace atrioventrikulární nodální reentry tachykardie
- Prodloužené podávání nízkomolekulárních heparinů
- Genetické testy v predikci toxicity chemoterapie – první krok nové éry onkoterapie
- Normoglykemie – terapeutický cíl pro diabetiky (i nediabetiky) v kritickém stavu
- Obezita, spánková apnoe a erektilní dysfunkce: tři vrcholy jednoho trojúhelníku?
- Naše zkušenosti s léčbou membranózní nefropatie cyklosporinem
- Akútna myokarditída, výskyt, diagnostika a liečba v spádovej nemocnici
- Prevence žilní trombózy a plicní embolie na interním oddělení
- Příčina klinických projevů chronické žilní nedostatečnosti u pacientů s nadváhou a obezitou
- Urgentní endoskopická papilosfinkterotomie u osob starších 70 let
- Prietok cez portálnu vénu a kongestívne poškodenie pečene u chorých s pokročilým srdcovým zlyhávaním
- Katetrová ablace atrioventrikulární nodální reentry tachykardie (neinvazivní možnosti diagnostiky, okamžité a jednoroční výsledky sledování skupiny 40 nemocných s provedenou radiofrekvenční ablací v roce 2002)
- Vazospastická angina pectoris – patogeneza, diagnostika a léčba
- Prodloužené podávání nízkomolekulárních heparinů v prevenci pooperační trombózy
- Genetické testy v predikcii účinnosti a toxicity chemoterapie u onkologických pacientov
- Pneumologická problematika pacientů s diabetes mellitus
- Obstrukční spánková apnoe, hypertenze a erektilní dysfunkce
- Lokalizace zdroje recidivujícího krvácení v tenkém střevě u hemoragické hereditární teleangiektazie pomocí scintigrafie s in vivo označenými erytrocyty pomocí 99mTc−pertechnetátu
- Systémová AL−amyloidóza s dominující klinickou manifestací v trávicím traktu
- Primář MUDr. Petr Svačina jubilující
- XXIV. dny mladých internistů, Olomouc 26.–27. 5. 2005 – gastroenterologie
- XXIV. dny mladých internistů, Olomouc 26.–27. 5. 2005 – hematologie
- XXIV. dny mladých internistů, Olomouc 26.–27. 5. 2005 – kardiologie
- XXIV. dny mladých internistů, Olomouc 26.–27. 5. 2005 – nefrologie
- XXIV. dny mladých internistů, Olomouc 26.–27. 5. 2005 – poruchy metabolizmu, endokrinologie, diabetes mellitus
- XXIV. dny mladých internistů, Olomouc 26.–27. 5. 2005 – revmatologie
- XXIV. dny mladých internistů, Olomouc 26.–27. 5. 2005 – varia
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Akútna myokarditída, výskyt, diagnostika a liečba v spádovej nemocnici
- Vazospastická angina pectoris – patogeneza, diagnostika a léčba
- Naše zkušenosti s léčbou membranózní nefropatie cyklosporinem
- Pneumologická problematika pacientů s diabetes mellitus
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



