-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Mechanické podpory a transplantace srdce v léčbě chronického srdečního selhání
Mechanical circulatory support and heart transplantation for treatment of chronic heart failure
Heart transplantation is the gold standard for patients with end‑stage heart failure. The available donor supply limits the number of cardiac transplants. Transplant centres need to provide alternative therapy for these patients with heart failure. The mechanical circulatory support systems are used as a bridge to transplantation in heart transplant candidates (long‑term support). This review describes the current status of heart transplantation and long‑term mechanical circulatory support devices for treatment of chronic heart failure.
Keywords:
chronic heart failure – mechanical circulatory support – heart transplantation
Autoři: P. Fila 1,2; H. Bedáňová 1,2; V. Horváth 1,2; J. Ondrášek 1; P. Piler 1,2; P. Němec 1,2
Působiště autorů: Centrum kardiovaskulární a transplantační chirurgie, Brno 1; Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně 2
Vyšlo v časopise: Kardiol Rev Int Med 2014, 16(2): 109-115
Kategorie: Kardiologická revue
Souhrn
Zlatým standardem léčby konečného stadia srdečního selhání je transplantace srdce. Nedostatek dárců omezuje množství provedených srdečních transplantací. Transplantační centra potřebují těmto pacientům nabídnout alternativu pro léčbu srdečního selhání. Mechanické srdeční podpory jsou používány jako tzv. most k transplantaci u pacientů na čekací listině (dlouhodobé podpory). Tento souhrnný článek popisuje současný stav léčby chronického srdečního selhání transplantací srdce a implantací mechanické srdeční podpory.
Klíčová slova:
chronické srdeční selhání – mechanická srdeční podpora – transplantace srdceSrdeční selhání
Srdeční selhání je syndromem, při kterém dochází ke snížení minutového výdeje navzdory dostatečnému plnění komor. Snížený výdej není schopen pokrýt metabolické nároky tkání [1]. V závislosti na čase hovoříme o chronickém srdečním selhání (CHSS) jako takovém, které se v čase projevuje perzistentním nebo zhoršujícím se průběhem. V definici srdečního selhání hraje důležitou roli přítomnost symptomů, objektivní známky a prokázaná porucha srdeční funkce. Na základě těchto příznaků dělíme srdeční selhání na levostranné, pravostranné a oboustranné. Prevalence srdečního selhání v evropské populaci se pohybuje mezi 1 a 2 %. Stárnutím populace a zlepšením léčby však prevalence s věkem narůstá [2]. Před rokem 1990 zemřely dvě třetiny pacientů do pěti let po stanovení diagnózy. Zefektivněním léčby bylo v posledních letech dosaženo redukce počtu hospitalizací a signifikantního poklesu mortality [3,4]. Cílem terapie srdečního selhání není však pouze snížení mortality a prodloužení života, ale i zlepšení kvality života (tj. zmenšení nebo úplné odstranění symptomů, zvýšení tolerance zátěže) [5]. Stewart et al upozorňují na to, že pacienti s diagnózou nádorového onemocnění přežívají déle než ti s diagnostikovaným srdečním selháním. Proto může být srdeční selhání považováno za „malignější“ onemocnění než většina nádorů [6] a proto také vyžaduje „agresivní“ léčbu.
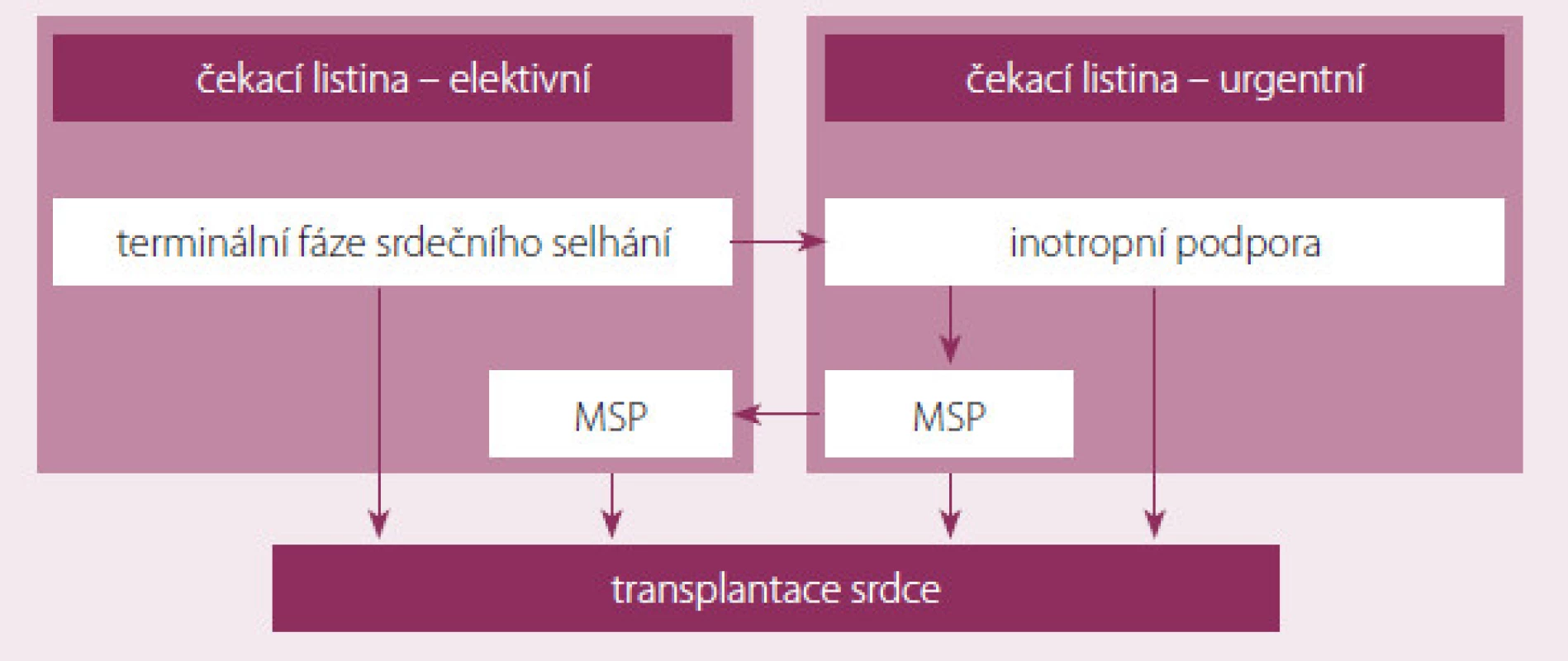
Definitivním terapeutickým řešením konečného stadia srdečního selhání je v indikovaných případech transplantace srdce (TS). Navzdory komplikacím nutné imunosupresivní terapie po TS je shoda na tom, že TS poskytuje zlepšené přežívání, tělesnou aktivitu a kvalitu života ve srovnání s konvenční léčbou. Počet pacientů na čekací listině (waiting list – WL) k transplantaci srdce v ČR se za posledních pět let více než zdvojnásobil. Počet uskutečněných transplantací srdce se z důvodů nedostatečného počtu dárců mění pouze o jednotky procent [7]. Dochází tedy k prodlužování čekací doby pacientů na WL, a tím k vzestupu morbidity a mortality. To vedlo v posledních desetiletích ke snaze o vývoj a zdokonalování mechanické srdeční podpory (MSP) – zařízení, které u kriticky selhávajících pacientů umožní zlepšení hemodynamických parametrů, a tím zlepšení orgánové perfuze. Tak lze překlenout dobu do uskutečnění transplantace srdce (obr. 1). Porovnání výhod a nevýhod obou zmíněných léčebných postupů je prezentováno v tab. 1.
Tab. 1. Výhody a nevýhody mechanické srdeční podpory a transplantace srdce. 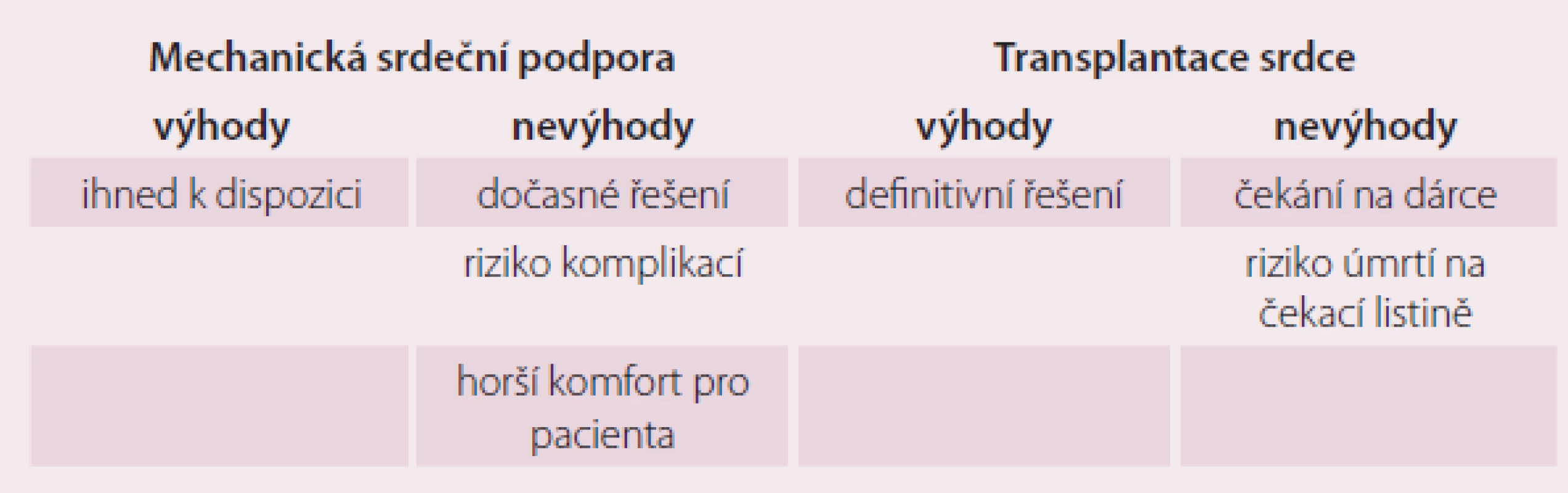
Mechanická srdeční podpora
Mechanické srdeční podpory jsou terapeuticky a technologicky dynamicky se rozvíjející oblastí. Jejich vývoj začal v USA v 50. letech minulého století. V tehdejším Československu se vývoji věnoval i tým kolem prof. Vašků v Brně [8]. K širšímu použití se komerčně vyráběné systémy dostaly v posledních dvou desetiletích.
Mechanické srdeční podpory jsou čerpadla, která jsou schopna částečně nebo zcela převzít úlohu srdce u pacientů v terminální fázi srdečního selhání a umožní obnovení dostatečného srdečního výdeje. Principem je, že funkce srdce je nahrazena mechanickým čerpadlem. Pomocí těchto pump je možné pacienta dovést k úspěšné transplantaci srdce. Podle toho, která část funkce srdce je čerpadlem nahrazena, dělíme podpory na levostranné (LVAD – left ventricular assist device), pravostranné (RVAD – right ventricular assist device) a biventrikulární (BIVAD – biventricular assist device). Dělení MSP podle ostatních parametrů ukazuje tab. 2.
Tab. 2. Dělení mechanických srdečních podpor. 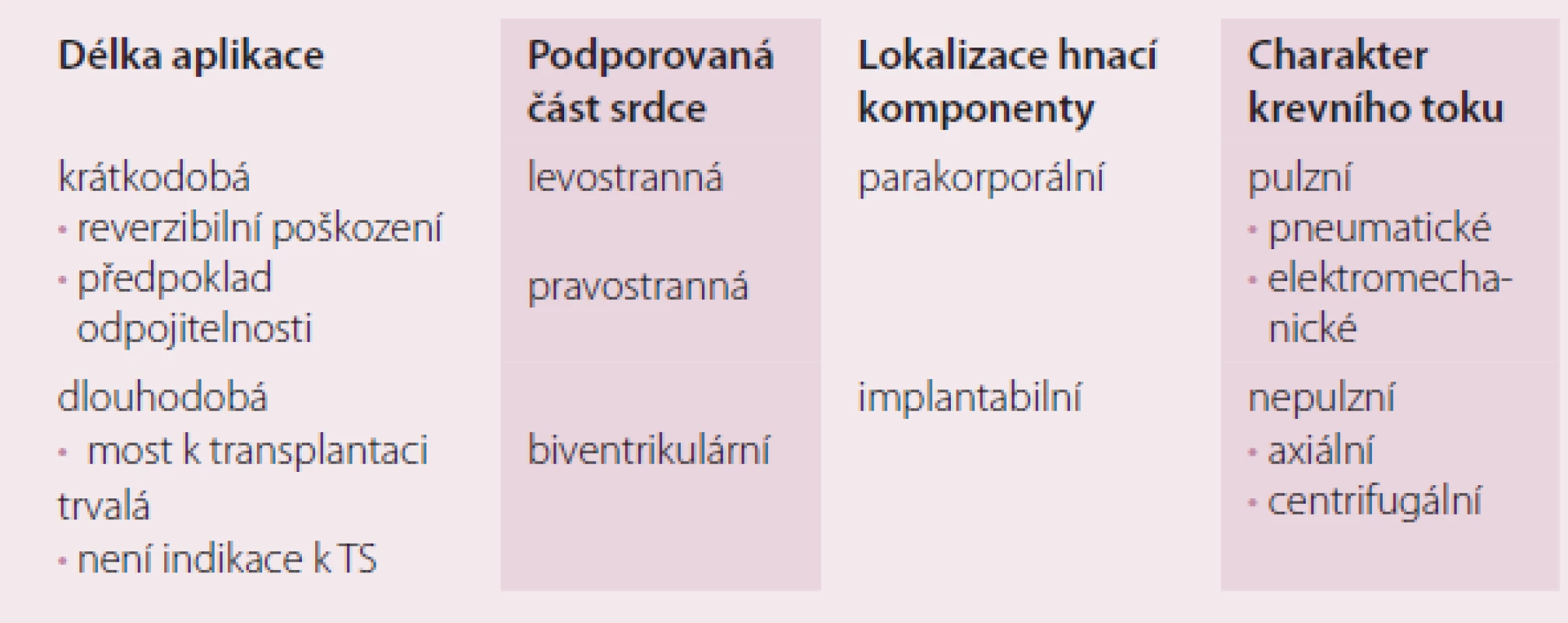
Daleko méně často používaným zařízením jsou tzv. umělá srdce (total artificial heart), která srdeční komory včetně atrioventrikulárních a ventrikuloarteriálních chlopní zcela nahrazují. Tato zařízení nebudou v následujícím textu diskutována.
Účel, k jakému mohou být MSP použity:
- Bridge to decision – pacienti s akutním srdečním selháním před zhodnocením dalších terapeutických možností, zhodnocením neurologického stavu a orgánových funkcí.
- Bridge to recovery – u akutních, ale reverzibilních stavů srdečního selhání. Před vlastní implantací není možná validní predikce pacientů, u kterých doje k úspěšnému zotavení. Po zotavení funkce srdce je MSP explantována.
- Bridge to candidancy – ke zlepšení orgánových funkcí tak, aby se z pacienta nevhodného k transplantaci stal pacient vhodný. Vhodné zvláště u pacientů s renální insuficiencí a plicní hypertenzí, kdy po implantaci MSP může dojít ke změnám v plicní cirkulaci a snížení plicní vaskulární rezistence. Nemocní mohou z tohoto postupu profitovat [9].
- Bridge to transplantation – k přežití doby, než bude k dispozici vhodný srdeční štěp.
- Destination therapy – trvalé použití MSP u pacientů v terminální fázi srdečního selhání, kteří nejsou indikováni k TS (v ČR není v současné době hrazena z veřejného zdravotního pojištění). Rychle narůstá podíl této skupiny pacientů v zemích západní Evropy a USA, kde se LVAD stává permanentním řešením u pacientů s chronickým srdečním selháním.
U prvních dvou skupin se jedná o akutní srdeční selhání. V tomto článku jsou však převážně diskutováni pacienti s chronickým srdečním selháním, při kterém se většinou použijí implantabilní zařízení pro dlouhodobou podporu srdce.
Indikace k implantaci MSP
Dlouhodobé MSP by měly být určeny pro pacienty, kteří jsou navzdory farmakologické léčbě v konečném stadiu srdečního selhání a jsou vhodní k zařazení na WL pro transplantaci srdce.
K MSP jako „bridge to transplantation“ je tedy indikován pacient, který je zařazený na čekací listinu a jehož stav se náhle zhoršil ve smyslu zhoršení dušnosti – NYHA IV, je závislý na inotropní podpoře, refrakterní na maximální medikamentózní terapii, má nízký srdeční výdej a nízký TK. V takovém případě MSP zlepšuje stav, redukuje počet rehospitalizací a snižuje riziko úmrtí na WL.
Dle doporučení European Society of Cardiology jsou možnými kandidáty pro implantaci MSP pacienti, kteří mají více než dva měsíce trvající těžké symptomy srdečního selhání i přes veškerou dostupnou terapii a splňují více než jedno z následujících kritérií [2]:
- EF LK < 25 %, a pokud lze provést, tak spotřeba kyslíku < 12 ml/ kg/ min,
- více než tři hospitalizace pro srdeční selhání v posledních 12 měsících,
- závislost na inotropní podpoře,
- progredující orgánová dysfunkce (zhoršení renálních a/ nebo jaterních funkcí) způsobená zhoršenou perfuzí a neadekvátním plnicím tlakem (PCWP ≥ 20 mmHg a systolický TK ≤ 80 – 90 mmHg nebo srdeční index ≤ 2 l/ min/ m²),
- zhoršující se funkce pravé komory.
Pacient s CHSS prochází epizody dekompenzace. Důležité je, aby MSP nebyla implantována příliš brzy (možnost kompenzace stavu při konvenční terapii), ale na druhé straně, aby nebyla implantována pozdě, kdy už dojde k selhání životně důležitých orgánů (obr. 2).
Obr. 2. Použití MSP v průběhu chronického srdečního selhání. 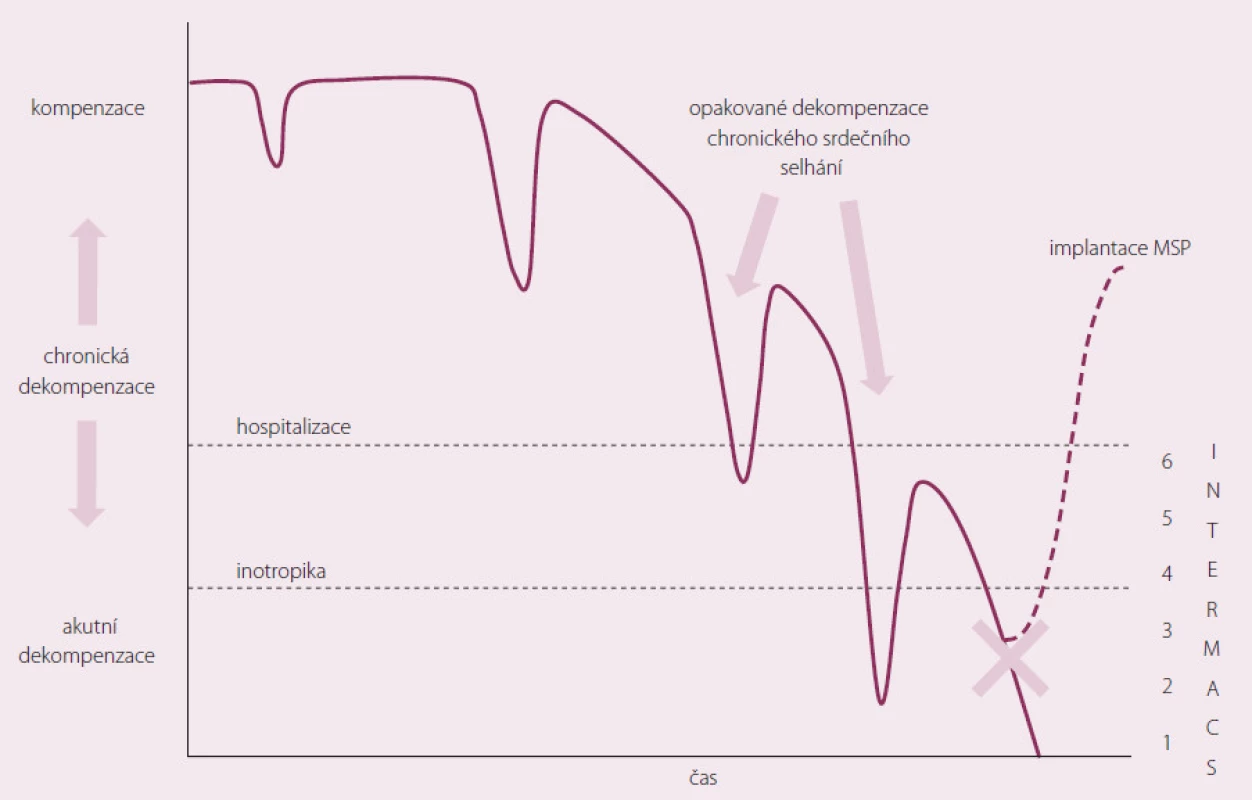
Byla vytvořena klasifikace do sedmi funkčních skupin tzv. INTERMACS škály podle stavu pacienta před implantací MSP (tab. 3). INTERMACS (Interagency Registry for Mechanically Assisted Circulatory Support) je registr, kde jsou shromažďována data o více než 6 000 pacientech s implantovanou dlouhodobou MSP, kteří jsou sledováni již více než šest let [10]. Za každoroční analýzou dat z tohoto registru je mj. snaha o zlepšení výběrů nemocných a zlepšení výsledků pacientů s dlouhodobou MSP.
Tab. 3. Dělení pacientů podle INTERMACS úrovně. 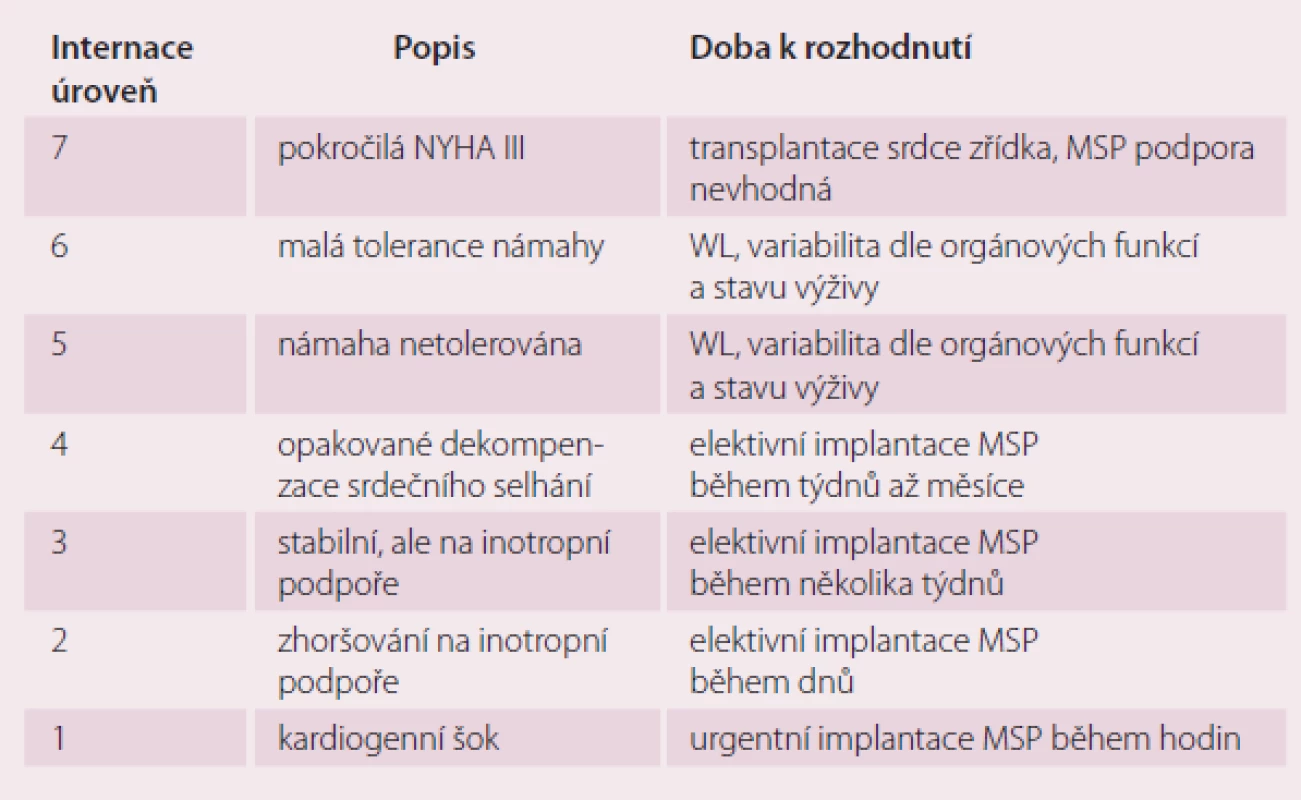
Používanými skórovacími systémy k odhadu prognózy pacienta na základě klinických, laboratorních a hemodynamických parametrů jsou např. Columbia Score, Leitz ‑ Miller Score, APACHE II Score, Seatle Heart Failure Model [11]. Zdá se, že predikce výsledků a hlavně načasování implantace (obr. 3) jsou klíčové pro celkový průběh léčby pacientů s MSP a poskytují nám i zpětnou vazbu při dalších rozhodováních o zvoleném postupu. Rozsáhlé registry v kombinaci s moderními statistickými analýzami umožňují vytvoření smysluplných skórovacích systémů, které mohou být alternativou randomizovaných studií [12].
Obr. 3. Správné načasování implantace MSP. 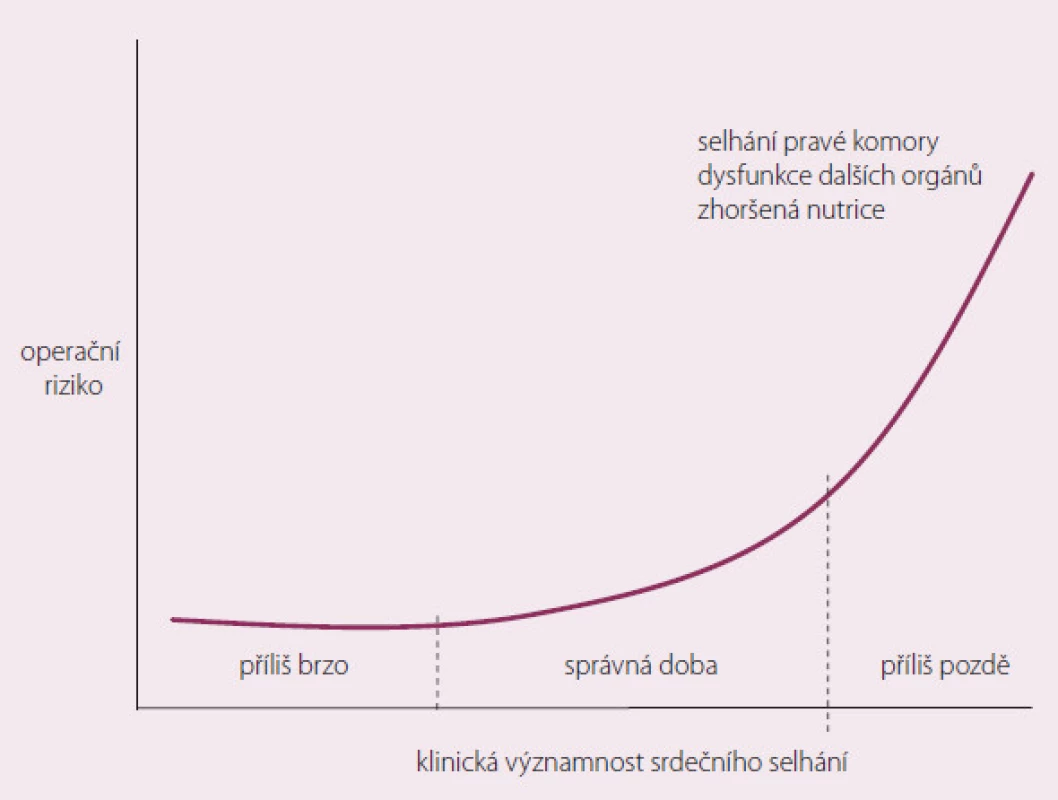
Chirurgická technika
Nejnovější dlouhodobé MSP používané v klinické praxi jsou bezložiskové centrifugální pumpy, jejichž konstrukce umožnila redukci rozměrů zařízení. Implantace dlouhodobé MSP je standardně prováděna v mimotělním oběhu ze střední sternotomie. Právě miniaturizace těchto zařízení umožnila užití miniinvazivních přístupů i v této oblasti. V současné době nejčastěji používané levostranné mechanické podpory lze implantovat z minitorakotomií nebo subkostálního řezu (implantace vlastního čerpadla – zavedení vtokové části čerpadla do hrotu levé komory) v kombinaci s parciální horní ministernotomií nebo pravostrannou minitorakotomií (pro našití výtokové protézy). Menší invazivitou dochází ke snížení výskytu adhezí před následnou transplantací srdce. Miniinvazivní technika implantace zlepšuje pooperační průběh, redukuje poškození jater [13], krvácivé komplikace a hlavně snižuje riziko selhání pravé komory [14] pravděpodobně tím, že bez sternotomie se vyhneme rozsáhlejšímu otevření perikardu, čímž omezíme dilataci pravé komory [15]. Právě selhání pravé komory musí být léčeno časně a agresivně. Pokud je dysfunkce pravé komory po implantaci LVAD refrakterní k medikamentózní léčbě, je nutná následná implantace většinou krátkodobé pravostranné MSP.
Pooperační péče
Na pooperačním oddělení jsou nemocným s implantovanou dlouhodobou MSP standardně monitorovány životní funkce. Časně po operaci mají zavedenou antikoagulační terapii kontinuálním heparinem s následným převodem na terapii warfarinem. Cílové INR by se mělo pohybovat mezi 2,0 a 3,0 se současnou antiagregační terapií [16] nebo dle doporučení výrobců jednotlivých zařízení. Pacienti jsou postupně vertikalizováni a za současné rehabilitace přemístěni na standardní oddělení. Pacient i rodinní příslušníci jsou proškoleni v péči o zařízení a je důležité, aby pochopili jednotlivé typy jeho alarmů. Pacient musí zvládnout péči o místo vstupu kabelu. Pokud to vše pacient zvládne a jeho zdravotní stav to dovoluje, může být propuštěn do domácí péče (15 z 19 nemocných s implantovanou dlouhodobou MSP na našem pracovišti bylo propuštěno do domácí péče). Po propuštění je ambulantně kontrolováno nastavení antikoagulační terapie a pacient dochází po 2 – 4 týdnech k pravidelným kardiologickým kontrolám v centru, kde byla MSP implantována. Pacienti jsou zařazeni na čekací listinu k transplantaci srdce.
Komplikacemi po implantaci MSP může být krvácení (důsledek antikoagulační terapie, koagulopatie v důsledku dysfunkce jater), tromboembolické a neurologické komplikace, infekce (celkové nebo lokální kolem kabelu – tzv. drive‑line infekce) a hemolýza. U pacientů zařazených na čekací listinu je třeba před TS počítat se zvýšenou imunologickou senzibilizací, kdy zvláště množství podaných krevních derivátů v perioperačním období způsobí vzestup panelu reaktivních protilátek [17]. Tato senzibilace se vyskytuje až u 60 % nemocných s LVAD [18] a vyžaduje agresivnější imunosupresivní léčbu po TS. Některé studie ukazují, že novější generace MSP způsobují nižší imunologickou a zánětlivou odpověď organizmu [19].
Budoucnost MSP
Rychlý rozvoj moderních technologií je vidět i v oblasti MSP. Jejich budoucnost se dá shrnout do tří základních bodů:
- Miniaturizace – již na generaci v současné době implantovaných podpor je vidět trend ve zmenšování rozměrů. To umožňuje snadnější implantaci miniinvazivními přístupy s menší zátěží pro pacienta. Zatímco na počátku vývoje byla řídicí jednotka obrovské zařízení vážící několik desítek kilogramů, nyní je to malá krabička, kterou spolu s bateriemi nosí pacient v příruční tašce. Miniaturizace bude zcela jistě i nadále pokračovat.
- Bezdrátové ovládání a přenos energie – kabel k ovládací jednotce a napájení je jediným spojením moderních implantabilních zařízení se zevním prostředím. Tento vstup je současně rizikovým místem pro vznik tzv. drive‑line infekcí. V současnosti vidíme pokroky ve vývoji zařízení, které mohou být podobně jako pacemakery nastavovány přes kůži, a plně implantabilních vysokokapacitních baterií s možností transkutánního dobíjení. To umožní zlepšení komfortu pro pacienta se snížením rizika infekčních komplikací.
- Eliminace antikoagulační terapie – všechna v současné době používaná MSP vyžadují nutnost antikoagulace. Zdá se, že k vytvoření netrombogenního neointimálního povrchu zařízení, který by dovolil eliminovat antikoagulační terapii, je zatím cesta nejdelší.
Pokud by se podařilo vyřešit výše zmíněné problémy, mechanické srdeční podpory by mohly být zařízeními, která se stanou definitivním řešením pro selhávající srdce a která možná nahradí i transplantace srdce.
Transplantace srdce
Historie a současnost
Po první transplantaci srdce u člověka v roce 1967 v Jihoafrické republice nastalo období špatných výsledků a skepse. K oživení zájmu došlo po objevení imunosupresivního účinku cyklosporinu v roce 1976 [20]. První TS v tehdejším Československu byla provedena v roce 1968 v Bratislavě. V ČR fungují v současnosti dvě centra, kde se provádějí transplantace srdce – IKEM Praha a Centrum kardiovaskulární a transplantační chirurgie (CKTCH) Brno.
Indikace k transplantaci srdce
K TS je indikován pacient v terminálním stadiu srdečního selhání, které není řešitelné konvenčními metodami léčby (vč. biventrikulární kardiostimulace, implantace kardiovertoru/ defibrilátoru), a zároveň je bez přítomných kontraindikací zařazení na WL. Pacienta, u kterého došlo k akutnímu zhoršení stavu, lze k transplantaci přivést pomocí dlouhodobé MSP (jak bylo zmíněno výše). Indikační a kontraindikační kritéria [1] k TS jsou uvedena v tab. 4 a 5. Onemocnění jako ischemická choroba srdeční a kardiomyopatie tvoří zdaleka nejčastější důvod k indikaci k TS. Dále jsou to vrozené srdeční vady a srdeční selhání v důsledku chlopenních vad. V poslední době se objevují některé choroby (amyloidóza), které dříve byly kontraindikací, a dnes jsou tito pacienti zařazováni na WL [21]. Stávající kritéria jsou stanovena obecně a například závažné postižení jater nebo ledvin, případně obojího, lze řešit kombinovanou transplantací srdce + játra, srdce + ledvina, případně srdce + játra + ledvina. Tato raritní operace byla na našem pracovišti jako první v Evropě provedena v roce 2005 týmem profesora Černého.
Tab. 4. Indikace k transplantaci srdce. 
Tab. 5. Kontraindikace transplantace srdce. 
Pacienti, kteří vyžadují hospitalizaci, a pacienti na levostranné mechanické srdeční podpoře figurují na WL v urgentním pořadí, ostatní nemocné považujeme za elektivní příjemce. Průměrná čekací doba na elektivním WL je na našem pracovišti v posledních pěti letech 186 dnů, u urgentních pacientů 46 dnů. Mortalita na WL se pohybuje kolem 9 %.
Dárcem srdce je člověk s prokázanou nevratnou mozkovou smrtí. Kritéria pro stanovení smrti mozku jsou uvedena v platném znění Zákona o darování, odběrech a transplantacích tkání a orgánů (Transplantační zákon) [22]. V ČR není vyžadován souhlas s odběrem orgánů, vychází se z předpokládaného souhlasu.
Akceptován je dárce s ohledem na věk, váhový rozdíl s příjemcem ± 20 %, shodou v krevní skupině a ev. cross ‑ match testu. Vzhledem ke zvyšujícímu se počtu pacientů na WL a úbytku tzv. ideálních dárců (muž, do 40 let, nekuřák s negativní kardiovaskulární anamnézou) je snaha o rozšíření dárcovského poolu využitím takzvaných marginálních dárců. To ovšem s sebou může nést vyšší riziko selhání graftu, vyšší incidenci přenesené aterosklerózy a koronární nemoci štěpu a je třeba počítat i s horším dlouhodobým přežíváním [23]. Khush et al však na základě analýzy více než 1 800 dárců zjistili, že pouze smrt dárce na cévní mozkovou příhodu prodloužila hospitalizaci příjemce. A pouze diabetes mellitus dárce byl prediktorem zvýšené mortality příjemce. Proto si troufají tvrdit, že vliv řady komplikujících faktorů u dárců je přeceňován a rozbor výsledků by nás mohl nasměrovat k více liberálnímu použití srdečních štěpů s relativní kontraindikací [24]. I přesto je potřeba odběr srdce od takového dárce vždy pečlivě individuálně zvážit. Navzdory rozevírajícím se nůžkám mezi nárůstem počtu pacientů v terminálním srdečním selhání a nedostatkem dárců se počet akceptovaných dárcovských srdcí pro transplantaci na našem pracovišti pohybuje pouze kolem 36 %. Je to dáno tím, že velká část dárců jsou právě dárci marginální či zcela nevhodní k použití srdce k transplantaci.
Chirurgická technika
Vlastní operační výkon má dvě části – odběr srdce od dárce (většinou v rámci tzv. multiorgánového odběru) a transplantace příjemci. Při dárcovské operaci provede odebírající chirurg po otevření perikardiální dutiny definitivní zhodnocení srdce. V důsledku mozkové smrti dochází k tzv. katecholaminové bouři. Z tohoto důvodu je snaha minimalizovat poškození srdce systémem péče o dárce a kvalitní ochranou myokardu kardioplegickým roztokem při odběrové operaci. Ať již probíhá odběr orgánu v místě transplantace nebo v jiném zdravotnickém zařízení, je potřebná důsledná koordinace mezi odběrovým a transplantačním týmem. Cílem je, aby k obnovení průtoku koronárním řečištěm transplantovaného srdce došlo v co nejkratší době (max. do 4 hod). Transplantované srdce je v současnosti v naprosté většině případů našíváno tzv. bikavální technikou popsanou Sarsamem v roce 1993 [25]. Příjemci se zvýšenou plicní vaskulární rezistencí mají vyšší riziko selhání pravé komory. Toto je však po dostatečné reperfuzi transplantovaného srdce většinou zvládnuto farmakologicky. Ve výjimečných případech musí být transplantovanému implantována pravostranná mechanická srdeční podpora.
Pooperační péče
Základ pooperační péče o pacienty po TS zůstává podobný jako u pacientů po jiných kardiochirurgických operacích. V čem se však zásadně liší, je nutnost imunosupresivní terapie k zabránění rejekce transplantovaného orgánu.
Podle doby vzniku od TS rozdělujeme rejekci na:
- Hyperakutní – protilátkami zprostředkovaná rejekce s trombózou srdečních venul, ke které dochází do 24 hod od transplantace. Pouze urgentní napojení pacienta na oboustrannou mechanickou srdeční podporu a následná retransplantace může zachránit nemocného od smrti.
- Akutní humorální – působením na antigeny v endotelu štěpu dochází ke zvýšené permeabilitě endotelu a ke tvorbě mikrovaskulárních trombóz.
- Akutní celulární – dochází k infiltraci myokardu lymfocyty. Hodnocení závažnosti tohoto typu rejekce je na základě tzv. Banffské klasifikace [26], která byla upravena v roce 2004 Mezinárodní společností pro transplantaci srdce a plic (ISHLT) [27]. 20 – 40 % příjemců srdečního štěpu prodělá tento typ rejekce nejméně 1× v průběhu prvního roku po transplantaci [28].
- Pozdní humorální – dochází k postižení věnčitých tepen.
K potlačení rejekce je pacientům peroperačně podána tzv. indukční imunosuprese (navození tolerance štěpu), která je následována chronickou imunosupresivní profylaxí (pro dlouhodobou toleranci štěpu). Pokud se u pacienta po TS vyskytne akutní rejekční epizoda, je použita nárazová léčba rejekce. Jako indukční imunosuprese je v současné době v CKTCH podáván basiliximab (monoklonální protilátky). Pro chronickou imunosupresi používáme kombinaci tacrolimus nebo cyklosporin A (u diabetiků na inzulinu) + mykofenolát mofetil + metylprednisolon. Imunosupresivní protokoly se v jednotlivých centrech mohou lišit, ale obecně se pro chronickou imunosupresi používá kombinace léků, aby mohla být redukována maximální dávka jednotlivých preparátů. Posouzení rizikovosti pacientů zhruba jeden rok po operaci umožňuje individuální nastavení imunosupresivní profylaxe. Vzhledem k tomu, že postupně dochází k určité imunotoleranci, je možné imunosupresivní léčbu některým pacientům ušít na míru [29].
Dalšími komplikacemi po TS kromě rejekce může být srdeční selhání, selhání ledvin, systémová a plicní hypertenze, arytmie, porucha glukózové tolerance, porucha metabolizmu lipidů, nádorová onemocnění a různé typy často i oportunních infekcí. Je potřebné, aby k možnému výskytu bylo ze strany pacienta přistupováno s určitou prevencí a ze strany ošetřujících lékařů časnou diagnostikou a optimální léčbou.
Po propuštění z hospitalizace zůstává transplantovaný ve sledování a péči lékařů z transplantačního centra. Jsou prováděny pravidelné endomyokardiální biopsie, posuzována funkce štěpu, řešeny případné komplikace, sledovány hladiny imunosuprese. Pacienti jsou motivováni ke zdravému a aktivnímu životnímu stylu.
Je snaha, aby díky spolupráci mezi jednotlivými lékařskými specializacemi a pacientem došlo k návratu transplantovaného, který byl ještě před několika měsíci v terminální fázi závažného srdečního selhání, do normálního a plnohodnotného života.
Závěr
Chronické srdeční selhání je ve své terminální fázi agresivním onemocněním a jako takové vyžaduje i agresivní léčebný přístup. Dovést pacienta úspěšně k transplantaci srdce nám pomáhají v posledních letech mechanické srdeční podpory. Až následující roky nebo desítky roků ukážou, jestli budoucnost léčby chronického srdečního selhání bude ve zvýšení počtu transplantací (při zvýšení počtu dárců), v nahrazení transplantací srdcí plně implatabilními mechanickými srdečními podporami, v kmenových buňkách nebo spíše v kombinaci všech zmíněných metod.
Podpořeno projektem European Regional Development Fund – Project FNUSA ‑ ICRC (No. CZ.1.05/ 1.1.00/ 02.0123.
Doručeno do redakce 21. 3. 2014
Přijato po recenzi 28. 3. 2014
MU Dr. Petr Fila
www.cktch.cz, www.icrc.cz
petr.fila@cktch.cz
Zdroje
1. Spinar J, Vitovec J, Hradec J et al. Czech Society of Cardiology guidelines for the diagnosis and treatment of chronic heart failure 2011. Cor et Vasa 2012; 54: e113 – e134. doi: 10.1016/ j.crvasa.2012.05.001.
2. McMurray JJ, Adamopoulos S, Anker SD et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur Heart J 2012; 33 : 1787 – 1847. doi: 10.1093/ eurheartj/ ehs104.
3. Stewart S, Ekman I, Ekman T et al. Population impact of heart failure and the most common forms of cancer: a study of 1 162 309 hospital cases in Sweden (1988 to 2004). Circ Cardiovasc Qual Outcomes 2010; 3 : 573 – 580. doi: 10.1161/ CIRCOUTCOMES.110.957571.
4. Jhund PS, Macintyre K, Simpson CR et al. Long‑term trends in first hospitalization for heart failure and subsequent survival between 1986 and 2003: a population study of 5.1 million people. Circulation 2009; 119 : 515 – 523. doi: 10.1161/ CIRCULATIONAHA.108.812172
5. Lewis EF, Johnson PA, Johnson W et al. Preferences for quality of life or survival expressed by patients with heart failure. J Heart Lung Transplant 2001; 20 : 1016 – 1024. doi: 10.1016/ S1053 – 2498(01)00298 – 4.
6. Stewart S, MacIntyre K, Hole DJ et al. More ‘malignant’ than cancer? Five‑year survival following a first admission for heart failure. Eur J Heart Fail 2001; 3 : 315 – 322. doi: 10.1016/ S1388 – 9842(00)00141 – 0.
7. Koordinační středisko transplantací: Statistiky 2014. Dostupné z: http:/ / www.kst.cz/ web/ ?cat=4.
8. Vasku J, Cerny J, Dostal M et al. Recent efforts in artificial heart research in Czechoslovakia. ASAIO Trans 1989, 35 : 805 – 811.
9. Elhenawy AM, Algarni KD, Rodger M el al. Mechanical circulatory support as a bridge to transplant candidacy. J Card Surg 2011; 26 : 542 – 547. doi: 10.1111/ j.1540 - 8191.2011.01310.x.
10. Kirklin JK, Naftel DC, Kormos RL et al. Fifth INTERMACS annual report: risk factor analysis from more than 6,000 mechanical circulatory support patients. J Heart Lung Transplant 2013, 32 : 141 – 156. doi: 10.1016/ j.healun.2012.12.004.
11. Schaffer JM, Allen JG, Weiss ES et al. Evaluation of risk indices in continuous ‑ flow left ventricular assist device patients. Ann Thorac Surg 2009; 88 : 1889 – 1896. doi: 10.1016/ j.athoracsur.2009.08.011.
12. Acker MA, Pagani FD, Stough WG et al. Statement regarding the pre and post market assessment of durable, implantable ventricular assist devices in the United States. Circ Heart Fail, 2013, 6: e1 – e11. doi: 10.1161/ HHF.0b013e318279f6b5.
13. Rojas SV, Avsar M, Hanke JS et al. Minimally ‑ Invasive Implantation of Left Ventricular Assist Devices Improves the Operative Outcome in Adult Patients with Severe Heart Failure. J Heart Lung Transplant 2013; 32: S142. doi: 10.1016/ j.healun.2013.01.321.
14. Schmitto JD, Molitoris U, Haverich A et al. Implantation of a centrifugal pump as a left ventricular assist device through a novel, minimized approach: Upper hemisternotomy combined with anterolateral thoracotomy. J Thorac Cardiovasc Surg 2012; 143 : 511 – 513. doi: 10.1016/ j.jtcvs.2011.07.046.
15. Berglund E, Sarnoff SJ, Isaacs JP. Ventricular Function Role of the Pericardium in Regulation of Cardiovascular Hemodynamics. Circ Res 1955; 3 : 133 – 139. doi: 10.1161/ 01.RES.3.2.133.
16. Feldman D, Pamboukian SV, Teuteberg JJ et al. The 2013 International Society for Heart and Lung Transplantation Guidelines for mechanical circulatory support: executive summary. J Heart Lung Transplant 2013; 32 : 157 – 187. doi: 10.1016/ j.healun.2012.09.013.
17. McKenna DH Jr, Eastlund T, Segall M et al. HLA alloimmunization in patients requiring ventricular assist device support. J Heart Lung Transplant 2002; 21 : 1218 – 1224. doi: 10.1016/ S1053 – 2498(02)00448 – 5.
18. Pagani FD, Dyke DB, Wright S et al. Development of anti‑major histocompatibility complex class I or II antibodies following left ventricular assist device implantation: effects on subsequent allograft rejection and survival. J Heart Lung Transplant 2001; 20 : 646 – 653.
19. Bull DA, Reid BB, Selzman CH at al. The impact of bridge ‑ to ‑ transplant ventricular assist device support on survival after cardiac transplantation. J Thorac Cardiovasc Surg 2010; 140 : 169 – 173. doi: 10.1016/ j.jtcvs.2010.03.026.
20. Borel JF. Comparative study of in vitro and in vivo drug effects on cell ‑ mediated cytotoxicity. Immunology 1976; 31 : 631 – 641.
21. Adam Z, Krejčí J, Krejčí M et al. Heart transplantation and the subsequent treatment of AL amyloidosis Vnitr Lek 2013; 59 : 136 – 147.
22. Koordinační středisko transplantací: Zákony a vyhlášky 2014. Dostupné z: http:/ / www.kst.cz/ web/ download/ zakon_285 – 2013 – 5.pdf.
23. Kilic A, Weiss ES, George TJ et al. What Predicts Long‑Term Survival After Heart Transplantation? An Analysis of 9,400 Ten ‑ Year Survivors. Ann Thorac Surg 2012, 93 : 699 – 704. doi: 10.1016/ j.athoracsur.2011.09.037.
24. Khush KK, Menza R, Nguyen J et al. Donor predictors of allograft use and recipient outcomes after heart transplantation. Circ Heart Fail 2013; 6 : 300 – 309. doi: 10.1161/ CIRCHEARTFAILURE.112.000165.
25. Sarsam MA, Campbell CS, Yonan NA et al. An alternative surgical technique in orthotopic cardiac transplantation. J Card Surg 1993; 8 : 344 – 349. doi: 10.1111/ j.1540 – 8191.1993.tb00375.x.
26. Billingham ME, Cary NR, Hammond ME et al. A working formulation for the standardization of nomenclature in the diagnosis of heart and lung rejection: heart rejection study group. The International Society for Heart Transplantation. J Heart Transplant 1990; 9 : 587 – 593.
27. Stewart S, Winters GL, Fishbein MC et al. Revision of the 1990 working formulation for the standardization of nomenclature in the diagnosis of heart rejection. J Heart Lung Transplant 2005; 24 : 1710 – 1720. doi: 10.1016/ j.healun.2005.03.019.
28. Patel JK, Kobashigawa JA. Should we be doing routine biopsy after heart translantation in a new era of antirejection? Curr Opin Cardiol 2006; 21 : 127 – 131. doi: 10.1097/ 01.hco.0000210309.71984.30
29. Pirk J, Málek I. Transplantace srdce. 1st ed. Praha: Karolinum 2008 : 129 – 130.
Štítky
Detská kardiológia Interné lekárstvo Kardiochirurgia Kardiológia
Článok vyšiel v časopiseKardiologická revue – Interní medicína
Najčítanejšie tento týždeň
2014 Číslo 2- Nová klasifikace vnímání rizikových faktorů a etiologie kardiovaskulárních onemocnění
- Zástava srdce u pacienta se střelnými ranami – kazuistika
- Genetický výzkum potvrdil asociaci mezi autismem a střevními obtížemi
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Intermitentní hladovění v prevenci a léčbě chorob
-
Všetky články tohto čísla
- Možnosti sledování stavu oběhu a vliv dálkové monitorace na srdeční selhání
- Problematika nonrespondérů resynchronizační léčby
- Mechanické podpory a transplantace srdce v léčbě chronického srdečního selhání
- Mechanická podpora oběhu v léčbě kardiogenního šoku – přehled
- Observační studie pacientů léčených lerkanidipinem v podmínkách běžné klinické praxe v České republice
- Stabilita a jednoduchost ovládly Washington
- Ischemická choroba srdeční u nemocných s diabetes mellitus 1. typu
- Výsledky velkých kardiologicko‑diabetologických studií posledních let (EXAMINE, ORIGIN, SAVOR)
- Nové možnosti farmakoterapie diabetu
- Principy terapie bazálním inzulinem u diabetu 2. typu
- Selfmonitoring jako prevence komplikací diabetu
- Centrálně působící antihypertenziva – rilmenidin
- Into the Heart of Stroke
- Výroční sjezd ČKS v Brně
- AUTORSKÁ SOUTĚŽ ČASOPISU KARDIOLOGICKÁ REVUE – INTERNÍ MEDICÍNA
- Současnost a budoucnost léčby srdečního selhání
- Nefarmakologická léčba srdečního selhání z pohledu nových evropských doporučení pro srdeční resynchronizační léčbu
- Současné možnosti optimalizace nastavení biventrikulární stimulace k maximálnímu využití resynchronizační léčby
- Kardiologická revue – Interní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Centrálně působící antihypertenziva – rilmenidin
- Mechanická podpora oběhu v léčbě kardiogenního šoku – přehled
- Mechanické podpory a transplantace srdce v léčbě chronického srdečního selhání
- Nefarmakologická léčba srdečního selhání z pohledu nových evropských doporučení pro srdeční resynchronizační léčbu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy