-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Aspergillus fumigatus a plicní postižení u cystické fibrózy – přehled problematiky
Aspergillus fumigatus and cystic fibrosis lung disease – the overview
Diagnostics and treatment of mycotic complications is an integral part of care for cystic fibrosis (CF) patients with lung disease. Aspergillus fumigatus is one of the mycotic pathogens we can find in CF patients' airways. The most common manifestation of Aspergillus associated disease is allergic bronchopulmonary aspergillosis (ABPA). It is not an infection in the true sense of the word but a hypersensitive reaction to mycotic antigens. Colonization of the airways with Aspergillus fumigatus causing infection was documented in 2006 for the first time. It was also pointed out that Aspergillus infection has negative influence on lung functions and causes more frequent exacerbations of lung disease. Since then subsequent studies haven't confirmed this observation completely, however they haven't excluded it either and some recommendations for the diagnostics and treatment of this clinical conditions have been published.
The treatment of Aspergillus infections in CF patients remains strictly individual, it doesn't involve corticoid therapy like CF-ABPA. Besides systemic antimycotic treatment, inhalation therapy is used as well. The task of further studies is to confirm whether the mycotic pathogens present a real threat to CF patients as “emergency pathogens” or whether they are only a non-pathogenic colonization of CF patients' airways as a part of the chronic processes.Key words:
Aspergillus fumigatus, cystic fibrosis, aspergillus bronchitis, allergic bronchopulmonary aspergillosis, ABPA
Autori: M. Zápalka 1; F. Kopřiva 1; V. Raclavský 2
Pôsobisko autorov: Dětská klinika FN a LF UP, Olomouc přednosta prof. MUDr. V. Mihál, CSc. 1; Ústav mikrobiologie LF UP, Olomouc přednosta prof. MUDr. M. Kolář, Ph. D. 2
Vyšlo v časopise: Čes-slov Pediat 2015; 70 (6): 342-350.
Kategória: Přehledový článek
Předneseno na pracovním setkání lékařů center CF v ČR, RECYF 2013, 8. 11. 2013, Praha.
Súhrn
Nedílnou součástí péče o pacienty s plicním postižením u cystické fibrózy (CF) je i diagnostika a léčba mykotických komplikací. Mezi patogeny, které u CF také nacházíme, patří také aspergily – především druh> Aspergillus fumigatus (AF). Nejčastější klinickou formou onemocnění vyvolaného aspergily v dýchacích cestách u pacientů s cystickou fibrózou je alergická bronchopulmonální aspergilóza (CF-ABPA). Zde se ale nejedná o infekci v pravém slova smyslu – jde o alergickou reakci na plísňové antigeny. Od první práce publikované v roce 2006, která popsala kolonizaci dýchacích cest kmenem Aspergillus fumigatus u pacientů s cystickou fibrózou jako možnou infekci, tzv. aspergilovou bronchitidu, byla nyní publikována doporučení k diagnostice a léčbě těchto klinických stavů. Zároveň bylo poukázáno, že aspergilová infekce u pacienta s CF má negativní vliv na hodnoty plicních funkcí a byly pozorovány častější exacerbace plicního postižení. Následné práce zatím toto pozorování jednoznačně nepotvrdily, ale také ani nevyvrátily.
Vlastní léčba této infekce u pacientů s cystickou fibrózou je stále přísně individuální, nezahrnuje kortikoidní terapii jako u CF-ABPA a mimo systémově působící antimykotika se nově využívá inhalační podání antimykotik nebulizací. Cílem dalších studií je potvrdit, zda jsou opravdu plísňové organismy hrozbou jako tzv. „emergency pathogens“, nebo jen nepatogenní kolonizací dýchacích cest v rámci chronických změn u pacientů s cystickou fibrózou.Klíčová slova:
Aspergillus fumigatus, cystická fibróza, aspergilová bronchitida, alergická bronchopulmonální aspergilóza, ABPAÚvod
Mykotická onemocnění jsou převážně podmíněně patogenní infekce u jedinců s imunodeficitem ať již primárním, nebo sekundárním. U těchto nemocných, jako jsou např. pacienti s neutropenií indukovanou chemoterapií nebo s dlouhodobým užíváním systémových kortikosteroidů, může inhalace konidiových spor vést k onemocnění, jako je invazivní plicní aspergilóza nebo chronická nekrotizující plicní aspergilóza (dochází ke klíčení konidií a vytváření plísňových hyf) – viz dále. Podobně je tomu i u pacientů s těžkými formami imunodeficitů anebo chronické obstrukční nemoci bronchopulmonální (CHOPN) při infekci virem chřipky [1].
Jinou klinickou manifestací jsou nemoci s alergickým zánětem dýchacích cest – především u pacientů s bronchiálním astmatem, ale také s cystickou fibrózou ve formě alergické bronchopulmonální aspergilózy (ABPA, CF-ABPA).
Nyní se tyto potenciálně infekční agens díky zlepšené diagnostice dostávají u pacientů s cystickou fibrózou do popředí zájmu. U nemocných s cystickou fibrózou (CF) se ale nejedná primárně o imunitně kompromitovaného jedince, ale o pacienta s progresivním poškozením plicního parenchymu, s přetrvávajícím osídlením patogenními mikroby se všemi negativními důsledky a s narušenou fyziologickou zánětlivou odpovědí organismu.
Procento záchytu vláknitých hub v sekretech z dýchacích cest u pacientů s CF stoupá s věkem. Byla prokázána souvislost s častým a opakovaným užíváním antibiotik, která vytvářejí selekční tlak na bakteriální osídlení a tím dochází také k přerůstání vláknitými a jinými houbovými nebo plísňovými agens (ovlivnění mikrobiomu plic). Nejčastěji vykultivovanou plísní ve sputu pacientů s cystickou fibrózou je Aspergillus fumigatus [2]. Je také nejlépe prostudovanou vláknitou houbou u CF pacientů vzhledem ke své schopnosti vyvolat alergickou bronchopulmonální aspergilózu (CF-ABPA), která je častější manifestací než vlastní infekce. V současnosti se uvádí více než 200 druhů z rodu Aspergillus spp., z toho je asi 10 % patogenních pro člověka. Aspergillus fumigatus je hlavní příčinou invazivních infekcí u pacientů, Aspergillus flavus je agens nalézané u nemocných s rinosinusitidou a tvoří cca 10 % izolovaných invazivních kmenů. Aspergillus terreus je znám svou rezistencí na amfotericin B. Různá patogenita kmenů je dávána do souvislosti s odlišnou schopností růstu při teplotě 37 °C, s velikostí konidií jednotlivých druhů, s růstovou rychlostí a s produkcí enzymů, toxinů a dalších faktorů virulence.
Aspergillus fumigatus
Aspergillus fumigatus je ubikviterní vláknitá houba, kterou lze izolovat především v půdě, kde se podílí na rozkladu organické hmoty, a ve vodě. Molekulárně genetickými studiemi bylo postupně zjištěno, že i původně druh Aspergillus fumigatus je komplexní organismus – v současné době se dělí na poddruhy rodu A. fumigatus – Aspergillus fumigatiaffinis, Neosartorya fischeri a N. udagawae s různou patogenicitou a klinickým významem [3].
Inhalace spor této plísně může vést ke kolonizaci dýchacích cest u pacientů s plicním onemocněním v anamnéze – jako je cystická fibróza, bronchiální astma nebo chronická obstrukční nemoc bronchopulmonální (CHOPN), ale i u zdravých jedinců. Plicní manifestace onemocnění je v rozsahu od hypersenzitivní reakce až k invazivnímu onemocnění, kde dojde k sekundární germinaci spor a následné infiltraci tkání hyfy. Předpokládá se saprofytický vztah mykotického agens a plicní tkáně. U pacientů s cystickou fibrózou, kteří nejsou po transplantaci plic, se jedná především o neinvazivní formy infekce. Aspergillus fumigatus obsahuje také několik velmi účinných alergenů, které vedou ke stimulaci antigen prezentujících buněk a následně Th2 lymfocytů v rámci reakce specifické imunity a mohou se podílet na projevech hypersenzitivních nemocí, jako je alergická rinosinusitida a již zmiňovaná CF-ABPA.
Aspergilus a imunitní systém
Lidský imunitní systém je trvale vystaven vlivu exogenních plísní. Je známo, že denně vdechneme několik stovek spor [4]. Tato nepohlavní konidia jsou převážně neškodná a jsou kompletně eliminována imunitními mechanismy dýchacích cest. Navíc jsou imunologicky inertní díky přítomnosti povrchového hydrofobinu, který funguje jako bariéra proti rozpoznání nespecifickou imunitou hostitele. Turbulentní proudění v horních cestách dýchacích, především v nose, zanese inhalovaná konidia do oblastí, kde je přítomen mukociliární transport a množství hlenu. Kašel a smrkání je tedy z dýchacích cest může odstranit. Některá z konidií ovšem vzhledem ke své velikosti (asi 5 mikronů) pronikají hlouběji a mohou být zanesena až do oblasti alveolů. V důsledku narušené očisty dýchacích cest u predisponovaných pacientů dojde ke klíčení a k vytvoření vláken – hyf.
Jsou uváděny tři mechanismy vlastního průniku plísní do tkání. Jsou to přímá penetrace hyf cestou mezibuněčných spojení, průnik hyf přes epiteliální buňky sliznice dýchacích cest anebo internalizace konidií epiteliálními buňkami [5].
Mechanismy nespecifické imunity jsou hlavní součástí obrany organismu proti plísňovým agens včetně aspergilů. Anatomická bariéra, která zahrnuje neporušenou sliznici, bronchiální hlen, surfaktant a respirační ciliární epitel, eliminuje konidia a je také prevencí proti jejich klíčení po vdechnutí. Na vlastní eliminaci inhalovaných konidií se podílí profesionálně fagocytující buňky – především makrofágy a neutrofilní leukocyty. Tyto přestupují do oblastí výskytu konidií a zde dochází k ingesci. První obrannou linií v plicích jsou alveolární makrofágy. Rozeznávají konidie plísní cestou PRRs (pattern recognition receptors) receptoru na svém buněčném povrchu. Jsou rozpoznávány především komponenty stěny konidií jako beta glukany, chitin, mannan nebo galaktomannan. Následná internalizace konidií a tvorba fagolysozomu vede k jejich destrukci. K tomu je nutná dostatečná tvorba reaktivních kyslíkových radikálů fagocytujícími buňkami, neboť při jejich nedostatečné tvorbě dochází k dalšímu rozvoji onemocnění, čímž je vysvětlována vyšší incidence aspergilových infekcí u chronické granulomatózy (snížená tvorba radikálů). Alveolární makrofágy a následně i neutrofilní leukocyty je sice fagocytují, ale vlastní proces zabíjení po ingesci je pomalý a nekompletní. Ačkoli neutrofilní leukocyty vyvíjejí vlastní aktivitu proti konidiím, jejich hlavní funkcí je eliminace neoxidativními mechanismy.
Antimikrobní peptidy jsou také nepostradatelnou součástí vrozených imunitních mechanismů. Mezi tyto proteiny patří defenziny – malé kationické molekuly, které narušují membránu plísní a tím vedou k její destrukci. Dělí se na podskupiny alfa, tvořené neutrofilními leukocyty, a beta, které jsou asociované s epiteliálními buňkami. Další skupinou jsou katelicidiny, které mají podobný mechanismus účinku, navíc ale stimulují další imunitní odpověď pomocí alarminů. Aspergilus vyvolává tvorbu IL-22, který vede k tvorbě těchto proteinů [1].
Na odstranění infekce se podílí i trombocyty a komplementová kaskáda – tento mechanismus zatím není zcela přesně objasněn. Předpokládá se vliv i T buněčné odpovědi (u některých pacientů s invazivní formou onemocnění byl popsán defekt Treg lymfocytů). Ale i samotné produkty aspergilů ovlivňují imunitní odpověď – především proteázy, které jsou přímo toxické vůči plicnímu epitelu a indukují následné zánětlivé procesy vedoucí k fibrotizaci.
Jak bylo uvedeno dříve, hlavní roli ve fagocytóze a nespecifické části imunitních dějů probíhajících v dýchacích cestách hrají alveolární makrofágy. Jedním z prvních kroků je sekrece prozánětlivých mediátorů, které způsobí degranulaci neutrofilních leukocytů a následně degradaci inhalovaných konidií. Aspergillus fumigatus reaguje se systémem vrozené imunity cestou již zmíněných PRRs receptorů, jako je např. dectin 1 a TLR 2 a 4. Klíčící konidia aktivují fosfatidylinositol-3-kinázu (PI3K), p38 protein-kinázu (MAPK) a ERK1/2, vedoucí k syntéze IL-8. U pohlcených klíčících konidií dojde k odhalení buněčného povrchu s beta 1-3 glukanem (využíván diagnosticky), který stimuluje další rozpoznání dectin 1 receptory v cirkulaci na makrofázích a tím podporuje následné procesy. U dectin 1 deficitních myší je porucha funkce IL-1a, IL-1b, TNF-a a chemokinů CCL-3 (podílí se na aktivaci neutrofilních leukocytů), CCL-4 (chemoatraktant NK buněk a monocytů) a CXCL1 (chemoatraktant neutrofilních leukocytů), která je následně příčinou nedostatečného přestupu neutrofilů, což vyvolá nekontrolovaný růst konidií. Fagocytovaná konidia endocytózou fúzují s lysozomy a dochází k jejich degradaci. Aktivují se T lymfocyty a následně se rozvíjí specifická imunitní odpověď, ve které hrají klíčovou roli především T lymfocyty – Th1, Th17 a Treg [1].
Klinická manifestace nemocí spojených s přítomnosti aspergilů v dýchacích cestách závisí převážně na interakci mezi inhalovanými konidiemi a efektorovými buňkami – role zánětlivé a imunitní odpovědi je ale zásadní pro další rozvoj onemocnění.
Aspergilová infekce vs. CF-ABPA
U zdravých jedinců inhalace spor nevyvolává onemocnění. Spory jsou eliminovány neporušeným mukociliárním transportem a fagocytovány buňkami nespecifické imunity. U pacientů s cystickou fibrózou vlivem porušené mukociliární clearance a stagnace hlenu dochází k postižení fyziologických fagolysozomálních funkcí a poruše činností komplementu – výsledkem je lokálně invazivní i diseminovaná infekce [2].
Historicky, jako hlavní klinická jednotka v souvislosti s nálezem kmenů Aspergillus fumigatus v dýchacích cestách u pacientů s CF, je uváděna alergická bronchopulmonální aspergilóza (CF-ABPA). Již v roce 2006 ale byla publikována práce Shoseyova, která upozornila na situace, kdy u pacientů s CF docházelo ke zhoršování klinického stavu s opakovaným kultivačním průkazem aspergilů v dýchacích cestách, ale zároveň nebyla splněna diagnostická kritéria alergické bronchopulmonální aspergilózy (nízké celkové IgE v séru, nízké specifické sIgE Asp). Zároveň tato práce poprvé uvedla termín „aspergilová bronchitida“. Autoři také nevylučovali i možnost, že kolonizace dýchacích cest kmeny Aspergillus fumigatus je vlastně první fází onemocnění CF-ABPA [6]. V současné době je snaha již přesněji definovat další jednotlivé klinické jednotky spojené s přítomností těchto vláknitých hub v dýchacích cestách u CF pacientů.
Formy onemocnění spojené s přítomností Aspergillus fumigatus v dýchacích cestách u pacientů s CF
Formy onemocnění spojené s nálezem Aspergillus fumigatus shrnuje přehledně tabulka 1.
Tab. 1. Formy onemocnění spojené s přítomností <em>Aspergillus fumigatus</em> pacientů s CF (upraveno dle Mosse, 2013). 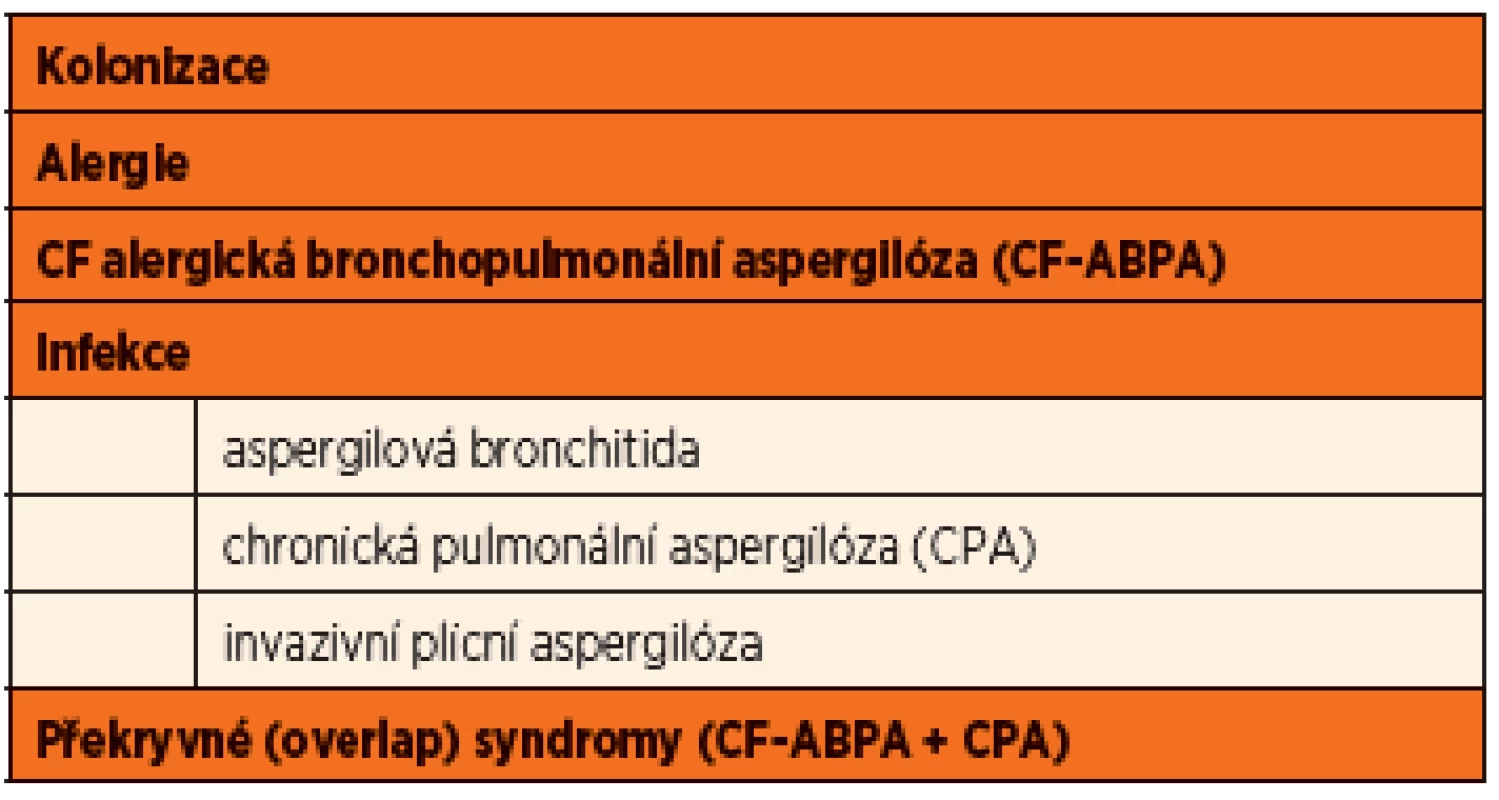
Nejlépe prostudovaným onemocněním spojených s přítomností druhu Aspergillus fumigatus je CF-ABPA – alergická bronchopulmonální aspergilóza. Nejedná se o infekci v pravém slova smyslu, neboť vlastním mechanismem vyvolávajícím zánět v dýchacích cestách je imunopatologická reakce. (Podrobněji v následné kapitole.)
Před několika lety byla poprvé vyslovená hypotéza vyčleňující aspergilovou infekci jako non-ABPA – tzv. aspergilovou bronchitidu. V současné době je již posuzována i jako samostatná klinická jednotka a byla vytvořena první diagnostická doporučení a postupy, především k odlišení prosté kolonizace a infekce, podílející se na zhoršení plicního onemocnění u pacientů s CF a vyžadujících terapii [7].
U aspergilové bronchitidy byly prokázány kmeny této plísně v dýchacích cestách v opakovaných kultivačních vzorcích společně s progresivním zhoršením klinického stavu. Aspergilus byl identifikován jako příčina poklesu plicních funkcí a zvýšeného rizika plicních exacerbací vyžadujících hospitalizaci a terapii. Zásadním rozhodnutím je to, zda se jedná o prostou kolonizaci (nejčastěji v souvislosti s chronickým zánětem v oblasti paranazálních dutin), nebo již o projev bronchitidy, tedy infekce. Byla publikována dvojí diagnostická schémata – americká podle Mosse (8) a britská podle Liu [2] (tab. 2, 3).
Tab. 2. Diferenciální diagnóza mezi kolonizací a aspergilovou bronchitidou (dle Mosse, 2013). 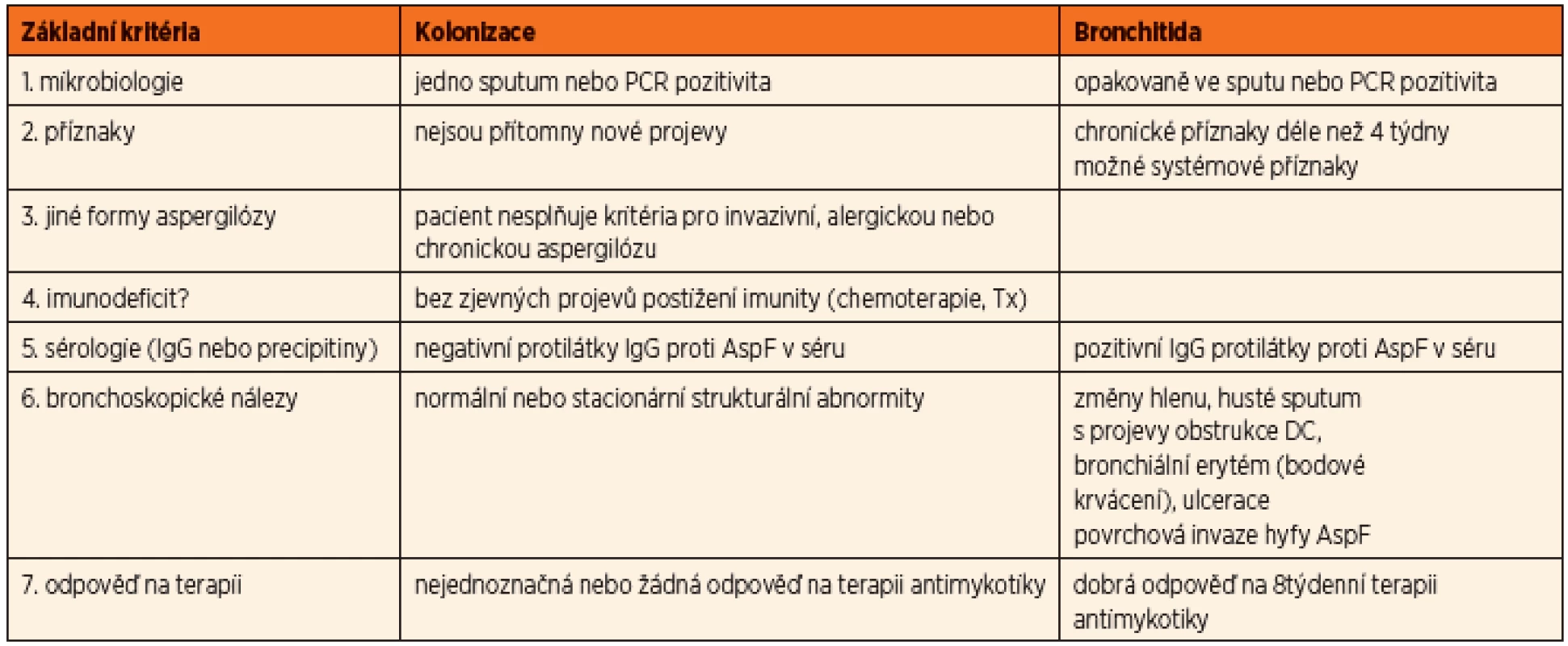
Tab. 3. Kolonizace vs. infekce <em>Aspergillus fumigatus</em> (dle Liu, 2013). 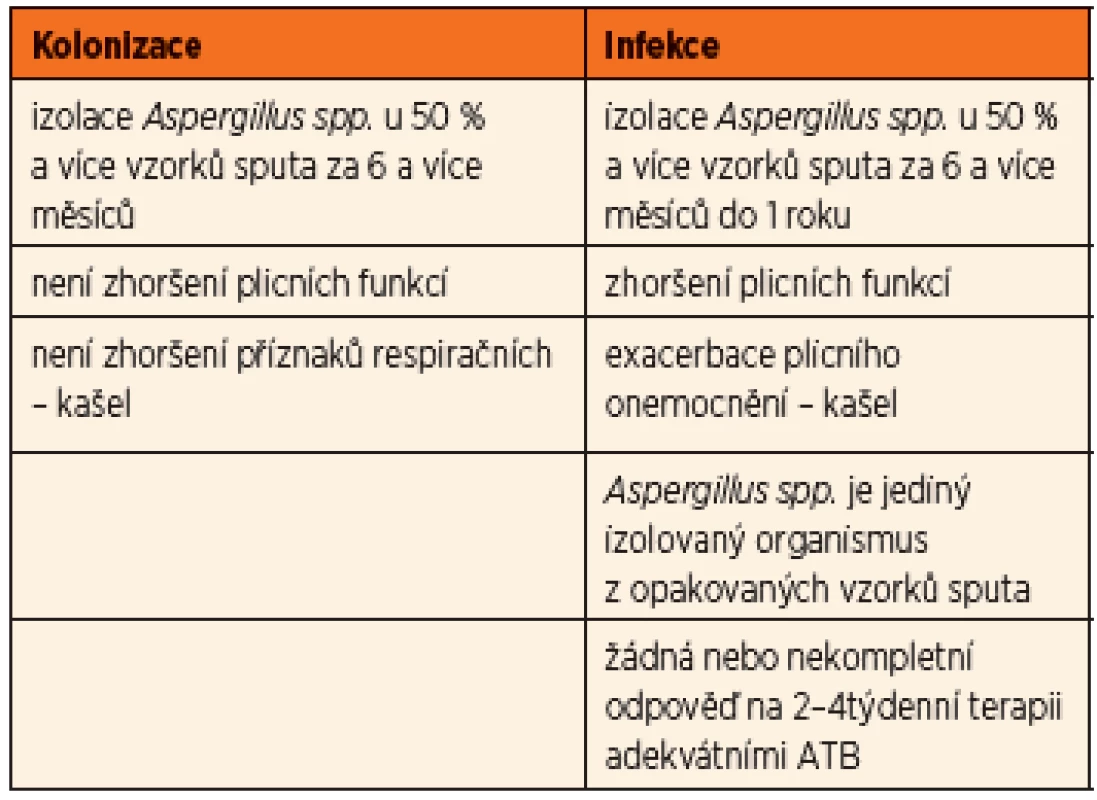
Obě posuzují u pacientů s cystickou fibrózou nejen četnost a délku záchytu kmenů Aspergillus fumigatus v kultivačních vzorcích z dýchacích cest, ale také klinické a laboratorní změny (plicní exacerbace, spirometrické zhoršení, průkaz specifických protilátek) a zároveň klinickou odpověď na podanou terapii (v americké na antimykotika, v britské na antibiotika).
Stanovení diagnózy aspergilové bronchitidy vzhledem k uvedeným skutečnostem ve vztahu k plicním funkcím samozřejmě vede k nutnosti zvážit antimykotickou terapii.
Z dalších klinických manifestací aspergilové infekce uvádíme především čtyři klinické jednotky (zatím ale nepopsanými v literatuře u pacientů s cystickou fibrózou). Jsou to plicní aspergilóza, aspergilová tracheobronchitida, aspergilová rinosinusitida a diseminovaná infekce. Nejčastější je plicní forma infekce – chronická plicní aspergilóza. Objevuje se hlavně u pacientů s nádory a chemoterapií, chronickou granulomatózou, nebo u HIV. Plicní infekce zahrnuje příznaky hemoragického infarktu v plicní tkáni, lobární pneumonie, plicního abscesu, solitárního nebo mnohočetných nodulů nebo onemocnění charakteru pleurální efuze. Symptomy jsou často nespecifické – teplota, kašel nebo dušnost, uváděn je váhový úbytek a hemoptýza.
V centru CF v Olomouci jsme v letech 2004–2013 pozorovali u 2 z 25 sledovaných dětí aspergilovou infekci charakteru bronchitidy s dominujícím klinickým zhoršením. Obě děti byly léčeny systémovými i inhalačními antimykotiky (itrakonazol + amfotericin B). Intermitentně u nich nadále přetrvává kultivační záchyt kmenů již při negativitě protilátek IgG v séru po terapii, se zlepšením klinického stavu a snížením četnosti plicních exacerbací.
Chronická plicní aspergilóza
Chronická plicní aspergilóza zahrnuje několik klinických obrazů. Trvání nemoci déle než 3 měsíce odlišuje tyto formy od forem invazivních, kdy je průběh rychlejší. Terminologická klasifikace ovšem nezahrnuje všechny možné klinické manifestace, neboť často dochází k překrývání symptomů a tudíž i klinických jednotek a zároveň je variabilní i tíže postižení u jednotlivých onemocnění. Část pacientů má genetické riziko, jako je deficit manózu-vázajícího lektinu (MBL), defekt funkce surfaktantu (především složky A2) nebo toll-like receptoru 4 (TLR-4), které vede k rozvoji onemocnění (tab. 4).
Tab. 4. Formy plicního onemocnění způsobeného aspergily – chronická plicní aspergilóza. 
Aspergilom je kulovitý útvar v plicním parenchymu tvořený hyfy vlastní plísně, fibrinem, hlenem a buněčnými zbytky. Může se objevit v již dříve vzniklé dutině.
Aspergilové noduly se objevují i u imunokompetentních pacientů, mohou být jednotlivé nebo mnohočetné a nedochází u nich k tvorbě dutin (kavitaci). Tento klinický obraz je nutno odlišit od jiných invazivních plicních mykóz nebo mykobakterióz, neboť může být zcela totožný. Pacient může být zcela asymptomatický, nebo má minimální příznaky, jako jsou kašel nebo opakované plicní infekce. Může dojít k exacerbaci jiných chronických onemocnění, jako je bronchiální astma nebo chronická obstrukční nemoc bronchopulmonální (CHOPN). Diagnosticky je zde možno využít i PET-CT – jednotlivé noduly vykazují variabilní aviditu k FDG (fludeoxyglukóza 18F) a laboratorně nacházíme pozitivitu IgG protilátek proti aspergilům. Histopatologicky se jedná o nekrózu obklopenou granulomatózní infiltrací, často nacházíme mnohojaderné obrovské buňky a v centru nekrózy jsou prokazovány plísňové hyfy.
Chronická kavitární plicní aspergilóza se může objevit i u imunokompetentních pacientů. Během měsíců dochází v plicním parenchymu k tvorbě dutiny. Dřívější název zahrnoval termín komplexní aspergilom. U těchto pacientů bývá také pozitivní IgG proti aspergilům v séru.
Chronická fibrotizující plicní aspergilóza je konečným stadiem a manifestací chronické kavitární aspergilózy, která vede k extenzivní fibrotizaci plicního parenchymu.
Chronická nekrotizující plicní aspergilóza bývá prokázána spíše již u imunodeficitních pacientů. Mívá krátký průběh ve srovnání s chronickou kavitární aspergilózou (týdny vs. měsíce) a invaze hyfy jsou prokazovány histologicky. U některých pacientů lze nalézt jen jednu tenkostěnnou kavitu nebo oblast kavitující pneumonie//konsolidace parenchymu, s průkazem protilátek IgG nebo pozitivním galaktomannanem v séru. V části literatury se používá spíše termín subakutní invazivní plicní aspergilóza k odlišení rychlosti postižení.
Všechny tyto formy mohou mít také pozitivní sIgE proti aspergilům (až 50 % pacientů), ale také všechny zároveň nesplňují kritéria ABPA.
Diferenciálně diagnosticky je u všech těchto pacientů nutno vyloučit infekci atypickými mykobakteriemi.
Alergická bronchopulmonální aspergilóza ABPA u CF (CF-ABPA)
CF-ABPA je imunopatologická hypersenzitivní reakce s podílem Th2 typu imunitní odpovědi, která se objevuje v případě kolonizace bronchů kmeny aspergilů, nejčastěji opět nalézáme Aspergillus fumigatus. Jsou vytvářeny specifické IgE protilátky proti některým antigenům aspergilů. Klinicky se objevují opakované ataky obstrukce dýchacích cest se zvýšenou produkcí hlenu a sputa u do té doby stabilizovaných pacientů s CF. Zvyšuje se také frekvence plicních exacerbací. To vše vede k rychlejšímu rozvoji bronchiektázií, fibrózy parenchymu plic a až k možnému respiračnímu selhání. Kolonizace kmeny Aspergillus fumigatus je mezi pacienty s cystickou fibrózou uváděna až v 60 %, ale klinicky se CF-ABPA objeví jen u 7–15 %. V kombinaci s chronickou perzistující infekcí kmeny bakterií Pseudomonas aeruginosa je uváděn horší průběh onemocnění a prognóza plicního postižení. Nově je popisována genetická vazba na některé HLA DR lokusy a polymorfismy genů pro IL-4R a IL-10 [9, 10].
Klinický obraz CF-ABPA zahrnuje opakované nálezy bronchiální obstrukce, teploty, únavnost, expektoraci hnědavého sputa, hemoptýzu.
Ke stanovení diagnózy CF-ABPA jsou konsenzuálně stanovena minimální diagnostická kritéria. Rozhodující pro diagnostiku je především průkaz imunopatologické reakce s tvorbou IgE specifických protilátek. Tím se zejména odlišuje od zmiňované aspergilové bronchitidy (tab. 5).
Tab. 5. Doporučená diagnostická kritéria CF-ABPA. 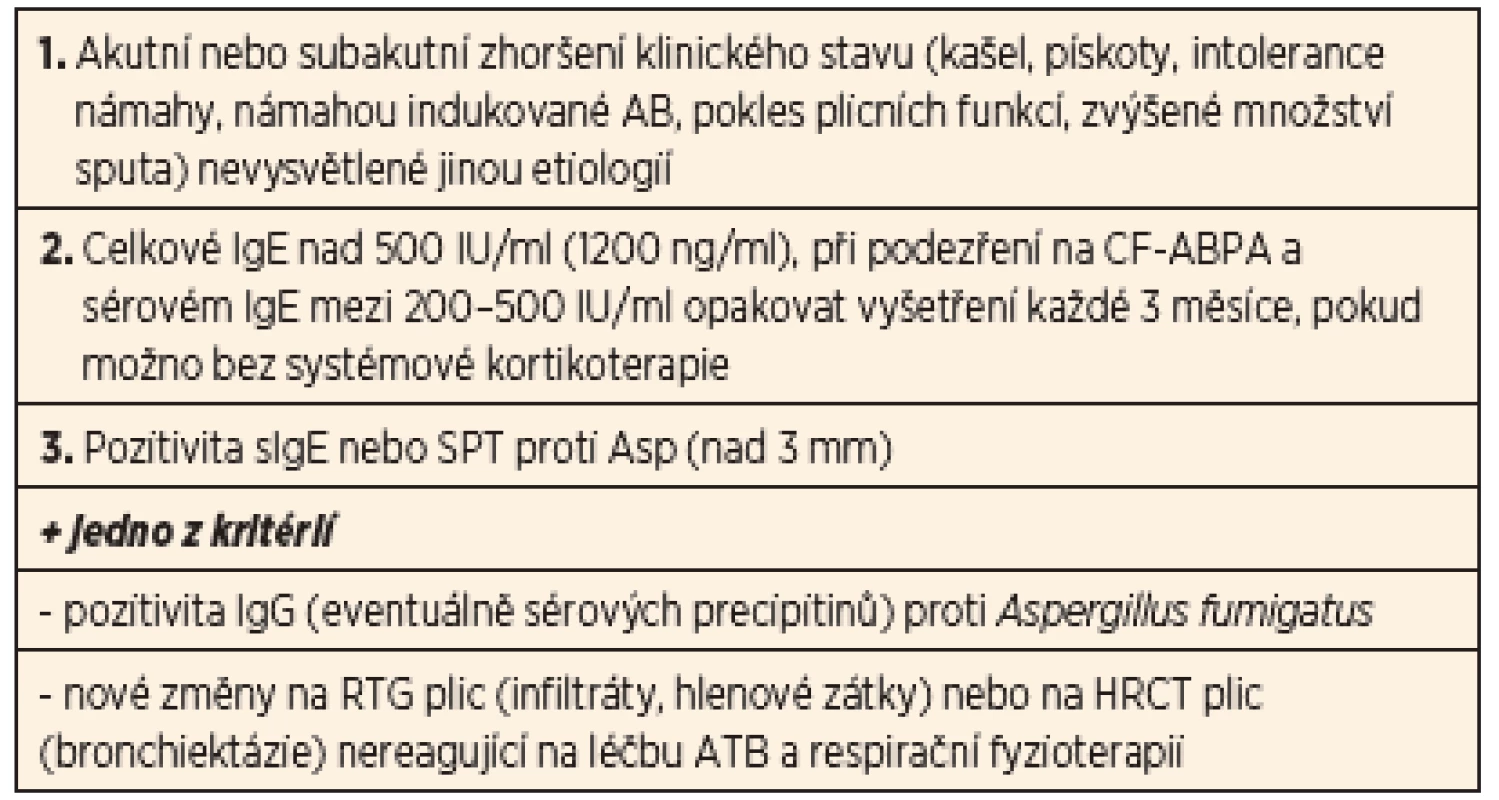
CF-ABPA – CF alergická bronchopulmonální aspergilóza Ze zobrazovacích a laboratorních metod využíváme RTG zobrazení nebo HRCT plic. Na RTG plic jsou popisovány infiltrace v parenchymu, především v horních lalocích, atelektázy a bronchiektázie, které nebyly na předchozích snímcích patrné. Doplněním HRCT se obraz zpřesňuje – můžeme nalézt cylindrické bronchiektázie především v horních lalocích, ztluštění bronchiální stěny, mukózní pláty, atelektázy, skelné opacity. V diferenciálním rozpočtu krevního obrazu nacházíme eozinofilii. V provedených testech plicních funkcí je obraz restriktivně-obstrukčního typu křivky s fenoménem „air trappingu“. Z imunologických metod se využívá stanovení specifických IgE protilátek proti Aspergillus fumigatus (jak hladiny v séru, tak pomocí kožních prick testů), nově se uplatňuje i stanovení chemokinu TARC (CCL17) – thymus aktivačního-regulačního chemokinu (indukuje po vazbě na receptor degranulaci mastocytů a Th2 mediovanou produkci IgE v plicní tkáni).
V rámci center CF v České republice je doporučeno provádět u všech pacientů s cystickou fibrózou starších 6 let screening se zaměřením na CF-ABPA. Ten zahrnuje: 1x ročně celkové IgE v séru, při hodnotě nad 500 IU/ml provedení kožních prick testů s alergeny Aspergillus fumigatus nebo průkaz specifického IgE; při hodnotě celkového IgE 200–500 IU/ml je doporučeno opakovat vyšetření s odstupem a sledovat klinický stav, při kli-nickém podezření na CF-ABPA doplnit další vyšetření (RTG plic, HRCT plic, SPT nebo sIgE, IgG či sérové precipitiny).
Možnosti diagnostiky
V předchozích letech byla základní možností diagnostiky těchto infekcí jen přímá kultivace a mikroskopický (histologický) průkaz ze vzorků tkáně získané jak z bronchiální biopsie, tak výjimečně cestou torakoskopie. V současné době je využívána kombinace zobrazovacích metod a kultivačních technik společně se stanovením specifických IgG protilátek k detekci invazivních nebo chronických forem a nově metoda PCR a kondenzát vydechovaného vzduchu.
Radiografické znaky invazivní aspergilózy nejsou typické – na prostém RTG snímku mohou být jen segmentální nebo multilobulární konsolidace parenchymu, perihilozní infiltráty, pleurální efuze a nodulární léze. Metodou první volby je HRCT plic. Typickým projevem je „halo sign“ – oblast konsolidovaného parenchymu se zvýšenou transparencí okolí, nebo druhý typický nález – „air crescent sign“ – nodulární kavitace; vše popisováno především u pacientů se sekundárním imunodeficitem (a s neutropenií) v rámci léčby maligního onemocnění.
Detekce plísňových patogenů kultivačními technikami není bohužel zatím úplně standardizována. Liu uvádí především významné rozdíly v ředění a přípravě vzorků ze sekretů dýchacích cest v rámci Velké Británie [2]. Rozdíly jsou v inkubační teplotě vzorků, v celkové době kultivace, jsou rozdílná použitá kultivační média a následně jsou i různé postupy v identifikaci kmenů buď konvenční (mikroskopické), nebo pomoci jiných metod (PCR, Maldi-Toff). Podobné rozdíly jsou i mezi pracovišti klinické mikrobiologie v ČR. Během posledních let byla upravena kultivační média ke zlepšení detekce plísní kultivací. Hlavní změnou u těchto selektivních půd je především snaha potlačit růst typických bakteriálních kmenů zachycovaných u pacientů s CF, jako jsou Pseudomonas aeruginosa, Staphylococcus aureus a rodu Burkholderia cepacia complex. V práci Nagana et al. je uvedeno, že pokud se ke kultivaci vzorků použije neselektivní médium na plísně, je záchyt kolonií cca 18%, v případě použití speciálních médií k mykologické kultivaci stoupá k 78 %. Metodika detekce genomu pomocí PCR posunula diagnostiku díky vyšší senzitivitě dále, bohužel, vzhledem k ubikviternosti plísňových patogenů stoupá ale riziko falešně pozitivní reakce i chybného nálezu. Je zajímavé, že u pacientů z různých center CF je také rozdílná frekvence záchytu jednotlivých druhů. Tyto rozdíly mohou odrážet právě rozdíly v rámci vlastního zpracování vzorků. V práci týkající se plicních forem aspergilózy (42 pacientů) je záchyt aspergilů kultivačně v 17 %, metodou PCR v 71 % případů [12]. Procento izolace kmenů aspergilů u pacientů s CF v dýchacích cestách kolísá mezi 6–58 % vzorků. Záchyt těchto plísní má celosvětově i rozdílnou geografickou lokalizaci, liší se navíc, jestli se jedná o dětskou nebo dospělou populaci pacientů s cystickou fibrózou [2]. Problémem je i délka kultivace, její průměrná doba je 7 dnů, přičemž některé jiné houbové organismy rostou déle (např. rod Exophiala minimálně 10 dnů).
Dalšími diagnostickými možnostmi jsou nekultivační techniky. Ty detekují především invazivní formu infekcí a mají různou specificitu a senzitivitu (tab. 6).
Tab. 6. Nekultivační metody detekce kmenů <em>Aspergillus spp.</em> 
Sérový galaktomannan je využíván k detekci invazivních mykóz. Detekce galaktomannanu je nejlépe prostudována u neutropenických pacientů – zde je uváděna senzitivita 81 % a specificita 89 % (podle FDA, USA). U jiných diagnóz tato prediktivní hodnota klesá, u dětí je uváděná ještě nižší. U pacientů léčených kombinací piperacilin/tazobaktam jsou navíc nacházeny falešně pozitivní výsledky. Problémem stanovení galaktomannanu je nízká senzitivita vyšetření (podle některých prací jen okolo 50 %). Pozitivní nález bývá u pacientů s chronickou plicní aspergilózou (senzitivita 38 % v séru, 92 % v BAL). Vyšší záchyt pozitivních vzorků je uváděn u pacientů s hemoptýzou. V současné době se dává přednost spíše citlivějším metodám.
Metoda přímé detekce dalších součástí konidií, především jejich stěny – 1-3 beta D glukanu, je jen nespecifickým ukazatelem. Má rozdílnou prediktivní hodnotu a nedokáže rozlišit kmeny Aspergillus spp. od jiných se stejnou molekulární strukturou beta D glukanů – jako je Candida sp. nebo Pneumocystis jiroveci.
Detekce specifického IgG je v současné době standardizovaná a klinicky zavedená metoda. Stanovení sérových precipitinů je semikvantitativní, není příliš senzitivní a je založeno na nestandardizovaných antigenech Aspergillus spp.
PCR je nejcitlivější metodou detekce těchto patogenů. Bohužel, je zde vysoké riziko znečištění vzdušnými plísněmi, a to jak v rámci vlastního získání vzorku – kontaminace při bronchoskopii a odběru BAL průchodem přes HCD nebo z paranazálních dutin konidiemi jiných druhů se společným detekčním místem na receptorech (nutný krytý odběr), ale také při vlastním zpracování vzorků v laboratoři. Pro detekci plísňových druhů se využívá detekce 18S ribozomální RNA podjednotky. Kombinací výše uvedených metod v rámci diagnostiky (sérový galaktomannan + PCR) je možno zvýšit specificitu i senzitivitu záchytu infekce u pacientů.
Další metodou v rámci diagnostiky je vyšetření rekombinantních sIgE Asp (alergeny rAsp f1, rAsp f2, rAsp f3, rAsp f4 a rAsp f6) v séru. Prvotní studie ukazují na možnost diferenciace mezi prostou senzitizací pacienta (rAsp f1, rAsp f3 – zvýšeny jak u senzitizace, tak i ABPA, kdežto rAsp f4 a rAsp f6 jsou zvýšeny jen u ABPA) [9].
Byly již i nalezeny specifické metabolity stanovené v kondenzátu vydechovaného vzduchu u pacientů s invazivní formou aspergilové infekce. Detekce těchto molekul (α-trans-bergamoten, β-trans-bergamoten, β-vatirenen-like seskviterpen, trans-geranyl-aceton) vykazuje 94% senzitivitu a 93% specificitu pro invazivní formu infekce Aspergillus fumigatus. Tato metoda zatím není uvedena do klinické praxe, ale nabízí především diagnostické možnosti do budoucnosti [11].
Terapie
Léčba infekcí
Léčba infekčních onemocnění spojených s nálezem aspergilů v dýchacích cestách u pacientů s cystickou fibrózou je stále kontroverzní a plná nejasností a především chybí kontrolované studie. V současné době je přísně individuální a „šitá na míru“ daného pacienta. Využíváme zejména celkově a nově i inhalačně podávaná antimykotika, především itrakonazol, vorikonazol a amfotericin B. Je stále minimum prospektivních studií, které by hodnotily na dostatečném počtu pacientů také efektivitu této terapie a její bezpečnost. Existují i práce, které uvádějí zhoršení klinického stavu po dlouhodobém podávání antimykotik (statisticky vyšší četností exacerbací) [12]. Otázkou je i podávání antimykotické terapie v rámci prevence rozvoje alergické bronchopulmonální aspergilózy (přítomnost antigenů může vést k následnému rozvoji hypersenzitivity). Zvláště v dětském věku je nutno vždy brát ohled na nežádoucí účinky antimykotické terapie a jejich lékové interakce, což u pacientů s CF může být závažný faktor.
Pilotní randomizovaná, dvojitě zaslepená studie o využití antimykotik u non-ABPA pacientů s CF byla provedena v roce 2012 s nejednoznačnými výsledky [9]. Jednalo se o soubor 35 pacientů, jak dětí, tak i dospělých, s opakovanými pozitivními kultivacemi s nálezem Aspergillus fumigatus v minimálně 2 vzorcích během předchozího roku. Podáván byl itrakonazol p.o. vs. placebo po dobu 24 týdnů při monitoraci hladiny antimykotika. Výsledkem byla, jak bylo předpokládáno, snížená četnost plicních exacerbací vyžadujících parenterální terapii antibiotiky, nebyl ale nalezen rozdíl mezi hodnotami plicních funkcí FEV1 a v dotazníku kvality života (QoL) mezi skupinou léčených itrakonazolem a placebem. Naopak ve skupině léčených itrakonazolem byla pozorována časnější exacerbace než u léčených placebem (výsledek ale nebyl statisticky signifikantní) [13].
Zajímavá je práce Baxtera, publikovaná v roce 2013, který podával intravenózní antibiotika (!) dospělým nemocným s CF a s kolonizací Aspergillus fumigatus zároveň s nebulizovanými beta-2-mimetiky a intenzivní fyzioterapií – i v této práci bylo popsáno statisticky signifikantní snížení počtu aspergilových kolonií ve sputu těchto pacientů [14]. Tato práce potvrzuje předpokládaný vztah mezi bakteriální kolonizací a záchytem plísňo-vých patogenů v rámci mikrobiomu plic u cystické fibrózy.
Rozdíly u jednotlivých antimykotických preparátů jsou ve farmakokinetice, farmakodynamice, v ceně, dostupnosti na daném trhu a ve frekvenci nežádoucích účinků. Zatím nebyla stanovena optimální délka podávání této terapie – doporučeno je léčbu podávat po dobu trvaní klinických projevů a do vymizení radiografických nálezů, které se objevily nově v souvislosti se zhoršením klinického stavu. Problémem antimykotické terapie je také vznik rezistence (u itrakonazolu se uvádí literárně až ve 20 %).
Možnosti antimykotické terapie
Antimykotickou terapii aspergilové infekce můžeme rozdělit podle účinné látky jednotlivého léčiva (tab. 7).
Tab. 7. Možnosti léčby aspergilové infekce antimykotiky u CF pacientů. 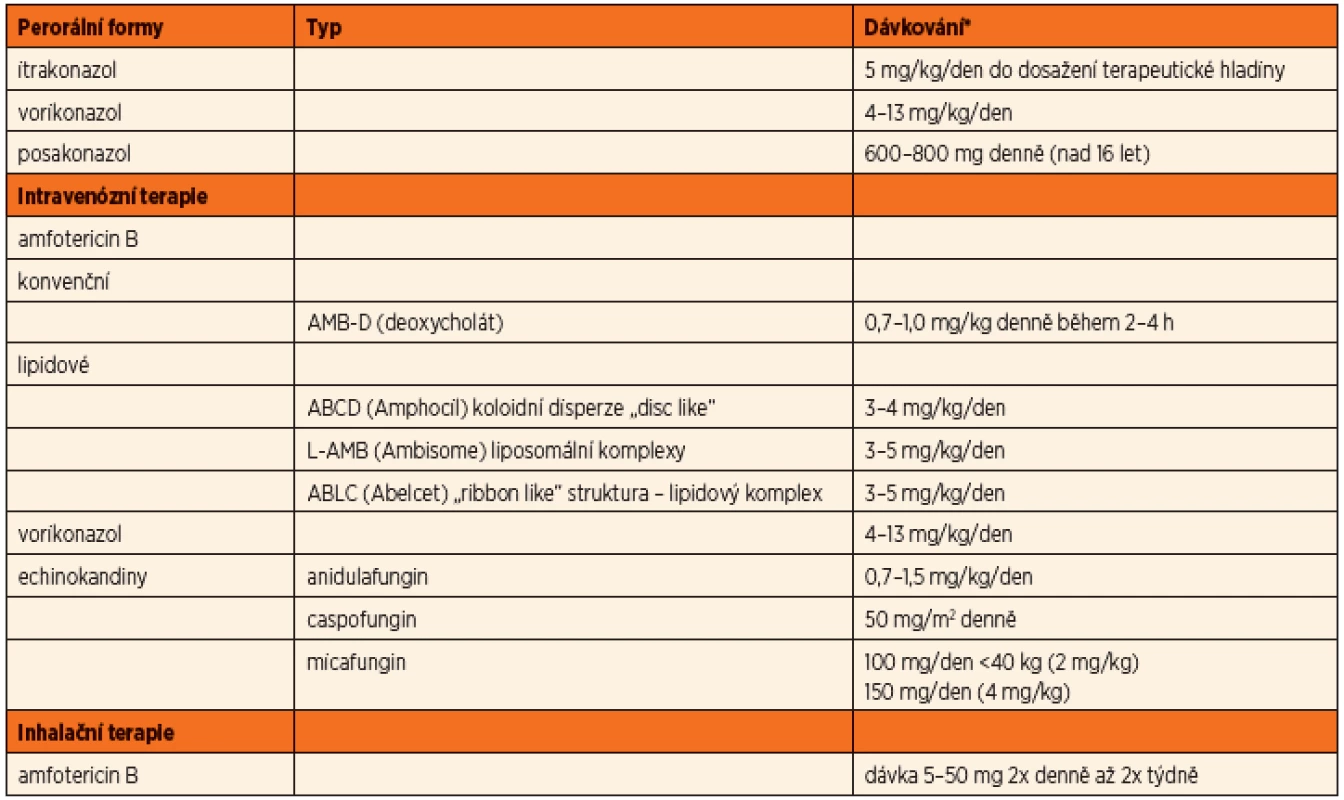
*upraveno dle http://www.aspergillus.org.uk/, Proesmans, 2010, Hayes Jr. 2010, SPC Amfotericin B (Amfotericin B, Amphocil, Abelcet, Ambisome)
Více než 40 let byl amfotericin B hlavním lékem invazivních aspergilových infekcí. I přes známou nefrotoxicitu je stále lékem první volby invazivních infekcí. Nyní jsou k dispozici modifikace ve formě lipidových formulí, které především snižují toxicitu preparátu při nezměněné účinnosti antimykotika. U invazivních plicních infekcí se uvádí účinnost 55 %, u těžkých forem méně než 40 %. Mortalita pacientů s invazivní formou aspergilózy je uváděna cca 65 % [13].
Amfotericin B lze podat i v inhalační formě. Dávkování se pohybuje v širokém rozmezí mezi 5–50 mg 2x denně až 2x týdně [16]. Amfotericin deoxycholát (AMB-D) vede ale při nebulizaci k tvorbě pěny, která inhalaci znesnadňuje a navíc interferuje s funkcí surfaktantu (funkce detergentu). Lipidové formule se lépe inhalují, mají delší poločas tkáňové depozice, neovlivňují funkci surfaktantu, respektive mohou částečně plnit jeho roli vzhledem ke své molekulární lipidové struktuře [16].
Itrakonazol (Itraconazol, Prokanazol, Sporanox)
Dalším preparátem uvedeným na trh v roce 1992 je itrakonazol. Jedná se o první triazolový derivát s účinností i na kmeny Aspergillus spp. a některé další plísně. Retrospektivní studie uvádějí, že po iniciálním použití amfotericinu B má primární i udržovací terapie lepší výsledky. Problémem itrakonazolu je vstřebávání při p.o. podání. To je především ovlivněno hodnotou pH v žaludku. Kapsle je doporučeno brát s jídlem a zapíjet kyselými nápoji, jako jsou kolové nápoje nebo pomerančový džus. V sirupové formě je vstřebávání zlepšeno (suspenze má uváděnu 2x větší biologickou dostupnost než forma cps.). Vždy je nutné monitorovat hladinu, ať už ve formě vlastní molekuly itrakonazolu, tak i ve formě aktivních účinných metabolitů (hydroxy-itrakonazol). Doporučené dávkování je 5 mg/kg/den do dosažení hladiny, doporučená hladina v séru je 0,5–2,5 mg/ml podle použité metodiky. Vlivem nedostatečného dávkování často také vzniká rezistence na tento preparát, literárně až ve 20 %.
Vorikonazol (V-Fend, Voriconazol)
V roce 2002 byl uveden v USA na trh vorikonazol. Jeho spektrum účinnosti zahrnuje i aspergilové kmeny, na které je primárně amfotericin B neúčinný, jako je A. terreus a A. nidulans. Vorikonazol je k dispozici v p.o. formě s výborným vstřebáváním i k i.v. podání. Po jeho uvedení na trh se objevily studie, kde byl vorikonazol použit jako první krok léčby invazivní aspergilové infekce. Z výsledků vyplývá, že je účinnější, přežívá více pacientů s těžkou formou onemocnění a má nižší toxicitu než předchozí preparáty [15]. Problémem je ale variabilní metabolismus farmaka, zejména u dětí, a proto je pediatrická dávka uváděna v rozmezí 4–13 mg/kg/den. Monitorování hladiny v séru je v praxi problematické vzhledem k výrazné tkáňové depozici (doporučená hladina v séru 0,5–4 mg/ml, podle závažnosti infekce). U kavkazské rasy je navíc riziko fotosenzitivity a nádorů kůže [9].
Posakonazol (Noxafil)
Posakonazol byl doporučen k použití v roce 2006 primárně jako prevence rozvoje mykotické infekce u imunokompromitovaných pacientů. Je uváděna nižší biologická dostupnost než u vorikonazolu, ale lepší než u itrakonazolu. Je ve formě suspenze. Uváděná terapeutická dávka je 600–800 mg denně (u dětí nad 16 let).
Echinokandiny (caspofungin (Cancidas), micafungin (Mycamine))
Echinokandiny byly doporučeny k terapii aspergilové infekce v roce 2001 – první byl na trh uveden caspofungin. Jeho mechanismus účinku je v interferenci s tvorbou buněčné stěny plísní. Společně s dalšími zástupci skupiny micafunginem a anidulafunginem jsou tyto přípravky k dispozici v parenterální formě. Zatím nebyla provedena porovnávací studie k možnosti jejich použití jako léku první volby u terapie aspergilové infekce.
Léčba CF-ABPA
Současné doporučené postupy k léčbě CF asociované alergické bronchopulmonální aspergilózy (CF-ABPA) shrnuje tabulka 8. Léčba zahrnuje také imunomodulační léčbu alergického zánětu, který je u této formy přítomen v plicích. Historicky se systémově podávají především glukokortikoidní preparáty (pravidelně nebo nověji ve formě pulzů), nyní se spíše doporučuje kombinace s antimykotikem především pro „šetřící efekt“ triazolových antimykotik na dávku glukokortikoidů. Předpokládá se redukce antigenních stimulů snížením množství aktivních plísňových komponent [9]. Novým přístupem je použití monoklonální protilátky proti IgE – omalizumabu, zatím s nejednoznačnými výsledky [18, 19].
Tab. 8. Návrh doporučené terapie CF-ABPA. 
CF-ABPA – CF alergická bronchopulmonální aspergilóza Závěr
Vliv přítomnosti kmenů Aspergillus fumigatus v dýchacích cestách na vlastní plicní onemocnění u pacientů s cystickou fibrózou není stále jasný. Není zcela jednoznačně potvrzeno, že se podílejí na progresi plicního onemocnění u CF při jejich záchytu v sekretech – i když některé studie toto naznačují. Není definován vztah a vzájemné ovlivnění s jinými kolonizujícími patogeny v rámci mikrobiomu plic – jako jsou Pseudomonas aeruginosa nebo i jiné bakteriální patogeny (Stenotrophomonas maltophilia, Achromobacter xylosooxidans, Burkholderia cepacia komplex atd.) či jiná agens (Candida sp., Exophiala sp., Scedosporium sp., atypická mykobakteria), které nacházíme u našich CF pacientů s plicním postižením. Také není zcela jasné, zda jejich přítomnost v dýchacích cestách je jen prostou kolonizací bez vlivu na plicní postižení pacienta s CF, anebo již projevem infekce. Lze využít pracovní klasifikační schémata, která nám mohou pomoci tyto stavy rozlišit a rozhodnout o nutnosti zahájení antimykotické terapie u pacientů se zhoršením klinického stavu. Přesto jsou nutné další, nejlépe prospektivní, dvojitě zaslepené a placebem kontrolované studie u CF pacientů k posouzení přínosu systémové nebo inhalační antimykotické léčby při hodnocení počtu exacerbací, změn plicních funkcí a fibrózní přestavby plicního parenchymu.
Současná léčba přítomné infekce je u jednotlivých pacientů stále přísně individuální s přihlédnutím k rizikům v dětském věku a možným nežádoucím účinkům a farmakologickým interakcím s jinými u CF podávanými preparáty.
Práce vznikla bez finanční podpory.
Došlo: 22. 4. 2015
Přijato: 19. 10. 2015
MUDr. Martin Zápalka, Ph.D.
Dětská klinika FN a LF UP
I. P. Pavlova 6
775 00 Olomouc
e-mail: zapalkam@seznam.cz
Zdroje
1. Kolwijck E, van de Veerdonk FL. The potential impact of the pulmonary microbiome on immunopathogenesis of aspergillus-related lung disease. Eur J Immunol 2014; 44 (11): 3156–3165.
2. Liu JC. What is the clinical significance of filamentous fungi positive sputum cultures in patients with cystic fibrosis? J Cyst Fibros 2013; 12 (3): 187–193.
3. Araujo R, Amorim A, Gusmão L. Diversity and specificity of microsatellites within aspergillus section Fumigati. BMC Microbiology 2012; 12 : 154.
4. Chotirmall SH. Aspergillus-associated airway disease, inflammation, and the innate immune response. Biomed Res Int 2013.
5. Amitani R, Kawanami R. Interaction of aspergillus with human respiratory mucosa: a study with organ culture model. Med Mycol 2009; 47 (Suppl 1): S127–131.
6. Shoseyov D, Brownlee KG, Conway SP, Kerem E. Aspergillus bronchitis in cystic fibrosis. Chest 2006; 130 (1): 222–226.
7. Speirs JJ. Effects od Aspergillus fumigatus colonization on lung function in cystic fibrosis. Curr Opin Pulm Med 2012; 18 (6): 632–638.
8. Moss RB. Allergic bronchopulmonary aspergilossis and aspergillus infection in cystic fibrosis. Curr Opin Pulm Med 2010; 16 (6): 598–603.
9. Agarwal R. Allergic bronchopulmonary aspergillosis: Review of literature and proposal of new diagnostic and classification criteria. Clin Exp Allergy 2013; 43 (8): 850–873.
10. Heribanová L. Alergická bronchopulmonální aspergilóza. Prakt Lék 2014; 94 (2): 59–63.
11. Koo S, Thomas HR, Daniels SD, et al. A breath fungal secondary metabolite signature to diagnose invasive aspergillosis. Clin Infect Dis 2014; 59 (12): 1733–1740.
12. Aaron SD, Vandemheen KL, Freitag A, et al. Treatment of Aspergillus fumigatus in patients with cystic fibrosis: a randomized, placebo-controlled pilot study. PLoS One 2012; 7.
13. Middleton PG: Fungal infections and treatment in cystic fibrosis. Curr Opin Pulm Med 2013; 19 (6): 670–675.
14. Baxter CG. Novel immunologic classification of aspergillosis in adult cystic fibrosis. J Allergy Clin Immunol 2013; 132 (3): 560–566.
15. Wilmott R. Kendig and Chernick’s Disorders of the Respiratory Tract in Children. 8th ed. Elsevier 2012. ISBN: 978-1-4377-1984-0.
16. Hayes D Jr. Aerosolized amphotericin for the treatment of allergic bronchopulmonary aspergillosis. Pediatr Pulmonol 2010; 45 (11): 1145–1148.
17. Proesmans M. Use of nebulized amphotericin B in the treatment of allergic bronchopulmonary aspergillosis in cystic fibrosis. Int J Pediatr 2010; 287.
18. Tanou K. Omalizumab therapy for allergic bronchopulmonary aspergillosis in children with cystic fibrosis. A synthesis of published evidence. Pediatr Pulmonol 2013; 25.
19. Lehmann S, Pfannenstiel C, Friedrichs F, et al. Omalizumab: a new treatment option for allergic bronchopulmonary aspergillosis in patients with cystic fibrosis. Ther Adv Respir Dis 2014; 8 (5): 141–149.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článek Primární (autoimunitní) sklerozující cholangitida u pacienta s nespecifickým střevním zánětemČlánek RejstříkyČlánek Akutní dušnostČlánek Stridor
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2015 Číslo 6- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
- Rejstříky
- Vliv valgozity paty na pohyb nohy při chůzi u dětí ve věku 3 až 8 let
- Primární (autoimunitní) sklerozující cholangitida u pacienta s nespecifickým střevním zánětem
- Molekulárna genetika, fenotypová variabilita a súčasné trendy v personalizovanej medicíne fenylketonúrie
- Aspergillus fumigatus a plicní postižení u cystické fibrózy – přehled problematiky
- Etanolová zátka v terapii a prevenci katetrové sepse
- Nikotin ovlivňuje vývoj mozku
- Pěstounská péče na přechodnou dobu: psychologické aspekty
- Akutní dušnost
- Stridor
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Primární (autoimunitní) sklerozující cholangitida u pacienta s nespecifickým střevním zánětem
- Akutní dušnost
- Nikotin ovlivňuje vývoj mozku
- Stridor
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



