-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Molekulární testování melanocytárních lézí
Molecular testing in malignant melanoma
The use of molecular biology and cytogenetic methods and the development of knowledge regarding the molecular basis of melanocytic tumors in recent years has been on the rise. Topics of interest include not only diagnostic and predictive pathology, but also genetic counseling and molecular classification of melanocytic lesions. The following text discusses the current knowledge on the molecular basis of malignant melanoma, the use of molecular biology and cytogenetic methods, especially in the differential diagnosis of melanocytic lesions, and the difficulties of predictive testing.
Keywords:
cytogenetics - diagnostics - malignant melanoma - molecular biology - prediction
Autoři: Pavel Dundr; Libor Staněk; Kristýna Němejcová
; Radek Jakša
Působiště autorů: Ústav patologie 1. LF UK a VFN, Praha
Vyšlo v časopise: Čes.-slov. Patol., 50, 2014, No. 3, p. 127-131
Kategorie: Přehledový článek
Souhrn
Využití molekulárně biologických a cytogenetických metod a rozvoj poznatků týkající se molekulární podstaty melanocytárních nádorů je v posledních letech na vzestupu. Okruhy zájmu zahrnují nejen diagnostiku a oblast prediktivní patologie, ale např. i genetické poradenství a molekulární klasifikaci melanocytárních lézí. V následujícím textu jsou probrány současné poznatky týkající molekulární podstaty maligního melanomu, využití molekulárně biologických a zejména cytogenetických metod v diferenciální diagnostice sporných melanocytárních lézí a problematika prediktivního testování.
Klíčová slova:
cytogenetika - diagnostika - maligní melanom - molekulární biologie - predikceMaligní melanom (MM) patří celosvětově mezi nejčastější nádorová onemocnění. Molekulární testování MM se dostává stále více do popředí ať už v rámci diagnostiky, nebo predikování odpovědi na cílenou léčbu. S ohledem na diagnostiku je snahou využít molekulárně biologické a cytogenetické metody zejména u sporných melanocytárních lézí, jejichž biologickou povahu nelze stanovit pouze na podkladě histologických rysů. Tyto hraniční léze představují velmi problematickou a komplikovanou oblast patologie a využití pomocných metod při stanovení jejich biologické povahy je nanejvýše žádoucí. Další oblastí využívající metod molekulární biologie je oblast prediktivní patologie, která má přímý dopad na druh použité léčby. Léčebné možnosti MM kromě standardních postupů jako je chirurgická léčba, chemoterapie a radioterapie, zahrnují i moderní postupy imunoterapie a cílené léčby s využitím ATP-kompetitivního inhibitoru kinázové domény BRAF (vemurafenib) (1). Imunoterapie (ipilimumab, IL-2, nivolumab) je v současné době zřejmě jediná léčba, která má kurativní potenciál i u metastázujícího MM, byť pouze u malého procenta pacientů (2). Pro tuto léčbu však v současné době nemáme na molekulární úrovni definovaný prediktor a v dalším textu se problematikou imunoterapie nezabýváme. Celkově je využití molekulárně biologických a cytogenetických metod v problematice MM vázáno na znalosti vyplývající z molekulární podstaty tohoto onemocnění. V následujícím textu jsou probrány současné poznatky týkající se tumorigeneze MM, využití molekulárně biologických a cytogenetických metod v diferenciální diagnostice sporných melanocytárních lézí a problematika prediktivního testování MM.
TUMORIGENEZE MALIGNÍHO MELANOMU
Molekulární mechanismy související s rozvojem a progresí MM nejsou zcela jednoznačné. S ohledem na patogenezu se jedná o komplexní onemocnění související s genetickými aberacemi, ale i epigenetickými změnami (metylace DNA), nekódující RNA a změnami na úrovni proteinů (modifikace histonů, remodelace chromatinu a další) (3,4). Určité procento pacientů má pro vznik tohoto nádoru zvýšenou hereditární predispozici, která nejčastěji souvisí se zárodečnou mutací CDKN2A (obr. 1) (5). Další geny s předpokládaným vlivem na vznik MM, avšak s nízkou penetrancí, zahrnují např. BRCA2 a MCR1 (melanocortin-1-receptor) (6,7). S ohledem na další genetické aberace vyskytující se na úrovni somatických mutací se zdá být nejvýznamnější signální kaskáda MAP kinázy (mitogenem aktivované protein kinázy), která zahrnuje několikastupňovou fosforylační kaskádu produktů genů RAS-RAF-MEK-ERK (obr. 2). Výskyt somatických mutací genu NRAS a BRAF je popisován u melanocytárních névů i MM a zřejmě představuje časnou změnu v rozvoji melanocytárních nádorů. Většina MM vykazuje mutaci v některém z genů této kaskády (8,9). Somatické mutace těchto genů se zdají být u MM vzájemně vylučující alespoň na úrovni jedné buňky, vzácně jsou však popsány současně v jednom nádoru v různých buňkách v souvislosti s heterogenitou nádorové populace (10). Další signální kaskádou často aktivovanou u MM je cesta PIK3K-AKT-mTOR. Na progresi MM jsou však zřejmě zapotřebí další genetické aberace hlavně onkosupresorických genů, jako např. CDKN2 a PTEN (11).
Obr. 1. Hereditární mutace v genu CDKN2A. Tyto hereditární mutace mohou mít za důsledek poškození dvou proteinů (p16/INK4a a p14/ARF). Mutace v genu p16/INK4a vede k inaktivaci kaskády pRb. Inaktivace p14/ARF vede k porušení kaskády p53. Mutace genu CDKN2A může tedy vést k rozvoji nádorového růstu (narušení kontrolních mechanizmů přechodu buňky z G1 do S fáze). 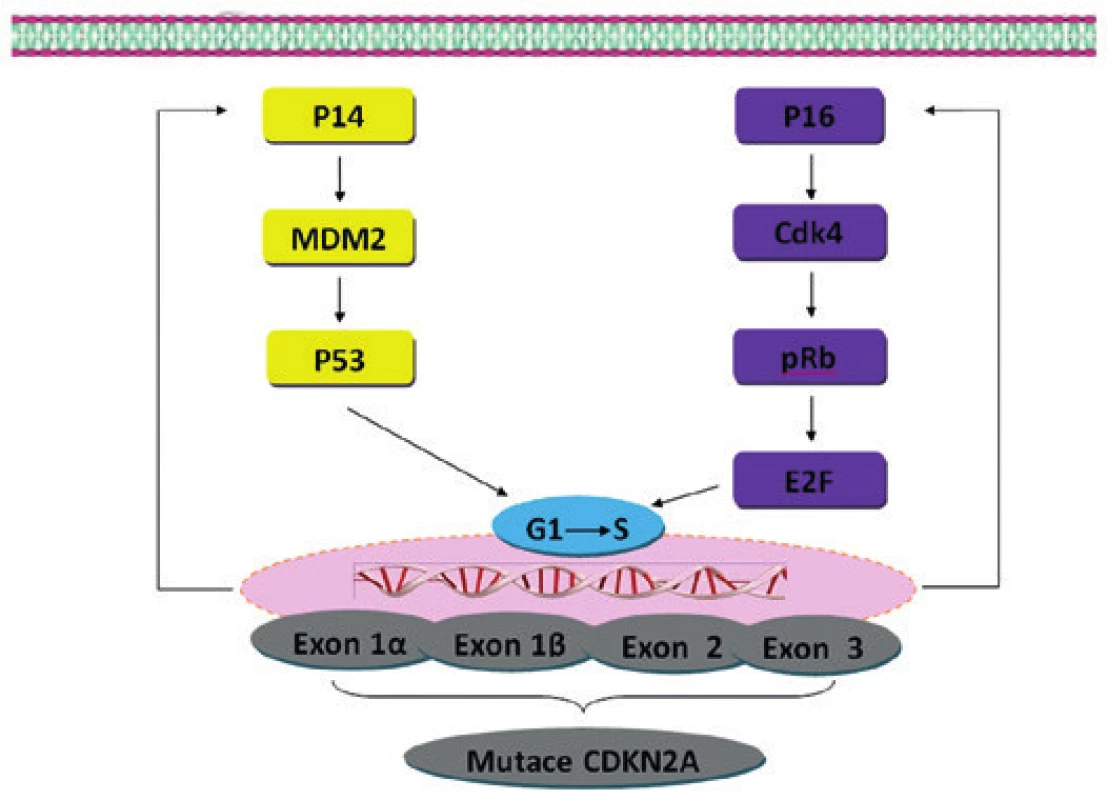
Obr. 2. Signální dráhy v kancerogenezi MM a možnost jejich inhibice. Možná inhibice molekul RAF a MEK (modré šipky) a následné změny v signálních drahách (červené šipky) u maligního melanomu. Při inhibici pouze RAF pomocí vemurafenibu může docházet k reaktivaci MAPK dráhy (modré šipky) a poruše ostatních signálních drah (PI3K/Akt a zvýšená aktivita kinázy PDGFR-β nebo IGF-1R). 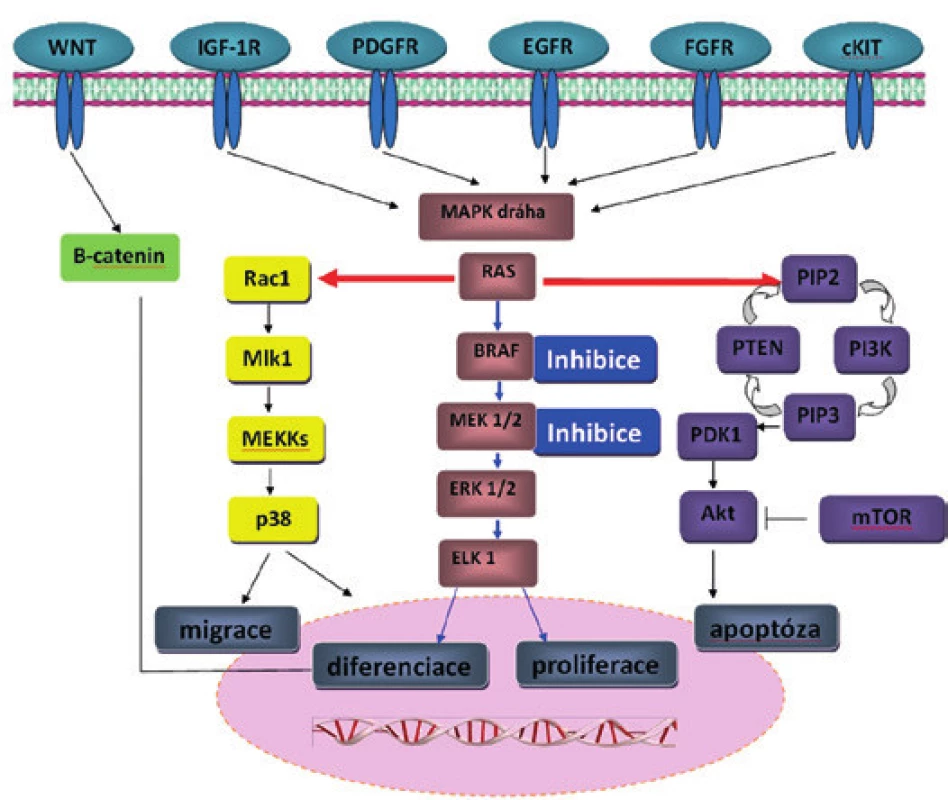
VYUŽITÍ CYTOGENETICKÝCH METOD U BĚŽNÝCH MELANOCYTÁRNÍCH LÉZÍ
Diagnostika melanocytárních lézí je ve většině případů jednoznačná. Existují však sporné léze, které vykazují atypické rysy a stanovení jejich biologické povahy je na úrovni světelné mikroskopie obtížné. Situace je komplikována tím, že nejsou jednoznačná objektivní a reprodukovatelná kritéria, která by byla specifická pro příslušnou lézi a existuje poměrně výrazná variabilita mezi jednotlivými hodnotiteli i na úrovni specializovaných dermatohistopatologů. Snahou je proto identifikace markerů, které by mohly být při stanovení biologické povahy melanocytárních lézí nápomocné. V minulosti bylo publikováno několik prací zaměřených na tuto problematiku využívajících k nalezení chromozomálních aberací metody komparativní genomové hybridizace (CGH). Ve studii z roku 2003 analyzující 132 melanomů a 54 benigních névů byly u většiny maligních melanomů (96 %) prokázány mnohočetné chromozomální aberace, zejména zisky v oblasti 6p, 1q, 7p, 8q, 17q, 11q a 20q a ztráty v oblasti 9p, 9q, 10q, 10p a 6q (12). U benigních névů byly nalezeny chromozomální změny u 7 lézí (13 %), které odpovídaly névu Spitzové, avšak chromozomální aberace (zisk krátkého raménka chromozómu 11) byla odlišná od změn vyskytujících se u MM. Ztráty v oblasti chromozómu 9 jsou u MM obzvláště časté (až v 80 % případů) a zřejmě se vyskytují již v časných fázích tumorigeneze. Změny v chromozómu 6 (ztráta 6q, zisk 6p) se zřejmě vyskytují v souvislosti s progresí nádoru. Tyto změny se také zdají souviset s horší prognózou nádoru (13). Oproti tomu benigní névy (s výjimkou névu Spitzové) chromozomální aberace vykazují velmi vzácně.
Na podkladě těchto poznatků byl vyvinut komerčně dostupný kit sestávající ze 4 sond zaměřených na nejčastěji se vyskytující aberace: tři z nich jsou lokus specifické sondy, konkrétně 6p25 (RREB1), 6q23 (MYB) a 11q13 (CCND1) a čtvrtá je centromerická sonda chromozomu 6 (CEP6) (14-19). Recentně bylo publikováno několik studií využívajících tento kit, které se zaměřily na jeho využití v diagnostice MM. Jedna z těchto studií se zaměřila na využití sond při stagingu MM asociovaného s benigním névem (36 případů, aberace se prokázaly pouze v oblasti MM u 28 případů (78 %) a u všech 6 případů névoidního MM použitých jako kontrolní skupina) (20). Další studie analyzovala skupinu 10 névoidních MM a 10 mitoticky aktivních névů, přičemž chromozomální aberace se prokázaly u všech MM, u névů se nevyskytly (16). Jinou analyzovanou oblastí bylo rozlišení mezi intranodálním névem a metastázou MM. Chromozomální změny byly prokázány u 20/24 metastáz MM (83 %) a pouze u 1/17 nodálního névu (6 %) (14). Studie zaměřená na rozlišení mezi dezmoplastickým melanomem a sklerozujícím névem prokázala ve skupině 15 dezmoplastických melanomů chromozomální alterace u 7 lézí, zatímco všech 15 sklerozujících névů bylo bez těchto změn (19). Další studie analyzující epiteloidní modré névy a kožní metastázy MM napodobující modrý névus v souboru 10 epitelodních modrých névů neprokázala chromozomální změny u žádného případu, oproti tomu 9/10 (90 %) metastáz vykazovalo chromozomální aberace (18). Obdobně v jiné práci analyzující 12 buněčných modrých névů a 5 MM napodobujících tento névus byla prokázaná 100% senzitivita i specifita a stejně vysoká senzitivita i specifita (100 %) byla zastižena na souboru 4 névů a 8 MM spojivky (22,23). Jako pomocný marker byla metoda testována u melanocytárních lézí s prominentní pagetoidní melanocytózou (24). Studie analyzovala 24 těchto lézí se zaměřením na interpersonální variabilitu (hodnotili 3 specialisté v dermatopatologii) a výskyt chromozomálních aberací. U 17 případů (71 %) byla mezi hodnotiteli diagnostická shoda, u 7 případů (29 %) byly s ohledem na diagnózu výrazné rozpory. U 6 lézí hodnotiteli diagnostikovaných jako benigní nebyly u žádného případu zastiženy chromozomální aberace. U lézí hodnocených jako MM byly aberace nalezeny u 5/7 případů (71 %). 2/11 lézí hodnocených jako nejisté biologické povahy měly prokázané chromozomální aberace (jedna z těchto lézí v reexcizi vykazovala jednoznačné morfologické známky MM). Výsledky jedné recentní studie zaměřené na hodnocení melanocytárních lézí se spornými rysy však naopak poukazují na poměrně nízkou senzitivitu i specifitu vyšetření tímto kitem (metodou FISH) i nedostatečnou korelaci s výsledky CGH, soubor však není jednoznačně definován a zahrnuje i spitzoidní léze (u kterých se vyskytují jiné chromozomální aberace) (25). Faktem však zůstává, že popsané studie obvykle analyzují pouze malé soubory a limitace je také v některých případech dána poměrně krátkým follow-up, zejména u sporných lézí.
Vyšetření metodou FISH se zmíněnými sondami lze tedy v určitých případech použít jako pomocný marker, nicméně nejedná se o test, který by jednoznačně umožnil stanovení biologické povahy příslušné melanocytární léze. Recentní práce udává další zvýšení senzitivity i specifity při zahrnutí dalších sond, zejména 9p21 (CDKN2), a navrhuje pro diagnostiku nový algoritmus (26). Nutné je také vzít v potaz technické aspekty vyšetření včetně možnosti falešné pozitivity i falešné negativity, variability mezi jednotlivými hodnotiteli, výskytu polyploidie a stejně jako u jiných molekulárních vyšetření inadekvátnosti vzorku pro analýzu (obecně udávané mezi 3 - 5 % vzorků). Zásadně důležité je však v tomto kontextu nastavení hraničních hodnot, které mohou výrazně ovlivnit senzitivitu i specifitu. Hranice, při které je výsledek konkrétní sondy nahlížen jako abnormální, se v některých případech mezi jednotlivými studiemi poněkud liší (27,28). Stejně jako u jiných vyšetření, zvýšení hraničních hodnot zvyšuje specifitu na úkor senzitivity a obráceně. Jako pozitivní je podle původních kritérií nahlíženo vyšetření při nalezení alespoň jedné chromozomální aberace s hraničními hodnotami: >38 % hodnocených buněk s > 2 signály pro CCND1; >55 % buněk s více signály pro RREB1 než pro CEP6; > 40 % buněk s méně signály pro MYB než pro CEP6; > 29 % buněk s více než 2 signály pro RREB1 (15).
VYUŽITÍ CYTOGENETICKÝCH METOD U MELANOCYTÁRNÍCH LÉZÍ SE SPITZOIDNÍMI RYSY
Většina lézí se spitzoidními rysy je na podkladě morfologických kritérií klasifikována jako Spitzové névus, nebo spitzoidní MM. Přesto však existuje poměrně malá, nicméně důležitá skupina těchto lézí, u které nelze biologickou povahu jednoznačně stanovit. Tyto léze bývají označovány jako atypický névus Spitzové (ASN), atypický Spitzové nádor, či jako spitzoidní melanocytární proliferace nejisté biologické povahy (29,30). Častý je u nich výskyt metastáz do sentinelových lymfatických uzlin (téměř v 50 %), přesto však mají poměrně dobrou prognózu. Pokud jde o přítomnost chromozomálních změn, asi u 15 % benigních névů Spitzové se vyskytuje amplifikace 11p, zbylé léze jsou bez prokazatelných chromozomálních změn (31). Několik prací se zaměřilo na charakteristiku genetických změn vyskytujících se u spitzoidních lézí (27,28). V jedné práci byla prokázána přítomnost chromozomálních aberací u 7/16 (44 %) ASN. Tyto aberace však byly heterogenní bez možnosti stanovení jasné molekulární signatury společné pro analyzované případy. Všechny případy byly také analyzovány metodou FISH s využitím výše popsaného komerčně dostupného kitu, který však nebyl schopen detekovat chromozomální aberace u žádného případu. U 1/8 névů Spitzové byla nalezena amplifikace 11p15.5-p12 (28). Výsledky této studie však nejsou v souladu s dalšími pracemi. V jedné z těchto prací byly pomocí komerčně dostupného kitu metodou FISH prokázány u ASN aberace u 6/25 případů (24 %). V kontrolní skupině byly prokázany aberace u 2/10 névů Spitzové a u 9/10 MM se spitzoidními rysy (27). Další recentní práce analyzovala 75 ASN (64 s benigních chováním, 11 s metastázujícím nádorem) s použitím komerčně dostupného kitu ve srovnání s jinou kombinací sond zahrnující oblast 6p25, 9p21, 11q13 a 8q24 (32). Všech 11 případů metastázujícího ASN vykazovalo alespoň jednu z detekovaných chromozomálních aberací. U 9 z těchto pacientů byla detekována delece 9p21. Další časté změny představoval zisk 6p25 a 11q13. Ve skupině 64 ASN s benigním chováním byly chromozomální aberace zastiženy v 15 případech (23,4 %). Změny v 8q24 časté v névoidním či amelanotickém nodulárním melanomu se ve skupině ASN vyskytovaly pouze zcela výjimečně.
PREDIKTIVNÍ TESTOVÁNÍ U MALIGNÍHO MELANOMU
U značné části pacientů s MM se vyskytují mutace v genu BRAF (výskyt je v literatuře udáván mezi 33 - 66 % MM) (33,34). Tento gen je součástí signální dráhy MAP-kinázy (RAS-BRAF-MEK-ERK). Většina mutací je aktivačních a způsobuje proliferaci buněk nezávisle na signalizaci RAS. V současné době je k dispozici reverzibilní ATP-kompetitivní inhibitor kinázové domény BRAF (vemurafenib). Tento lék je schválen pro použití u pacientů s metastázujícím či inoperabilním MM starších 18 let, u kterých je prokázána aktivační mutace genu BRAF. Možným problémem je však řada vedlejších nežádoucích účinků léčby, z nichž nejzávažnější je možnost spinocelulárního karcinomu kůže či keratoakantomu, reaktivace dráhy MAPK a porucha ostatních signálních drah zejména PIK3/Akt a zvýšená aktivita kinázy PDGFR-β nebo IGF-1R (35). Naprostá většina mutací genu BRAF jsou aktivační mutace V600, které představují více než 95 % všech mutací. Ve většině těchto případů jde o náhradu valinu na pozici 600 v aminokyselinové sekvenci genu BRAF (V600E) za kyselinu glutamovou. Ostatní mutace (V600K, V600R, V600D a V600M) jsou poměrně vzácné, nicméně údaje o jejich počtu se v jednotlivých studiích liší a odlišné mutace než V600E jsou variabilně udávány mezi 6 - 30 % případů (34). V recentní studii bylo zastoupení mutací V600 následující: V600E 79 %, V600K 12 %, V600R 5 % a V600M 4 % (36). Terapeutický efekt je prokázán pouze v případě mutace V600E a V600K. Senzitivní na léčbu jsou pravděpodobně také pacienti s mutací V600G a V601, avšak pro určení významu těchto a jiných mutací je zapotřebí dalších studií. Vlastní testování přítomnosti mutace BRAF lze provádět více metodami, z nichž každá má své výhody i nevýhody a jejich rozbor je nad rámec tohoto článku. Současně s vemurafenibem byl však firmou Roche vyvinut i diagnostický kit (Cobas® 4800 BRAF V600 Mutation Test). Podle údajů výrobce je tento test schopný detekovat alespoň 96 % mutací V600E při 5 % mutovaných alel. Kromě toho identifikuje i mutace V600K a V600D, tyto mutace jsou však detekovány s nižší účinností a ve vzorku musí být přítomno ≥ 18 % mutovaných alel. Nevýhodou testu je, že v současné době nedokáže detekovat ostatní vzácné mutace a také neumožňuje rozlišit, o jaký typ mutace se jedná. Za zmínku stojí, že v současné době je komerčně dostupná imunohistochemická protilátka proti V600E. Výsledky však nejsou zcela přesvědčivé, někteří autoři udávají 100% shodu mezi molekulárně biologickými metodami a IHC, jiní naopak prokázali určité procento falešně pozitivních i falešně negativních výsledků, a tato protilátka kromě toho také není schopná (zřejmě s výjimkou ojedinělých případů) detekovat vzácné mutace (34,37,38).
Stejně jako při hodnocení prediktivních markerů u jiných nádorů je otázkou, kdy a které pacienty testovat, jak zajistit co nejkratší dobu testování (zahrnující samozřejmě i interval od žádosti po dodání bloku do testující laboratoře) a jakou testovací metodu použít. V současné době je v ČR testování prováděno na žádost klinika u vybraných pacientů vhodných pro léčbu vemurafenibem. Nicméně je otázkou, jestli je tento způsob optimální. Algoritmus pro testování BRAF byl recentně diskutován a publikován na úrovni panelu expertů v UK (33). Okruhy, které byly diskutovány, zahrnovaly: 1) který pacient má být testován a na čí žádost; 2) jaký test má být použit a v jaké laboratoři má být test proveden; 3) management pacientů s MM. Některé závěry z tohoto setkání, zejména týkající se bodu 1 a 2, mohou být zajímavé i pro nás.
- S ohledem na náklady a očekávaný význam testování bylo dosaženo shody v tom, že i přes výhody vyplývající z automatického testování všech pacientů v době diagnózy je toto v současné době ekonomicky neúnosné, nicméně testování až v době založení metastáz je doprovázeno značným rizikem zpoždění dodání výsledku a tím i odkladem léčby, zejména z toho důvodu, že k metastázování může docházet až po mnoha letech a dle zkušeností expertů někdy dodání parafinového bločku do vyšetřující laboratoře od podání žádosti trvá i několik týdnů. Konsenzus je testovat všechny pacienty ve stadiu IIb a vyšším, tj. pacienty s nádorem o tloušťce > 2 mm s ulcerací, > 4 mm bez ulcerace, nebo jakékoliv tloušťky s metastázami do lymfatických uzlin či jiných lokalit.
- S ohledem na způsob testování a laboratoř došlo ke konsenzu, že i přes to, že Cobas test je jediný test schválený FDA pro toto vyšetření, v UK není důležité jaký test a kde je proveden, ale to, aby se jednalo o akreditovanou laboratoř a validovaný postup splňující všechny požadavky s ohledem na kontrolu kvality včetně EHK.
Dalším sporným bodem může být, jakou tkáň testovat, tj. jestli je vhodnější primární nádor nebo metastáza. Problematika heterogenity na úrovni primárního nádoru i metastáz není u melanomu stejně jako u jiných nádorů doposud objasněna. Některé studie nalezly vyšší procento mutací v metastázách nežli v primárních nádorech, jiné však toto neprokázaly (39,40). Stejně tak jsou popsány případy s metastázami s různým mutačním stavem genu BRAF a to i v rámci jedné metastázy (41). Popisována je s ohledem na mutační stav BRAF vyšší konkordance mezi primárním nádorem a viscerálními metastázami a metastázami do lymfatických uzlin než mezi primárním nádorem a metastázami do kůže či mozku (39). Odlišnosti v mutačním stavu na úrovni typu i četnosti mutací jsou závislé i na lokalizaci nádoru (primárního i metastázy - např. byl popsán častější výskyt mutací v kožních metastázách ve srovnání s viscerálními), popsány jsou i geografické (rasové) rozdíly (39-42).
ZÁVĚR
Využití molekulárně biologických metod v problematice melanocytárních lézí nabývá neustále na významu. I přes značný pokrok a množství studií zabývajících se danou problematikou zůstává stále dosti nejasností nejen s ohledem na diagnostické využití v rámci odlišení sporných melanocytárních lézí, ale i v rámci prediktivní diagnostiky. Kromě problematiky zmíněné v textu je snahou využít molekulární metody i např. v rozvoji klasifikačního systému MM založeného na kombinaci morfologie a molekulárních alterací, který by umožnil stratifikovat pacienty s MM do skupin na podkladě patogeneze, prognózy a predikce odpovědi na léčbu. V neposlední řadě také probíhá výzkum v oblasti identifikace nových biomarkerů zaměřených na diagnostiku i nalezení nových terapeutických možností. Praktickým dopadem je možnost identifikace jedinců se zvýšeným rizikem vzniku MM (např. pacienti s germinální mutací CDKN2A a/nebo CDK4), kteří by mohli profitovat z aktivního sledování se snahou o zachycení časných stádií.
Poděkování
Práce byla podpořena projektem PRVOUK-P27/LF1/1
Adresa pro korespondenci:
Doc. MUDr. Pavel Dundr, Ph.D.
Ústav patologie 1. LF UK v Praze a VFN
Studničkova 2, 128 00 Praha 2
e-mail: pdundr@seznam.cz
tel.: 224968624
fax: 224911715
Zdroje
1. Sala E, Mologni L, Truffa S, Gaetano C, Bollag GE, Gambacorti-Passerini C. BRAF silencing by short hairpin RNA or chemical blockade by PLX4032 leads to different responses in melanoma and thyroid carcinoma cells. Mol Cancer Res 2008; 6(5): 751-759.
2. Maker AV, Phan GQ, Attia P, et al. Tumor regression and autoimmunity in patients treated with cytotoxic T lymphocyte-associated antigen 4 blockade and interleukin 2: a phase I/II study. Ann Surg Oncol 2005; 12(12): 1005-1016.
3. van den Hurk K, Niessen HE, Veeck J, et al. Genetics and epigenetics of cutaneous malignant melanoma: a concert out of tune. Biochim Biophys Acta 2012; 1826(1): 89-102.
4. Palmieri G, Capone M, Ascierto ML, et al. Main roads to melanoma. J Transl Med 2009; 7 : 86.
5. Bishop DT, Demenais F, Goldstein AM, et al. Geographical variation in the penetrance of CDKN2A mutations for melanoma. J Natl Cancer Inst 2002; 94(12): 894-903.
6. Casula M, Colombino M, Satta MP, et al. Factors predicting the occurrence of germline mutations in candidate genes among patients with cutaneous malignant melanoma from South Italy. Eur J Cancer 2007; 43(1): 137-143.
7. Kennedy C, ter Huurne J, Berkhout M, et al. Melanocortin 1 receptor (MC1R) gene variants are associated with an increased risk for cutaneous melanoma which is largely independent of skin type and hair color. J Invest Dermatol 2001; 117(2): 294-300.
8. Casula M, Muggiano A, Cossu A, et al. Role of key-regulator genes in melanoma susceptibility and pathogenesis among patients from South Italy. BMC Cancer 2009; 9 : 352.
9. Solus JF, Kraft S. Ras, Raf, and MAP kinase in melanoma. Adv Anat Pathol 2013; 20(4): 217-226.
10. Sensi M, Nicolini G, Petti C, et al. Mutually exclusive NRASQ61R and BRAFV600E mutations at the single-cell level in the same human melanoma. Oncogene 2006; 25(24): 3357-3364.
11. Švajdler M, Rychlý B, Benický M. Cielená liečba melanómu: fakt alebo fikcia? Cesk Patol 2011; 47(4): 165-167.
12. Bastian BC, LeBoit PE, Hamm H, Brocker EB, Pinkel D. Chromosomal gains and losses in primary cutaneous melanomas detected by comparative genomic hybridization. Cancer Res 1998; 58; 2170–2175.
13. Namiki T, Yanagawa S, Izumo T et al. Genomic alterations in primary cutaneous melanomas detected by metaphase comparative genomic hybridization with laser capture or manual microdissection: 6p gains may predict poor outcome. Cancer Genet Cytogenet 2005; 157(1): 1-11.
14. Dalton SR, Gerami P, Kolaitis NA, et al. Use of fluorescence in situ hybridization (FISH) to distinguish intranodal nevus from metastatic melanoma. Am J Surg Pathol 2010; 34(2): 231-237.
15. Gerami P, Jewell SS, Morrison LE, et al. Fluorescence in situ hybridization (FISH) as an ancillary diagnostic tool in the diagnosis of melanoma. Am J Surg Pathol 2009; 33(8): 1146–1156.
16. Gerami P, Wass A, Mafee M, Fang Y, Pulitzer MP, Busam KJ. Fluorescence in situ hybridization for distinguishing nevoid melanomas from mitotically active nevi. Am J Surg Pathol 2009; 33(12): 1783-1787.
17. North JP, Kageshita T, Pinkel D, LeBoit PE, Bastian BC. Distribution and significance of occult intraepidermal tumor cells surrounding primary melanoma. J Invest Dermatol 2008; 128(8): 2024-2030.
18. Pouryazdanparast P, Newman M, Mafee M, Haghighat Z, Guitart J, Gerami P. Distinguishing epithelioid blue nevus from blue nevus like cutaneous melanoma metastasis using fluorescence in situ hybridization. Am J Surg Pathol 2009; 33(9): 1396-1400.
19. Senetta R, Paglierani M, Massi D. Fluorescence in-situ hybridization analysis for melanoma diagnosis. Histopathology 2012; 60(5): 706-714.
20. Newman MD, Lertsburapa T, Mirzabeigi M, Mafee M, Guitart J, Gerami P. Fluorescence in situ hybridization as a tool for microstaging in malignant melanoma. Mod Pathol 2009; 22(8): 989-995.
21. Gerami P, Beilfuss B, Haghighat Z, Fang Y, Jhanwar S, Busam KJ. Fluorescence in situ hybridization as an ancillary method for the distinction of desmoplastic melanomas from sclerosing melanocytic nevi. J Cutan Pathol 2011; 38(4): 329-334.
22. Busam KJ, Fang Y, Jhanwar SC, Pulitzer MP, Marr B, Abramson DH. Distinction of conjunctival melanocytic nevi from melanomas by fluorescence in situ hybridization. J Cutan Pathol 2010; 37(2): 196–203.
23. Gammon B, Beilfuss B, Guitart J, Busam KJ, Gerami P. Fluorescence in situ hybridization for distinguishing cellular blue nevi from blue nevus-like melanoma. J Cutan Pathol 2011; 38(4): 335-341.
24. Gerami P, Barnhill RL, Beilfuss BA, LeBoit P, Schneider P, Guitart J. Superficial melanocytic neoplasms with pagetoid melanocytosis: a study of interobserver concordance and correlation with FISH. Am J Surg Pathol 2010; 34(6): 816-821.
25. Gaiser T, Kutzner H, Palmedo G et al. Classifying ambiguous melanocytic lesions with FISH and correlation with clinical longterm follow up. Mod Pathol 2010; 23(3): 413-419.
26. Gerami P, Li G, Pouryazdanparast P, et al. A highly specific and discriminatory FISH assay for distinguishing between benign and malignant melanocytic neoplasms. Am J Surg Pathol 2012; 36(6): 808-817.
27. Massi D, Cesinaro AM, Tomasini C, et al. Atypical Spitzoid melanocytic tumors: a morphological, mutational, and FISH analysis. J Am Acad Dermatol 2011; 64(5): 919-935.
28. Raskin L, Ludgate M, Iyer RK, et al. Copy number variations and clinical outcome in atypical spitz tumors. Am J Surg Pathol 2011; 35(2): 243-252.
29. Ludgate MW, Fullen DR, Lee J, et al. The atypical Spitz tumor of uncertain biologic potential: a series of 67 patients from a single institution. Cancer 2009; 115(3): 631-641.
30. Barnhill RL. The Spitzoid lesion: rethinking Spitz tumors, atypical variants, ‘Spitzoid melanoma’ and risk assessment. Mod Pathol 2006; 19(Suppl): S21-33.
31. Bastian BC, Wesselmann U, Pinkel D, LeBoit PE. Molecular cytogenetic analysis of Spitz nevi shows clear differences to melanoma. J Invest Dermatol 1999; 113(6): 1065-1069.
32. Gerami P, Scolyer RA, Xu X,et al. Risk assessment for atypical spitzoid melanocytic neoplasms using FISH to identify chromosomal copy number aberrations. Am J Surg Pathol 2013; 37(5): 676-684.
33. Gonzalez D, Fearfield L, Nathan P, et al. BRAF mutation testing algorithm for vemurafenib treatment in melanoma: recommendations from an expert panel. Br J Dermatol 2013; 168(4): 700-707.
34. Heinzerling L, Kühnapfel S, Meckbach D, et al. Rare BRAF mutations in melanoma patients: implications for molecular testing in clinical practice. Br J Cancer 2013; 108(10): 2164-2171.
35. Heidorn SJ, Milagre C, Whittaker S, et al. Kinase-dead BRAF and oncogenic RAS cooperate to drive tumor progression through CRAF. Cell 2010; 140(2): 209-221.
36. Lovly CM, Dahlman KB, Fohn LE, et al. Routine multiplex mutational profiling of melanomas enables enrollment in genotype-driven therapeutic trials. PLoS One 2012; 7(4): e35309.
37. Capper D, Preusser M, Habel A, et al. Assessment of BRAF V600E mutation status by immunohistochemistry with a mutation-specific monoclonal antibody. Acta Neuropathol 2011; 122(1): 11-19.
38. Skorokhod A, Capper D, von Deimling A, Enk A, Helmbold P. Detection of BRAF V600E mutations in skin metastases of malignant melanoma by monoclonal antibody VE1. J Am Acad Dermatol 2012; 67(3): 488-491.
39. Colombino M, Capone M, Lissia A, et al. BRAF/NRAS mutation frequencies among primary tumors and metastases in patients with melanoma. J Clin Oncol 2012; 30(20): 2522-2529.
40. Libra M, Malaponte G, Navolanic PM, et al. Analysis of BRAF mutation in primary and metastatic melanoma. Cell Cycle 2005; 4(10): 1382-1384.
41. Yancovitz M, Litterman A, Yoon J, et al. Intra - and inter-tumor heterogeneity of BRAF(V600E)) mutations in primary and metastatic melanoma. PLoS One 2012; 7(1): e29336.
42. Colombino M, Lissia A, Capone M, et al. Heterogeneous distribution of BRAF/NRAS mutations among Italian patients with advanced melanoma. J Transl Med 2013; 11 : 202.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek Editorial
Článok vyšiel v časopiseČesko-slovenská patologie

2014 Číslo 3-
Všetky články tohto čísla
- Editorial
- Chronické podfinancování má zhoubný vliv na kvalitu naší diagnostiky
- MONITOR aneb nemělo by vám uniknout, že...
- Komplexní přístup v diagnostice lymfomů v praktických příkladech
- Molekulární testování melanocytárních lézí
- Nádory měkkých tkání očima molekulárního patologa
- Intestinální metaplazie žaludku a jícnu: imunohistochemická studie 60 případů včetně porovnání expresí hlenů v normální a zánětlivě změněné sliznici střeva
- Myxoidní varianta epiteloidního maligního mezoteliomu peritonea. Popis případu.
- Extraintestinálna oxyuriáza – popis troch prípadov a prehľad literatúry
- Bioptická diagnostika nádorů CNS a melanocytárních nádorů kůže
- Přehled dosavadních zkušeností s mezinárodní klasifikací tenkojehlové aspirační cytologie štítné žlázy Bethesda 2010
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Intestinální metaplazie žaludku a jícnu: imunohistochemická studie 60 případů včetně porovnání expresí hlenů v normální a zánětlivě změněné sliznici střeva
- Nádory měkkých tkání očima molekulárního patologa
- Přehled dosavadních zkušeností s mezinárodní klasifikací tenkojehlové aspirační cytologie štítné žlázy Bethesda 2010
- Komplexní přístup v diagnostice lymfomů v praktických příkladech
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



