-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Možnosti průkazu biologicky relevantní papilomavirové infekce u maligních nádorů hlavy a krku v diagnostické patologii
The testing strategy for detection of biologically relevant infection of human papillomavirus in head and neck tumors for routine pathological analysis
There is a subgroup among head and neck squamous cell carcinomas, which is etiologically linked to the infection of high-risk human papillomavirus (HPV). In recent studies, HPV related squamous cell carcinomas have been placed in a separate group because of their different epidemiology, distinctive histopathological characteristics, therapeutic response and clinical outcome. The reported prevalence of high-risk HPV in head and neck tumors varies in different studies. This fact occurs mainly due to the absence of a widely accepted consensus for HPV detection in head and neck malignancies.
We present a methodological algorithm for detection of biologically relevant HPV infection:
a combination of an immunohistochemical staining of the p16 protein – a surrogate marker for a transforming HPV infection, and a molecular genetic identification of HPV DNA by three different polymerase chain reactions (PCR). The study group consisted of 41 patients with a tumor in head and neck region. A verification of detection of biologically relevant HPV infection has been performed in 10 available samples using an alternative approach, which comprised the detection of RNA transcript of HPV by reverse transcription followed by PCR (RT-PCR), and further in situ hybridization (ISH) with a commercial high-risk HPV probe.
We have found a high correlation between HPV DNA detection using triple-PCR approach and strong diffuse positivity of the p16 protein (correlation coefficient 0.94) and have confirmed the validity of this algorithm. In 94 % of HPV related squamous cell carcinomas HPV type 16 was detected. In one case HPV type 33 was identified. That is in agreement with earlier published data. A more appropriate alternative method for the detection of biologically relevant - transforming HPV infection seems to be RT-PCR, which proved 100 % agreement with the original methodological approach of p16 determination and PCR status.
Interpretation of the ISH has been complicated by frequent nonspecific staining of the sample and its routine usage in the diagnostic algorithm of our laboratory is currently not feasible.Keywords:
HPV – squamous cell carcinoma – head and neck tumors – p16
Autoři: Jana Kašpírková 1; Ondrej Ondič 1
; Kateřina Černá 1; Alena Skálová 1,2
Působiště autorů: Bioptická laboratoř s. r. o., Plzeň 1; Šiklův ústav patologie, Univerzita Karlova v Praze, Lékařská fakulta v Plzni, Plzeň 2
Vyšlo v časopise: Čes.-slov. Patol., 49, 2013, No. 1, p. 29-34
Kategorie: Původní práce
Souhrn
Podskupina dlaždicobuněčných karcinomů v oblasti hlavy a krku je etiologicky spojována s vysoce rizikovými typy lidských papilomavirů (HPV). Recentní studie tyto HPV asociované dlaždicobuněčné karcinomy vyčleňují do separátní skupiny díky odlišné epidemiologii, histopatologickým charakteristikám, terapeutické odpovědi na léčbu a prognóze. Publikované prevalence HPV v nádorech hlavy a krku však dosahují značné variability, což je z velké části dáno absencí celosvětově přijímaného konsenzu pro vyšetření HPV u těchto malignit.
Na vlastním souboru 41 pacientů s nádorem v oblasti hlavy a krku prezentujeme detekci biologicky relevantní HPV infekce při využití algoritmu kombinujícího imunohistochemický průkaz proteinu p16 – „surrogate“ markeru transformující HPV infekce, a molekulárně genetický průkaz HPV DNA pomocí tří různých polymerázových řetězových reakcí (PCR). Ověření průkazu biologicky relevantní HPV infekce je v 10 případech provedeno alternativní metodikou, a to detekcí transkriptu HPV RNA pomocí reverzní transkripce následované PCR (RT-PCR) a dále in situ hybridizací (ISH) s komerční sondou proti vysoce rizikovým HPV.
Prokázali jsme vysokou korelaci detekce HPV DNA pomocí souboru tří PCR reakcí a přítomností silné difuzní pozitivity p16 proteinu (korelační koeficient 0,94) a potvrzujeme validitu tohoto algoritmu. U 94 % HPV asociovaných dlaždicobuněčných karcinomů byl detekován HPV typ 16, v jednom případě byl zachycen typ 33, což odpovídá literárním údajům. K alternativní detekci biologicky relevantní transformující infekce HPV se zdá být vhodnější metoda průkazu RNA transkriptu HPV, kterou bylo dosaženo lepších výsledků – 100% shoda s průkazem HPV původní metodikou p16/PCR. Metoda ISH byla zatížena poměrně častým nespecifickým barvením preparátu a její rutinní užití v diagnostickém algoritmu v našich podmínkách není zatím možné.Klíčová slova:
HPV – dlaždicobuněčný karcinom – nádory hlavy a krku – p16
Virová infekce je příčinou 15 – 20 % maligních nádorů u člověka (1). Jedním z nejdůležitějších onkogenních virů je lidský papilomavirus (HPV). Perzistentní infekce vysoce rizikovými lidskými papilomaviry (HR-HPV, z angl. High-Risk Human Papillomavirus) je příčinou vzniku maligních nádorů zejména v oblasti anogenitálního traktu. Za karcinogenní proces jsou zodpovědné dva onkoproteiny kódované virovými geny E6 a E7. Tyto onkoproteiny mimo jiné inaktivují p53 a pRB, čímž jednak podporují postup buněčného cyklu a syntézu DNA, a dále také blokují apoptózu (2). HR-HPV asociovaná etiologie byla prokázána u 99,7 % dlaždicobuněčných karcinomů děložního hrdla, 81,8 % adenokarcinomů děložního hrdla, 40 % karcinomů vulvy, 64 až 91 % karcinomů pochvy, 88 až 93,8 % análních karcinomů a 40 až 81,8 % karcinomů penisu (3-5). HR-HPV jsou také asociovány s neopláziemi v oblasti hlavy a krku, publikované prevalence HPV v této oblasti se však pohybují v širokém rozmezí 0 až 100 % (6). Tato variabilita je dána jednak rozdílnou anatomickou lokalizací tumoru, ale je také z velké části ovlivněna použitím různých detekčních metod průkazu přítomnosti HPV v nádoru (tab. 1)(7).
Tab. 1. Prevalence HPV v nádorech hlavy a krku dle různých autorů 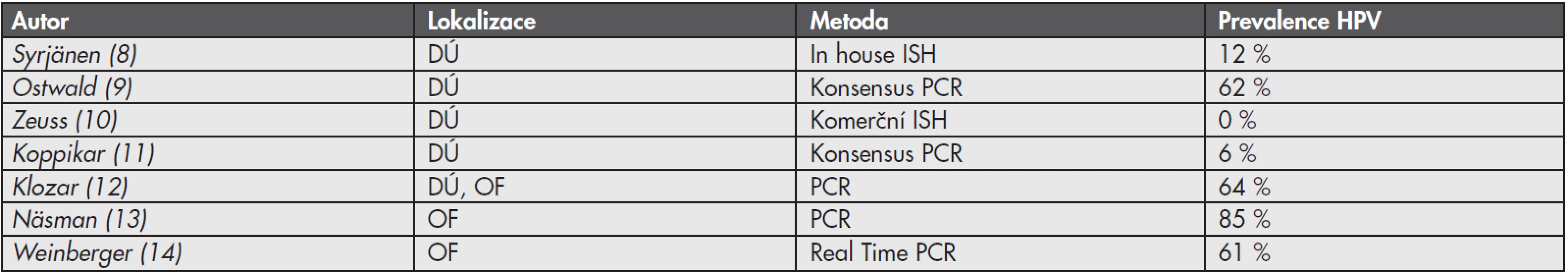
DÚ: dutina ústní, OF: orofarynx, ISH: in situ hybridizace, PCR: polymerázová řetězová reakce Na roli HR-HPV v etiologii nádorů hlavy a krku poprvé poukázal Syrjänen se spolupracovníky v roce 1983 u dlaždicobuněčných karcinomů (HNSCC, z angl. Head and Neck Squamous Cell Carcinomas), jež jsou nejčastějším typem malignity v této oblasti (90 %) (15). Prokázané rizikové faktory pro vznik tohoto onemocnění do té doby byly pouze abúzus alkoholu a tabáku (16). Následně mnohé klinicko-patologické studie prokázaly rozdílnou etiologii a epidemiologii HR-HPV asociovaných HNSCC a zejména díky klinicko-patologickým odlišnostem jsou nyní pokládány za specifickou podskupinu HNSCC. Histologicky se jedná většinou o nekeratinizující nízce diferenciované karcinomy malé velikosti (pT1–pT2), ale s vysokou frekvencí postižení lymfatických uzlin (pN+)(17,18). Přestože jsou HR-HPV asociované HNSCC někdy diagnostikované v klinicky pokročilém stadiu (pT3–pT4), ve většině případů je prognóza pacienta příznivější ve srovnání s pacienty s HNSCC neasociovanými s HR-HPV, což je velmi dobře dokumentováno např. ve studii vedené Angem a spol. (19). HPV status u HNSCC by proto měl být standardní součástí histopatologického vyšetření, neboť je důležitým prognostickým faktorem potencionálně ovlivňujícím léčebnou strategii.
Molekulárně genetické metody detekce HR-HPV
Ve tkáni je HR-HPV možné detekovat množstvím molekulárně biologických metodik. Naprostá většina vyšetření se provádí na materiálu fixovaném ve formalínu a zalitém do parafínu (FFPE, z angl. Formalin-Fixed, Paraffin-Embedded), což ovlivňuje volbu metody průkazu. Dále je kladen důraz na detekci biologicky relevantní HR-HPV infekce, která je skutečně ve vztahu ke vniku nádoru. Nejrozšířenější je průkaz HR-HPV DNA pomocí metod vycházejících z polymerázové řetězové reakce (PCR) (20,21). Při interpretaci nálezu je třeba zohlednit vyšší riziko falešně pozitivních výsledků, neboť PCR metoda je extrémně citlivá a detekuje HPV už na základě přítomnosti pouze několika kopií viru v izolátu. To však může být způsobeno i tranzientní infekcí nebo dokonce kontaminací při zpracování bloku (6). Na druhou stranu použití pouze jediného detekčního PCR systému zase může vést k falešně negativním výsledkům, což vychází zejména z biologické podstaty HPV infekce, neboť nejčastější cíle amplifikace při širokospektrální detekci, geny L1 a E1, nemusí být nutně zachovány ve všech nádorech (22). DNA onkogenů E6 a E7 sice zůstává v nádoru i během progrese, ale sekvenčně se velmi liší mezi různými HR-HPV typy, a proto PCR cílené do těchto oblastí nedetekují široké spektrum HR-HPV typů, ale jednotlivé specifické typy (23).
Na řezu lze HR-HPV prokázat metodou hybridizace in situ (ISH). V čitelně obarveném řezu lze podle druhu signálu rozlišit, zda je DNA HPV integrovaná do genomu, nebo se vyskytuje pouze v epizomální formě (17). Výhoda detekce HPV v topografické souvislosti ve tkáni je však zastřená nižší citlivostí metody (70 %), poměrně častým nespecifickým barvením a vysokým pozadím na řezu (24).
Detekce exprese virových onkogenů pomocí reverzní transkripce (RT) a následné PCR by podle posledních prací měla poskytovat důkaz transformační aktivity HR-HPV v lézi a objevit pouze klinicky relevantní infekci, která je v etiologickém vztahu k nádoru. Úskalím metody je ale kvalita RNA v FFPE materiálu. Navíc je reakce typově specifická a poměrně náročná na provedení (7).
Imunohistochemický průkaz p16 proteinu
Detekce HR-HPV viru se neomezuje pouze na genetické metody a lze využít i imunohistochemického průkazu viru nebo zástupných markerů. Rutinně se využívá imunohistochemického barvení buněčného proteinu p16. Signální dráha p16-Rb je častým cílem virových onkoproteinů při imortalizaci buňky a většina těchto virových interakcí má za následek p16 overexpresi díky přímé nebo nepřímé inaktivaci pRB a následném pokusu buňky zastavit buněčnou proliferaci (25). Přestože transformující HR-HPV infekce není jedinou příčinou overexprese proteinu p16, v některých typech nádorů, zejména u karcinomů děložního hrdla a v perianálních lézích, je imunohistochemické barvení proteinu p16 používáno jako senzitivní zástupný (surrogate) marker HR-HPV infekce (26). Hodnocení exprese p16 proteinu však není jednotné (27), a proto v naší studii expresi p16 posuzujeme dvoustupňovým způsobem: pouze výrazná difuzní jaderně-cytoplazmatická overexprese se hodnotí jako pozitivní nález.
Algoritmus molekulárně biologické detekce klinicky relevantní infekce HR-HPV v karcinomech hlavy a krku
Rozsáhlé možnosti přímé a nepřímé detekce HR-HPV vnáší poměrně širokou variabilitu do publikovaných prevalencí HPV u malignit v oblasti hlavy a krku, pohybující se téměř od 0 do 100 %, což je samozřejmě také ovlivněno rozdílnými lokacemi nádorů v jednotlivých studiích a použitým materiálem (6,28). Detekční algoritmus, který senzitivně a specificky detekuje biologicky relevantní HR-HPV infekci a je snadno použitelný v praxi, je stále předmětem vědeckých diskuzí. Recentní práce upřednostňují přístup, který začíná imunohistochemickým barvením p16 a pokračuje genetickou detekcí HR-HPV, nejčastěji pomocí PCR nebo ISH. Výsledkem je rozdělení nádorů do 4 kategorií: p16-/HPV - (1. kategorie), p16-/HPV+ (2. kategorie), p16+/HPV+ (3. kategorie) a p16+/HPV - (4. kategorie), přičemž pouze u 3. kategorie se předpokládá, že skutečně odpovídá HPV indukovanému nádoru (14). Přestože je tento přístup určen pro HNSCC, Smeets se spolupracovníky (7) se domnívají, že by mohl být zlatým standardem pro určení HPV etiologie i u nádorů jiných lokalizací.
MATERIÁL A METODIKA
V našem sdělení prezentujeme použití výše uvedeného algoritmu, tedy kombinaci imunohistochemického průkazu proteinu p16 a detekci HR-HPV pomocí několika různých PCR na souboru pacientů s nádorem v oblasti hlavy a krku. Výběr materiálu byl prováděn se záměrem porovnání účinnosti a spolehlivosti jednotlivých detekčních metodik, proto výsledky neodpovídají skutečné prevalenci HPV pro jednotlivé neoplastické jednotky. Verifikace průkazu biologicky relevantní HPV infekce ve vztahu ke vzniku nádoru byla provedena na 10 dostupných případech pomocí detekce mRNA HPV transkriptu a in situ hybridizace se sondou pro HR-HPV.
Z registru konzultací naší laboratoře bylo vybráno 41 pacientů: v 32 případech se jednalo o primární nádor a v 9 o uzlinovou metastázu s pravděpodobnou primární lokalizací nádoru v oblasti hlavy a krku. Průměrný věk pacientů byl 60,6 let, medián 64 let (18 – 88 let), 21 mužů a 20 žen. Histologické nálezy zahrnovaly: adenoidně cystický karcinom (2x), kribriformní adenokarcinom (6x), schneideriánský papilom s „high grade” dysplázií (1x), polymorfní nízce maligní adenokarcinom (PLGA, z angl. polymorphous low-grade adenocarcinoma)(5x), nediferencovaný malobuněčný karcinom s neuroendokrinní diferenciací (1x), onkocytární adenom (1x), slizniční neurofibrom (1x), mukoepidermoidní karcinom (1x), papilom s lehkou dysplázií dlaždicového epitelu (1x), nediferencovaný karcinom s abortivními známkami fenotypické neuroendokrinní diferenciace (1x), nediferencovaný solidní karcinom (5x), dlaždicobuněčný karcinom (13x), bazaloidní varianta dlaždicobuněčného karcinomu (3x).
Imunohistochemické barvení proteinu p16 bylo provedeno na FFPE řezech o šířce 4 μm za použití monoklonální protilátky p16 CINtec Histology V-kit na automatickém imunostaineru Ventana BenchMark ULTRA (Ventana, mtm Laboratories AG, Germany) podle firemního protokolu. Jako pozitivní byl hodnocen nález, kdy alespoň 75 % nádorových buněk v souvislém ložisku silně a difúzně exprimovalo p16 protein (obr. 1). Jakýkoliv jiný nález byl považován za negativní.
Obr. 1. Silná difúzní exprese proteinu p16 u HNSCC. (CINtec Histology V-kit, zvětšení 100x). 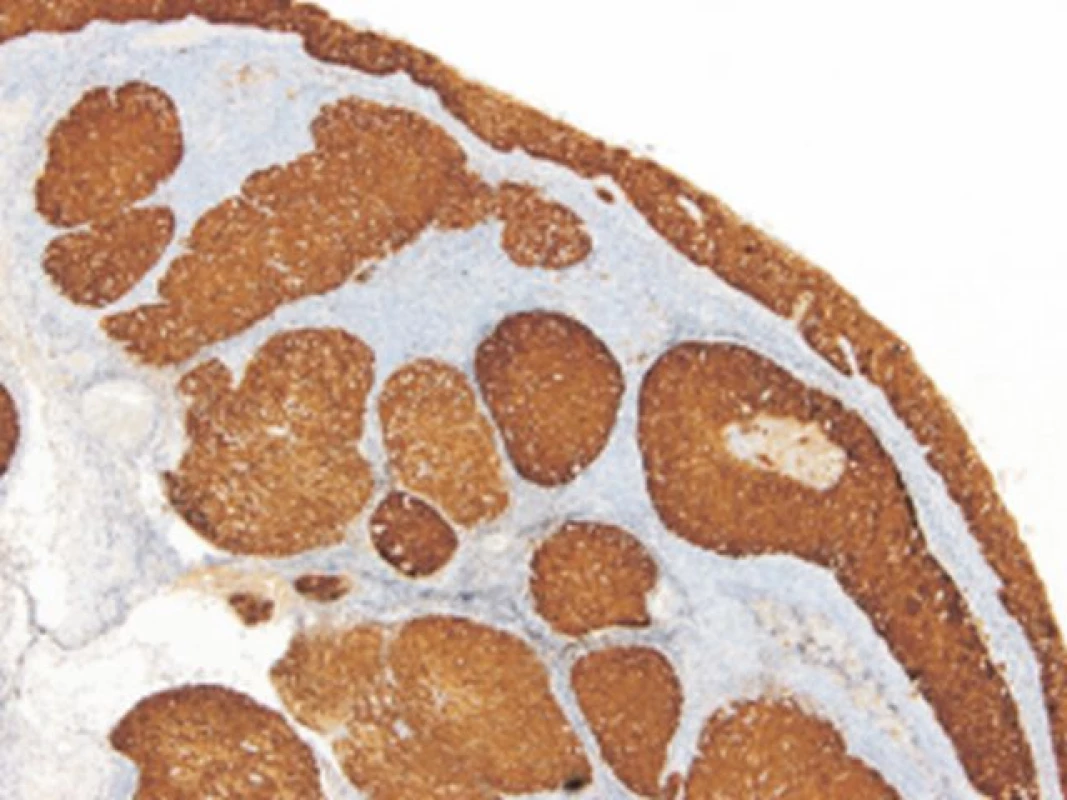
Pro molekulárně biologickou detekci HPV byla provedena DNA extrakce z FFPE bloků. Ve stručnosti: 3–10 řezů o síle 5 μm bylo deparafinizované xylenem a DNA byla izolována komerční soupravou Nukleospin Tissue Kit (Macherey Nagel, Amtsgericht Düren, Germany) podle firemního protokolu. Kvalita izolované DNA a účinnost extrakce byla konfirmována spektroskopickým měřením koncentrace a PCR amplifikací kontrolních genů z lidské DNA (29). Během izolace byla dodržována speciální bezpečnostní opatření, aby nedocházelo ke zkřížené kontaminaci vzorků.
RNA izolace byla provedena kitem RecoverAll Total Nucleic Acid Isolation Kit (Ambion/Applied Biosystems, Foster City, CA, USA) podle firemního protokolu po deparafinizaci xylenem. Kvalita izolované RNA byla ověřena po reverzní transkripci pomocí PCR amplifikace kontrolních genů (30).
Několik různých PCR reakcí bylo použito pro detekci HPV tak, aby bylo možné detekovat co nejširší spektrum onkogenních papilomavirů a zároveň snížit riziko falešné negativity způsobené ztrátou některých genů v primárním nebo sekundárním nádoru. Zároveň byla zohledněna nižší kvalita vstupního DNA materiálu a délka amplifikovaných produktů v jednotlivých PCR nepřesáhla 300 bp, což odpovídá průměrné kvalitě DNA izolované z FFPE materiálu. PCR cílená do oblasti L1 genu byla provedena s primery GP5/6+ (31). Další PCR detekující široké spektrum slizničních a kožních HPV byla cílena do oblasti genu E1 (32). Multiplexní typově specifická PCR amplifikující v oblasti E6 onkogenu byla použita pro detekci 6 nejčastějších HR-HPV, a to 16, 18, 31, 33, 35 a 45. PCR reakce byly modifikovány pro potřeby laboratoře (33). Při podezření na koinfekci více HPV typy nebo při nízké integritě izolované DNA byla navíc použita komerční souprava INNO-LiPA HPV Genotyping kit Extra (Innogenetic NV, Belgium), která pracuje na principu reverzní hybridizace krátkého PCR produktu na typově specifické sondy navázané na membráně.
Podskupina 10 karcinomů, jejichž bloky byly archivovány v naší databázi, byla dále použita pro verifikaci nálezu klinicky relevantní HR-HPV infekce, a to detekcí exprese mRNA virových onkogenů a topografickou detekcí HPV v nádoru. Vzorky byly analyzovány na přítomnost nejčastější sestřihové varianty E6*1, kódované HPV 16 E6 genem. Pro tyto účely byla izolovaná RNA převedena na cDNA pomocí reverzní transkripce a pomocí PCR byl amplifikován úsek E6*1 (7). Dále byla u těchto vzorků na 2 a 4 μm silných řezech provedena in situ hybridizace se sondou INFORM HPV III Family 16 Probe (detekující HR-HPV typy 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 a 66) na automatickém imunostaineru Ventana BenchMark ULTRA (Ventana, mtm Laboratories AG, Germany) podle firemního protokolu. V souladu s firemním protokolem za pozitivní byly považovány ty případy, kdy jsme v nádoru zastihli alespoň jednu souvislou (mapovitou) zónu buněk, jejichž jádra vykazovala granulární/integrovaný či epizomální typ signálu bez ohledu na jeho intenzitu (viz obr. 2).
Všechny PCR a reverzní transkripce byly provedeny na přístroji GeneAmp PCR System 9700 (PE/Applied Biosystems, Forster City, CA). Produkty PCR byly vizualizovány na 2% agarózovém gelu po elektroforéze a obarvení etidium bromidem. Typ HPV viru byl dourčen sekvenací a srovnáním s databází BLAST, popřípadě reverzní hybridizací (LiPA systém). Pouze úspěšná amplifikace HPV ve dvou a více PCR systémech byla považována za pozitivní nález.
VÝSLEDKY
Výsledky imunohistochemické analýzy a genetického PCR průkazu HR-HPV jsou detailně uvedeny v tabulce č. 2 (v elektronickém suplementu k tomu článku na www.CSpatologie.cz). Exprese p16 a zároveň přítomnost HPV byla prokázána u 9 primárních dlaždicobuněčných karcinomů a 3 metastáz dlaždicobuněčného karcinomu v uzlině, dále u 3 případů bazaloidní varianty dlaždicobuněčného karcinomu a 2 metastáz nediferencovaného karcinomu. Exprese p16 proteinu ani přítomnost HPV prokázána nebyla v 1 metastáze nediferencovaného karcinomu. Expresi p16 proteinu a přítomnost HPV DNA nebylo možné ohodnotit u 1 případu dlaždicobuněčného karcinomu a ve 2 metastázách nediferencovaného karcinomu vzhledem k velmi nízké kvalitě materiálu. U dalších nádorových jednotek byla prokázána difuzní imunohistochemická pozitivita p16 pouze v případě schneideriánského papilomu s „high grade“ dysplázií. HPV DNA nebyla detekována v žádné z těchto jednotek.
Průkaz silné difuzní exprese p16 proteinu a určení přítomnosti HPV pomocí PCR v naší skupině silně korelovaly (korelační koeficient 0,94). Jednotlivé PCR metody se shodovaly v 83 %. U 7 případů došlo k vychýlení jedné metody PCR (falešná negativita, nebo falešná pozitivita) a výsledek byl sestaven na základě shody dvou metod.
Genotypizace pozitivních případů pomocí sekvenace PCR produktů a následného porovnání s databází BLAST byla úspěšná u všech HPV pozitivních případů. V 16 nádorech (94 %) byl detekován HR-HPV typ 16, v jednom případě se jednalo o typ 33.
U 10 karcinomů byla provedena detekce nejčastější sestřihové varianty mRNA HPV typu 16 - E6*1 - a in situ hybridizace (tabulka 3, v elektronickém suplementu k tomu článku na www.CSpatologie.cz). Nejčastější sestřihová varianta mRNA HPV typu 16 – E6*1 - byla prokázána u 7 karcinomů, kde byla zároveň detekována exprese proteinu p16 a HPV DNA typu 16, a nebyla prokázána v případě v 2 karcinomů s nedetekovatelnou expresí p16 a HPV DNA. V jednom případě byl průkaz transkriptu neohodnotitelný díky nízké kvalitě RNA v nádoru. In situ hybridizace se sondou detekující HR-HPV DNA byla úspěšně vyhodnocena u 6 vzorků (obr. 2). Touto metodikou byla HPV prokázána u 4 karcinomů, kde byla zároveň detekována exprese proteinu p16 a HPV DNA typu 16, a nebyla prokázána na případu 2 karcinomů s nedetekovatelnou expresí p16 a HPV DNA. Metodika je optimalizována pro cervikální dysplázie (obr. 3).
Obr. 2. <i>In situ hybridizace</i> (ISH - integrovaný typ barvení) u HNSCC s pruhy infiltrujícího dlaždicového karcinomu obsahujícími oblasti s granulární jadernou pozitivitou signálu modré barvy svědčící pro integraci DNA HPV do genomu buňky (INFORM HPV III Family 16 Probe, zvětšení 100x). 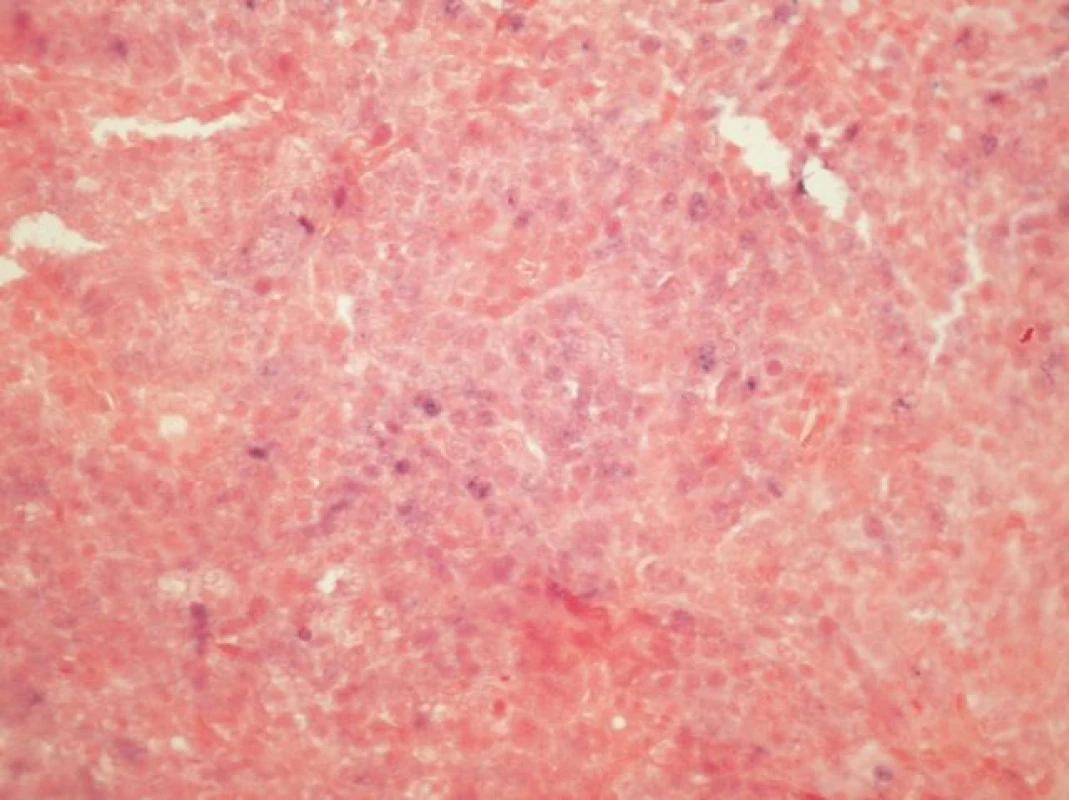
Obr. 3. <i>In situ hybridizace</i> (ISH – epizomální typ barvení) u cervikální léze, kde v horních vrstvách dlaždicového epitelu jsou sytě modře difúzně zbarvená jádra svědčící pro DNA HPV v epizomální podobě (INFORM HPV III Family 16 Probe, zvětšení 100x). 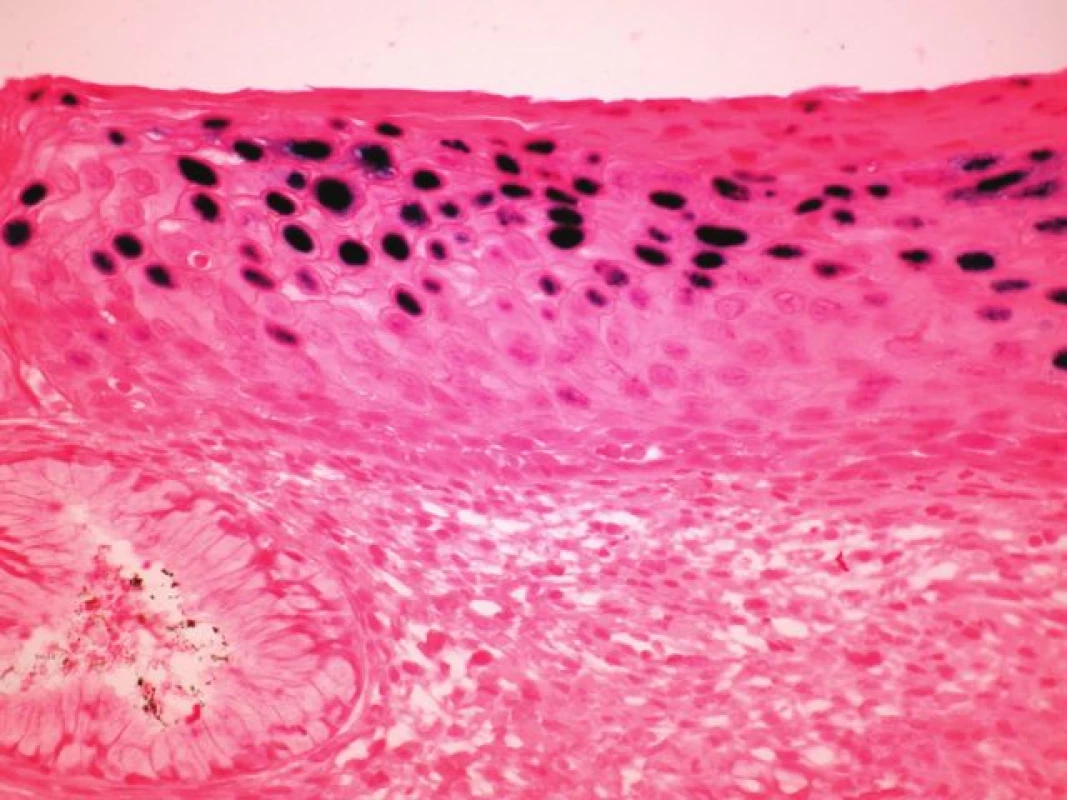
DISKUZE
HPV statut se zdá být důležitým prognostickým markerem u HNSCC a v dohledné době bude zřejmě i léčba HPV pozitivních HNSCC, zejména těch s lokalizací v orofaryngu, odlišná od HNSCC bez prokázané virové etiologie (34,35). Diagnostický význam má i přítomnost HPV infekce v uzlinové metastáze v oblasti hlavy a krku, neboť může pomoci určit lokalizaci primární malignity. V současné době však stále neexistuje celosvětový metodický konsenzus detekce HPV v nádorech hlavy a krku (36).
Imunohistochemická detekce exprese p16 je rutinně používaným zástupným markerem klinicky relevantní HPV infekce u lézí děložního čípku. Použití p16 jako zástupného markeru HR-HPV infekce pro neoplázie jiných lokalit má však svoje úskalí. Pro lokalizaci hlavy a krku se sice citlivost detekce HR-HPV ve tkáni pomocí p16 IHC uvádí až 100%, nicméně specifita IHC průkazu overexprese p16 pro identifikaci HPV infekce je nižší, neboť se vyskytuje u více nádorových jednotek, které jsou evidentně bez vztahu k HPV infekci (33,37). Lewis ve své práci tvrdí, že samotné stanovení overexprese p16 je samostatným kriteriem k odlišení skupiny HNSCC pacientů s příznivější prognózou (38). Je však třeba dalších studií, aby se potvrdilo, že je tento přístup dostačující pro konvenční HNSCC, či dokonce vhodný i pro další nádorové jednotky. Navíc stále je diskutabilní otázka interpretace exprese p16 proteinu.
Aktuální práce nejčastěji upřednostňují efektivní kombinaci více metod tak, aby bylo dosaženo dostatečné citlivosti i specifity detekce HR-HPV. Jako velmi užitečná se jeví kombinace imunohistochemického stanovení p16 exprese a DNA HR-HPV detekce, která je provedena buďto pomocí PCR technik nebo ISH (7,39). Nicméně citlivost obou DNA metod není stejná a podle Smeetse asi 20 % výsledků detekce HR-HPV pomocí PCR a ISH se liší (7).
Průkaz overexprese proteinu p16 a průkaz HPV DNA pomocí PCR v našem souboru výborně koreloval. Vysoká shoda korelace metod byla dána dle našeho mínění striktním stanovením pozitivity exprese proteinu p16 a určením výsledku HPV detekce pomocí kombinace tří PCR technik. Nejlépe HPV DNA detekovala typově specifická PCR cílená do oblasti E6 genů, s ostatními metodami se rozcházela pouze v 1 případě. Velmi dobrých výsledků bylo dosaženo i pomocí PCR s použitím GP+ primerů, zde byla neshoda s ostatními metodami objevena ve 2 případech. PCR detekující v oblasti E1 genů byla třikrát slabě falešně pozitivní a jednou falešně negativní, zřejmě díky deleci genu E1 během integrace HPV do lidského genomu. Tato PCR byla použita zejména pro širší typový pokryv detekovaných HPV.
Námi zjištěná HPV typová distribuce – HPV typ 16 (94 %) a HPV typ 33 (6 %) – velmi dobře koreluje s literárními údaji, neboť spektrum HPV typů detekovaných v neopláziích hlavy a krku není tak široké jako u maligních cervikálních lézí. Zdaleka nejčastějším typem detekovaným v HNSCC je typ 16 (6,40,41). Znatelně méně (5 %) jsou v těchto nádorech detekovány HR-HPV typy 18, 33 a 35. Koinfekce jednoho vzorku více typy HPV v našem souboru objevena nebyla, což je opět ve shodě s publikovanými údaji (42).
Ověření biologické relevance infekce pomocí detekce transkripce virových onkogenů bylo možné v 7 případech a ve všech bylo potvrzeno (kromě jednoho neanalyzovatelného vzorku), že jsme detekovali HPV infekci s aktivní transkripcí HPV onkogenů. Na stejných případech byla provedena ISH HR-HPV DNA, ale úspěšnost detekce byla podstatně nižší. Jasná pozitivita byla prokázána u 6 případů. Ostatní materiál nebylo možné odečíst díky vysokému pozadí a nespecifickému barvení tkáně. Použitá komerční souprava pro ISH sice není přímo výrobcem určena pro HPV detekci v neopláziích hlavy a krku, ale je pro tyto účely běžně používána (43). Přebarvené pozadí a nespecifické barvení byly způsobeny nešetrnou fixací vzorku před zalitím do parafínového bloku, což je parametr, který však nelze metodicky v diagnostické laboratoři optimalizovat.
Ve schneideriánském papilomu s „high-grade“ dysplázií byla detekována exprese proteinu p16, ale nebyla zde prokázána přítomnost HPV DNA. Při pozitivním průkazu proteinu p16 a negativní detekci HR-HPV je třeba vzít v úvahu přítomnost jiného DNA onkoviru nebo současnými detekčními technikami nezachytitelný typ HR-HPV. V literatuře se popisují další příčiny nadměrné exprese p16 v nádoru bez vztahu s virovou infekcí, které vychází zejména z antiproliferativní funkce p16, např. u karcinomu prsu a plic, kde byla popsána ztráta pRb (44,45). Dalším mechanizmem může být „onkogenem indukovaná senescence“ (OIS), tak jak bylo popsáno u pigmentových névů a schwannomů (46).
SOUHRN
Potvrdili jsme vysokou korelaci p16 overexprese a pozitivního průkazu HPV DNA pomocí PCR u dlaždicobuněčných karcinomů v primárním nádoru i uzlinových metastázách. Této vysoké shody (korelační koeficient 0,94) bylo dosaženo významnou úpravou způsobu hodnocení exprese antigenu p16, kdy za pozitivní se považuje pouze výrazná difuzní pozitivita, a dále stanovením HPV DNA statutu pomocí tří PCR reakcí, které zaručují pokrytí širokého detekčního spektra HPV a maximální redukci falešně pozitivních a falešně negativních nálezů. Verifikace klinicky relevantního nálezu HPV 16 pomocí detekce mRNA transkriptu se zdá být užitečná a použitelná pro praxi, zatímco využití in situ hybridizace v algoritmu HPV detekce je zatím omezené vzhledem k velmi častému výskytu nespecifického barvení, které je často dané nešetrnou předlaboratorní fixací. V případě vzácnějších diagnostických jednotek byla také potvrzena vysoká shoda barvení p16 a HPV detekce.
PODĚKOVÁNÍ
MUDr. Petru Mukenšnablovi, Ph.D a prof. MUDr. Ondřeji Hesovi, Ph.D. za pomoc při zpracování článku a Bioptické laboratoři, s.r.o. za finační podporu studie
Adresa pro korespondenci:
RNDr. Jana Kašpírková
Bioptická laboratoř s.r.o.
Mikulášské náměstí 4, Plzeň, 326 00
tel.:737220433
fax: 377 440 539
email: kaspirkova@medima.cz
Zdroje
1. zur Hausen H. The search for infectious causes of human cancers: where and why. Virology 2009; 392(1): 1–10.
2. zur Hausen H. Papillomaviruses and cancer: from basic studies to clinical application. Nat Rev Cancer 2002; 2(5): 342–350.
3. Katzenellenbogen RA, Galloway DA. Human papillomavirus-associated cancers. In:Viral Oncology-Basic Science and Clinical Applications, 1st ed, New Yersey: Wiley - Blackwell, 2009 : 1–23.
4. MuĖoz N, Castellsagué X, de González AB, Gissmann L. Chapter 1: HPV in the etiology of human cancer. Vaccine 2006; 31, Suppl 3: S3/1–10.
5. Walboomers JM, Jacobs MV, Manos MM, et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol 1999; 189(1): 12–19.
6. Kreimer AR, Clifford GM, Boyle P, Franceschi S. Human papillomavirus types in head and neck squamous cell carcinomas worldwide: a systematic review. Cancer Epidemiol Biomarkers Prev 2005; 14(2): 467–475.
7. Smeets SJ, Hesselink AT, Speel EJ, et al. A novel algorithm for reliable detection of human papillomavirus in paraffin embedded head and neck cancer specimen. Int J Cancer 2007; 121 (11): 2465–2472.
8. Syrjänen SM, Syrjänen KJ, Happonen RP. Human papillomavirus (HPV) DNA sequences in oral precancerous lesions and squamous cell carcinoma demonstrated by in situ hybridization. J Oral Pathol 1988; 17(6): 273–278.
9. Ostwald C, Müller P, Barten M, et al. Human papillomavirus DNA in oral squamous cell carcinomas and normal mucosa. J Oral Pathol Med 1994; 23(5): 220–225.
10. Zeuss MS, Miller CS, White DK. In situ hybridization analysis of human papillomavirus DNA in oral mucosal lesions. Oral Surg Oral Med Oral Pathol 1991; 71(6): 714–720.
11. Koppikar P, de Villiers EM, Mulherkar R. Identification of human papillomaviruses in tumors of the oral cavity in an Indian community. Int J Cancer 2005; 113(6): 946–950.
12. Klozar J, Tachezy R, Rotnáglová E, Koslabová E, Saláková M, Hamšíková E. Human papillomavirus in head and neck tumors: epidemiological, molecular and clinical aspects. Wien Med Wochenschr 2010; 160(11-12): 305–309.
13. Näsman A, Attner P, Hammarstedt L, et al. Incidence of human papillomavirus (HPV) positive tonsillar carcinoma in Stockholm, Sweden: an epidemic of viral-induced carcinoma? Int J Cancer 2009; 125(2): 362–366.
14. Weinberger PM, Yu Z, Haffty BG, et al. Molecular classification identifies a subset of human papillomavirus-associated oropharyngeal cancers with favorable prognosis. J Clin Oncol 2006; 24(5): 736–747.
15. Syrjänen KJ, Pyrhönen S, Syrjänen SM, Lamberg MA. Immunohistochemical demonstration of human papilloma virus (HPV) antigens in oral squamous cell lesions. Br J Oral Surg 1983; 21(2): 147–153.
16. Lambert R, Sauvaget C, de Camargo Cancela M, Sankaranarayanan R. Epidemiology of cancer from the oral cavity and oropharynx. Eur J Gastroenterol Hepatol 2011; 23(8): 633–641.
17. Snow AN, Laudadio J. Human papillomavirus detection in head and neck squamous cell carcinomas. Adv Anat Pathol 2010; 17(6): 394 –403.
18. Westra WH. The changing face of head and neck cancer in the 21st century: the impact of HPV on the epidemiology and pathology of oral cancer. Head Neck Pathol 2009; 3(1): 78–81.
19. Ang KK, Harris J, Wheeler R. Human papillomavirus and survival of patients with oropharyngeal cancer. N Engl J Med 2010; 36(1): 24–35.
20. Remmerbach TW, Brinckmann UG, Hemprich A, Chekol M, Kühndel K, Liebert UG. PCR detection of human papillomavirus of the mucosa: comparison between MY09/11 and GP5+/6+ primer sets. J Clin Virol 2004; 30(4): 302–308.
21. Morshed K, Polz-Dacewicz M, Szymański M, Polz D. Short-fragment PCR assay for highly sensitive broad-spectrum detection of human papillomaviruses in laryngeal squamous cell carcinoma and normal mucosa: clinico-pathological evaluation. Eur Arch Otorhinolaryngol 2008; 265, (Suppl.1): 89–96.
22. Morris BJ. Cervical human papillomavirus screening by PCR: advantages of targeting the E6/E7 region. Clin Chem Lab Med 2005; 43(11): 1171–1177.
23. Karlsen F, Kalantari M, Jenkins A, et al. Use of multiple PCR primer sets for optimal detection of human papillomavirus. J Clin Microbiol 1996; 34(9): 95–100.
24. Poljak M, Ostrbenk A, Seme K, et al. Comparison of clinical and analytical performance of the Abbott Realtime High Risk HPV test to the performance of hybrid capture 2 in population-based cervical cancer screening. J Clin Microbiol 2011; 49(5): 1721–1729.
25. Romagosa C, Simonetti S, López-Vicente L, et al. p16(Ink4a) overexpression in cancer: a tumor suppressor gene associated with senescence and high-grade tumors. Oncogene 2011; 30(18): 2087–2097.
26. Mulvany NJ, Allen DG, Wilson SM. Diagnostic utility of p16INK4a: a reappraisal of its use in cervical biopsies. Pathology 2008; 40(4): 335 –344.
27. Campisi G, Giovannelli L. Controversies surrounding human papilloma virus infection, head & neck vs oral cancer, implications for prophylaxis and treatment. Head Neck Oncol 2009; 30 : 1:8.
28. D’Souza G, Kreimer AR, Viscidi R, et al. Case-control study of human papillomavirus and oropharyngeal cancer. N Engl J Med 2007; 356(19): 1944–1956.
29. van Dongen JJ, Langera AW, Bruggemann M, et al. Design and standardization of PCR primers and protocols for detection of clonal immunoglobulin and T-cell receptor gene recombinations in suspect lymphoproliferations: report of the BIOMED-2 Concerted Action BMH4-CT98-3936. Leukemia 2003; 17(12): 2257–2317.
30. Gaffney R, Chakerian A, O’Connell JX, et al.: Novel fluorescent ligase detection reaction and flow cytometric analysis of SYT-SSX fusions in synovial sarcoma. J Mol Diagn 2003; 5(2): 127 –135.
31. Jacobs MV, Snijders PJ, van den Brule AJ, Helmerhorst TJ, Meijer CJ, Walboomers JM. A general primer GP5+/GP6(+)-mediated PCR-enzyme immunoassay method for rapid detection of 14 high-risk and 6 low-risk human papillomavirus genotypes in cervical scrapings. J Clin Microbiol 1997; 35(3): 791–795.
32. Tieben LM, ter Schegget J, Minnaar RP, et al. Detection of cutaneous and genital HPV types in clinical samples by PCR using consensus primers. J Virol Methods 1993; 42(2-3): 265–279.
33. Skálová A, Kašpírková - Němcová J, Vaněček T. Role of Human Papillomaviruses (HPV) in salivary gland tumors. Cesk Patol 2013 - v tisku.
34. Marur S, D’Souza G, Westra WH, Forastiere AA. HPV-associated head and neck cancer: a virus-related cancer epidemic. Lancet Oncol 2010; 11(8): 781–789.
35. Nichols AC, Faquin WC, Westra WH, et al. HPV-16 infection predicts treatment outcome in oropharyngeal squamous cell carcinoma. Otolaryngol Head Neck Surg 2009; 140(2): 228 –234.
36. Pannone G, Rodolico V, Santoro A, et al. Evaluation of a combined triple method to detect causative HPV in oral and oropharyngeal squamous cell carcinomas: p16 Immunohistochemistry, Consensus PCR HPV-DNA, and In Situ Hybridization. Infect Agent Cancer 2012; 29 : 7:4.
37. Wadsworth B, Bumpous JM, Martin AW, Nowacki MR, Jenson AB, Farghaly H. Expression of p16 in Sinonasal Undifferentiated Carcinoma (SNUC) Without Associated Human Papillomavirus (HPV). Head Neck Pathol 2011; 5(4): 349–354.
38. Lewis JS Jr, Thorstad WL, Chernock RD, et al. p16 positive oropharyngeal squamous cell carcinoma: an entity with a favorable prognosis regardless of tumor HPV status. Am J Surg Pathol 2010; 34(8): 1088–1096.
39. Cantley RL, Gabrielli E, Montebelli F, Cimbaluk D, Gattuso P, Petruzzelli G. Ancillary studies in determining human papillomavirus status of squamous cell carcinoma of the oropharynx: a review. Patholog Res Int 2011; 138469, Epub.
40. Termine N, Panzarella V, Falaschini S. HPV in oral squamous cell carcinoma vs head and neck squamous cell carcinoma biopsies: a meta-analysis (1988-2007). Ann Oncol 2008; 19(10): 1681–1690.
41. Herrero R, Castellsagué X, Pawlita M, et al. IARC Multicenter Oral Cancer Study Group. Human papillomavirus and oral cancer: the International Agency for Research on Cancer multicenter study. J Natl Cancer Inst 2003; 95(23): 1772–1783.
42. Rotnáglová E, Tachezy R, Saláková M, et al. HPV involvement in tonsillar cancer: prognostic significance and clinically relevant markers. Int J Cancer 2011; 129(1): 101–110.
43. Schlecht NF, Brandwein-Gensler M, Nuovo GJ, et al. A comparison of clinically utilized human papillomavirus detection methods in head and neck cancer. Mod Pathol 2011; 24(10): 1295 –1305.
44. Herschkowitz JI, He X, Fan C, Perou CM. The functional loss of the retinoblastoma tumour suppressor is a common event in basal-like and luminal B breast carcinomas. Breast Cancer Res 2008; 10(5): R75, Epub.
45. Bastide K, Guilly MN, Bernaudin JF, et al. Molecular analysis of the Ink4a/Rb1-Arf/Tp53 pathways in radon-induced rat lung tumors. Lung Cancer 2009; 63(3): 348–353.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek Česká eponyma v patologii
Článok vyšiel v časopiseČesko-slovenská patologie

2013 Číslo 1-
Všetky články tohto čísla
- 24th EUROPEAN CONGRESS OF PATHOLOGY 2012, PRAHA - Patologie dolního GIT
- 24th EUROPEAN CONGRESS OF PATHOLOGY 2012, PRAHA - Pulmopatologie
- 24th EUROPEAN CONGRESS OF PATHOLOGY 2012, PRAHA - Patologie hlavy a krku
- 24th EUROPEAN CONGRESS OF PATHOLOGY 2012, PRAHA - Hematopatologie
- 24th EUROPEAN CONGRESS OF PATHOLOGY 2012, PRAHA - Patologie mammy
- 24th EUROPEAN CONGRESS OF PATHOLOGY 2012, PRAHA - Endokrinní patologie
- 24th EUROPEAN CONGRESS OF PATHOLOGY 2012, PRAHA - Cytopatologie
- 24th EUROPEAN CONGRESS OF PATHOLOGY 2012, PRAHA - Ortopedická patologie
- 24th EUROPEAN CONGRESS OF PATHOLOGY 2012, PRAHA - Hepatopatologie
- 24th EUROPEAN CONGRESS OF PATHOLOGY 2012, PRAHA - Nefropatologie
- 24th EUROPEAN CONGRESS OF PATHOLOGY 2012, PRAHA - Uropatologie
- 24th EUROPEAN CONGRESS OF PATHOLOGY 2012, PRAHA - Neuropatologie
- 24th EUROPEAN CONGRESS OF PATHOLOGY 2012, PRAHA - Novinky v molekulární patologii
- Možnosti průkazu biologicky relevantní papilomavirové infekce u maligních nádorů hlavy a krku v diagnostické patologii
-
UPDATE IN PATHOLOGY 2012
24. Evropský kongres patologie v Praze -
HLAVOVA CENA a LAMBLOVA CENA
za rok 2012 -
Dysplázie sliznice žaludku.
Klinickopatologická studie 35 případů - Autofagické vakuolární myopatie – aneb co nás naučila diferenciální diagnostika vakuol ve svalové biopsii
- O 24. evropském kongresu patologie v Praze s prezidentem místního organizačního výboru prof. Alešem Ryškou
-
Nanopatologie - nový vědecký obor
Minireview - With the president of the ESP - Prof. Carneiro - about the 24th European Congress of Pathology in Prague 2012
- Prof. MUDr. Zdeněk Nožička, DrSc., osmdesátiletý
- Česká eponyma v patologii
- 24th EUROPEAN CONGRESS OF PATHOLOGY 2012, PRAHA - Gynekopatologie
- 24th EUROPEAN CONGRESS OF PATHOLOGY 2012, PRAHA - Horní GIT a pankreas
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Česká eponyma v patologii
-
Dysplázie sliznice žaludku.
Klinickopatologická studie 35 případů - Autofagické vakuolární myopatie – aneb co nás naučila diferenciální diagnostika vakuol ve svalové biopsii
- Možnosti průkazu biologicky relevantní papilomavirové infekce u maligních nádorů hlavy a krku v diagnostické patologii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



