-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Zdravotní rizika při působení prachu při práci
Health risks of exposure to dust at work
This review article summarizes the up to date available data about the diseases in causal association with exposure to dust. Collagen pneumoconiosis diseases are dealt with in more detail in view of their serious complications.
Keywords:
exposure to dust – complications in pneumoconiosis – interstitial lung diseases – silicosis and coal miner pneumoconiosis – asbestosis – malignancies
Autoři: Sglunda Ondřej
Působiště autorů: Student Univerzity Karlovy v Praze, 3. lékařské fakulty
Vyšlo v časopise: Pracov. Lék., 65, 2013, No. 3-4, s. 134-141.
Kategorie: Souborný referát
Souhrn
Tento přehledový článek shrnuje aktuálně dostupná data k onemocněním v příčinné souvislosti k expozici prachu. Kolagenním pneumokoniózám, vzhledem k jejich potenciálním vážným komplikacím, je věnován detailní popis.
Klíčová slova:
expozice prachu – komplikace pneumokonióz – intersticiální plicní onemocnění – silikóza a uhlokopská pneumokonióza – azbestóza – malignityÚVOD
Částice a sloučeniny inhalované v pracovním prostředí mohou způsobovat většinu hlavních chronických plicních onemocnění. Z důvodů rozdílů v metabolismu a odolnosti různých jedinců může jedna látka způsobovat rozličná onemocnění, stejně jako cigaretový kouř způsobuje mnoho zdravotních následků. Naopak jedno respirační onemocnění může mít více příčin ve spojitosti s pracovním prostředím. Rozpoznání kauzálních příčin spojených s pracovním prostředím může být značně náročné, jelikož následky přichází po rocích latence, obvykle v době, kdy jedinec již nepracuje na pracovišti, kde byl předtím kauzálnímu zdroji vystaven. Incidence onemocnění spojených s intersticiální plicní fibrózou způsobených minerálních prachem v poslední době v rozvinutých zemích klesá, zatímco astma se ukazuje být hlavním plicním onemocněním spojeným s pracovním prostředím [17]. Z těchto i mnoha dalších důvodů je nutné dbát na prevenci onemocnění spojených s expozicí prachu, stejně tak jako na správnou diagnózu a léčbu již vzniklých patologických stavů.
CHARAKTERISTIKA PRACHU
Prach patří k nejrozšířenějším škodlivinám, kterými je vystaven profesionální pracovník během výkonu pracovní činnosti. Faktory, které ovlivňují účinek prachových částic na člověka, jsou mnohé: původ, chemická charakteristika, vlastnosti a velikost prachových částic. Pravděpodobnost vzniku patologických stavů je zvýšena při elevovaných koncentracích prachu a při dlouhodobé expozici. V zákoníku České republiky je proto ukotvena rozsáhlá legislativa, která popisuje předpisy, které je nutné dodržet při organizaci práce v prašném prostředí.
Definice prachu není jednoznačně stanovena, mezinárodní norma [4] nicméně uvádí pojem „prach“ (dust) jako „malé tuhé částice o průměru pod 75 µm, které se vlastní hmotností usazují, ale mohou zůstat v suspendovaném stavu po jistou dobu“. Můžeme tedy jinými slovy říci, že prach jsou pevné částice rozptýlené ve vzduchu, které se díky svým malým rozměrům usazují natolik pomalu, že vytvářejí během usazování poměrně stabilní aerosolovou soustavu.
Prach lze dělit podle různých kritérií, základní dělení je na toxický a netoxický prach. Dělení netoxického prachu podle jeho následků pro organismus je v předpisech ČR používáno při evaluaci prašnosti pracovního prostředí (tab. 1) [7].
Tab. 1. Dělení prachu podle účinků na organismus 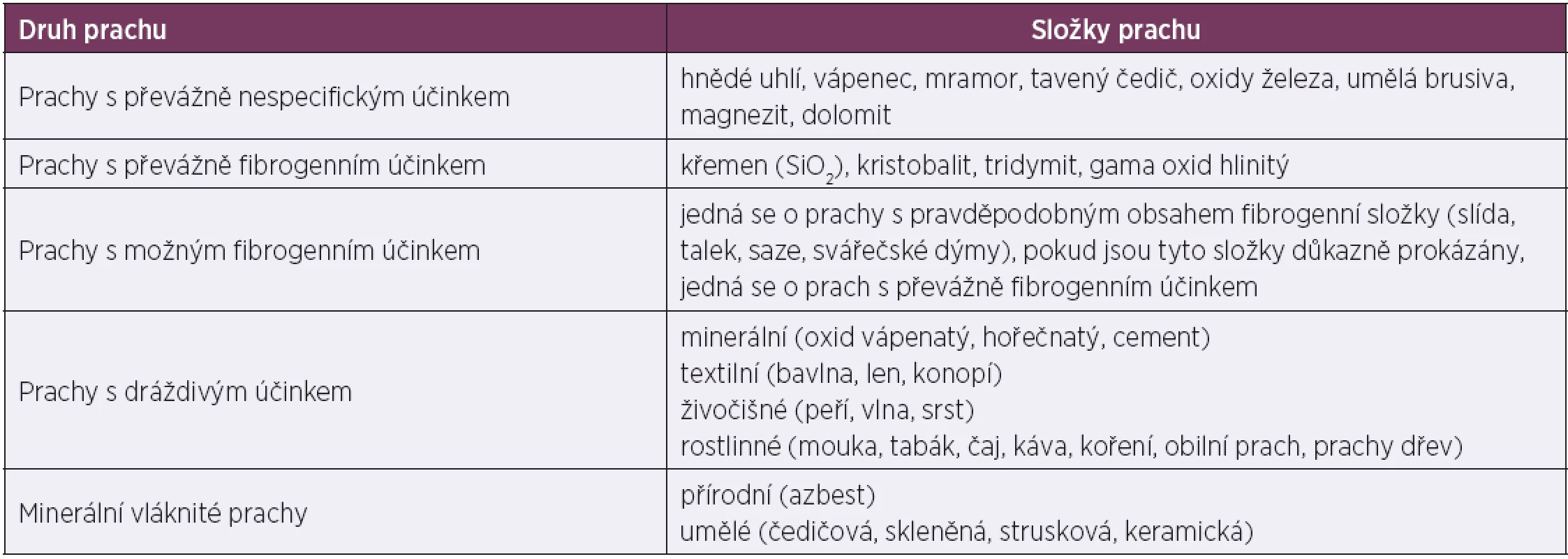
Naprostá většina zdravotních důsledků vznikajících v souvislosti s expozicí prachu zasahuje respirační ústrojí člověka. V případě vdechnutí prachových částic také nabývá na důležitosti velikost prachových částic. Větší prachové částice jsou zadrženy na řasinkovém epitelu již v horních dýchacích cestách. Spolu se sekretovaným hlenem jsou tyto částice poté spolknuty, nebo vykašlány. Menší částice (ale větší než 5 µm) se zachytí v bronších a bronchiolech (thorakální složka). Částice, jejichž velikost je menší než 5 µm, již pronikají do plicních alveolů (respirabilní složka). Pro částice velikosti 3 µm je tato pravděpodobnost vyšší než 50 %. Velikost částic je tedy nejdůležitější vlastností určující, kde bude prachová částice zachycena [2, 3, 5].
PATOLOGICKÉ STAVY SOUVISEJÍCÍ S EXPOZICÍ PRACHOVÝM ČÁSTICÍM V PRACOVNÍM PROSTŘEDÍ
Jeden kauzální faktor může způsobit větší množství klinických následků a jedno onemocnění může být způsobeno mnoha různými faktory. Tabulka 2 přináší souhrn možných nemocí se stručnou charakteristikou. Nemoci charakteristicky spojené s pracovním prostředím budou popsány dále.
Tab. 2. Přehled onemocnění vznikající v souvislosti s expozicí prachu v pracovním prostředí 
Intersticiální plicní onemocnění
Tato skupina onemocnění má společný patofyziologický základ – prachové částice přítomné v pracovním prostředí, které jsou menší než 5 µm, se dostávají do alveolů, kde vyvolávají zánět a dále stimulují tvorbu fibrózních vláken.
Detailní patofyziologický podklad těchto onemocnění se předpokládá tento: po dosažení alveolu jsou prachové částice (typicky azbest a křemíkový prach) fagocytovány alveolárními makrofágy (prašnými buňkami). Makrofágy jsou těmito prašnými partikulemi poškozovány a sekretují zánětlivé cytokiny, zejména TNF-α a IL-1, které stimulují extravazaci zánětlivých buněk z krve do alveolární stěny a na povrch alveolární epiteliální výstelky, čímž vzniká alveolitida. Zánětlivý proces je následován reparační fází, ve které růstové hormony sekretované makrofágy (fibroblast growth factor (FGF), platelet derived growth factor (PDGF) a insulin-like growth factor (IGF)) stimulují vznik a proliferaci pneumocytů II typu a fibroblastů, které společně syntetizují kolagen a fibronectin, hlavní složky fibrózního procesu [12, 15].
Intersticiální plicní onemocnění, vzniklá v souvislosti s pracovním prostředím, se standardně rozdělují na 2 skupiny podle míry produkce kolagenu v plicním intersticiu (tab. 3).
Tab. 3. Přehled intersticiálních plicních onemocnění v souvislosti s expozicí prachu 
Silikóza a uhlokopská pneumokonióza
Vzhledem k podobnostem mezi těmito dvěma klinickými jednotkami budou obě onemocnění popisována společně, vždy se zdůrazněním případných rozdílů mezi nimi.
• Epidemiologie
V období 1980–1990 bylo každý rok diagnostikováno okolo 700 nových profesionálních onemocnění plic, přičemž uhlokopská pneumokonióza tvořila přes dvě třetiny těchto onemocnění. Z geografického hlediska bylo přes 80 % případů hlášeno v regionu severní Moravy a Slezska. V současnosti (v souvislosti s restrukturalizací a útlumem těžebního průmyslu, zejména na severní Moravě a na Kladensku) je výskyt nových onemocnění redukován přibližně na desetinu původního počtu. Silikóza plic je charakteristická pro horníky v rudných dolech, pro lamače, tuneláře a dělníky v kamenolomech. Vyskytuje se rovněž u bílých zedníků, slévačů, čističů odlitků, při výrobě žáruvzdorných materiálů, v porcelánkách, u výroby brusiv a v jiných rizikových profesích [6].
Hlavní noxou je tzv. fibrogenní prach. Mezi minerály s nejvyšším fibrogenním účinkem patří zejména křemen, který lze v přírodě nalézt v nejrůznějších formách (ametyst, růženín, záhněda). Chemicky se ale vždy jedná o oxid křemičitý.
Z hlediska patologie je obraz onemocnění poměrně charakteristický. V souvislosti s usazováním prašných částic v alveolech a aktivaci zánětu a fibrózy se rozvíjí tzv. silikotický uzlík. Centrální zóna uzlíku je hyalinizována a skládá se z koncentricky uspořádaných kolagenních vláken. Periferní zóna je méně organizována a obsahuje makrofágy, lymfocyty a menší množství kolagenu. V této zóně probíhá aktivní zánět.
Uzlíky jsou difuzně uloženy v plicích, v těžších stadiích onemocnění pak narůstá jejich četnost a periferie uzlíku se šíří dál směrem od hyalinizovaného centra, fibrotickým procesem poté zasahuje bronchioly, krevní a lymfatické cévy. S další progresí pak uzlíky splývají do tzv. uzlů masivních – kompaktní fibrózy. Centrum uzlíku může dále podléhat ischemické nekróze a vzniká kavita. Po provalení nekrotického ložiska do bronchu následně vzniká kavita [14].
U uhlokopské pneumokoniózy jsou charakteristická drobná prašná ložiska (makuly). Jedná se o depozita uhelného prachu vyskytující se volně a v plicních makrofázích v pojivu kolem periferního větvení respiračních bronchiolů. V některých makulách dochází k tvorbě kolagenních vláken s následným perifokálním emfyzémem. Méně četné jsou tzv. sekundární uzlíky. Jsou větší (do 10 mm) a více kolagenizované. V dalších stadiích onemocnění vzniká obraz masivní fibrózy – černé, velké a tuhé uzly, které jsou tvořeny masou hyalinizovaného vaziva s velkým množstvím uhelného prachu. Tento stav je spojen s deformací nebo obliterací bronchů a cév s možnou dislokací plicních hilů. Častý je výskyt ischemické nekrózy, která je podmíněna obliterací arterií. Následuje rozpad, respektive provalení nekrózy do bronchu s následným vznikem aseptické dutiny [6].
• Klinický obraz
Klinický obraz prosté silikózy i prosté pneumokoniózy není charakteristický. Onemocnění může probíhat dlouho bez klinické symptomatologie nebo pod obrazem jednoduché chronické bronchitidy. V pozdějších stadiích udávají pacienti kašel s expektorací černě zbarveného sputa, vzácně mohou vykašlat černé masy (při ischemické nekróze masivní fibrózy). Dušnost se objevuje zpočátku po námaze, později dochází při progresi chronické bronchitidy k rozvoji obstrukcí a emfyzému. Při tomto stavu se již objevuje dušnost klidová. Postupný zánik funkčního parenchymu plic a cévního řečiště je příčinou vzniku plicní hypertenze a chronického cor pulmonale s následným kardiopulmonálním selháním.
• Diagnostika
Pro diagnózu silikózy je nezbytné splnění těchto 3 podmínek:
- Pozitivní pracovní anamnéza s expozicí křemičitému prachu v dostatečném množství a trvání.
- Zobrazovací vyšetření hrudníku (viz dále).
- Absence jiné pravděpodobnější diagnózy, která by mohla být odpovědná za klinické potíže pacienta.
Rentgenologickým nálezem jsou malé, okrouhlé a pravidelné opacity o různé četnosti, které se nalézají zprvu ve středních, později v ostatních plicních polích. Při velikosti opacit do 10 mm se jedná o pneumokoniózu (silikózu) prostou (obr. 1), nad 10 mm jde o formu komplikovanou (obr. 2). CT vyšetření lépe než předozadní snímek zobrazí různé druhy emfyzému a dutin vzniklých ischemickou nekrózou nebo komplikacemi základního onemocnění. Poměrně přesně zobrazí bulózní emfyzém, který je topograficky vázán na kompaktní fibrózu. V případě podezření svědčící pro plicní arteriální hypertenzi je diagnostickou metodou volby srdeční katetrizace, pomocí které se odhalí již časné nebo lehké formy plicní hypertenze. Jednou prokázané rentgenologické změny jsou ireverzibilní.
Obr. 1. Prostá silikóza plic S výjimkou plicních bazí jsou v celých plicích patrné početné malé opacity o velikosti do 10 mm. 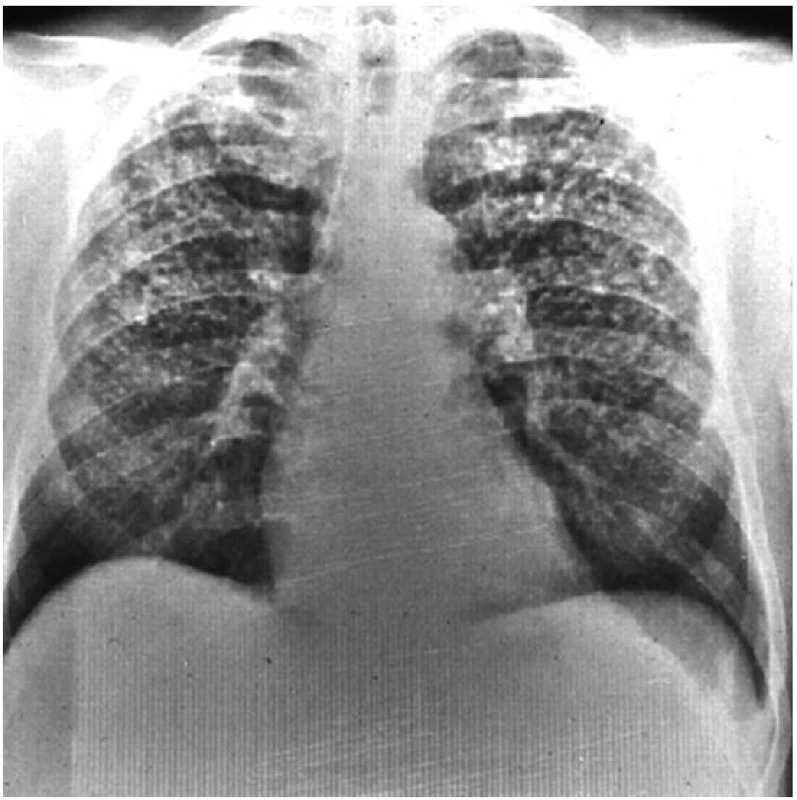
Obr. 2. Komplikovaná silikóza plic Ve středních a horních segmentech plic jsou jasně patrné splývající opacity o velikosti nad 10 mm. 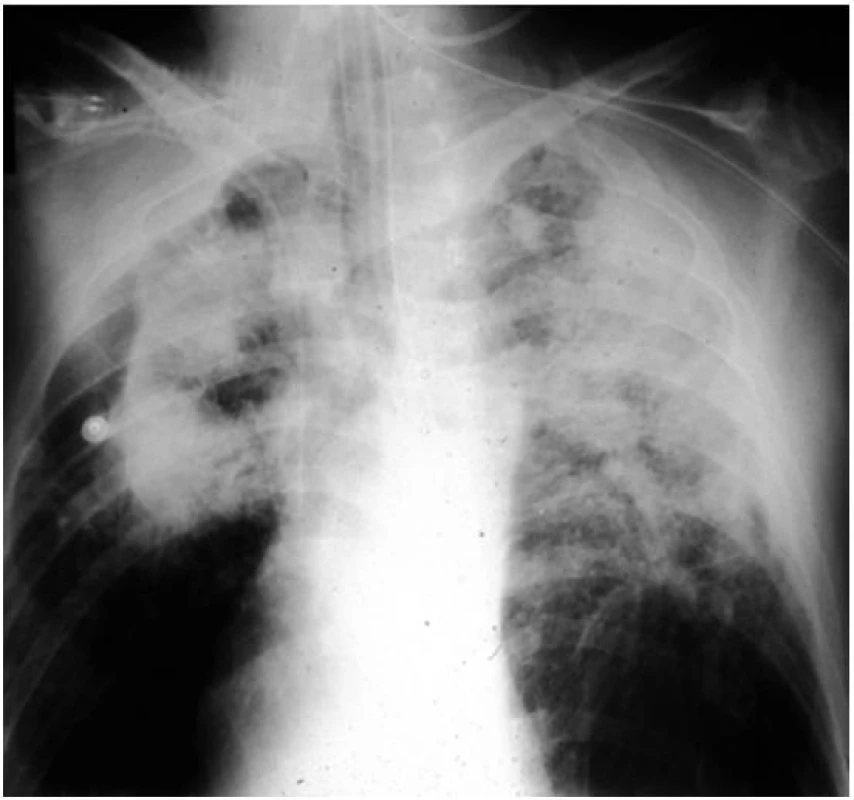
• Komplikace
Plicní nádory
Vztah mezi expozicí křemičitým prachem a plicními nádory byl potvrzen v roce 1997, i když nebyl nalezen lineární vztah mezi mírou expozice a incidencí nádorů [10].
Plicní tuberkulóza
Patří k nejčastějším komplikacím a zároveň představuje i největší diferenciálnědiagnostický problém. RTG rozlišení tuberkulózy a silikózy je obtížné a mnohdy nemožné. Jedinou metodou, která jasně určí diagnózu tuberkulózy, je přímý průkaz mykobakterií. Používá se časově náročná kultivace ze sputa, popř. bronchoskopie s punkcí uzlin, transtorakální punkční biopsie nebo otevřená plicní biopsie. Doplňující metodou je BAL (bronchoalveolární laváž) z postiženého segmentu. Nejnovější metodou je průkaz mykobaktérií podle PCR (polymerázová řetězová reakce).
Systémová onemocnění pojiva
Silikóza plic byla historicky spojována se systémovou sklerózou (sklerodermií podle starší terminologie). Výrazný vztah byl ale nalezen i mezi silikózou a revmatoidní artritidou [9] a také mezi pneumokoniózou a revmatoidní artritidou, tzv. Caplanův syndrom.
• Terapie
Léčba plicní silikózy není známa. Experimentální pokusy s některými perspektivními preparáty (PVNO, tilon, tetradrin, piperaguin fosfát) jsou ve fázi experimentu na zvířeti a dlouhodobého ověřování [6].
Vznik a vývoj onemocnění lze tedy ovlivnit pouze včasným ukončením prašné expozice a především léčbou nejčastějších komplikací (chronická bronchitida, cor pulmonale). Tyto léčebné postupy je účelné doplnit dechovou rehabilitací, naprostým zákazem kouření a komplexní lázeňskou léčbou. Důležitá ze strany ochrany pracovníků jsou preventivní opatření. Dělíme je na dvě základní skupiny:
- Opatření zdravotnická: povinné preventivní prohlídky vstupní, periodické, výstupní, mimořádné a následné na specializovaných pracovištích. Kontraindikováni pro práci v riziku fibrogenního prachu jsou zejména pacienti s tuberkulózou plic, chronickými onemocněními plicní tkáně, dýchacích cest a pohrudnice, bronchiálním astmatem a ostatními alergickými onemocněními. V podzemí platí absolutní kontraindikace práce pro ženy, spodní hranice pro muže byla snížena z 21 na 18 let;
- Opatření technická: měření prašnosti se stanovením koncentrace respirabilní frakce prachu, kategorizace pracovišť, výpočet nejvyšší přípustné expoziční doby (NPE) se včasným vyřazením pracovníků s naplněnou expozicí, zavlažování uhelných slojí, vodní postřiky prašných provozů, odprašovací zařízení. Technická protiprašná opatření doplňují osobní ochranné pomůcky (protiprašné respirátory).
• Prognóza
Prognóza onemocnění závisí na více faktorech. Především je to množství inhalovaného prachu a hladiny v něm obsaženého krystalického oxidu křemičitého. Důležitá je celková délka expozice, individuální vnímavost organismu, životní návyky. Průměrná délka expozice vedoucí k rentgenologické manifestaci onemocnění na Ostravsku činí 10–20 let. Výjimkou nejsou ale ani velmi krátké expozice (do pěti let).
Prognózu určuje nejen rozsah fibrózních a emfyzematózních změn a jejich vliv na kardiopulmonální systém, ale především přidružené komplikace. Nejčastější a zároveň velmi závažná je chronická obstrukční plicní nemoc ve všech svých formách. K úmrtí dochází z důvodů kardiopulmonálního selhání komplikujícího chronické cor pulmonale.
Z pohledu pracovní způsobilosti jsou silikóza a uhlokopská pneumokonióza absolutní kontraindikací pro rizikovou práci v prostředí obsahující fibrogenní prach. Dříve výrazný národohospodářský význam těchto profesionálních plicních onemocnění postupně klesá – úměrně s výrazným poklesem nově hlášených nemocí z povolání. Na tomto příznivém trendu se nepodílí pouze technická a zdravotnická preventivní opatření, ale především výrazná redukce počtu horníků pracujících v hlubinných dolech v souvislosti s restrukturalizací těžebního průmyslu v České republice [6].
AZBESTÓZA A ONEMOCNĚNÍ SPOJENÁ S EXPOZICÍ AZBESTEM
Azbestem se rozumí skupina nerostů (silikátů), které se vyskytují ve dvou formách – serpentiny a amfiboly. Jejich společnou vlastností je vláknitá struktura, kdy délka mnohonásobně převyšuje průřez. Vlákna jsou nehořlavá, odolná ke kyselinám a zásadám.
Formy nerostů s obsahem azbestu:
- serpentinová vlákna: chryzotil („bílý azbest“), dlouhá, ohebná, zkroucená, propletená;
- amfibolová vlákna – 5 typů: krocidolit („modrý azbest“), amozit, antofyllit, aktinolit, tremolit – kratší, křehká, velmi odolná vůči kyselinám.
Azbest díky své vláknité struktuře podmiňuje vznik onemocnění již dříve zmíněným způsobem – poškozuje makrofágy a způsobuje tvorbu prozánětlivých a následně proreparačních cytokinů. Tyto společně vedou ke vzniku fibrózních ložisek. Epidemiologicky dochází v poslední době k úbytku nemocí způsobených azbestem. Důvodem je stejně jakou u silikózy a uhlokopské pneumokoniózy úbytek důlní činnosti v ČR, která je hlavním místem, kde dochází k profesionální expozici azbestem.
• Klinické příznaky
U většiny pacientů se rozvine azbestóza jako klinická jednotka až po 20–30 letech po počáteční expozici. Změny v plicích se ale po expozici azbestu rozvíjejí již dříve, jedná se zejména o charakteristické postižení pleury. Typickým příznakem azbestózy, který přivádí pacienta k lékaři, je obvykle pozvolný nástup námahové dušnosti. Dušnost následně v čase dále progreduje, a to i bez další expozice azbestovému prachu. Další příznak plicních onemocnění – kašel a produkce sputa jsou ale pro azbestózu netypické a jedná se spíše o následek kouření cigaret než o plicní onemocnění způsobené azbestem.
Podle nejnovějších kritérií je pro diagnózu azbestózy nutné splnit tyto 3 podmínky:
- Spolehlivá anamnéza expozice azbestu se signifikantní latencí mezi počátkem expozice a objevením klinických příznaků nebo přímý průkaz azbestových vláken z plicní biopsie nebo bronchoalveolární laváže [11].
- Jasný důkaz plicní intersticiální fibrózy, projevující se jako: chropy na konci inspiria při fyzikálním vyšetření, snížené plicní objemy na funkčním vyšetření plic (spirometrie), nález typických známek na hrudním RTG/CT anebo histologický průkaz intersticiální fibrózy.
- Nepřítomnost jiných možných faktorů, které jsou prokázanými etiologickými faktory difuzních parenchymálních plicních onemocnění.
• Spirometrie
Při funkčním vyšetření plic nalézáme typicky snížené plicní objemy, zejména vitální a celkovou plicní kapacitu. Pro nález charakteristický pro azbestózu je poté nutná absence známek plicní obstrukce (normální poměr FEV1 k vitální kapacitě plic).
• Zobrazovací vyšetření
Hrudní RTG obvykle prokáže malé bilaterální parenchymální opacity, často spojené s pleurálními abnormalitami [8]. Intersticiální proces azbestózy na rozdíl od silikózy a uhlokopské pneumokoniózy začíná typicky v dolních plicních segmentech a je charakteristicky spojen s nálezem plaků na parietální pleuře. Tyto opacity pak způsobují snížení ostrosti hran srdečního stínu a bránice (obr. 3).
Obr. 3. Předozadní snímek pacienta s azbestózou Patrná jsou mnohočetná malá jemná ložiska fibrózy v charakteristických oblastech dolních plicních segmentů způsobující „rozmazání“ srdečního stínu a okraje bránice. 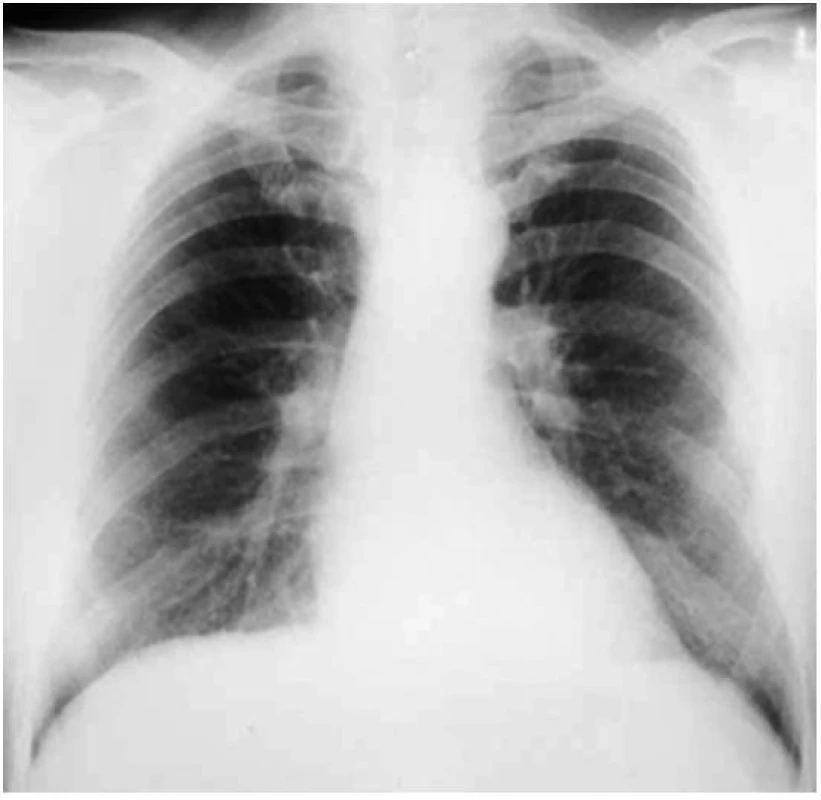
Nález lymfadenopatie v plicních hilech a mediastinu není pro azbestózu charakteristický a měl by ošetřujícího lékaře vést ke zhodnocení jiné etiologie plicního onemocnění.
Postižení pleury, jak již bylo zmíněno, je typické pro azbestózu a současně velmi netypické pro ostatní intersticiální plicní procesy. Přibližně 50 % osob vystavených azbestovému prachu rozvine pleurální plaky. Nejčastěji jsou nalézány podél šestého až devátého žebra a podél bránice (obr. 4). Jsou často spojené s pleurálním výpotkem, což přináší diferenciálnědiagnostické obtíže spojené s možnou malignitou.
Obr. 4. Předozadní snímek hrudníku u pacienta s azbestózou Při detailním zhodnocení snímku lze nalézt charakteristické postižení pleury – tzv. pleurální plaky seskupené přibližně podél žeberních oblouků. 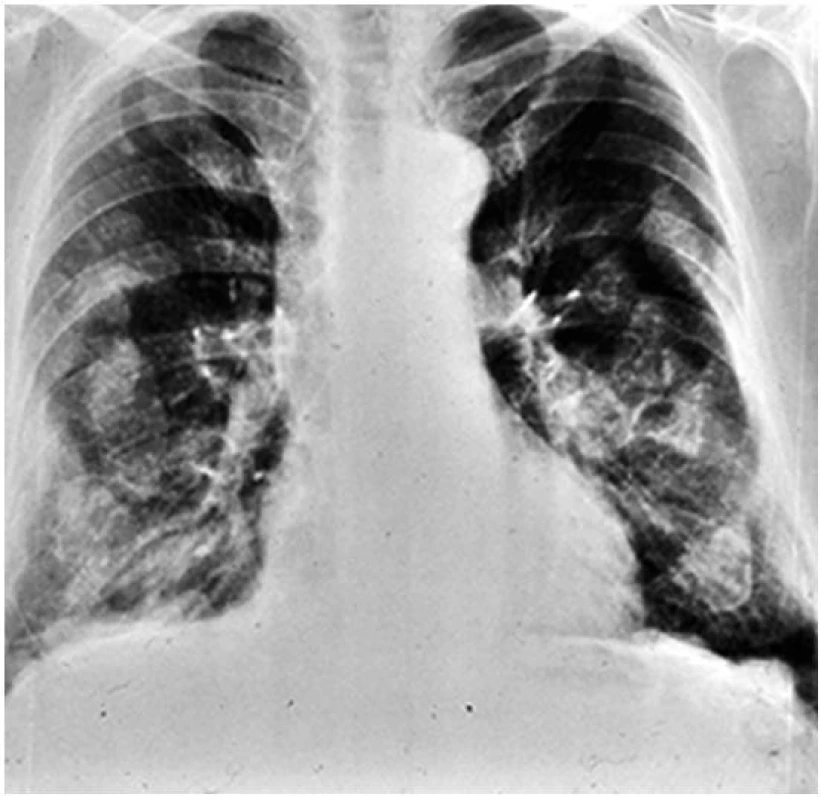
Makroskopické nálezy zahrnují přítomnost malých, nepoddajných plic s fibrózou v subpleurálních oblastech spodních laloků. Viscerální pleura těchto oblastí bývá také fibrotická a spojená s parietálními plaky.
Histologické nálezy zahrnují přítomnost neobalených či obalených (= azbestová tělíska) azbestových vláken. Pojem azbestová tělíska zahrnuje azbestová vlákna obklopená obalem železa a proteinů.
Počet azbestových vláken v plicích je obecně 10–20krát vyšší u pacientů s azbestózou ve srovnání s jedinci bez expozice a koreluje se závažností nemoci [16].
• Léčba
V současnosti neexistuje žádná specifická terapie azbestózy. Lékařská péče se tedy zaměřuje na prevenci progrese nemoci:
- zákaz kouření tabákových výrobků,
- časná detekce spirometrických či RTG nálezů,
- terapie kyslíkem v situacích klidové hypoxémie nebo snížené saturace při zátěži,
- rychlá a účinná léčba respiračních infekcí,
- pneumokokové a chřipkové očkování.
• Komplikace
Hlavní komplikace expozice azbestu jsou respirační selhání a malignity:
1. Respirační selhání
Azbestóza je pomalu progredující proces, který směřuje k respiračnímu selhání u menšiny pacientů. Rizikové faktory, které predisponují k respiračnímu selhání, zahrnují:
- trvání a míru expozice azbestem,
- míru dušnosti,
- kouření cigaret,
- difuzní ztluštění pleury
- vyšší koncentrace leukocytů a fibronektinu v bronchoalveolární laváži.
2. Malignity
Expozice azbestu je spojena s dvěma typy nádorových onemocnění. Bronchogenní karcinom je nádor, u kterého relativní riziko po expozici azbestu vzrůstá na 3,5 v porovnání s běžnou populací. Toto riziko je mnohonásobně zvýšené při současném kouření cigaret (až 16krát).
Druhé nádorové onemocnění je maligní pleurální mezoteliom. Jedná se o nejčastější primární nádor pleury s velmi špatnou prognózou. Tento nádor má jediný objasněný rizikový faktor a tím je právě expozice azbestu.
ZÁVĚR
Nemoci způsobené profesionální expozicí prachu představují v dnešní době čím dál větší diferenciálnědiagnostický problém. Příčinou tohoto stavu je zaprvé snížená incidence těchto onemocnění, která je sice příznivým jevem, ale na druhou stranu způsobuje snižování povědomí o těchto nemocích a za druhé velmi nespecifické příznaky, které se dají snadno přiřadit k jinému probíhajícímu onemocnění u pacientů vyššího věku. I kvůli těmto důvodům by se měla naše pozornost zaměřit na efektivní prevenci vzniku těchto stavů, jelikož při pečlivém dodržování zákonných norem je možné snížit incidenci těchto onemocnění na minimum.
Do redakce došlo dne 1. 10. 2013.
Do tisku přijato dne 20. 10. 2013.
Adresa pro korespondenci:
MUC. Ondřej Sglunda
Klinika pracovního a cestovního lékařství
Šrobárova 50
100 34 Praha 10
e-mail: ondrej.sglunda@seznam.cz
Zdroje
1. Blanc, P., Wong, H., Bernstein, M. S., Boushey, H. A. An experimental human model of metal fume fever. Ann. Intern. Med., 1991, 114, 11, s. 930–936.
2. ČSN EN 1540 Ovzduší na pracovišti – Terminologie, 9/1999.
3. ČSN EN 481 Ovzduší na pracovišti. Vymezení velikostních frakcí pro měření polétavého prachu, 10/1999.
4. ČSN ISO 4225 Kvalita ovzduší – Obecná hlediska – Slovník, 4/1997.
5. ČSN ISO 7708 Kvalita ovzduší – Definice velikostních částic pro odběr vzorků k hodnocení zdravotních rizik, 1/1998.
6. Gromnica, R. Silikózy plic a uhlokopské pneumokoniózy, LL 34/2003.
7. Hollerová, J. Prašnost na pracovišti. Státní zdravotní ústav, 14. listopad 2007.
8. Larson, T. C., Meyer, C. A., Kapil, V., Gurney, J. W., Tarver, R. D., Black, C. B., Lockey, J. E. Workers with Libby amphibole exposure: retrospective identification and progression of radiographic changes. Radiology, 2010, 255, 3, s. 924–933.
9. Makol, A., Reilly, M. J., Rosenman, K. D. Prevalence of connective tissue disease in silicosis (1985-2006)-a report from the state of Michigan surveillance system for silicosis. Am. J. Ind. Med., 2011, 54, 4, p. 255–262.
10. McDonald, J. C., McDonald, A. D., Hughes, J. M., Rando, R. J., Weill, H. Mortality from lung and kidney disease in a cohort of North American industrial sand workers: an update. Ann. Occup. Hyg., 2005, 49, 5, s. 367–373.
11. Mizell, K. N., Morris, C. G., Carter, J. E. Antemortem diagnosis of asbestosis by screening chest radiograph correlated with postmortem histologic features of asbestosis: a study of 273 cases. J. Occup. Med. Toxicol., 2009, 12, s. 4–14.
12. Mossman, B. T., Churg, A. Mechanisms in the pathogenesis of asbestosis and silicosis. Am. J. Respir. Crit. Care Med., 1998, 157, s. 1666–1680.
13. Perkner, J. J., Fennelly, K. P., Balkissoon, R., Bartelson, B. B., Ruttenber, A. J., Wood, R. P., Newman, L. S. Irritant-associated vocal cord dysfunction. J. Occup. Environ. Med., 1998, 40, 2, s. 136–143.
14. Rimal, B., Greenberg, A. K., Rom, W. N. Basic pathogenetic mechanisms in silicosis: current understanding. Curr. Opin. Pulm. Med., 2005, 11, 2, s. 169–173.
15. Robledo, R., Mossman, B. Cellular and molecular mechanisms of asbestosinduced fiblosis. J. Cell. Physiol., 1999, 180, s. 158–166.
16. Roggli, V. L. Human disease consequences of fiber exposures: a review of human lung pathology and fiber burden data. Environ. Health Perspect., 1990, 88, s. 295–303.
17. Ross, D. J. Ten years of the SWORD project. Surveillance of Work-related and Occupational Respiratory Disease. Clin. Exp. Allergy, 1999, 29, 6, s. 750–753.
18. Steenland, K., Loomis, D., Shy, C., Simonsen, N. Review of occupational lung carcinogens. Am. J. Ind. Med., 1996, 29, s. 474–490.
19. Weiss, W. Cigarette smoke, asbestos, and small irregular opacities. Am. Rev. Respir. Dis., 1984, 130, s. 293–301.
Štítky
Hygiena a epidemiológia Hyperbarická medicína Pracovné lekárstvo
Článek Syndrom karpálního tuneluČlánek Jmenný a věcný rejstřík
Článok vyšiel v časopisePracovní lékařství
Najčítanejšie tento týždeň
2013 Číslo 3-4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- V ČR chybí specializovaná péče o pacienty s nervosvalovým onemocněním
-
Všetky články tohto čísla
- Alergie na latexové rukavice a dezinfekční prostředky u zubních lékařů
- Účinok priemyselných minerálnych vláknitých prachov na parametre respiračnej toxicity – časová závislosť
- Účinky sklených vlákien na vybrané parametre respiračného systému v experimente*
- Etiologické faktory profesionálnej rinitídy v Slovenskej republike
- Syndrom karpálního tunelu
- Zdravotní rizika při působení prachu při práci
- Hypertenzní choroba a zdravotní způsobilost k práci
- Jmenný a věcný rejstřík
- Může soud rozhodovat o odborných věcech?
- Nový prístup k hodnoteniu vplyvu hluku a vibrácií na zdravie zamestnancov v prevádzkach autoservisov
- Pracovní lékařství
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Syndrom karpálního tunelu
- Hypertenzní choroba a zdravotní způsobilost k práci
- Zdravotní rizika při působení prachu při práci
- Účinky sklených vlákien na vybrané parametre respiračného systému v experimente*
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



