-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Akutní selhání ledvin a kardiovaskulární komplikace
Acute kidney failure and cardiovascular complication
Acute kidney injury is not an isolated event. Emerging evidence suggests that even mild acute kidney injury induces distant organ dysfunction to the heart, lung, liver and brain. Despite recent advances in renal replacement therapy, mortality of patients developing acute kidney injury and complicated by multiorgan dysfunction is 40–60%. It is believed that this unacceptable mortality rate stems, at least partly, from the distant organ effects of acute kidney injury. Therefore, there has been a surge of interest in elucidating mechanisms underlying complex and bidirectional nature of interconnection between acute kidney injury and distant organ dysfunction. Accumulating data indicate that acute kidney injury can trigger several immune, metabolic and humoral pathways, thus potentially contributing to distant organ dysfunction and overall morbidity and mortality. Better insights into bidirectional and synergistic pathways linking acute kidney injury and cardiovascular dysfunction might open the window for new therapeutic approaches that interrupt this vicious circle. Here, we briefly discuss the rationale for and current understanding of the bidirectional relationship between acute kidney injury and cardiovascular problems.
Keywords:
acute kidney injury – extrarenal complications – cardiorenal syndrome
Autoři: V. Danihel; L. Ledvinová; M. Matějovič
Vyšlo v časopise: Kardiol Rev Int Med 2012, 14(4): 251-253
Kategorie: Kardiorenální syndrom
Souhrn
Akutní poškození ledvin není izolovaným onemocněním. Rostoucí důkazy ukazují, že i mírné formy akutního poškození ledvin mohou vyvolat poruchy vzdálených orgánů, včetně srdce, plic, jater a mozku. Mortalita pacientů s akutním poškozením ledvin, kteří jsou komplikováni multiorgánovou dysfunkcí, zůstává navzdory pokrokům v metodách náhrady funkce ledvin vysoká (40–60 %). Předpokládá se, že takto nepřijatelně vysoká úmrtnost je přinejmenším zčásti důsledkem nepříznivého vlivu akutního poškození ledvin na funkci vzdálených orgánů. Z těchto důvodů probíhá v současnosti intenzivní výzkum mechanizmů, které se v patogenezi obousměrných interakcí mezi ledvinami a vzdálenými orgány uplatňují. Výsledky zejména experimentálních studií prokazují klíčovou úlohu imunitních, metabolických a humorálních cest, kterými akutní poškození ledvin ovlivňuje funkci vzdálených orgánů a mortalitu. Jejich přesnější pochopení je nástrojem k vývoji efektivních léčebných strategií k přetnutí bludného kruhu meziorgánových patomechanizmů. Článek diskutuje stručně současné poznatky o kardiovaskulárních důsledcích akutního poškození ledvin.
Klíčová slova:
akutní poškození ledvin – mimorenální komplikace – kardiorenální syndromÚvod
Koncept akutního selhání ledvin doznal v posledních letech zásadních změn. Tradiční učebnicové texty pracují s pojmem akutní selhání ledvin, zdůrazňující nejzávažnější stupeň náhle vzniklé renální dysfunkce. Rostoucí poznatky však ukazují, že i relativně mírné akutní poškození ledvin či porucha jejich funkce jsou spojeny s vážnými klinickými důsledky a nezávisle na základním onemocnění přispívají k nemocniční mortalitě a morbiditě [1]. Také z těchto důvodů byl termín akutní selhání ledvin nahrazen pojmem akutní poškození ledvin (acute kidney injury – AKI). AKI vyjadřuje dynamický proces zahrnující široké spektrum poruch renálních funkcí či morfologického poškození, od mírného zvýšení sérových hodnot kreatininu až po anurické selhání ledvin vyžadující mimotělní očišťovací metody. Jde o závažný problém medicínský a obecně zdravotnický, jehož incidence má stále stoupající charakter. Komunitní AKI je příčinou 1 % příjmů do nemocnice. AKI získané v nemocnici (nozokomiální) postihuje 5–7 % všech hospitalizovaných pacientů a jeho prevalence má rostoucí charakter [2]. Stoupá počet AKI v důsledku sepse a nefrotoxicity (antibiotika, nesteroidní antirevmatika, chemoterapeutika, antivirotika, kontrastní látky aj.). V prostředí jednotek intenzivní péče se AKI vyvíjí typicky jako součást syndromu multiorgánové dysfunkce a sepse je zde jeho hlavní příčinou [2]. Mortalita nemocných vyžadující náhradu funkce ledvin je stále nepřijatelně vysoká – 50–60 %. Nepříznivé důsledky AKI nejsou jen krátkodobé. Tito pacienti mají více než trojnásobně vyšší riziko chronického selhání ledvin v následující dekádě ve srovnání s kontrolní skupinou. Částečná reparace renálních funkcí po prodělaném AKI je stále více rozpoznávána jako významný rizikový faktor rozvoje chronického onemocnění ledvin.
Existuje mnoho významných a obousměrných fyziologických interakcí mezi srdcem a ledvinami. Zásahem do jejich fyziologické integrity může akutní nebo chronická dysfunkce jednoho z těchto orgánů vyvolat akutní nebo chronickou dysfunkci orgánu druhého. Na tomto principu byla v roce 2010 formulována nová definice tzv. kardiorenálního syndromu (CRS) [3]. Koncept CRS rozlišuje pět kategorií: Typ I CRS představuje náhlé zhoršení funkce srdce (např. kardiogenní šok) vedoucí sekundárně k AKI. Typ II CRS popisuje nepříznivý vliv chronického onemocnění srdce (např. chronické srdeční selhání) na funkci ledvin. Typ III CRS, resp. renokardiální syndrom je stav, kdy primární akutní porucha funkce ledvin (např. akutní ischemie ledvin, glomerulonefritis) způsobí akutní kardiovaskulární komplikace (např. arytmie, akutní srdeční selhání). Typ IV CRS, resp. chronický renokardiální syndrom odráží stav, kdy chronické onemocnění ledvin přispívá ke kardiovaskulární morbiditě a mortalitě (srdeční hypertrofie, dilatace, kardiovaskulární příhody). Konečně typ V CRS je vnímán jako syndrom, kdy akutní (sepse) nebo chronické (diabetes) systémové onemocnění způsobuje jak poruchy funkce srdce, tak i ledvin. Posouzeno terminologií CRS, tento článek se věnuje problematice typu III CRS a rovněž diskutuje některé nové poznatky o mechanizmech, kterými AKI nepříznivě ovlivňuje funkci kardiovaskulárního systému.
Kardiovaskulární komplikace AKI
Rozvoj AKI zvyšuje riziko kardiovaskulárních komplikací a nemocniční úmrtnosti [4]. Až u 35 % nemocných s AKI se může vyvinout kardiovaskulární komplikace (srdeční selhání, arytmie, srdeční zástava). Základní patofyziologické interakce, kterými AKI nepříznivě ovlivňuje funkci kardiovaskulárního systému, shrnuje obr. 1. Důsledkem je nerovnováha v řadě neurohormonálních systémů. Dominujícími poruchami jsou aktivace sympatického nervového systému a osy renin-angiotenzin-aldosteron (RAAS). Jejich aktivací dochází mj. k poruchám regulace objemu extracelulární tekutiny a krevního tlaku, k nadprodukci reaktivních forem kyslíku a dusíku a ke zvýšené produkci prozánětlivých cytokinů [5].
Obr. 1. Patofyziologie akutních renokardiálních interakcí. 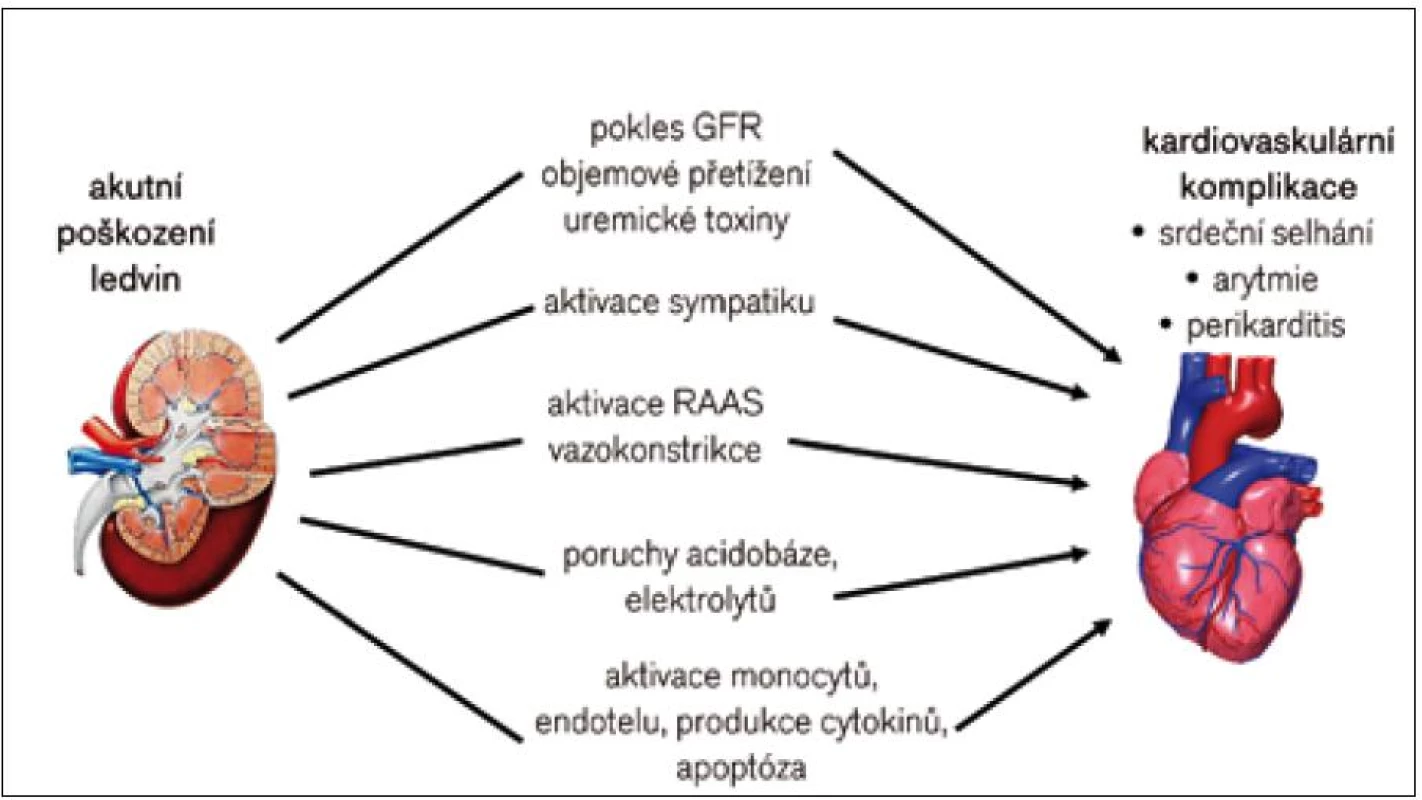
Kardiovaskulární dysfunkce je důležitou determinantou přežití u pacientů s AKI, zejména na jednotkách intenzivní péče [6]. Spektrum kardiovaskulárních komplikací v průběhu AKI ukazuje tab. 1. Pacienti s AKI častěji vyžadují vazoaktivní léky a umělou plicní ventilaci ve srovnání s nemocnými bez AKI, ale se srovnatelnou tíží akutního stavu. Další komplikací je tekutinové přetížení, významné především u oligurického AKI a starších pacientů s limitovanou kardiální rezervou. Metabolická acidóza a retence uremických toxinů jsou faktory, které snižují srdeční kontraktilitu (negativně inotropní efekt) a podporují plicní hypertenzi (vazokonstrikce plicních arteriol). Společně s poruchami elektrolytů (hyperkalemie) představují rizikové metabolické prostředí pro vznik arytmií [7]. Naopak perikarditida je dnes při včasné léčbě vzácnou komplikací AKI. Pokud je přítomna, je nutné vyloučit i jiné diagnózy, např. systémový lupus a hepatorenální syndrom.
Tab. 1. Kardiovaskulární komplikace při akutním poškození ledvin. 
Negativní kardiovaskulární důsledky může mít i vlastní podpůrná léčba AKI [8]. Intermitentní dialýza vystavuje nemocného riziku hypotenze a myokardiální ischemie, rychlé změny v elektrolytové a tekutinové rovnováze mohou provokovat vznik arytmií. Je známý i vliv hemodialyzačních procedur na srdeční elektrofyziologii, zahrnující změny QT intervalu, variability srdeční frekvence a QT disperze [9]. U hemodynamicky nestabilních pacientů a u nemocných s výrazně limitovanou kardiální rezervou jsou proto z důvodů lepší hemodynamické tolerance preferovány metody kontinuální (kontinuální veno-venózní hemodialýza, hemofiltrace nebo hemodiafiltrace). Sami jsme v experimentálním modelu sepse testovali vliv kontinuální hemofiltrace na srdeční elektrofyziologii a demonstrovali jsme, že tato metoda zkracuje trvání srdeční depolarizace, ale bez negativního ovlivnění incidence srdečních arytmií [10].
AKI může být také přímou komplikací kardiovaskulárních chorob, např. u endokarditidy, dekompenzovaného srdečního selhání (kardiorenální syndrom II. typu), fibrilace síní (embolizace) či po intervenčních cévních výkonech (cholesterolová embolizace).
Molekulární mechanizmy kardiovaskulárních komplikací u AKI
Přetrvávající vysoká mortalita pacientů s AKI (50 % u kriticky nemocných) navzdory dostupnosti široké palety mimotělních očišťovacích metod a poznatky o významné asociaci mezi i mírnou poruchou funkce ledvin (vzestup sérového kreatininu o 26 µmol/l) a rizikem úmrtí vyústily v intenzivní výzkum zaměřený na objasnění mechanizmů, kterými AKI nepříznivě ovlivňuje funkce extrarenálních orgánů a tím osud nemocných (obr. 2). Je dobře známo, že prozánětlivé cytokiny negativně ovlivňují funkci myokardu [11]. Zvýšené koncentrace TNF-alfa, IL-6 a CRP jsou spojené s rizikem rozvoje městnavého srdečního selhání (hazard ratio 4,07) a korelují s progresí srdečního selhání [12]. V experimentálních modelech ischemicko-reperfuzního AKI byl echokardiograficky dokumentován časný (do 48 hod) vzestup end-diastolického rozměru levé komory srdeční a pokles frakčního zkrácení [13]. Tyto změny byly úzce vázány na hladiny uvedených cytokinů. Příčiny zvýšených hladin cytokinů nejsou přesně známy, nelze je však vysvětlit prostým poklesem jejich eliminace poškozenými ledvinami. Samotné tekutinové přetížení může být jednou z příčin zvýšených hladin cytokinů, fenomén známý také u pacientů s městnavým srdečním selháním [14]. Dalšími faktory, které se uplatňují v renokardiálních interakcích (v experimentálních modelech), jsou zvýšená exprese srdečních intercelulárních adhezních molekul, infiltrace myokardu polymorfonukleáry a aktivace programované buněčné smrti (apoptózy) v kardiomyocytech [15]. I tyto změny byly v přímé korelaci s poklesem kontraktilní funkce srdce a levokomorové dilatace. Popsaný negativní vliv systémové zánětlivé odpovědi na funkci srdce je na subcelulární úrovni zprostředkován především komplexem interakcí mezi nadprodukcí oxidu dusnatého, volnými kyslíkovými radikály a narušenou senzitivitou beta-adrenergních receptorů. Rozvoj AKI neovlivňuje pouze funkci srdečních myocytů, recentně byly popsány i změny vazoregulace koronárních tepen ve smyslu poruch cévního tonu, koronární rezervy a cévní reaktivity [16]. V klinickém kontextu může limitovaná koronární rezerva v terénu zvýšených metabolických nároků přispívat ke zvýšené náchylnosti pacientů s AKI k srdeční ischemii a kardiovaskulárním komplikacím obecně.
Obr. 2. Mechanizmy, kterými AKI ovlivňuje funkci vzdálených orgánů. 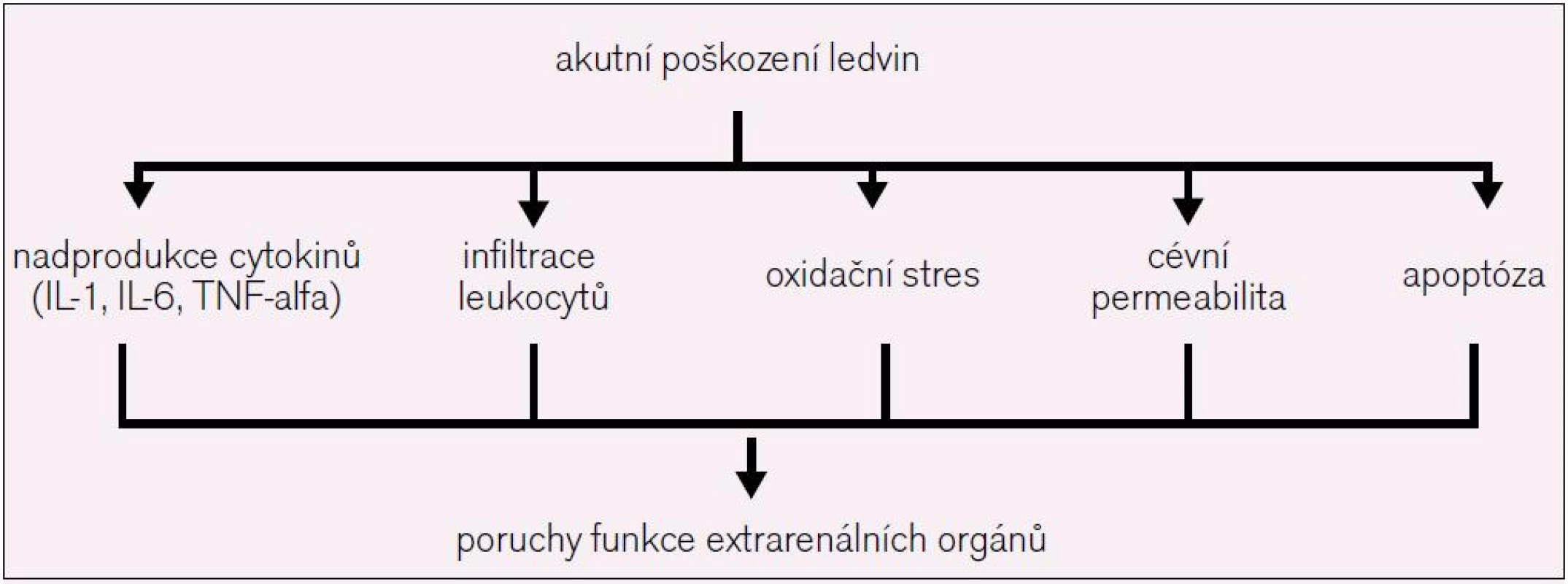
Renální komplikace srdečního selhání
Přibližně 30–60 % nemocných s chronickým srdečním selháním má současně určitý stupeň renální nedostatečnosti. Zhoršení funkce ledvin je u této skupiny nemocných silným a nezávislým prediktorem mortality. Rozvoj renální dysfunkce u pacientů s dekompenzovaným srdečním selháním je tradičně připisován renální hypoperfuzi (tj. prerenální azotemie) jako následku nízkého srdečního výdeje nebo objemové deplece navozené nadměrným používáním diuretik. Toto paradigma bylo recentně přehodnoceno. Ukazuje se, že hlavními mechanizmy jsou aktivace řady neurohormonálních cest (RAAS, endotelin, katecholaminy, natriuretické peptidy), systémová inflamace nízkého stupně a renální venózní městnání (tzv. kongestivní selhání ledvin). Léčba CRS se opírá o komplexní léčbu dekompenzovaného srdečního selhání (především dekongesci) a eliminaci faktorů, které k dekompenzaci vedou (např. infekce, ischemie, arytmie, hypertenze, plicní embolie, medikace – NSAID, tyreopatie). U refrakterních stavů či při progresi renální dysfunkce je vhodným a často jediným možným postupem kontinuální ultrafiltrace [3].
Závěr
Uvedené poznatky ukazují, že ledviny hrají významnou a aktivní úlohu v rozvoji kardiovaskulárních komplikací, zejména je-li AKI součástí kritického stavu. Rostoucí incidence a závažné důsledky syndromu AKI jsou oprávněným důvodem k intenzivnímu hledání a uplatňování opatření, která brání jeho rozvoji, snižují míru již vzniklého poškození ledvin či urychlují zotavení. Dodržováním jednoduchých opatření lze v nemocnicích zabránit nejméně 30 % případů AKI. Těmi jsou především včasná a dostatečná objemová náhrada, rychlá korekce hypotenze, přerušení a/nebo vyvarování se nefrotoxických léků a včasné rozpoznání pacientů v riziku. Přesné rozpoznání mechanizmů zúčastněných v rozvoji extrarenálních komplikací je rozhodující pro formulaci nových léčebných cílů.
Tento projekt byl podpořen Programem rozvoje vědních oborů Univerzity Karlovy (projekt P36) a projektem CZ.1.05/2.1.00/03.0076 Evropského fondu pro regionální rozvoj.
Doručeno do redakce 14. 11. 2012
Přijato po recenzi 30. 11. 2012
prof. MUDr. Martin Matějovič, Ph.D.1,2
MUDr. Vojtěch Danihel1
MUDr. Lenka Ledvinová1
1 I. interní klinika, LF a FN Plzeň UK v Praze,
2 Biomedicínské centrum, LF v Plzni UK v Praze
matejovic@fnplzen.cz
Zdroje
1. Singbartl K, Kellum JA. AKI in the ICU: definition, epidemiology, risk stratification, and outcomes. Kidney Int 2012; 81 : 819–825.
2. Matějovič M. Desatero akutního selhání ledvin. Postgraduální medicína 2011; 13 : 27–34.
3. Ronco C, McCullough P, Anker SD et al. Acute Dialysis Quality Initiative (ADQI) consensus group. Cardio--renal syndromes: report from the consensus conference of the acute dialysis quality initiative. Eur Heart J 2010; 31 : 703–711.
4. Ronco C, House AA, Haapio M. Cardiorenal syndrome: refining the definition of a complex symbiosis gone wrong. Intensive Care Med 2008; 34 : 957–962.
5. Berl T, Henrich W. Kidney-heart interactions: epidemiology, pathogenesis, and treatment. Clin J Am Soc Nephrol 2006; 1 : 8–18.
6. Metnitz PGH, Krenn CG, Steltzer H et al. Effect of acute renal failure requiring renal replacement therapy on outcome in critically ill patients. Crit Care Med 2002; 30 : 2051–2058.
7. Hoste EA, De Corte W. Clinical consequences of acute kidney injury. Contrib Nephrol 2011; 174 : 56–64.
8. Burton JO, Jefferies HJ, Selby NM et al. Hemodialysis-induced cardiac injury: determinants and associated outcomes. Clin J Am Soc Nephrol 2009; 4 : 914–920.
9. Covic A, Diaconita M, Gusbeth-Tatomir P et al. Haemodialysis increases QT(c) interval but not QT(c) dispersion in ESRD patiens without manifest cardiac disease. Nephrol Dial Transplant 2002; 17 : 2170–2177.
10. Stengl M, Sykora R, Krouzecky A et al. Continuous hemofiltration in pigs with hyperdynamic septic shock affects cardiac repolarization. Crit Care Med 2008; 36 : 3198–3204.
11. Yap SC, Lee HT. Acute kidney injury and extrarenal organ dysfunction: new concepts and experimental evidence. Anesthesiology 2012; 116 : 1139–1148.
12. Blake P, Hasegawa Y, Khosla MC et al. Isolation of „myocardial depressant factor(s)“ from the ultrafiltrate of heart failure patients with acute renal failure. ASAIO J 199; 42(5): M911-5.
13. Kelly KJ. Distant effects of experimental renal ischemia/reperfusion injury. J Am Soc Nephrol 2003; 14 : 1549–1558.
14. Silverberg DS, Wexler D, Iaina A et al. The interaction between heart failure and other heart diseases, renal failure, and anemia. Semin Nephrol 2006; 26 : 296–306.
15. Grams ME, Rabb H. The distant organ effects of acute kidney injury. Kidney Int 2012; 81 : 942–948.
16. Kingma JG Jr , Vincent C, Rouleau JR et al. Influence of acute renal failure on coronary vasoregulation in dogs. J Am Soc Nephrol 2006; 17 : 1316–1324.
Štítky
Detská kardiológia Interné lekárstvo Kardiochirurgia Kardiológia
Článek Galerie autorů
Článok vyšiel v časopiseKardiologická revue – Interní medicína
Najčítanejšie tento týždeň
2012 Číslo 4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Kardio-reálny syndróm – o čo ide ?
- Patofyziologie kardiorenálního syndromu
- Kardiorenální syndrom – pohled nefrologa
- Kardiorenální syndrom u pacientů s akutním srdečním selháním
- Kardio-renálny syndróm u chronického srdcového zlyhávania – pohľad kardiológa
- Akutní selhání ledvin a kardiovaskulární komplikace
- Chronické renální selhání a kardiovaskulární příhody
- Candesartan v léčbě hypertenze a srdečního selhání
- O čem se ještě hovořilo na Evropském kardiologickém kongresu v Mnichově 2012
- Stenóza kmene levé věnčité tepny způsobená kompresí dilatovanou plicnicí
- Twiddlerův syndrom – neobvyklá příčina oversensingu vedoucí k inadekvátním výbojům implantabilního kardioverteru-defibrilátoru
- Ovlivní podávání redukované formy koenzymu Q10 statinovou myopatii?
- Co (a proč) potřebujeme znát z posledních doporučení pro léčbu dyslipidemií? Pohled lékaře i právníka
- Galerie autorů
- Kardiologická revue – Interní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Kardiorenální syndrom – pohled nefrologa
- Ovlivní podávání redukované formy koenzymu Q10 statinovou myopatii?
- Kardio-renálny syndróm u chronického srdcového zlyhávania – pohľad kardiológa
- Akutní selhání ledvin a kardiovaskulární komplikace
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



