-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Demyelinizační změny mozku u dětí s Crohnovou nemocí
Brain demyelination in children with Crohn’s disease
Background:
Crohn’s disease and ulcerative colitis are inflammatory bowel disease (IBD) with chronic relapsing course and multifactorial etiology. IBDs are usually considered to be a systemic illness, often involve other organs (6–47 %, principally skin, eyes, joints and hepatobiliary system). There are only sporadic reports of neurological manifestation in IBD patients (3–19 %, cerebrovascular disease, polyneuropathy, myopathy, and demyelinating disease including multiple sclerosis) and MRI studies have shown clinical non apparent cerebral demyelination in these patients. The cause of demyelination in IBD patients has not been explained yet.Aim:
To draw attention to less common potentially serious illness of central nervous system in patients with IBD.Methods:
We report on several cases of children with focal brain demyelination at the time of diagnosis Crohn’s disease and with neurological symptomatology in two of them. Two patients were treated by infliximab without worsening neurological symptomatology. No of them has developed demyelinating disease.Conclusion:
Neurological disorders in IBD patients are less common but potentially severe. We point out the importance of an increased awareness for this problem, particularly in anti - TNFα-era.Key words:
demyelination, Crohn’s disease, extraintestinal manifestation, anti-TNFα
Autoři: A. Šuláková 1,2; J. Horáček 3; V. Doležilová 4; O. Škopková 2
Působiště autorů: Katedra interních oborů, LF Ostravská univerzita, Ostrava vedoucí katedry MUDr. I. Valkovský 1; Klinika dětského lékařství, FN Ostrava přednosta doc. MUDr. M. Hladík, Ph. D. 2; Ústav patologické anatomie a soudního lékařství, LF Ostravská univerzita, Ostrava vedoucí katedry prof. MUDr. J. Mačák, CSc. 3; Radiodiagnostický ústav, FN Ostrava přednosta MUDr. A. Jahodová 4
Vyšlo v časopise: Čes-slov Pediat 2012; 67 (Suppl 1): 29-35.
Kategorie: Původní práce
Souhrn
Pozadí:
Nespecifické střevní záněty (NSZ) jsou chronická onemocnění s relabujícím průběhem a multifaktoriální etiopatogenezí se zřetelným podílem dysbalance imunitního systému. V 6 až 47 % případů jsou asociovány s extraintestinálními projevy v řadě systémů (kůže, oči, klouby a hepatobiliární systém). Postižení nervového systému je uváděno sporadicky. Podle dostupných údajů je incidence 3 až 19 % (cerebrovaskulární onemocnění, polyneuropatie, myopatie, demyelinizační onemocnění včetně roztroušené sklerózy mozkomíšní (RSM) a další). Demyelinizace může souviset s NSZ, jejich léčbou (blokátory TNFα) nebo jde o koincidenci dvou onemocnění. Určit příčinu bývá obtížné.Cíl:
Upozornit na vzácné, potenciálně závažné postižení nervového systému u nemocných s NSZ.Metody:
Popis tří případů dětí s Crohnovou nemocí (CN), u kterých byly zjištěny demyelinizační změny CNS v době manifestace CN a s neurologickou symptomatologií u dvou z nich. Dva nemocní byli léčeni infliximabem bez rozvoje neurologických příznaků. U třetího pacienta je pozitivní rodinná anamnéza pro RSM a přetrvává u něj diskrétní neurologická symptomatologie. U žádného pacienta nebyla RSM potvrzena.Závěr:
Postižení nervového systému u pacientů s NSZ není časté, ale je potenciálně závažné. Je proto nutné zaměřit pozornost také na tento problém, a to zejména v době rozvoje anti-TNFα léčby NSZ.Klíčová slova:
demyelinizace, Crohnova nemoc, extraintestinální manifestace, anti-TNFαÚVOD
Nespecifické střevní záněty (NSZ, Crohnova nemoc – CN, ulcerózní kolitida – UC) jsou střevní onemocnění s chronickým relabujícím průběhem a dosud ne zcela objasněnou multifaktoriální etiopatogenezí se zřetelným podílem dysbalance imunitního systému. Nemocní s imunitně mediovaným onemocněním mají zvýšené riziko rozvoje dalšího takového onemocnění [1]. V 6–47 % případů [2, 3] jsou NSZ provázeny postižením jiných orgánů (extraintestinální manifestace, EIM) a lze je tedy považovat za onemocnění systémová. Zdá se, že vývoj EIM v jednom systému zvyšuje riziko dalších extraintestinálních projevů nemoci [3]. Nejčastěji postižené systémy jsou kůže (pyoderma gangrenosum, erythema nodosum), oči, muskuloskeletální (artralgie, artritidy) a hepatobiliární systém. Extraintestinální postižení může manifestaci NSZ předcházet, objevit se současně nebo s odstupem po stanovení jeho diagnózy. Ne vždy EIM korelují s aktivitou nemoci ve střevě (např. primární sklerozující cholangoitida, ankylozující spondylitida), ale ve většině případů reflektují průběh NSZ a mohou mít výrazný podíl na zhoršené kvalitě života i morbiditě a mortalitě nemocných s NSZ [3]. Od „pravé“ EIM je někdy obtížné odlišit sekundární komplikace, které jsou důsledkem chronického zánětu, malabsorpce, malnutrice nebo léčby.
Postižení nervového systému je uváděno sporadicky, jednou z příčin je také malá pozornost věnovaná tomuto problému. Data o výskytu a spektru neurologických onemocnění u NSZ jsou často protikladná a jejich přesná incidence není známá. Studie z roku 1995 [4] (638 nemocných s NSZ) uvádí 3% incidenci neurologických onemocnění a z toho postižení CNS u 47 % z nich. V prospektivní studii z roku 2008 (82 nemocných s NSZ) [5] mělo 13,4 % nemocných nevysvětlitelnou periferní neuropatii. V další dostupné literatuře jsou u UC častěji uváděny cerebrovaskulární onemocnění a periferní neuropatie, v průběhu CN častěji myopatie a myelopatie, dále demyelinizační onemocnění, sporadické případy neuritidy optiku a neurosenzorické poruchy postihující sluch, event. neuropsychiatrické poruchy [2, 6–8]. U nemocných s NSZ je také uváděna vyšší prevalence roztroušené sklerózy mozkomíšní (RSM) ve srovnání s běžnou populací, pravděpodobně častěji v souvislosti s UC než s CN [1, 2, 9, 10].
Další kapitolou v této problematice mohou být neurologické komplikace spojené s léčbou NSZ, zejména s léčbou biologiky. Zavedení anti-TNFα léčby je nepochybně velkým pokrokem v léčbě NSZ i dalších autoimunních nemocí, může však být spojena se závažnými nežádoucími účinky včetně rozvoje demyelinizace a zhoršení již existujícího, latentně probíhajícího demyelinizujícího onemocnění včetně RSM [11, 12]. Klinické projevy u těchto demyelinizací mohou být variabilní, např. smyslové poruchy, dysestézie, neuritida optického nervu, svalová slabost, kognitivní dysfunkce. Ložiska demyelinizace jsou dobře detekovatelná pomocí MR (magnetická rezonance) mozku jako hypersignální ložiska v T2W (z anglického T2-weighted) a FLAIR (z anglického fluid-attenuated inversions recovery) sekvencích a zvýšeným sycením po podání gadolinia v T1W sekvencích u nově vzniklých. Podobně MR vyšetření orbity může prokázat hypersignální ložiska v intraorbitální části optického nervu [12].
Cílem práce je upozornit na málo časté, nikoliv však neobvyklé postižení nervového systému, které nabývá na významu zejména v éře anti-TNFα terapie NSZ, kde může být kontraindikací zahájení nebo pokračování léčby.
VÝSLEDKY
Uvádíme kazuistiky tří chlapců s CN, u kterých v době diagnostiky nebo průběhu CN byly zjištěny demyelinizační změny s/bez neurologické symptomatologie.
Pacient A
Sedmnáctiletý chlapec, je sledován pro X-vázanou agamalobulinémii, která byla potvrzena DNA analýzou BTK genu (Bruton tyrosin kinase gene, p.R615G) v r. 2002. Pacient byl substituován IVIG (intravenózní imunoglobuliny) ve standardní dávce 0,5 g/kg/měsíc, poslední čtyři roky 0,37–0,5 g/kg/měsíc subkutánně s dostatečnou klinickou odezvou na léčbu. V rodinné anamnéze se nevyskytuje další případ primární imunodeficience, neurologická onemocnění či nespecifické střevní záněty. V r. 2003 byl dlouhodobě a úspěšně léčen methylprednisolonem (0,25 mg/kg/den) a DMARDs (z anglického disease-modifying antirheumatic drugs) pro synovitidu obou kolenních kloubů – bakteriologická, sérologická vyšetření včetně polymerázové řetězové reakce (PCR, z anglického polymerase chain reaction) byla negativní. Začátkem roku 2005 se manifestovala rychle progredující neuropatie optického nervu, která vedla k amauróze levého a parciální ztrátě zraku pravého oka. Roztroušená skleróza mozkomíšní (RSM) a infekce CNS byly likvorologickým vyšetřením (včetně PCR) vyloučeny. Vyšetření MR mozku neprokázala patologii, ale kontrolní MR CNS po 5 měsících ukázalo nepatrné změny signálu v T2W a FLAIR sekvencích v obou parietálních lalocích. Tyto změny byly rentgenologem hodnoceny jako perinatální variace gliálních buněk. EEG vyšetření nevykazovalo žádnou abnormitu. Stav byl uzavřen jako oboustranná atrofie optiku neznámé etiologie, Leberova hereditární atrofie optiku a retinitis pigmentosa byly vyloučeny.
Od r. 2004 se u chlapce objevovaly epizodické průjmy, rozvinula se malabsorpce a neprospívání. Celiakii se nepodařilo jednoznačně prokázat a bezlepková dieta neměla žádoucí efekt. V srpnu 2005 se manifestovala perianální píštěl bez prokazatelné komunikace se střevem. Enteroklýza prokázala diskrétní změny v oblasti terminálního ilea. Mikrobiologická vyšetření stolice byla negativní, v krevním obraze byla trombocytóza, leukocytóza a anemie a bylo vysoké CRP. Protilátky ASCA (anti-saccharomyces cerevisiae antibody) a ANCA (anti-neutrophil cytoplasmatic antibody) byly negativní. Další vyšetření nebyla provedena a chlapec byl na přání rodičů propuštěn z nemocnice. Pro opakované průjmy, epizodické bolesti břicha, neprospívání, malnutrici a opožděnou pubertu byl chlapec znovu vyšetřen gastroenterologem v roce 2007. Nálezy na MR enterografii, kolonoskopii a přítomnost epiteloidních granulomů v bioptickém vzorku potvrdilo diagnózu CN s postižením terminálního ilea. Po konzultaci s imunologem byla za obvyklých podmínek zahájena léčba infliximabem 5 mg/kg ve schématu indukční dávky a následně každých 8 týdnů. Již po první infuzi došlo k dramatickému zlepšení klinického stavu. Během 8 měsíců léčby infliximabem se znormalizoval klinický stav, chlapec přibral 14 kg a vyrostl 10 cm. V listopadu 2008 byla z indikace neurologa provedena kontrolní MR CNS. Pacient v tuto dobu nevykazoval žádné neurologické symptomy, neurotopický nález byl v normě. Nicméně, na MR byly popsány demyelinizační změny ve fronto-parietální periventrikulární a temporální oblasti v T2W a FLAIR sekvencích podezřelých z demyelinizujícího onemocnění (obr. 1 a 2). Žádná z uvedených lézí nevykazovala zvýšené sycení po aplikaci gadolinia. Likvorové nálezy byly negativní, RSM, akutní ani chronická infekce nebyly prokázány. ANA protilátky byly negativní. Terapie infliximabem byla ukončena. Pacient byl v tuto dobu v kompletní remisi CN a byla mu nasazena léčba azathioprinem v dávce 2 mg/kg/den.
Obr. 1. Sagitální řez CNS: MR FLAIR, šipky ukazují ložiska zvýšené intenzity signálu v subkortikální oblasti. Fig. 1. Sagittal section of CNS: MR FLAIR, arrows show the foci of increased signal intensity in subcortical area. 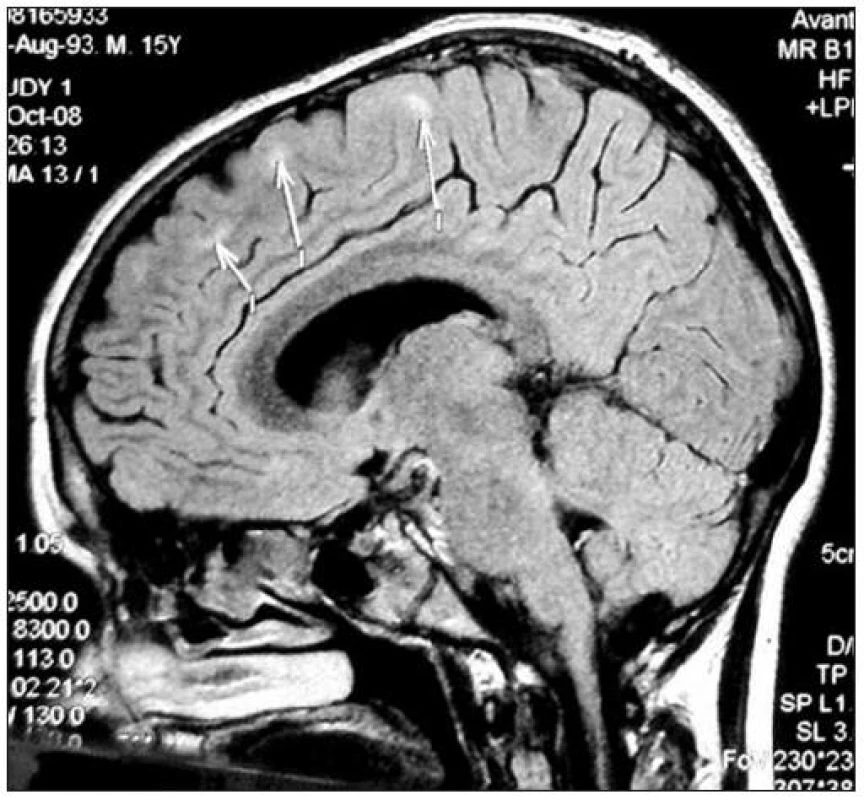
Obr. 2. Transaxialní řez CNS: MR FLAIR, šipky ukazují ložiska zvýšené intenzity signálu v subkortikální oblasti v temporálních lalocích. Fig. 2. Transaxial section of CNS: MR FLAIR, arrows show the foci of increased signal intensity in temporal area. 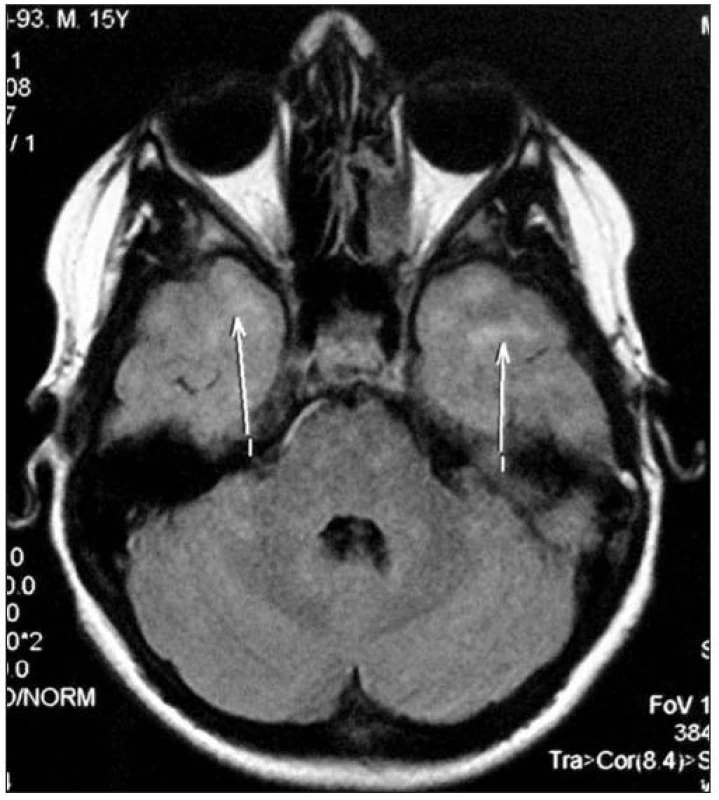
Během následujících tří let pacient nevykazuje žádné neurologické symptomy včetně změny sluchu, kontrastního vidění a barvocitu, intelektových či jiných neurodegenerativních změn. Demyelinizační ložiska jsou podle kontrolních MR CNS prováděných v ročním intervalu stabilní. Byly však zjištěny diskrétní známky rozvoje glaukomu na pravém oku. V r. 2010 prodělal relaps synovitidy na pravém koleni, CN je však v dlouhodobé remisi.
Pacient B
Patnáctiletý chlapec byl v únoru 2005 přijat k hospitalizaci pro podezření na CN. V širší rodině se vyskytuje CN u dvou bratranců. V roce 1997 chlapec prodělal závažnou synovitidu obou kyčelních kloubů a dlouhodobě užíval Plaquenil. Od roku 2003 byl ve sledování revmatologické ambulance pro juvenilní revmatoidní artritidu (JRA) a léčba byla změněna na metotrexát (MTX). V červnu 2003 byl hospitalizován pro artritidu pravého kolena, subfebrilie, splenomegalii a perikardiální výpotek. Byl léčen pulzy kortikosteroidů (celkem 5) s dobrou klinickou odezvou. V listopadu 2004 byl znovu hospitalizován pro relaps artritidy v pravém koleni a systémovou reakci. Zánětlivý fokus nebyl nalezen. Stav opět příznivě reagoval na pulzní terapii kortikosteroidy.
V únoru 2005 byl přijat na Oddělení pediatrické resuscitační a intenzivní péče pro týdenní anamnézu třesu horních končetin, dezorientaci a fatickou poruchu. Současně trpěl již tři týdny trvajícím průjmem, intermitentně zvracel a měl bolesti břicha. Neurolog hodnotil stav jako lehký neocerebelární syndrom s poruchou vědomí charakteru globální tranzientní amnézie. CT vyšetření mozku a likvorový nález včetně mikrobiologického vyšetření byly negativní. Na EEG záznamu byla popsána středně těžká difuzní nespecifická abnormita pro periodický charakter základní aktivity se střídáním úseků labilní alfa s epizodami difuzního zpomalení základní aktivity a ložiskové ostré vlny temporálně. Vyšetření EMG bylo negativní. Hladiny MTX byly v normě. Na MR CNS byla popsána v T2W sekvencích drobná hypersignální ložiska do 2 mm subkortikálně parietálně bilaterálně, dále v oblasti putamen a capsula interna vlevo. Laboratorní vyšetření včetně analýzy likvoru vyloučilo demyelinizační onemocnění typu RSM. Stav byl neurologem uzavřen jako vaskulitida. Pacient byl léčen methylprednisolonem s příznivým efektem. Po konzultaci s revmatologem byl MTX vysazen a diagnóza JRA byla překlasifikována na enteropatickou artritidu. Nález na kontrolním MR CNS v březnu 2005 byl bez progrese.
U pacienta se rozvinula přechodná porucha chování typu obsedantně kompulzivní poruchy a depresivní stavy. Léčba Citalecem a Seropramem byla úspěšná. Sledování pedopsychiatrem bylo následně ukončeno. Neurologická symptomatologie postupně úplně vymizela. Pro přetrvávající průjmy byl chlapec vyšetřen v březnu 2005 gastroenterologem a byla stanovena diagnóza CN s postižením terminálního ilea. Protilátky ASCA byly pozitivní, ANCA negativní. Byl léčen po dobu tří měsíců systémovými steroidy a mesalazinem s příznivou odezvou. V únoru 2006 chlapec prodělal závažný relaps CN spojený s masivní enteroragií s nutností krevní transfuze. Byla prokázaná krvácející peptické ulcerace na velké kurvatuře žaludku. Po zvládnutí této akutní komplikace byl ordinován azathioprin a byla navozena remise CN. V srpnu 2007 prodělal relaps synovitidy pravého kolenního kloubu a současně i CN, ubyl 10 % tělesné hmotnosti během 5 měsíců. Pro pouze přechodný efekt intenzifikované léčby byl po splnění zvyklých kritérií indikován k léčbě infliximabem. Kontrolní neurologické vyšetření bylo negativní a pacient neměl žádné neurologické symptomy. Léčba infliximabem (5 mg/kg, 0., 2. a 6. týden a dále každých 8 týdnů) byla velmi úspěšná, během tří měsíců byla navozena klinická a laboratorní remise.
V průběhu dalších měsíců byl chlapec bez gastrointestinální, kloubní i jakékoliv neurologické symptomatologie. Kontrolní MR CNS v září 2009 neprokázalo žádné demyelinizační změny v CNS. V dobrém klinickém stavu byl pacient předán do péče gastroenterologa pro dospělé.
Pacient C
Devítiletý chlapec s anamnézou alergického asthma bronchiale a recidivujících zánětů středouší byl v květnu 2005 hospitalizován pro několikaměsíční pocit únavy, nejasné teploty, epizodické bolesti břicha a průjmy, závažnou anemizaci (Hb 97 g/l), elevaci CRP nad 30 mg/l a současně pozitivitu ASCA protilátek. V osobní anamnéze dominovala dlouhodobá léčba inhalačními steroidy a inhibitory receptoru pro leukotrieny. Matka pacienta je léčena pro CN a její matka pro roztroušenou sklerózu mozkomíšní. Otec a bratr pacienta jsou dlouhodobě léčení pro polinózu a asthma bronchiale.
Pro suspekci na NSZ byla u pacienta provedena řada vyšetření, enteroklýza a kolonoskopie potvrdily zánět v oblasti terminálního ilea, bioptické vyšetření potvrdilo diagnózu CN nálezem epiteloidních granulomů. Byla zahájena léčba systémovými kortikosteroidy a mesalazinem.
V prosinci 2005 byl pacient hospitalizován na neurologické klinice pro třes rukou, cefaleu a opakované stavy rudnutí, které byly dány do souvislosti s léčbou systémovými steroidy. Z tohoto důvodu bylo jejich podávání ukončeno. Neurotopický nález byl negativní, EEG vyloučilo epileptickou aktivitu, ale na MR CNS bylo zjištěno hypersignální ložisko velikosti 10 x 6 mm v bílé hmotě pravé mozečkové hemisféry v T2W a bez zvýšeného sycení po podání gadolinia v T1W. Vyšetření likvoru bylo negativní, infekce a demyelinizující onemocnění byly vyloučeny. Diferenciálně diagnosticky zvažovaná cévní etiologie nebyla ani potvrzena, ani vyloučena. Kontrolní vyšetření MR CNS po dvou letech nevykazovalo dynamiku ložiska a PET (pozitronová emisní tomografie) mozku vyloučila neoplastický charakter ložiska. Oční vyšetření zjistilo lehkou hypermetropii na obou očích bez nutnosti korekce. Kontrolní MR CNS v říjnu 2009 prokázalo infratentoriálně v T2W a FLAIR sekvencích malé hypersignální ložisko velkosti cca 6 mm v oblasti nucleus dentatus v pravé mozečkové hemisféře, které je dlouhodobě bez progrese (obr. 3).
Obr. 3. Sagitální řez CNS: MR FLAIR, ložisko zvýšené intenzity signálu pravé mozečkové hemisféry. Fig. 3. Sagittal section of CNS: MR FLAIR, a focus of increased signal intensity of the right cellular hemisphere. 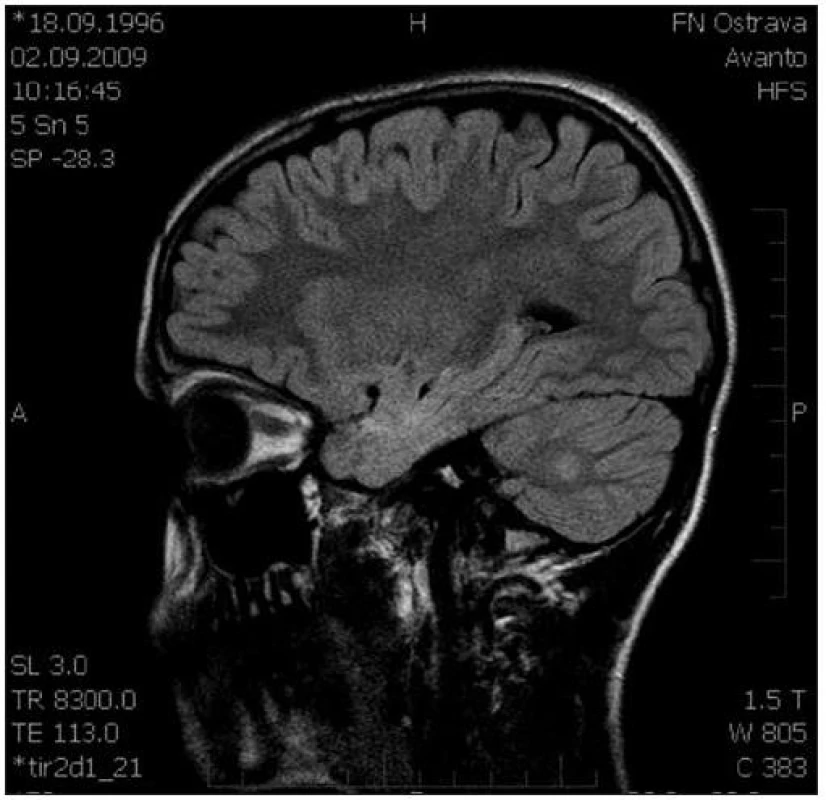
V prosinci 2007 došlo k relapsu CN, bez manifestace neurologické symptomatologie. Od té doby je chlapec léčen azathioprinem v kombinaci s 5-ASA a CN je v dlouhodobé klinické a laboratorní remisi. Intermitentně se vyskytuje cefalea a nově parestézie dolních končetin. Pacient je v současné době vyšetřován pro suspekci na postižení periferních nervů dolních končetin.
DISKUSE
Popisujeme tři případy dětí s CN, u kterých byla zjištěna ložiska demyelinizace v CNS v období manifestace CN (do 8 měsíců od stanovení diagnózy) a neurologická symptomatologie u dvou z nich. Všichni prezentovaní pacienti byli chlapci ve věku 9–15 let v době manifestace neurologických změn. Neurologické symptomy u pacientů B a C se objevily v době diagnózy nebo krátce po stanovení diagnózy CN. Vývoj demyelinizačních ložisek u pacienta A pravděpodobně začal 2–3 roky před stanovením diagnózy CN (2005). Tehdy byly poprvé popsány nepatrné změny signálu v T2W a FLAIR sekvencích v obou parietálních lalocích. Bohužel, protože byl klinický stav během následujících let bez jakékoliv neurologické symptomatologie, kontrolní MR CNS nebylo provedeno. Nicméně gastrointestinální potíže, které již pravděpodobně souvisely s rozvojem CN, se manifestovaly poprvé v roce 2004. Mohlo by se tedy v tomto případě spekulovat o demyelinizaci také jako o extraintestinálním projevu CN. Ložiska demyelinizace jsou podle MR vyšetření dlouhodobě stabilní, bez známek sycení po podání gadolinia vylučující aktivní plaky RSM. Protože se jedná o pacienta se závažným primárním deficitem tvorby protilátek, je také možné spekulovat o infekční etiologii. V anamnéze pacienta sice chybí údaj o prodělané CNS infekci, nicméně atrofie optických nervů u tohoto pacienta je s největší pravděpodobností důsledkem enterovirové neuritidy při základním onemocnění X-vázané agamaglobulinemie. Akutní a/nebo chronická infekce CNS, především enterovirové etiologie, je nejobvyklejší příčinou neurologických komplikací u těchto nemocných [28]. Je také možné spekulovat o asociaci neuritidy optiku a CN [1]. Spekulace o dalších příčinách – neznámé infekční agens, souvislost se substituční léčbou (chemické nebo imunologické faktory) v etiologii této komplikace u pacienta s X-vázanou agamaglobulinemií již překračuje rozsah tohoto sdělení.
Lokalizace demyelinizačních změn zjištěná MR CNS v případě pacienta B je obvyklá pro vaskulitidu [13]. Negativní nález v likvoru vaskulitidu jako příčinu ložiskových změn CNS nevylučuje. Patologický likvorový nález je popisován pouze u 50 % nemocných s vaskulitidou CNS [13] a definitivní diagnózu lze potvrdit pouze bioptickým vyšetřením. Diagnózu vaskulitidy CNS podporuje naopak přítomnost systémového onemocnění. Vzhledem k věku a chybění jiných rizikových faktorů lze také vyloučit aterosklerotický proces, přestože vyšetření MR nerozlišuje mezi aterosklerotickou a vaskulitickou příčinou lézí. MR angiografie u tohoto pacienta nebyla provedena. Polékové změny bílé hmoty v souvislosti s léčbou MTX byly vyloučeny (hladiny MTX v likvoru byly negativní). Demyelinizace a dokonce i nekróza v CNS může být důsledkem léčby MTX. Tyto změny jsou však popisovány pouze u vysokodávkovaného MTX podávaného intravenózně, intratekálně nebo intraventrikulárně u nemocných léčených pro lymfo - nebo myeloproliferativní onemocnění [14]. Lokalizace změn, drobná ložiska bez vývoje a negativní kontrolní MR vylučují podíl MTX na demyelinizačních změnách u tohoto pacienta [15]. V průběhu léčby infliximabem nedošlo k manifestaci neurologické symptomatologie a kontrolní MR mozku bylo bez patologického nálezu. V tomto případě se tedy pravděpodobně jednalo o sekundární vaskulitidu u nemocného s NSZ a enteropatickou artritidou.
Ložisko demyelinizace v oblasti mozečku u pacienta C je dlouhodobě bez vývoje a může být extraintestinálním projevem CN. Vzhledem k rodinné zátěži nelze v dalším průběhu vyloučit rozvoj RSM. Periferní neuropatie zatím nejasné etiologie a cefalea pravděpodobně souvisí s CN [5].
Neurologická onemocnění u pacientů s NSZ mohou souviset přímo s onemocněním, být jejich komplikací (např. malabsorpce vitaminu B12, B6, E, folátů, selenu), souviset s léčbou (metronidazol, sulfasalazin, anti-TNFα), nebo se může jednat o náhodnou koincidenci různých nemocí. Přesná incidence není známá, literární údaje se dosti liší, ale je zřejmě vyšší, než se dříve předpokládalo [16]. Studie z roku 1995 (638 nemocných s NSZ) [4] uvádí 3% incidenci neurologických onemocnění, z toho postižení CNS u 47 % z nich, a široké spektrum diagnóz – periferní neuropatie, myopatie a myastenia gravis, cerebrovaskulární onemocnění a myelopatie. Vzhledem k malému počtu postižených bylo obtížné přesněji charakterizovat jejich klinické spektrum a patogenezi. V prospektivní studii z roku 2008 (82 nemocných s NSZ) [5] mělo 13,4 % nemocných nevysvětlitelnou periferní neuropatii. Studie z roku 1997 (253 nemocných s CN) uvádí 19,3% incidenci neurologických a neuropsychiatrických komplikací. Incidence cerebrovaskulárních komplikací 4,7 % byla vyšší u CN ve srovnání s běžnou populací a postihovala především pacienty v mladším věku. Příčina nebyla objasněna a autoři spekulovali o autoimunním mechanismu postihujícím malé cévy centrální a periferní nervové soustavy [8]. Asociace neurologických onemocnění a NSZ je nepatrně častější u mužů, obvykle se manifestují až po diagnóze NSZ a vzácně koincidují s relapsem onemocnění. U nemocných s NSZ a s neurologickými komplikacemi se častěji vyskytují EIM v dalších systémech (kůže, klouby, hepatobiliární systém) ve srovnání s nemocnými s NSZ bez neurologického postižení [4]. Cerebrovaskulární onemocnění a periferní neuropatie (akutní/chronické zánětlivé demyelinizační polyneuropatie) jsou častěji uváděny u UC, myopatie a myelopatie častěji v průběhu CN. Riziko demyelinizujícího onemocnění u nemocných s NSZ je až čtyřnásobné ve srovnání s kontrolní populací, vyšší pro UC a nezávislé na léčbě anti-TNFα [1,10,17]. Naopak bylo zjištěno vyšší riziko demyelinizujícího onemocnění u nemocných s NSZ, kteří nebyli léčeni azathioprinem/6-merkaptopurinem (OR u CN 1,59; 95% CI 1,03–2,44 a OR u UC 1,85; 95% CI 1,35–2,54) [1]. Zvýšené riziko demyelinizace u NSZ naznačuje společnou genetickou predispozici, spouštěcí faktor, event. i možnost spuštění zánětlivého onemocnění v důsledku léčby jiného zánětlivého stavu [10]. Roli imunitního systému podporuje přítomnost demyelinizačních změn s/bez neurologické symptomatologie i u dalších autoimunních a systémových onemocnění, jako je např. celiakie, systémový lupus erythematodes. Byly např. zjištěny u 20 % (n = 75) dětí s celiakií, incidence rostla s délkou expozice lepku ve stravě [8]. U dospělých nemocných s celiakií byla popsána progresivní leukoencefalopatie; neurologické symptomy se manifestovaly několik let po diagnóze celiakie, a to přes dodržování dietního omezení [18].
Pochopení asociace NSZ a demyelinizujícího onemocnění včetně RSM nabylo na významu v době anti-TNFα léčby. Léky blokující TNFα (infliximab, adalimumab, etanercept) indikované k léčbě chronických zánětlivých onemocnění (revmatoidní artritida, juvenilní revmatoidní artritida, ankylozující spondylitida, NSZ, psoriáza a psoriatická artritida) působí rychleji než tradiční léčiva a efektivněji brání progresi onemocnění a strukturálním změnám, které jsou spojené s autoimunním zánětem [11, 19]. Na druhou stranu se objevují zprávy o demyelinizujících onemocněních ve spojení s léčbou anti-TNFα (RSM, RSM-like syndrom, neuritida optiku, Guillainův-Barréův syndrom) u nemocných s NSZ, revmatoidní artritidou a psoriázou [1, 12, 19–24]. Není však známo, zda je incidence těchto onemocnění vyšší u nemocných s NSZ léčených anti-TNFα než u nemocných s NSZ, kteří anti-TNFα léčeni nejsou [11, 19]. Demyelinizace byly popsány především u infliximabu, objevují se však zprávy o demyelinizaci u pacientů s revmatoidní artritidou léčených adalimumabem či etanerceptem [10]. U 65 % nemocných s artritidou i CN léčených infliximabem byly nejčastějšími příznaky parestézie, dále pak poruchy chůze a neostré vidění, zmatenost a Guillainův-Barréův syndrom [20]. Při hodnocení souvislosti anti-TNFα léčby s neurologickým onemocněním je nutné brát v potaz několik faktorů: (a) časový sled – změny se vyvíjejí v průměru do 5 (2–18) měsíců od začátku léčby, (b) přítomnost vysvětlující alternativy (jiné léky, infekce atd.), (c) vymizení symptomů, event. i demyelinizačních ložisek na MR po vysazení anti-TNFα (u části nemocných), (d) rekurence ložiskových změn v mozku a neurologické symptomatologie při opětovném nasazení anti-TNFα, (e) biologická pravděpodobnost, založená na in vitro/in vivo zkušenostech s lékem [11, 14]. Časová souvislost mezi podáním anti - -TNFα a vznikem demyelinizace, vymizení neurologické symptomatologie, event. i vymizení změn v CNS po ukončení léčby svědčí pro kauzální vztah. V písemnictví je tento vztah podporován pouze sérií případů nebo kazuistickým sdělením. Byl také popsán případ úspěšného opakovaného nasazení infliximabu u pacienta s těžkou psoriatickou artritidou a Guillainovým-Barréovým syndromem [25]. Riziko relapsu demyelinizujícího onemocnění a jeho klinická závažnost se však při opakovaném zavedení anti-TNFα zvyšuje [26]. Důvodem nasazení anti-TNFα léčby je agresivní průběh základního onemocnění. Otázkou tak je, zda tito nemocní nemají také vyšší riziko demyelinizace i bez anti-TNFα terapie a zda tato terapie pouze nedemaskuje latentní onemocnění [10]. Vymizení neurologických příznaků a event. i demyelinizačních změn po ukončení léčby v řadě případů nasvědčuje pro přechodnou a reverzibilní poruchu [10]. Pro závažnost neurologického postižení se ale anti-TNFα léčba nedoporučuje u nemocných s osobní či rodinnou anamnézou demyelinizačního onemocnění a v případě vzniku neurologické symptomatologie během léčby se doporučuje ji ukončit a nemocné dále sledovat. V některých případech je nutná terapie systémovými steroidy, IVIG, event. plazmaferézou [21, 27]. Zda monitorovat CNS změny pomocí MR před a v průběhu anti-TNFα léčby u nemocných s nespecifickým střevním zánětem vyžaduje další zkoumání, objasnění etiopatogeneze demyelinizačních změn, neurologické symptomatologie a jejich souvislostí u nemocných s NSZ.
Souvislost s anti-TNFα léčbou by bylo možné zvažovat pouze u pacienta A. Předpokládáme však, že vývoj demyelinizačních změn začal již před nasazením infliximabu (MR v srpnu 2005). Není známo, zda došlo k nějakému vývoji ložiskových změn v bílé hmotě mezi léty 2005 a 2008, kdy nebylo provedeno kontrolní MR vyšetření. Nicméně, v tomto období se nemanifestovaly žádné neurologické příznaky a oční nález byl stacionární. Rovněž po dobu léčby infliximabem i po jejím ukončení se neurologické příznaky neobjevily a na MR CNS je v průběhu následujících let stacionární nález.
ZÁVĚR
Postižení nervového systému u nemocných s NSZ není časté a dosud je tomuto problému věnována ze strany gastroenterologů malá pozornost. Potenciální závažnost postižení tohoto systému a možná terapeutická omezení však nabývají na významu zejména v době rozvoje biologické léčby.
Došlo: 22. 8. 2011
Přijato: 10. 1. 2012
MUDr. Astrid Šuláková
KDL FN Ostrava
17. listopadu 1790
708 52 Ostrava-Poruba
e-mail: astrida.sulakova@fno.cz
Zdroje
1. Gupta G, Gelfand JM, Lewis JD. Increased risk for demyelinating diseases in patients with inflammatory bowel disease. Gastroenterology 2005; 129 : 819–826.
2. de Lau LML, de Vries JM, van der Woude CJ, et al. Acute CNS white matter lesions in patients with inflammatory bowel disease. Inflamm Bowel Dis 2009; 15 (4): 576–580.
3. Rothfuss KS, Stange EF, Herrlinger KR. Extraintestinal manifestation and complication in inflammatory bowel disease. World J Gastroenterol 2006; 14 (12): 4819–4831.
4. Lossos A, River Y, Eliakim A, Steiner I. Neurologic aspects of inflammatory bowel disease. Neurology 1995; 45 : 416–421.
5. Oliveira GR, Teles BCV, Brasil ÉF, et al. Peripheral neuropathy and neurological disorders in an unselected Brazilian population – based cohort of IBD patients. Inflamm Bowel Dis 2008; 14 : 389–395.
6. Benavente L, Moris G. Neurologic disorders associated with inflammatory bowel disease. Eur J Neurol 2011; 18 : 138–143.
7. Rajendra S, Kadir ZA, Karim N, Zain Z. Ulcerative colitis and motor neurone disease: causal or coincidental? Singapore Med 2003; 44 : 423–425.
8. Elsehety A, Bertorinin TE. Neurologic and neuropsychiatric complications of Crohn’s disease. South Med J 1997; 90 (6): 606–610.
9. Pokorny CS, Beran RG, Pokorny MJ. Association between ulcerative colitis and multiple sclerosis. Internal Medicine Journal 2007; 37 : 721–724.
10. Andersen NN, Caspersen S, Jess T, Munkholm P. Occurence of demyelinating diseases after anti-TNFα treatment of inflammtory bowel disease: A Danish Crohn colitis database study. Journal of Crohn’s and Colitis 2008; 2 : 304–309.
11. Magnano MD, Robinson WH, Genovese MC. Demyelination and inhibition of tumor necrosis factor (TNF). Clin Exp Rheumatol 2004; 22 (Suppl 35): S134–S140.
12. Fromont A, De Seze J, Fleury MC, et al. Inflammatory demyelinating events following treatment with anti-tumor necrosis factor. Cytokine 2009; 45 : 55–57.
13. Dejaco C, Fertl E, Prayer D, et al. Symptomatic cerebral microangiopathy preceeding initial manifestation of ulcerative colitis. Digestive Diseases and Sciences 1996; 41 (9): 1807–1810.
14. Mohan N, Edwards ET, Cupps TR, et al. Demyelination occuring during anti-tumor necrosis factor a therapy for inflammatory arthritides. Arthritis Rheum 2001; 44 (12): 2862–2869.
15. Hesselink JR. Demyelinating diseases of the brain. http://spinwarp.ucsd. edu/neuroweb/ Text/br-840.htm.
16. Zois CD, Katsanos KH, Kosmidou M, et al. Neurologic manifestations in inflammatory bowel diseases: current knowledge and novel insights. J Crohn Colitis 2010; 4 : 115–124.
17. Geissler A, Andus T, Roth M, et al. Focal white-matter lesions in brain of patients with inflammatory bowel disease. Lancet 1995;15 (346): 190–191.
18. Beyenburg S, Scheid B, Deckert-Schlüter M, et al. Chronic progressive leukoencephalopathy in adult celiac disease. Neurology 1998;50 (3): 820–822.
19. Caminero A, Comabella M, Montalban X. Tumor necrosis factor alpha (TNFα) and demyelination revisited: An ongoing story. J Neuroimmunol 2011; 234 : 1–6.
20. Freeman HJ, Flak B. Demyelination-like syndrome in Crohn’s disease after infliximab therapy. Can J Gastroenterol 2005; 19 (5): 313–316.
21. Lozeron P, Denier Ch, Lacroix C, et al. Long-term course of demyelinating neuropathies occurring during tumor necrosis factor-alpha-blocker therapy. Arch Neurol 2009; 66 (4): 490–497.
22. Tanno M, Nakamura I, Kobayashi S, et al. New-onset demyelination induced by infliximab therapy in two rheumatoid patients. Clin Rheumatol 2006; 25 : 929–933.
23. van der Laken CJ, Lerns WF, van Soersbergen RM, et al. Paraplegia in a patient receiving anti–tumor necrosis factor therapy for rheumatoid arthritis: comment on the article by Mohan et al. Arthritis Rheum 2003; 48 (1): 269–270.
24. Thomas CW Jr, Weinshenker BG, Sandborn WJ. Demyelination during anti-tumor necrosis factor α therapy with infliximab for Crohn’s disease. Inflamm Bowel Dis 2004; 10 (1): 28–31.
25. Cisternas M, Gutiérrez M, Jacobelli S. Successful rechallenge with a-tumor necrosis factor α for psoriatic arthritis after development of demyelinating nervous system disease during initial treatment: comment on the article by Mohan et al. Arthritis Rheum 2002; 46 (11): 3107–3108.
26. Mohan N. Letter to the editor. Arthritis Rheum 2002; 46 (11): 3108–3109.
27. Jarand J, Zochodne DW, Martin LO, et al. Neurological complications of infliximab (case report). J Rheum 2006;33 : 1018–1020.
28. Ziegner UHM, Kobayashi RH, Cunningham-Rundles Ch, et al. Progressive neurodegeneration in patients with primary immunodeficiency disease on IVIG treatment. Clin Immunol 2002; 102 (1): 19–24.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článek Úvodní slovo
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2012 Číslo Suppl 1- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
- ECMO (extrakorporální membránová oxygenace) v léčbě respiračního a oběhového selhání u novorozenců a dětí – kazuistiky
-
Terminálne zlyhanie obličiek u detí na Slovensku
Epidemiológia z Európskej perspektívy - Diagnostika a léčba dětské katarakty
- Demyelinizační změny mozku u dětí s Crohnovou nemocí
- Úvodní slovo
- Extracorporeal Membrane Oxygenation – trocha historie, současnost, ale hlavně budoucnost
- Cizí těleso v gastrointestinálním traktu (kazuistika) a současná diagnostická a terapeutická doporučení
- Syndrom týrané rodiny dítětem v dětské obezitologické ambulanci
- Kyselina listová a poruchy uzatvárania neurálnej rúry – od minulosti po súčasnosť
- Prof. MUDr. Miloš Máček, DrSc. – 90 let
- ECMO (extrakorporální membránová oxygenace) v léčbě respiračního a oběhového selhání u novorozenců a dětí
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Diagnostika a léčba dětské katarakty
- Cizí těleso v gastrointestinálním traktu (kazuistika) a současná diagnostická a terapeutická doporučení
- ECMO (extrakorporální membránová oxygenace) v léčbě respiračního a oběhového selhání u novorozenců a dětí
- Kyselina listová a poruchy uzatvárania neurálnej rúry – od minulosti po súčasnosť
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



