-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Role moderní mikrobiologické diagnostiky v péči o pacienty s cystickou fibrózou
Role of Novel Microbiological Diagnostics in the Care for Patients with Cystic Fibrosis
Patients with cystic fibrosis (CF) are susceptible to chronic respiratory infections that considerably affect their long-term prognosis. Burkholderia cepacia complex and Pseudomonas aeruginosa are the most severe pathogens that can cause epidemic outbreaks within a CF population. To prevent their potential spread, early and reliable diagnostics along with transmissible strain identification is required.
Molecular genetic methods allow highly sensitive and specific detection of bacteria belonging to B. cepacia complex and their speciation. Furthermore, the typing techniques help identify the strains capable of transmission among patients.
The Prague CF Centre has been combating the widespread infection of B. cepacia complex caused by the strain ST-32 for more than 10 years. The current drop in its incidence is a likely consequence of strict infection control, which is monitored by applying molecular microbiological tools.Key words:
cystic fibrosis, microbiology, diagnostics, Burkholderia cepacia complex, Pseudomonas aeruginosa, epidemic strai
Autoři: P. Dřevínek 1; L. Fila 2
Působiště autorů: Cardiff School of Biosciences, Cardiff University, Park Place, Cardiff, CF0 3TL, Velká Británie vedoucí prof. J. Harwood, Ph. D. 1; Pneumologická klinika UK 2. LF a FN Motol, Praha přednosta doc. MUDr. J. Musil, Ph. D. 2
Vyšlo v časopise: Čes-slov Pediat 2008; 63 (2): 83-89.
Souhrn
Pacienti s cystickou fibrózou (CF) jsou náchylní k chronickým infekcím dýchacích cest, které zásadním způsobem ovlivňují jejich prognózu. Mezi nejzávažnější původce těchto infekcí patří bakterie komplexu Burkholderia cepacia a Pseudomonas aeruginosa, které navíc hrozí epidemickým rozsevem infekce v CF populaci. Z tohoto důvodu je důležité umět nejen časně a spolehlivě takové patogeny diagnostikovat, ale též určit, zda mají schopnost se mezi pacienty přenášet.
Molekulárně genetické metody používané pro potřeby mikrobiologické diagnostiky umožňují s vysokou citlivostí detekovat komplex B. cepacia a zároveň určit jeho příslušnost k jednomu z devíti druhů. Genotypizační techniky vedou k identifikaci rizikových kmenů, které se mohou v CF populaci šířit.
Pražské CF centrum se již více než jedno desetiletí potýká s mimořádnou epidemií infekce komplexem B. cepacia, za kterou je zodpovědný epidemický kmen ST-32. Pokles incidence pozorovaný v současnosti je velmi pravděpodobně výsledkem dodržování přísného protiepidemického režimu, nad jehož efektivitou bdí mikrobiologie používající moderní diagnostické přístupy.Klíčová slova:
cystická fibróza, mikrobiologie, diagnostika, komplex Burkholderia cepacia, Pseudomonas aeruginosa, epidemický kmenÚvod
Klinický průběh cystické fibrózy (CF) je významně ovlivňován respiračními infekcemi, které se v průběhu života pacienta stávají chronickými a které jsou obvykle doprovázeny epizodami plicních exacerbací. Infekce představují jednu z hlavních příčin úmrtnosti u CF, neboť se podílejí na zhoršování plicní funkce a způsobují nevratné změny v plicním parenchymu.
Spektrum bakterií typických pro CF zahrnuje poměrně omezený počet mikroorganismů. Nejčastěji se jedná o bakterie Staphylococcus aureus, Haemophilusinfluenzae, Pseudomonas aeruginosa a o komplex Burkholderia cepacia. Poslední dva jmenované druhy jsou pokládány za nejzávažnější CF patogeny, které prokazatelně zkracují očekávanou délku života pacientů [1, 2]. Obě bakterie vyvolávají nevyléčitelné perzistentní infekce, které se nedaří i přes agresivní antibiotickou léčbu z dýchacích cest eradikovat.
Vážnost infekce je umocněna skutečností, že jak P. aeruginosa, tak bakterie komplexu B. cepacia jsou schopné přenosu z pacienta na pacienta [3]. Infikovaný pacient tedy představuje potenciální zdroj nákazy pro každého dalšího pacienta s CF, s nímž přijde do kontaktu. Z tohoto důvodu každé specializované CF centrum uplatňuje v rámci svého provozu řadu přísných opatření, jimiž minimalizuje riziko dalšího šíření nebezpečné infekce [4, 5]. Základní pravidlo spočívá v rozdělení pacientů podle aktuálního mikrobiologického nálezu do skupin, které se vzájemně nesmějí setkat na oddělení či v ambulanci. Pravidla izolace pacientů pochopitelně přesahují brány nemocničního zařízení a zasahují do společenského života nemocných CF, pro které setkání s druhým nemocným znamená riziko získání celoživotní infekce.
Z výše uvedeného je zřejmé, že bakterie hrají v problematice CF významnou roli. Za posledních 20 let se v historii onemocnění dostaly do popředí v takovém měřítku, že přestává být nadsázkou označovat CF nejen za onemocnění genetické, ale též za nemoc infekční [6]. Zákonitě se společně s bakteriemi zviditelňuje i mikrobiologie, jejímž primárním úkolem v rámci péče o CF je poskytnout přesnou a časnou diagnostiku bakteriálních infekcí.
Úskalí diagnostiky infekce komplexem B. cepacia
Největší problém v mikrobiologické diagnostice CF patogenů představuje komplex B. cepacia (Bcc). Svízelnost jeho detekce spočívá již na úrovni izolace mikroba při kultivaci klinického materiálu, kdy lze bez použití selektivních půd snadno přehlédnout drobné, pomalu rostoucí kolonie Bcc. Další úskalí tkví v nesprávné identifikaci Bcc při aplikaci obvyklých biochemických testů. Ve studii americké referenční laboratoře specializované na diagnostiku Bcc bylo zjištěno, že z celkového počtu 1051 izolátů, které byly do této laboratoře poslány k ověření z mikrobiologických pracovišť národních CF center, bylo 11 % izolátů nesprávně označených za Bcc a naopak 36 % skutečných izolátů Bcc bylo považováno za jinou bakterii [7].
Poslední zásadní problém v diagnostice Bcc má na svědomí složitá taxonomie, která uvádí na pravou míru skutečnost, že se pod dříve používaným souhrnným názvem Burkholderia cepacia skrývá vícečlenná skupina příbuzných organismů, z nichž každý reprezentuje samostatný bakteriální druh. Tento soubor organismů dohromady vytváří komplex, v jehož rámci je nyní oficiálně popsáno devět druhů, dříve označovaných pojmem genomovar a rozlišovaných římskou číslicí (tab. 1). Celý komplex se nadále rozrůstá a počet devíti druhů se stane záhy historií. Dá se očekávat, že zanedlouho budou v řadách Bcc skupiny provizorně označované 1 až 8 či skupina K [8, 9].
Tab. 1. Seznam jednotlivých druhů patřících ke komplexu Burkholderia cepacia (Bcc) a jejich zastoupení v české a americké populaci pacientů s CF jako ilustrativní příklad. V době provedení citovaných prací nebyly ještě druhy B. anthina a B. pyrrocinia popsány, proto chybí údaje o jejich výskytu. V obou studiích se vyskytla cca 2 % blíže neurčených kmenů Bcc, které velmi pravděpodobně patří k nedávno identifikovaným skupinám Bcc. 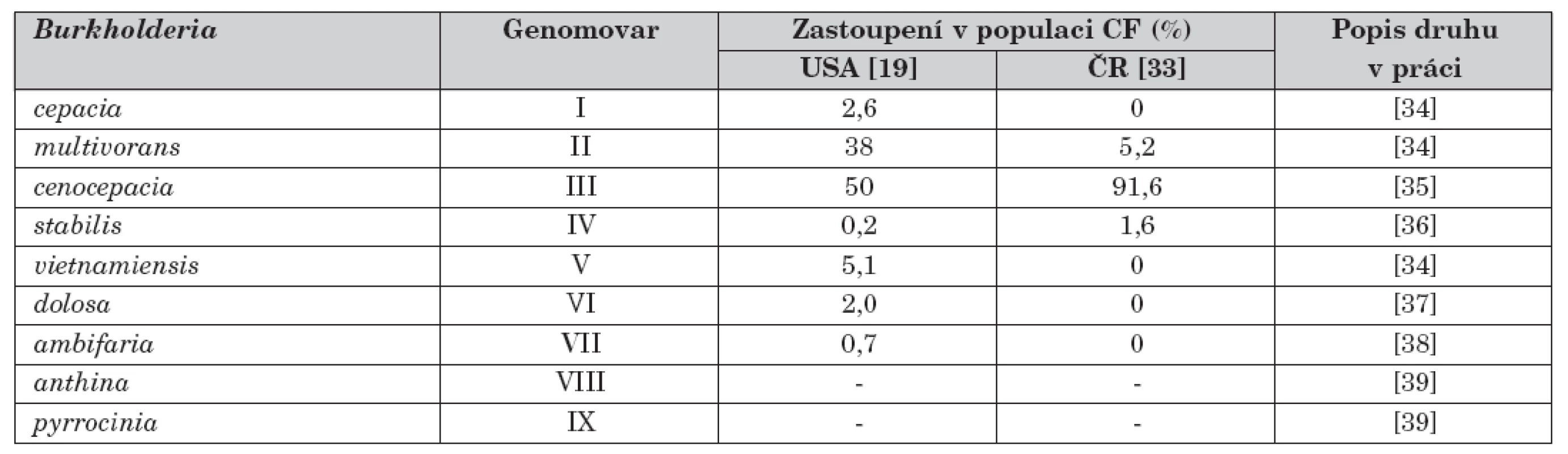
Existence mnoha úzce příbuzných druhů v rámci Bcc prakticky znemožňuje jejich rozlišení při použití obvyklých mikrobiologických metod. Výsledek kultivačního vyšetření určí v optimálním případě příslušnost bakterie ke komplexu, nedokáže však identifikovat její druhovou příslušnost. Určení druhu je tak zcela závislé na metodách molekulární genetiky, které se s výhodou využívají i pro diagnostiku Bcc jako celku.
Možnosti molekulárně genetické analýzy komplexu B. cepacia
Identifikace komplexu a jeho jednotlivých druhů
Molekulárně genetické metody užívané v mikrobiologické diagnostice jsou založeny na detekci úseku bakteriální DNA, jenž je svou nukleotidovou sekvencí pro daný mikroorganismus charakteristický a nevyskytuje se u žádné další bakterie. Tím je zaručena stoprocentní specificita diagnostického testu a vyloučena možnost záměny za jinou fenotypově podobnou bakterii. Není proto překvapením, že tento přístup se stal základem pro diagnostiku jak celého komplexu B. cepacia, tak jeho jednotlivých, kultivačně neodlišitelných druhů.
Ideálním genem pro určování Bcc se stal gen recA, který se v biologii buňky podílí na životně důležitých procesech, jako je rekombinace DNA vláken či opravy poškozené DNA. Z důvodu jeho nezastupitelnosti je pro buňku potřebné udržovat gen ve funkčním stavu a chránit jej před potenciálně škodlivými mutačními změnami. Výsledkem je pak stabilní a relativně neměnná nukleotidová sekvence genu mezi blízkými bakteriálními druhy, jakými jsou právě bakterie sdružující se pod hlavičkou Bcc. Vysoká míra podobnosti v sekvenci jejich recA umožňuje odlišit celou skupinu Bcc od jiných, kultivačně zaměnitelných bakterií (např. Burkholderiagladioli, Ralstonia spp. nebo Pandoraea spp.). Na druhou stranu není recA sekvence uvnitř Bcc zcela uniformní, ale obsahuje nukleotidové polymorfismy, které dovolují odlišit jednotlivé druhy mezi sebou.
Analýza genu recA tak vede jak k identifikaci celého Bcc, tak k určení každého druhu zvlášť. Všechny metody detekce vycházejí z amplifikace genu pomocí polymerázové řetězové reakce (PCR), která určuje, zda vyšetřovaná bakterie přísluší k Bcc [10]. Pokud ano, pozitivní výsledek PCR je v druhém sledu analýzy podroben buď sekvenaci, metodě RFLP (restriction fragment length polymorphism) nebo setu dalších reakcí PCR, čímž je identifikován druh uvnitř Bcc. Jednotlivé reakce PCR využívají druhově specifických primerů, jež vedou k úspěšné amplifikaci a k pozitivnímu výsledku PCR jen u toho druhu, pro který byly primery navrženy. Tento postup se stal východiskem pro diagnostický algoritmus Bcc v CF centru v Praze-Motole [11].
Identifikace kmenů
Možnosti molekulárně genetických metod nekončí na úrovni identifikace druhů, ale dostávají se až na hranici nejmenších taxonomických jednotek, tedy jednotlivých bakteriálních kmenů, které reprezentují klonální populace totožných bakteriálních buněk.
Důvodem určování kmenů je potřeba definovat charakter infekce ve smyslu její nebezpečnosti vůči okolí, tj. zda se může přenášet z pacienta na pacienta. Pokud nalezneme týž kmen u více pacientů, je vysoce pravděpodobné, že tito nemocní se nakazili vzájemně a že infekce v daném CF centru má epidemický ráz. Klinickou odpovědí je pak zavedení či upřesnění protiepidemických opatření tak, aby bránila dalšímu šíření infekce.
Typizační techniky vedoucí k identifikaci kmenů jsou zatím většinou založené na porovnávání profilů DNA, získaných rozdělením fragmentů bakteriální genomické DNA v elektroforetickém poli. Příkladem takových postupů může být v mikrobiologii velmi obvyklá metoda makrorestrikčního štěpení DNA následovaná elektroforézou v pulzním poli (tzv. PFGE, [12]), PCR metoda náhodné amplifikace polymorfních úseků DNA (tzv. RAPD, [13]) či metoda selektivní amplifikace fragmentů DNA, které byly získány štěpením jedním či dvěma restrikčními enzymy (tzv. AFLP, [14]). Zřejmá nevýhoda všech těchto metod spočívá ve špatné přenosnosti dat mezi laboratořemi i v subjektivním hodnocení podobnosti profilů. Není proto divu, že se v poslední době do popředí dostává nová metoda označovaná jako Multilocus sequence typing (MLST, [8]), která nahrazuje často nejednoznačné odečítání gelových profilů jednoznačným odečítáním nukleotidových sekvencí. Jak název metody prozrazuje, typizace vychází z určení sekvence u více bakteriálních genů (lokusů), jichž je v obvyklém MLST schématu sedm a jež se řadí stejně jako gen recA mezi životně důležité geny. Výsledek sekvenace vybraných sedmi genů je porovnán se sekvenčními profily ostatních kmenů, uloženými ve volně přístupné mezinárodní databázi (pro Bcc je databáze umístěna na stránce http://pubmlst.org/bcc, pro P. aeruginosa na http://pubmlst.org/paeruginosa). Metoda MLST tak elegantním způsobem umožňuje nejen sledovat lokální epidemiologickou situaci v jednom CF centru, ale zároveň mapovat distribuci kmenů v celosvětovém měřítku.
Některé přenosné kmeny je také možné detekovat pomocí PCR testů, jejichž cílovou oblastí jsou úseky DNA specifické pro daný epidemický kmen. U Bcc existují tři takovéto markery přenosnosti: cblA [15], BCESM [16] a inzerční sekvence IS1363 [17]; žádný z markerů ani kombinace všech tří však nesplnily funkci univerzálního epidemického markeru. Jejich absence nevylučuje možnost, že kmen si stále udržuje schopnost šířit se mezi pacienty. Výpovědní hodnota markerů je tak velmi orientační a jejich další užívání je diskutabilní, zvláště ve světle nabídky vysoce informativní metody MLST.
Klinický význam přesné diagnostiky Bcc
Diagnostika Bcc má v péči o nemocné CF dalekosáhlý význam, proto jejímu vyvinutí byla věnována maximální pozornost. Dnes lze díky molekulárně genetickým metodám bez pochybností identifikovat či verifikovat kultivační nález Bcc a stejně tak lze určit jednotlivé druhy v rámci Bcc.
Z celého komplexu se u pacientů s CF nejčastěji nacházejí druhy B. cenocepacia (genomovar III) a B. multivorans (genomovar II), které způsobují 85 až 98 % všech infekcí Bcc ( [18–20], viz též tab. 1). Obě bakterie mohou způsobit těžké infekce, zejména pak B. cenocepacia je asociována se zvýšenou mortalitou [21], a to i po provedené transplantaci plic. Pro tento druh je také nejpříznačnější hrozba epidemického rozsevu infekce, neboť obsahuje nejvíce známých přenosných kmenů (např. kanadský a britský kmen ET12 [22] nebo kmen z východního pobřeží USA označovaný jako PHDC [23]). Přenos mezi pacienty byl však popsán i v případě B. multivorans, B. cepacia (genomovar I) a B. dolosa (genomovar VI) [24].
Jak již bylo uvedeno, počet členů komplexu přibývá. Tento trend je nutné vést v patrnosti, protože nově popisované skupiny obsahují bakteriální kmeny izolované od pacientů s CF se zhoršujícím se klinickým stavem. Prokazatelně tak patří mezi CF patogeny. Za pozornost stojí především skupina K, která díky metodě MLST byla vystopována v mnoha různých zemích včetně České republiky [9] a která může kontaminovat kosmetické či lékařské přípravky (viz např. kontaminace nosního spreje [25]).
Diagnostika infekce Bcc též rozhoduje o zařazení každého pacienta do odpovídající izolační skupiny, které jsou definovány v CF centru na základě mikrobiologického nálezu a jsou od sebe vzájemně separovány (viz tab. 2 jako příklad izolačního systému). Mikrobiologický výsledek je přitom interpretován až na úroveň kmenů a pacienti, kteří nesou kmen z epidemiologického hlediska nebezpečný (tj. kmen přenosný, tzv. epidemický), vytvářejí zcela samostatnou skupinu. Jejich epidemický kmen totiž může způsobit vážnou superinfekci i u těch pacientů, kteří se liší pouze typem kmene, nikoliv bakteriálním druhem [21]. To je důvod, proč část pacientů v rámci infekce druhem B. cenocepacia je vyčleněna a vytváří vlastní izolační skupinu (skupina 3 v tab. 2).
Tab. 2. Přehled izolačních skupin, do nichž jsou pacienti s CF rozděleni v rámci protiepidemického režimu CF centra v Motole. Režim by měl být dynamický a jeho skupiny by vždy měly odpovídat aktuální epidemiologické situaci konkrétního CF centra se zřetelem na epidemiologický charakter kmenů. V případě S. aureus a H. influenzae nebyla typizační analýza kmenů provedena. 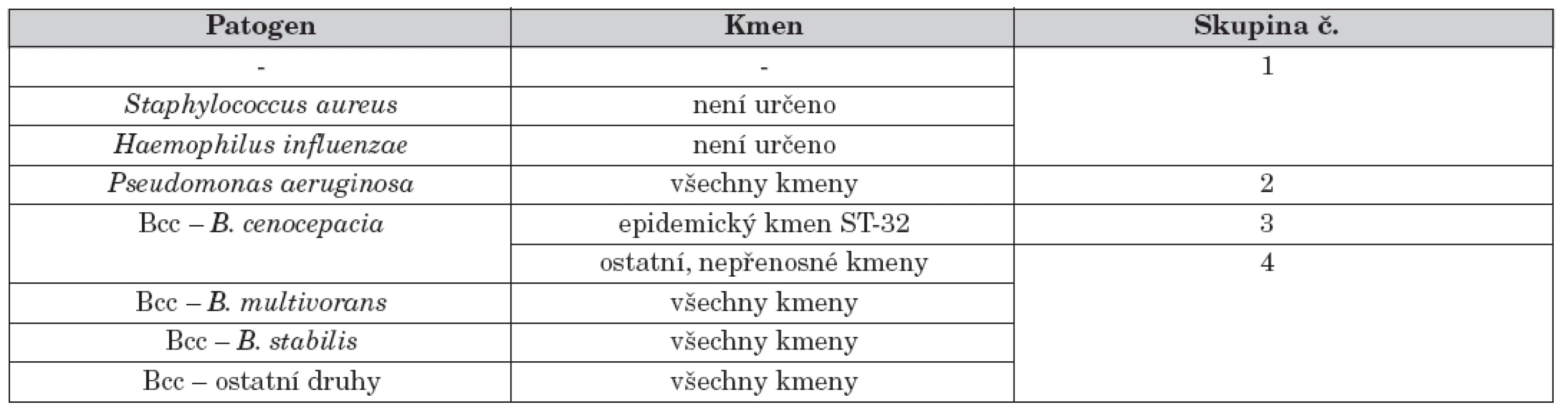
Funkční systém izolace zabezpečuje, že se infekce epidemicky nešíří, protože pacient s přenosným kmenem nepřijde po dobu hospitalizace či ambulantní kontroly vůbec do kontaktu s pacientem, který tento kmen nemá. Pravidla izolace se pochopitelně vztahují i na ostatní CF patogeny, o nichž se z odborné literatury či na základě vlastních zkušeností ví, že se mohou mezi pacienty přenášet.
Účelnost protiepidemického režimu sleduje mikrobiologická laboratoř, která v pravidelných časových intervalech kontroluje výskyt a distribuci epidemických kmenů v místní CF komunitě. Pokud se objeví nový kmen sdílený více pacienty, je takový kmen označen za epidemický a v rámci separačního systému znamená vytvoření nové skupiny pacientů. Revize protiepidemických opatření je nezbytná též v případě nálezu pacienta s novou infekcí Bcc, již vyvolal epidemický kmen, v daném CF centru už dříve identifikovaný. Takový alarmující nález napovídá o pochybení v izolaci pacientů či o celkové nedostatečnosti hygienicko-epidemiologických pravidel.
Výsledky nové mikrobiologické diagnostiky v CF centru v Motole
Komplex B. cepacia
Mikrobiologická diagnostika v motolském CF centru doznala v posledních patnácti letech podstatných změn, bez nichž si dnes nelze péči o nemocné představit. Prvním krokem vedoucím ke zkvalitnění záchytu Bcc bylo rozšíření kultivačních půd o selektivní agary [26]. Po jejich zavedení vyšla najevo šokující skutečnost, že přibližně třetina nemocných má infekci Bcc. Proto začala být v roce 1999 uplatňována první forma separace nemocných, jež rozlišovala dvě mikrobiologické skupiny: s infekcí Bcc a bez infekce Bcc.
Molekulárně genetická diagnostika Bcc, kterou jsme začali používat v roce 2001, přinesla možnost rozlišení bakterií na sedm základních druhů (tehdy ještě běžně označovaných genomovarovým číslem I až VII). Nález převažujícího genomovaru III (B. cenocepacia) vedl k podezření na přítomnost epidemického kmene, jehož existence se následně potvrdila typizačními metodami PFGE a RAPD [27]. Ačkoliv byl kmen podle místa záchytu původně označen CZ1, nejedná se o žádné české specifikum. Stejný kmen byl již dříve popsán v Kanadě jakožto RAPD typ 01 [20] a MLST analýza, která mu přisvojila označení ST-32, nedávno prokázala jeho globální výskyt (A. Baldwin, nepublikovaná data).
Kmen ST-32 má v české CF populaci velmi dominantní postavení (viz graf 1), a tak zdokonalený separační systém pacientů ve shodě s tabulkou 2 nepředstavoval žádné výrazné změny v praxi. Většina Bcc pozitivních pacientů zůstala ve stejné skupině, nyní však definované na základě infekce epidemickým kmenem ST-32 druhu B. cenocepacia. Nepatrně upravený protiepidemický režim přesto vedl ke snížení incidence infekce Bcc, a to navzdory její přetrvávající vysoké prevalenci, která přináší extrémní riziko nákazy. Z analýzy incidence v dospělé části motolského CF centra vyplývá, že počet nových případů se snížil na méně než polovinu z 5,5/100 „osobo-roků“ v letech 1993–1999 na 2,2/100 „osobo-roků“ v letech 2000–2006 (L. Fila, nepublikovaná data).
Graf 1. Charakter infekce Bcc u českých pacientů s CF. Zhruba 30 % všech CF pacientů je infikovaných bakteriemi komplexu B. cepacia (Bcc), z nichž většinu infekcí tvoří druh B. cenocepacia, respektive jeho kmen ST-32. Graf tak ukazuje vysoký stupeň uniformity bakteriální populace, která je charakterizována silnou dominancí jednoho druhu (B. cenocepacia) a jednoho kmene (ST-32). 
Vysvětlení, proč pozorujeme nižší incidenci, se pravděpodobně skrývá ve větší ostražitosti personálu i pacientů CF centra, kteří velice dbají na dodržování zásad separace. Svůj podíl bezesporu hraje i nová diagnostika Bcc založená na PCR, která je citlivější než kultivace. Infekce se tak diagnostikuje dříve a pacient je dříve izolován.
Bohužel nemůžeme očekávat, že incidence někdy v budoucnu klesne na absolutní nulu, jelikož separační systém dokáže zabránit pouze nákaze epidemickým kmenem. Nijak neovlivňuje riziko získání infekce z venkovního prostředí, v němž se bakterie Bcc přirozeně vyskytují (většinou jako kmeny, které nemají schopnost šířit se mezi pacienty). Nebezpečí získání infekce tak přetrvává, ačkoli riziko plynoucí „zvenčí“ je nepoměrně menší než riziko, které kdysi představoval volně se šířící epidemický kmen.
P. aeruginosa
P. aeruginosa hrozí rozsevem infekce mezi pacienty obdobně jako Bcc, i když výsledky epidemiologických šetření po světě nasvědčují tomu, že ne vždy se bakterie v CF komunitě šíří. Zatímco centra v Liverpoolu [28] či Melbourne [29] identifikovala epidemické kmeny, jinde pátrání po přenosném kmeni skončilo s negativním výsledkem [30]. Vzhledem k obecně vysoké prevalenci, která bez ohledu na přítomnost či absenci epidemického kmene dosahuje v dospělém věku hodnot až 80 % [31], se za primární zdroj infekce považuje zevní prostředí, v němž je P. aeruginosa běžně přítomna stejně jako Bcc.
Motolské CF centrum preventivně zavedlo separaci pacientů pozitivních na P. aeruginosa už v době, kdy ještě skutečná epidemiologická situace centra nebyla známa. Dodatečná analýza kmenů pomocí metod PFGE a AFLP pak prokázala, že v našich podmínkách epidemický kmen přítomen není [32]. V rámci izolačního systému tak zůstává pouze jedna souborná skupina pacientů s infekcí P. aeruginosa, u které je bezpředmětné další dělení na podskupiny podle kmene či kmenů, jako tomu je v případě Bcc.
Čistě teoreticky je možné uvažovat o úplném zrušení separace P. aeruginosa od ostatních non-Bcc patogenů a od nekolonizovaných pacientů (tj. spojení skupin 1 a 2 v tab. 2). Jednoznačný důkaz, který by prokázal nemožnost přenosu bakterie ze skupiny 2 na skupinu 1, ovšem stále chybí. I když v této chvíli není epidemický kmen v rámci skupiny 2 identifikován, stále je nutné brát v potaz variantu, že některý z kmenů je schopen přenosu, pokud k tomu dostane příležitost (například právě zmírněním pravidel izolace). Z bezpečnostních důvodů je tedy vhodné udržet historicky zavedenou skupinu pacientů s P. aeruginosa nadále jako samostatnou izolační jednotku, dokud to prostorové a personální možnosti centra dovolují. Debatu ve stejném duchu lze vést též nad adekvátností existence skupiny 4, kterou tvoří pacienti s předpokládaným nepřenosným kmenem Bcc. Po nedávných zkušenostech s masivní explozí infekce Bcc si lze však jen těžko představit sloučení jakýchkoli pacientů infikovaných Bcc s pacienty bez této infekce. Skupina 4 tak slouží jako druhá pojistka, která chrání CF pacienty před obávaným vznikem nové epidemie Bcc.
Závěr
Infekce dýchacích cest patogeny typickými pro CF zásadním způsobem ovlivňuje prognózu pacientů. Antiinfekční léčba by proto měla být razantní a měla by být zahájena v co nejčasnější fázi, kdy se ještě nevyvinula chronická infekce. Mikrobiologie tak v péči o pacienty s CF sehrává nepostradatelnou roli, jež spočívá v časné a přesné diagnostice všech patogenů, které přicházejí u této nemoci do úvahy. Další dimenzí mikrobiologického vyšetření se stává epidemiologická analýza, která hledá přenosné kmeny a sleduje jejich pohyb v populaci.
Zdaleka nejvíce problémů v identifikaci i managementu infekce přináší skupina bakteriálních druhů sdružených pod název komplex B. cepacia. Pro jejich určení jsou nezbytné molekulárně genetické metody, které při nálezu Bcc v CF centru téměř s jistotou odhalí také přítomnost přenosného kmene. Pacienty s takovým kmenem je nutné držet v přísné izolaci od ostatních neinfikovaných pacientů, aby se infekce v centru dále nešířila.
Obavy z přítomnosti epidemického kmene se v pražském CF centru naplnily, když byl molekulárně genetickými technikami potvrzen nadprůměrný počet pacientů s Bcc. Za toto vysoké číslo zodpovídá kmen ST-32 druhu B. cenocepacia, který se zřejmě rozšířil mezi pacienty ještě v době před zavedením separačního režimu. Nyní je kmen pečlivě hlídán a držen pod kontrolou, jak dokládá klesající incidence infekce.
Opačná epidemiologická situace je na poli infekce bakterií P. aeruginosa, kde epidemický kmen popsán nebyl. Riziko jejího přenosu tak na základě dostupné studie [32] nelze označit za zvýšené.
Sestavení izolačních skupin pacientů v rámci hygienicko-epidemiologických opatření vychází z historického třídění, nyní doplněného o výsledky typizace. Ty do celého systému přinášejí nezbytnou informaci potřebnou pro efektivní separaci a zároveň vyžadují jeho maximální flexibilitu v případě detekce nového podezřelého kmene. Současný režim CF centra v Motole rozlišuje čtyři skupiny pacientů, do nichž se promítá jak druh patogenu, tak i typ kmene.
Moderní mikrobiologické metody bezesporu usnadňují péči o nemocné CF díky nabídce rychlejší, citlivější a přesnější detekce patogenů. Na druhou stranu ale péči ztěžují často nelehkou organizací hygienicko-epidemiologického režimu. Nicméně jde o jedinou možnost, jak zlepšit prognózu našich pacientů, neboť prevence infekce zůstává spolu s časnou eradikační léčbou tím nejúčinnějším opatřením.
Uvedené výsledky byly získány za finanční podpory výzkumným záměrem MŠMT MSM 0021620812.
MUDr. Pavel Dřevínek, Ph.D.
Cardiff School of Biosciences
Main Building, Park Place
PO Box 915, Cardiff University
Cardiff, Wales, UK
CF10 3TL
e-mail: drevinekp@cardiff.ac.uk
Zdroje
1. Aaron SD. Pseudomonas aeruginosa and cystic fibrosis – a nasty bug gets nastier. Respiration 2006;73 : 16–17.
2. Vandamme P, Govan J, LiPuma JJ. Diversity and role of Burkholderia spp. In Coenye T, Vandamme P. Burkholderia: Molecular Microbiology and Genomics. Norfolk, UK: Horizon Bioscience, 2007 : 1–28.
3. Govan JR, Brown AR, Jones AM. Evolving epidemiology of Pseudomonas aeruginosa and the Burkholderia cepacia complex in cystic fibrosis lung infection. Future Microbiol. 2007;2 : 153–164.
4. Pseudomonas aeruginosa infection in people with cystic fibrosis. The UK Cystic Fibrosis Trust Infection Control Group Report. Cystic Fibrosis Trust, 2004.
5. The Burkholderia cepacia complex. The UK Cystic Fibrosis Trust Infection Control Group Report. Cystic Fibrosis Trust, 2004.
6. Sibley CD, Rabin H, Surette MG. Cystic fibrosis: a polymicrobial infectious disease. Future Microbiol. 2006;1 : 53–61.
7. McMenamin JD, Zaccone TM, Coenye T, et al. Misidentification of Burkholderia cepacia in US cystic fibrosis treatment centers: an analysis of 1,051 recent sputum isolates. Chest 2000;117 : 1661–1665.
8. Baldwin A, Mahenthiralingam E, Thickett KM, et al. Multilocus sequence typing scheme that provides both species and strain differentiation for the Burkholderia cepacia complex. J. Clin. Microbiol. 2005;43 : 4665–4673.
9. Mahenthiralingam E, Baldwin A, Drevinek P, et al. Multilocus sequence typing breathes life into a microbial metagenome. PLoS ONE 2006;1: e17.
10. Mahenthiralingam E, Bischof J, Byrne SK, et al. DNA-based diagnostic approaches for identification of Burkholderia cepacia complex, Burkholderia vietnamiensis, Burkholderia multivorans, Burkholderia stabilis, and Burkholderia cepacia genomovars I and III. J. Clin. Microbiol. 2000;38 : 3165–3173.
11. Drevinek P, Hrbackova H, Cinek O, et al. Direct PCR Detection of Burkholderia cepacia complex and identification of its genomovars by using sputum as source of DNA. J. Clin. Microbiol. 2002;40 : 3485–3488.
12. Tenover FC, Arbeit RD, Goering RV, et al. Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophoresis: criteria for bacterial strain typing. J. Clin. Microbiol. 1995;33 : 2233–2239.
13. Mahenthiralingam E, Campbell ME, Henry DA, et al. Epidemiology of Burkholderia cepacia infection in patients with cystic fibrosis: analysis by randomly amplified polymorphic DNA fingerprinting. J. Clin. Microbiol. 1996;34 : 2914–2920.
14. Nemec A, De Baere T, Tjernberg I, et al. Acinetobacter ursingii sp. nov. and Acinetobacter schindleri sp. nov., isolated from human clinical specimens. Int. J. Syst. Evol. Microbiol. 2001;51 : 1891–1899.
15. Sajjan US, Sun L, Goldstein R, et al. Cable (cbl) type II pili of cystic fibrosis-associated Burkholderia (Pseudomonas) cepacia: nucleotide sequence of the cblA major subunit pilin gene and novel morphology of the assembled appendage fibers. J. Bacteriol. 1995;177 : 1030–1038.
16. Mahenthiralingam E, Simpson DA, Speert DP. Identification and characterization of a novel DNA marker associated with epidemic Burkholderia cepacia strains recovered from patients with cystic fibrosis. J. Clin. Microbiol. 1997;35 : 808–816.
17. Liu L, Spilker T, Coenye T, et al. Identification by subtractive hybridization of a novel insertion element specific for two widespread Burkholderia cepacia genomovar III strains. J. Clin. Microbiol. 2003;41 : 2471–2476.
18. Brisse S, Cordevant C, Vandamme P, et al. Species distribution and ribotype diversity of Burkholderia cepacia complex isolates from French patients with cystic fibrosis. J. Clin. Microbiol. 2004;42 : 4824–4827.
19. LiPuma JJ, Spilker T, Gill LH, et al. Disproportionate distribution of Burkholderia cepacia complex species and transmissibility markers in cystic fibrosis. Am. J. Respir. Crit. Care Med. 2001;164 : 92–96.
20. Speert DP, Henry D, Vandamme P, et al. Epidemiology of Burkholderia cepacia complex in patients with cystic fibrosis, Canada. Emerg. Infect. Dis. 2002;8 : 181–187.
21. Mahenthiralingam E, Vandamme P, Campbell ME, et al. Infection with Burkholderia cepacia complex genomovars in patients with cystic fibrosis: virulent transmissible strains of genomovar III can replace Burkholderia multivorans. Clin. Infect. Dis. 2001;33 : 1469–1475.
22. Sun L, Jiang RZ, Steinbach S, et al. The emergence of a highly transmissible lineage of cbl+ Pseudomonas (Burkholderia) cepacia causing CF centre epidemics in North America and Britain. Nat. Med. 1995;1 : 661–666.
23. Chen JS, Witzmann KA, Spilker T, et al. Endemicity and inter-city spread of Burkholderia cepacia genomovar III in cystic fibrosis. J. Pediatr. 2001;139 : 643–649.
24. Biddick R, Spilker T, Martin A, et al. Evidence of transmission of Burkholderia cepacia, Burkholderia multivorans and Burkholderia dolosa among persons with cystic fibrosis. FEMS Microbiol. Lett. 2003;228 : 57–62.
25. Notice to readers: manufacturer’s recall of nasal spray contaminated with Burkholderia cepacia complex. Centers for disease control and prevention 2004 http://www.cdc.gov/mmwr/preview/mmwrhtml/mm5311a8.htm.
26. van Pelt C, Verduin CM, Goessens WH, et al. Identification of Burkholderia spp. in the clinical microbiology laboratory: comparison of conventional and molecular methods. J. Clin. Microbiol. 1999;37 : 2158–2164.
27. Drevinek P, Vosahlikova S, Cinek O, et al. Widespread clone of Burkholderia cenocepacia in cystic fibrosis patients in the Czech Republic. J. Med. Microbiol. 2005;54 : 655–659.
28. Cheng K, Smyth RL, Govan JR, et al. Spread of beta-lactam-resistant Pseudomonas aeruginosa in a cystic fibrosis clinic. Lancet 1996;348 : 639–642.
29. Armstrong DS, Nixon GM, Carzino R, et al. Detection of a widespread clone of Pseudomonas aeruginosa in a pediatric cystic fibrosis clinic. Am. J. Respir. Crit. Care Med. 2002;166 : 983–987.
30. Speert DP, Campbell ME, Henry DA, et al. Epidemiology of Pseudomonas aeruginosa in cystic fibrosis in British Columbia, Canada. Am. J. Respir. Crit. Care Med. 2002;166 : 988–993.
31. Cystic Fibrosis Foundation: Patient Registry Annual Data Report 2005. Cystic Fibrosis Foundation, 2005.
32. Vosahlikova S, Drevinek P, Cinek O, et al. High genotypic diversity of Pseudomonas aeruginosa strains isolated from patients with cystic fibrosis in the Czech Republic. Res. Microbiol. 2007;158 : 324–329.
33. Drevinek P, Cinek O, Melter J, et al. Genomovar distribution of the Burkholderia cepacia complex differs significantly between Czech and Slovak patients with cystic fibrosis. J. Med. Microbiol. 2003;52 : 603–604.
34. Vandamme P, Holmes B, Vancanneyt M, et al. Occurrence of multiple genomovars of Burkholderia cepacia in cystic fibrosis patients and proposal of Burkholderia multivorans sp. nov. Int. J. Syst. Bacteriol. 1997;47 : 1188–1200.
35. Vandamme P, Holmes B, Coenye T, et al. Burkholderia cenocepacia sp. nov. –a new twist to an old story. Res. Microbiol. 2003;154 : 91–96.
36. Vandamme P, Mahenthiralingam E, Holmes B, et al. Identification and population structure of Burkholderia stabilis sp. nov. (formerly Burkholderia cepacia genomovar IV). J. Clin. Microbiol. 2000;38 : 1042–1047.
37. Vermis K, Coenye T, LiPuma JJ, et al. Proposal to accommodate Burkholderia cepacia genomovar VI as Burkholderia dolosa sp. nov. Int. J. Syst. Evol. Microbiol. 2004;54 : 689–691.
38. Coenye T, Mahenthiralingam E, Henry D, et al. Burkholderia ambifaria sp. nov., a novel member of the Burkholderia cepacia complex including biocontrol and cystic fibrosis-related isolates. Int. J. Syst. Evol. Microbiol. 2001;51 : 1481–1490.
39. Vandamme P, Henry D, Coenye T, et al. Burkholderia anthina sp. nov. and Burkholderia pyrrocinia, two additional Burkholderia cepacia complex bacteria, may confound results of new molecular diagnostic tools. FEMS Immunol. Med. Microbiol. 2002;33 : 143–149.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2008 Číslo 2- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Gastroezofageální reflux a gastroezofageální refluxní onemocnění u kojenců a batolat
- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Léčba bolesti a horečky u dětí
-
Všetky články tohto čísla
- Současné mezinárodní projekty v oblasti diagnostiky a léčby cystické fibrózy: zapojení odborníků z České republiky do jejich řešení
- Doc. Věra Vávrová a historie cystické fibrózy v České republice
- Současné metodické postupy a přehled preimplantační, prenatální a postnatální DNA diagnostiky cystické fibrózy v České republice
- Moderní management cystické fibrózy a jeho vliv na zdravotní stav a přežívání českých nemocných
- Role moderní mikrobiologické diagnostiky v péči o pacienty s cystickou fibrózou
- Diabetes mellitus vázaný na cystickou fibrózu: diagnostika a terapie
- Novorozenecký screening v České republice a v Evropě
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Novorozenecký screening v České republice a v Evropě
- Současné metodické postupy a přehled preimplantační, prenatální a postnatální DNA diagnostiky cystické fibrózy v České republice
- Doc. Věra Vávrová a historie cystické fibrózy v České republice
- Diabetes mellitus vázaný na cystickou fibrózu: diagnostika a terapie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



