-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Preimplantační genetická diagnostika monogenně podmíněných chorob – její možnosti, úskalí a první úspěchy v České republice
Preimplantation Genetic Diagnostics of Monogenic-based Diseases: Possibilities, Pitfalls and First Accomplishments in the Czech Republic
Preimplantation genetic diagnosis (PGD) has become the standard part of reproductive genetics. PGD enables transfer of mutation free embryos and precedes prenatal diagnosis and termination of affected pregnancies.
The introduction of advanced techniques of molecular genetics into clinical practice has broadened spectrum of cases solvable by PGD: in addition to chromosomal aberrations diagnosed by fluorescent in situ hybridization (FISH), precise diagnosis of a wide range of monogenic disorders has become available as well.
Authors are reporting on the first successful PGD for cystic fibrosis carried out at their centre in 2007. Highly polymorphic intragenic and extragenic short tandem repeat markers were used for preimplantation genetic haplotype analysis of CFTR gene in combination with direct analysis of F508del deletion by fragment analysis.Key words:
monogenic diseases, PGD, PGH, multiplex PCR, whole genome amplification
Autoři: M. Putzová; L. Pecnová; J. Hulvert; L. Vykysalá; M. Landfeld; K. Míka; P. Potužníková; M. Brandejská; D. Stejskal
Působiště autorů: Centrum lékařské genetiky a reprodukční medicíny GENNET, Praha vedoucí MUDr. D. Stejskal
Vyšlo v časopise: Čes-slov Pediat 2008; 63 (11): 626-633.
Kategorie: Přehledový článek
Souhrn
Preimplantační genetická diagnostika (PGD) se stala standardní součástí spektra metod reprodukční genetiky. PGD umožňuje výběr a transfer zdravých embryí, předchází prenatální diagnostiku v I. či II. trimestru a tím i nutnost přerušení již probíhajícího patologického těhotenství. Zavedením vyspělých metod molekulární genetiky do klinické praxe se značně rozšířilo spektrum případů řešitelných pomocí PGD: kromě zavedené cytogenetické diagnostiky chromozomálních aberací pomocí fluorescenční hybridizace in situ (FISH) lze rovněž diagnostikovat širokou škálu monogenních onemocnění. I navzdory limitacím a potenciálním rizikům představuje PGD pro mnoho párů s rizikem genetického postižení potomstva přijatelné řešení.
Autoři referují o první úspěšné PGD cystické fibrózy v jejich centru v roku 2007, při které byla použita kombinace nepřímé haplotypové analýzy s přímým průkazem etiologické mutace F508del.Klíčová slova:
monogenní choroby, PGD, PGH, multiplexní PCR, celogenomová amplifikaceÚvod
Preimplantační genetická diagnostika (PGD), založená na analýze a vyloučení genetických abnormalit u embryí před jejich implantací, se stala standardní součástí spektra metod reprodukční genetiky. První případ PGD byl popsán před osmnácti lety a cílem byl výběr embryí ženského pohlaví ve snaze předejít onemocnění vázanému na pohlaví [1].
PGD můžeme považovat za časnou formu prenatální diagnostiky. Transfer a implantace embryí bez hledané mutace předchází klasickou prenatální diagnostiku v I. nebo II. trimestru. In vitro eliminace postižených embryí může být považována za přijatelnější než ukončení již probíhajícího těhotenství na základě výsledků prenatální diagnostiky nejdříve na konci prvního trimestru gravidity. To platí hlavně v případech chorob manifestujících se v pozdějším věku bez morfologické vrozené vady a primárního mentálního deficitu (např. hereditární senzoricko-motorické neuropatie, Huntingtonova choroba, Marfanův syndrom, oční vady nebo dědičné dispozice k neoplaziím).
V současné době existují dva základní metodické přístupy PGD: cytogenetický, využívající metodu fluorescenční hybridizace in situ (FISH), která umožňuje odhalit chromozomální (genomové) aberace, a molekulárně genetický, uplatňující se v diagnostice monogenních (genových) onemocnění.
PGD je nejčastěji indikována:
- při významném riziku postižení známým genetickým onemocněním s mendelovskou dědičností;
- při riziku přenosu chromozomálních abnormalit – recipročních a Robertsonských translokací, inverzí, delecí a inzercí;
- jako prevence chromozomálních anomálií u embryí žen vyššího věku;
- u párů s opakovaným selháním implantace embryí po absolvování cyklů s fertilizací in vitro;
- u párů s opakovanými potraty nejasné etiologie.
V dalším textu se zaměříme výhradně na diagnostiku monogenních onemocnění. Dosud bylo publikováno úspěšné provedení PGD u více než padesáti monogenních chorob s různým typem dědičnosti:
- autozomálně recesivní, jako je např. cystická fibróza a β-talasemie,
- autozomálně dominantní, jako např. Huntingtonova chorea a myotonická dystrofie a
- u X-vázaných onemocnění, jako je např. Duchennova muskulární dystrofie a hemofilie A (čerpáno z dat ESHRE, sbírka V (tab. 1) [2].
Tab. 1. Klinická aplikace PGD monogenních onemocnění – rok 2003 (aktuální data podle ESHRE) [2]. ![Klinická aplikace PGD monogenních onemocnění – rok 2003 (aktuální data podle ESHRE) [2].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/c7090e44923a815d72a609acd0cefbff.png)
Preimplantační diagnostikou lze prokázat většinu etiologických mutací a tak se seznam publikovaných chorob, u kterých byla PGD úspěšně provedena, stále rozšiřuje.
Technologie
Podmínkou PGD je podstoupení fertilizace in vitro (IVF). Techniky IVF jsou aplikovány při této indikaci u plodných párů s cílem získat embrya, ze kterých je biopsií možné odebrat 1–2 buňky třetí den po fertilizaci. Tento způsob je nejvíce používanou technikou pro získání materiálu k PGD. Optimálně by mělo být pro PGD k dispozici alespoň 5 embryí s optimistickou prognózou třetí den po fertilizaci.
Další možností je biopsie většího počtu (5–10) buněk vyhřezlého trofektodermu blastocyst pátý či šestý den po oplození. Tento postup je používán méně často kvůli úskalím spojeným s prodlouženou kultivací lidských embryí in vitro a faktu, že výsledek PGD musí být v tomto případě vydán již v den provedení biopsie.
Legislativní předpisy některých zemí nedovolují testování embryí, a proto jsou vyšetřována polární tělíska oocytu. Testováním polárních tělísek je možné analyzovat vylučovací metodou (= mutace přítomná v tělísku pravděpodobně není přítomna v embryu a opačně) pouze maternální mutace.
V minulosti byly při PGD monogenních onemocnění aplikovány metody přímé diagnostiky etiologických mutací pomocí neznačených primerů a gelové elektroforézy. V některých případech byla detekována místa štěpení pomocí restrikčních enzymů (např. u spinální muskulární atrofie SMA) [3], v jiných případech byla použita analýza heteroduplexů (např. průkaz mutace F508del v CFTR genu).
Technickým průlomem bylo zavedení multiplexní fluorescenční polymerázové řetězové reakce (PCR) v návaznosti na celogenomovou amplifikaci (WGA) umožňující namnožení DNA celého genomu z materiálu jediné buňky [4, 5]. S technikou fluorescenční PCR se otevřely možnosti semiautomatické analýzy pomocí kapilární elektroforézy a multiplexování (spojování) různých párů primerů do jediné reakce [6].
Při PGD monogenně podmíněných chorob se většinou používá metod kombinujících přímý průkaz etiologické mutace s nepřímým průkazem sousedících polymorfních DNA sekvencí (markerů). Etiologická mutace charakterizovaná sekvencí (sledem bází) a okolní markery charakterizované délkou (počtem bází) tvoří ve sledované oblasti chromozomu (lokusu) relativně stabilní, charakteristický tzv. haplotyp, který si můžeme představit jako čárový kód. Vlastní PGD předchází haplotypová studie u žijících členů rodiny – buď klinicky postižených, nebo zdravých nosičů etiologické mutace. Optimálním výsledkem haplotypové studie je rozlišení rizikových (s mutací) a nerizikových „čárových kódů“ odpovídajících lokusům na chromozomech rodičů vyšetřovaného embrya. Vizualizaci haplotypu po namnožení specifických sekvencí pomocí PCR umožňuje gelová nebo kapilární elektroforéza. Touto metodikou, která se označuje PGH – preimplantační genetická haplotypizace (obr. 1 a 2), byla doplněna či zcela nahrazena přímá mutační analýza.
Obr. 1. Metodický postup molekulárně genetické PGH: (A) Biopsií je z embrya 72 hodin po fertilizaci odebrána buňka a přenesena do lyzačního roztoku. (B) Genom jediné buňky je uvolněn z jádra a (C) mnohonásobně namnožen v procesu celogenomové amplifikace. (D) Produkty celogenomové amplifikace jsou následně podrobeny multiplexní fluorescenční PCR reakci, kde se specificky amplifikují sekvence markerů ve vazbě k vyšetřovanému genu. (E) Fragmentační analýzou pomocí kapilární elektroforézy je určen genotyp vyšetřovaného embrya. 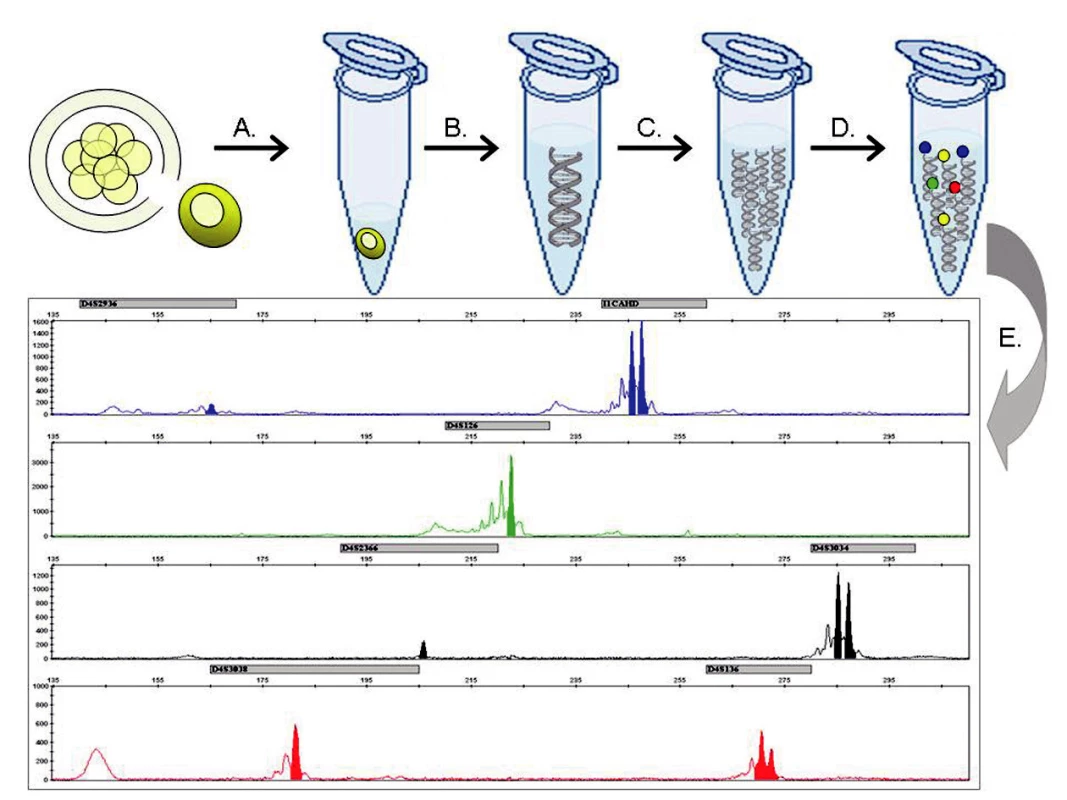
Obr. 2. Preimplantační genetická haplotypizace (PGH): (A) Princip nepřímé diagnostiky pro účely PGH spočívá v testování markerů, které jsou ve vazbě s vyšetřovaným genem – v tomto případě CFTR. Tímto způsobem lze odlišit tzv. patologický (nesoucí mutaci) a zdravý haplotyp. (B) Stanovení možných genotypů embryí na modelu autozomálně recesivně dedičné nemoci (cystická fibróza): patologický (P) a zdravý (N) haplotyp je vazební analýzou předem určen u obou rodičů, což umožňuje odvodit možné genotypy embryí páru; v případě autozomálně recesivně dědičné nemoci je k dispozici 75 % embryí pro transfer. 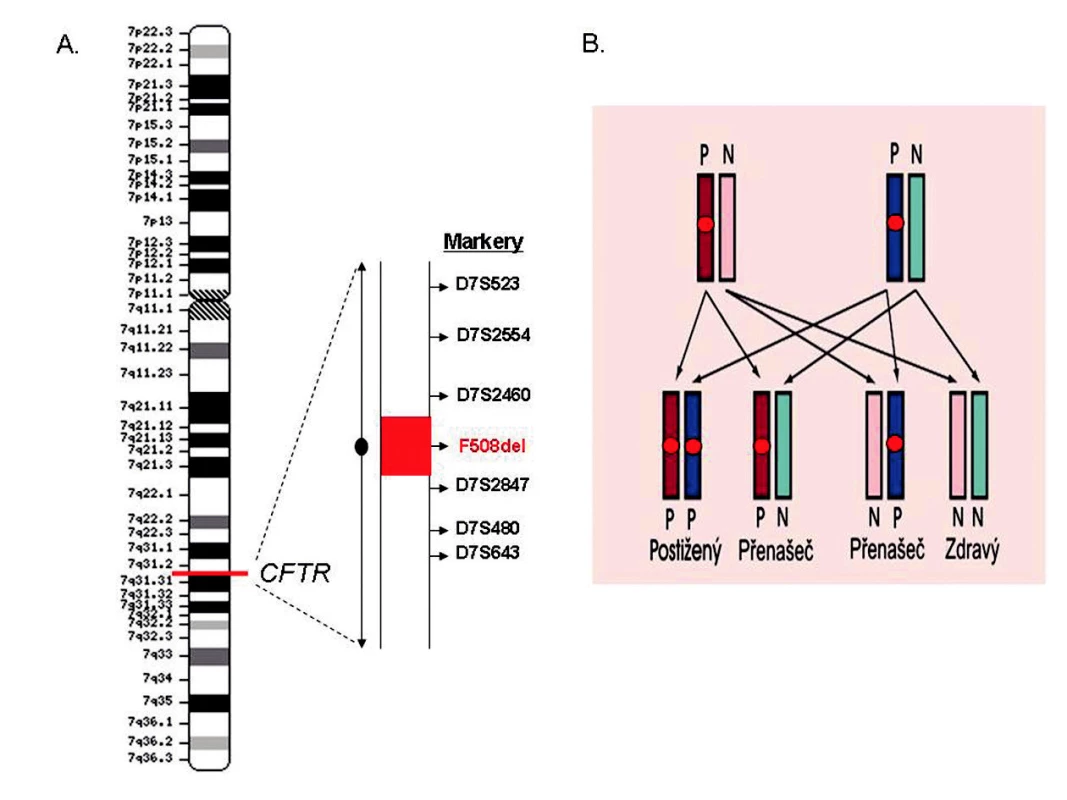
Vyšetřováním více markerů příslušejících k určitému haplotypu v rámci preimplantační genetické haplotypizace (PGH) se zvýšila přesnost analýzy jednak kontrolou kontaminace cizí DNA a jednak možností identifikace jevu zvaného alelický drop-out (ADO). ADO je výsledkem selhání PCR v některých oblastech DNA (alelách), který vzniká v důsledku malého množství vstupní DNA z jediné blastoméry.
V případě kontaminace cizí DNA se v očekávaném haplotypovém „čárovém kódu“ embrya objevují nové pruhy. V případě, že při analýze dojde k ADO (a dochází k němu při analýze z jediné buňky až ve 30 % PCR reakcí), je možno „čárový kód“ rekonstruovat s velkou jistotou, i když některý z pruhů chybí.
Monitorováním kontaminace a ADO lze významně snížit riziko chybné diagnózy na pouhé 1 % a metoda PGH je doporučena pokyny pro správnou laboratorní praxi [7, 8].
Nepřímá DNA diagnostika je vhodná pro onemocnění, jako je např. cystická fibróza [9], kde je v současné době kromě nejčastější mutace F508del známo dalších více než 1000 kauzálních mutací, často přítomných jen v jediné rodině [10]. Nepřímou vazebnou analýzu je možné nabídnout kterékoliv rodině, která je informativní v dostatečném počtu vazebných markerů. Informativní marker je ten, který umožní odlišit chromozom nesoucí gen postižený mutací od chromozomu, který nese zdravý gen. Limitujícím faktorem je počet markerů, které mohou být úspěšně amplifikovány na DNA získané z jediné buňky. Je proto nutné mít k dispozici několik variant vazebných markerů tak, aby v konkrétním případě bylo možné aplikovat multiplexy těch markerů, které jsou vysoce informativní v konkrétní diagnostikované rodině.
Recesivní choroby vázané na pohlaví (X-vázané)
PGD recesivních chorob vázaných na pohlaví může být v laboratořích některých IVF center limitována na selekci (sexing) ženských embryí s nízkým rizikem manifestace bez ohledu na nosičství mutace. Při sexingu jsou ale vyřazena všechna embrya mužského pohlaví s rizikem postižení „pouze“ 50 %.
Tento postup zároveň snižuje šanci úspěšného otěhotnění, protože je sníženo množství embryí vhodných k transferu. Proto by měl být sexing používán jen jako nouzová technika. Metodou volby je v případě X-vázaných chorob PGH umožňující identifikovat zdravá mužská embrya a ženská embrya přenášející postižený gen [11, 12].
Technické podmínky a limitace
PGD konsorciem Společnosti pro reprodukci a embryologii (ESHRE) a výborem mezinárodního sympozia pro preimplantační genetickou diagnostiku (PGDIS) byly vydány pokyny a doporučení pro správnou laboratorní praxi [13, 14]. Ve všech IVF cyklech, kdy je plánována preimplantační genetická diagnostika pomocí PCR technik, je aplikována fertilizace za využití intracytoplazmatické injekce spermie (ICSI). Důvodem je ohrožení zdárné diagnostiky kontaminací otcovskou DNA z nadbytečných spermií, které jsou po běžné IVF přítomné v zóně pelucidě.
Velmi malé množství DNA, kterou je možné získat z jediné buňky, vyžaduje preciznost a současně aplikaci technických inovací, protože standardní testy aplikované na takto malé vstupní množství DNA nefungují spolehlivě. Postupy aplikované na úrovni jediné buňky jsou vystavené snadné kontaminaci cizí DNA a fenoménu ADO. Dalším úskalím ohrožujícím zdárný výsledek diagnostiky je fenomén preferenční amplifikace jedné z alel [7, 13, 15]. Do současné doby bylo popsáno pouze 10 případů selhání preimplantační genetické diagnostiky založené na technice PCR [16]. Většina z nich selhala v důsledku ADO nebo neodhalené kontaminace cizí DNA či cizorodým produktem PCR reakce. PGH řeší tyto problémy výše popsaným způsobem nepřímé diagnostiky a riziko chybné diagnózy v důsledku ADO je při použití PGH zcela eliminováno.
K nepřímému testování pomocí vazebných markerů je nutná dostupnost biologických vzorků od odpovídajících členů rodiny, aby bylo možné určit rizikový chromozom nesoucí gen, v kterém je přítomna kauzální mutace (určení fáze/haplotypu). Z rozličných důvodů nemusí být vzorky vždy dostupné. V některých případech se pár uvažující o PGD nechce z různých osobních důvodů svěřit širší rodině. Někdy může kauzální mutace vzniknout de novo, jak bylo popsáno např. u neurofibromatózy [17]. V případě nedostupnosti relevantních vzorků existuje možnost analýzy fáze paternálních alel pomocí analýzy spermií, v případě maternálních alel pomocí analýzy polárních tělísek. Oba postupy vyžadují analýzu poměrně značného počtu vzorků, v případě zjišťování fáze maternálních alel je nutná hormonální stimulace před samotným zjištěním fáze vyšetřovaného chromozomu [12, 18].
Biologické limitace
Meiotická i mitotická nondisjunkce může vést ke ztrátě či získání nadbytečného chromozomu. Pokud k nondisjunkci dojde v časné fázi dělení buněk embrya, může vést k vzniku buněčných linií s rozdílnou chromozomální výbavou. Mnohé studie prokázaly vysoký stupeň mozaicismu v rýhujících se embryích, biologický význam však zůstává nejistý, protože existuje možnost, že buňky s chromozomální imbalancí budou v průběhu embryonálního vývoje negativně selektovány [19, 20]. Proto v případě, kdy z embrya pro testování odebereme 1–2 buňky, není zcela jisté, že reprezentují většinovou chromozomální konstituci ostatních buněk testovaného embrya. Morfologická kvalita embryí často odráží kvalitu DNA bioptovaných buněk. Problematické či nejasné výsledky jsou proto často získány v případě, kdy jsou embrya morfologicky nekvalitní a mají proto malou šanci implantovat.
Další biologickou limitací PGD je omezený genový pool, z něhož je každá kohorta embryí odvozena. Touto skutečností je proto velice omezená pravděpodobnost, že při testování dvou a více genů zároveň (např. při současném testování HLA a monogenní choroby) bude dostatek vhodných embryí k transferu. Z tohoto důvodu je představa, že se tzv. „děti na přání“ s požadovanými vlastnostmi stanou v budoucnu realitou, vysoce nepravděpodobná.
Úskalí PGD samozřejmě spočívají i v průběhu vlastního IVF cyklu, který je neoddělitelnou součástí provedení preimplantační diagnostiky. Rizika IVF spočívají především v nepřiměřené odpovědi pacientky na hormonální stimulaci, invazivním odběru oocytů a oplozením metodou ICSI (intracytoplazmatické injekci spermií), která jsou nezbytnou součástí IVF s plánovanou PGD. Rizika byla podrobněji diskutována recentně [21]. Je však nutné podotknout, že vyjmenovaná rizika jsou stejná jako u běžných IVF cyklů prováděných primárně z důvodu léčby neplodnosti.
PGD monogenních chorob v České republice
V České republice je velkou většinou IVF center nabízena preimplantační genetická diagnostika metodami FISH, v mnoha IVF centrech je tato diagnostika omezena na preimplantační genetický screening nejčastějších aneuploidií (PGS). Limitace a kontroverzní diagnostická hodnota tohoto výkonu byly popsány dříve [13, 22]. Velice významná je PGD familiárních translokací, která je prováděna rovněž metodikou FISH. PGD monogenních chorob je pro svou technickou náročnost prováděna pouze v limitovaném počtu IVF center (Sanatorium Helios Brno, Repromeda Brno), odkud však zatím nebylo úspěšné těhotenství po PGD monogenního onemocnění referováno.
Na našem pracovišti byla první preimplantační diagnostika monogenní choroby za použití haplotypizace pomocí vazebných markerů provedena v červenci roku 2007. Těhotná s negativní anamnézou a atypickým výsledkem biochemického screeningu ve II. trimestru (sníženy hCG 0,44 MoM a zvýšeny AFP 2,17 MoM) byla zachycena v 19. týdnu I. gravidity při superkonziliárním ultrazvukovém vyšetření. Ultrazvukovým vyšetřením byla u plodu prokázána hyperechogenita gastrointestinálního traktu (GIT) a následným prenatálním molekulárně genetickým vyšetřením zjištěna mutace F508del v homozygotním stavu. Těhotenství bylo na základě tohoto nálezu na přání pacientky ukončeno. Rodina následně projevila zájem o provedení PGD. Vybrali jsme 13 vysoce polymorfních intragenových a extragenových STR markerů vhodných pro haplotypovou analýzu CFTR genu, které jsme použili v kombinaci s přímým průkazem delece F508del fragmentační analýzou. Vlastní PGD byla provedena na blastomeře, která byla z vyšetřovaného embrya odebrána třetí den po oplození metodou ICSI. PGD byla provedena na produktech celogenomové amplifikace metodou „multiple displacement amplification“ (MDA). IVF cyklus byl zakončen transferem jednoho embrya, u kterého byla prokázána mutace F508del v heterozygotním stavu (obr. 3). V úspěšně probíhajícím těhotenství byl výsledek PGD ověřen pomocí amniocentézy v 17. týdnu těhotenství, což obecně doporučujeme pro všechna těhotenství vzniklá po PGD. Pacientka byla na našem pracovišti pravidelně sledována v průběhu celého těhotenství, zdravé děvčátko se narodilo v termínu, na začátku dubna 2008. Podle našich informací je tento případ první úspěšnou PGD monogenní choroby v ČR. Do současnosti jsme úspěšně provedli PGD daších pěti chorob (Charcot - -Marie-Tooth typu 1A, Huntingtonovy choroby, hemofilie A, myotonické dystrofie typu I, Marfanova syndromu a autozomálně recesivní polycystózy ledvin (ARPKD s mutací v genu PKHD1).
Obr. 3. Příklad CFTR-PGH provedené na našem pracovišti: Oba partneři byli přímou analýzou diagnostikováni jako heterozygoti pro mutaci F508del. Analýza polymorfních markerů plodu z předešlého postiženého těhotenství umožnila určení rodičovských haplotypů, tj. bylo možné jednoznačně určit, který polymorfismus se váže se zdravou a který s postiženou alelou vyšetřovaného genu u daného rodiče. Tyto jednoznačně informativní polymorfismy jsou pak vyhledávány u vyšetřovaných embryí. V rámci preimplantační diagnostiky provedené na našem pracovišti bylo jedno z vyšetřovaných embryí (nesoucí mutaci F508del v heterozygotním stavu) páru určeno jako vhodné k transferu. 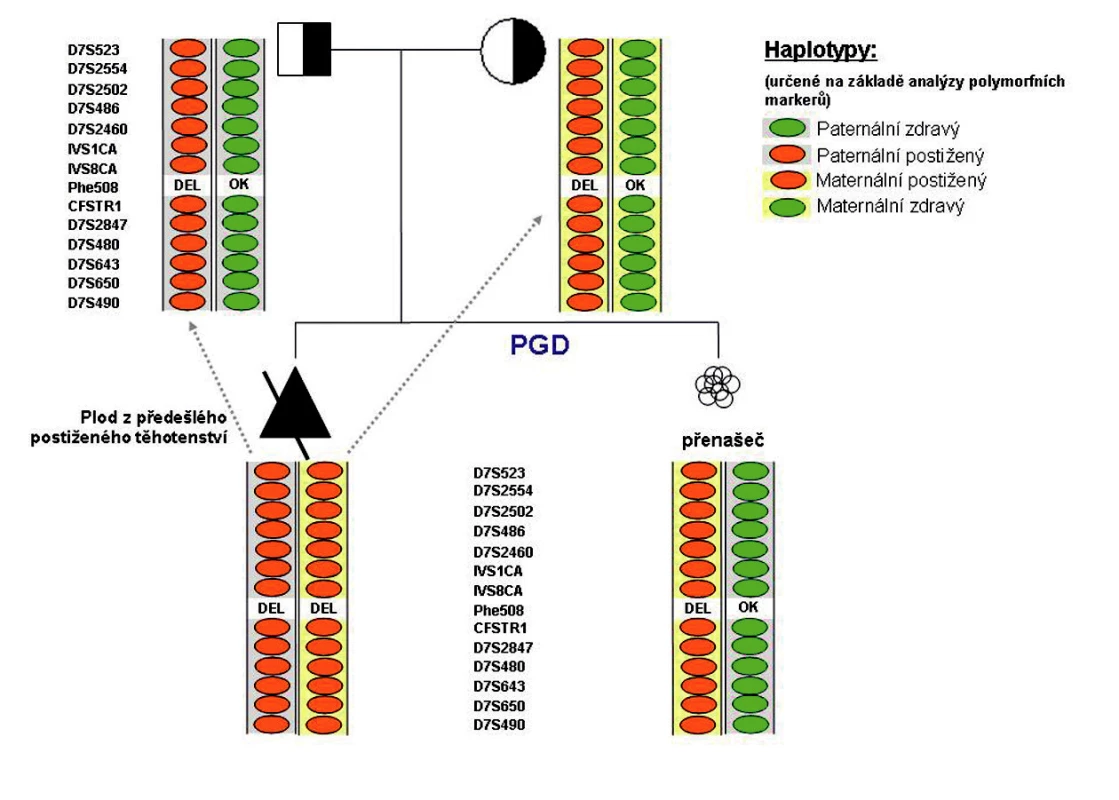
Diagnostika všech bioptovaných buněk, u nichž bylo před přenosem do lyzačního roztoku v buňkách zřetelně patrné jádro, proběhla úspěšně s dostatečným počtem informativních markerů. Další tři PGD cykly byly zakončeny transferem doporučených embryí, ve dvou z těchto případů (hemofílie A a myotonická dystrofie typu I) bylo těhotenství pacientek klinicky potvrzeno. Ve třech případech nebylo k transferu doporučeno žádné z vyšetřených embryí. V současné době jsme ukončili vývoj panelů markerů pro PGD onemocnění, jako je X-vázaná imunodeficience (X-SCID), RhD aloimunizace a syndrom fragilního chromozomu X (FRAXA) a připravujeme vyšetřovací panely pro další onemocnění (Lynchův syndrom).
Legislativa
PGD vyhledává na celém světě velké množství párů, ale aplikace této metody může být v rozporu s legislativou některých států nebo s dosud neustálenými názory na lege artis postupy, což v případě jejich zákazu jen podporuje fenomén tzv. reprodukční turistiky. Legislativní podmínky se v jednotlivých zemích velice liší.
PGD není povolena v zemích jako je Itálie, Rakousko a Švýcarsko, v Německu je zakázána biopsie dělících se embryí a blastocyst. PGD je povolena s určitými regulacemi ve Francii, Španělsku, Holandsku a ve Velké Británii. V USA není PGD nijak regulována.
Závěr
PGD monogenních chorob je sofistikovanou formou časné prenatální diagnostiky, která je na celém světě prováděna pouze ve vysoce specializovaných centrech. Nové technologie, jako je například popisovaná preimplantační genetická haplotypizace pomocí vazebných markerů (PGH), otvírá nové možnosti pro diagnostiku vážných genetických chorob u embryí ve stadiu před jejich implantací. Množství případů, které jsou tímto způsobem celosvětově řešeny, každoročně stoupá. PGD bývá ve velké míře aplikována i v případech, které z etických důvodů nebyly rutinně vyšetřovány prenatálně. Prvním krokem PGD musí být genetická konzultace, kdy je páru vysvětlen postup, možná rizika a úspěšnost PGD a IVF výkonů.
I navzdory jistým limitacím představuje PGD pro mnoho párů možnost mít zdravé dítě a vyhnout se riziku případného ukončení těhotenství z genetických důvodů či narození postiženého potomka.
Došlo: 19. 3. 2008
Přijato: 15. 7. 2008
RNDr. Martina Putzová
Centrum lékařské genetiky a reprodukční medicíny GENNET
Kostelní 7
170 00 Praha 7
e-mail: martina.putzova@gennet.cz
Přednášky:
Putzová M. a kol.: Preimplantační genetická diagnostika monogenních chorob. IPVZ, kurz: Molekulární genetika – možnosti molekulárně genetické diagnostiky a její použití 11/2007.
Putzová M. a kol.: Preimplantační genetická diagnostika monogenních chorob – IX. konference prenatální diagnostiky. Brno 11/2007.
Putzová M. a kol.: Preimplantační diagnostika monogenních chorob – 11. konference DNA diagnostiky 12/2007.
Zdroje
1. Handyside AH, Kontogianni EH, Hardy K, et al. Pregnancies from biopsied human preimplantation embryos sexed by Y-specific DNA amplification. Nature 1990;344(6268): 768–770.
2. Fragouli E. Preimplantation genetic diagnosis: present and future. J. Assist. Repris. Genet. 2007;24 : 201–207.
3. Dreesen JC, Bras M, de Die-Smulders C, et al. Preimplantation genetic diagnosis of spinal muscular atrophy. Mol. Hum. Reprod. 1998;4(9): 881–885.
4. Hawkins TL, Detter JC, Richardson PM. Whole genome amplification: applications and advances. Curr. Opin. Biotechnik. 2002;13 : 65–67.
5. Sun G, Kaushal R, Pal P, et al. Whole-genome amplification: relative efficiencies of the current methods. Leg. Med. (Tokyo) 2005;7 : 279–286.
6. Sherlock J, Cirigliano V, Petrou M, et al. Assessment of diagnostic quantitative fluorescent multiplex polymerase chain reaction assays performed on single cells. Ann. Hum. Genet. 1998;62 : 9–23.
7. Lewis CM, Pinel T, Whittaker JC, et al. Controlling misdiagnosis errors in preimplantation genetic diagnosis: a comprehensive model encompassing extrinsic and intrinsic sources of error. Hum. Reprod. 2001;16(1): 43–50.
8. Abou-Sleiman PM, Apessos A, Harper JC, et al. First application of preimplantation genetic diagnosis to neurofibromatosis types 2 (NF2). Prenat. Diagn. 2002;22(6): 519–524.
9. Goossens V, Sermon K, Lissens W, et al. Improving clinical preimplantation genetic diagnosis for cystic fibrosis by duplex PCR using two polymorphic markers or one polymorphic marker in combination with the detection of the ΔF508 mutation. Mol. Hum. Reprod. 2003;9(9): 559–567.
10. Cystic fibrosis mutations database. www.genet.sickkids. on.ca/cftr
11. Renwick PJ, Trussler J, Ostad-Saffari E, et al. Proof of principle and first cases using preimplantation genetic haplotyping – a paradigm shift for embryo diagnosis. Reprod. Biomed. Online 2006;13(1): 110–119.
12. Verlinsky Y, Rechitsky S, Verlinsky O, et al. Polar body-based preimplantation diagnosis for X-linked disorders. Reprod. Biomed. Online 2002;4(1): 38–42.
13. Thornhill AR, deDie-Smulders CE, Geraedts JP, et al. ESHRE PGD Consortium. Best practice quidelines for clinical preimplantation genetic diagnosis (PGD) and preimplantation genetic screening (PGS). Hum. Reprod. 2005;20(1): 35–48.
14. The Preimplantation Genetic Diagnosis International Society (PGDIS): Guidelines for good practice in PGD. Reprod. Biomed. Online 2004; 9(4), 430–434.
15. Rechitsky S, Kuliev A, Tur-Kaspa I, et al. Preimplantation genetic diagnosis with HLA matching. Reprod. Biomed. Online 2004;9(2): 210–221.
16. Renwick P, Ogilvie CM. Preimplantation genetic diagnosis for monogenic diseases: overview and emerging issues.Expert Rev. Mol. Diagn. 2007;Jan;7(1):33-43.
17. Altarescu G, Brooks B, Kaplan Y, et al. Singlesperm analysis for haplotype construction of de-novo paternal mutations: application to PGD for neurofibromatosis type 1. Hum. Reprod. 2006;21(8): 2047–2051.
18. Spits C, Le Caignec C, De Rycke M, et al. Optimization and evaluation of single-cell whole-genome multiple displacement amplification. Hum. Mutat. 2006;27(5): 496–503.
19. Baart EB, Martini E, van den Berg I, et al. Preimplantation genetic screening reveals a high incidence of aneuploidy and mosaicism in embryos from young women undergoing IVF. Hum. Reprod. 2006;21(1): 223–233.
20. Daphnis DD, Delhanty JD, Jerkovic S, et al. Detailed FISH analysis of day 5 human embryos reveals the mechanisms leading to mosaic aneuploidy. Hum. Reprod. 2005;20(1): 129–137.
21. Balaščaková M, Piskáčková T, Holubová A, et al. Současné metodické postupy a přehled preimplantační, prenatální a postnatální diagnostiky cystické fibrózy v České republice. Čes.-slov. Pediat. 2008;63(2): 62–75.
22. American Society for Reproductive Medicine. Preimplantation genetic testing: a practice committee opinion. Fertil. Steril. 2007 Dec;88(6):1497–504.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2008 Číslo 11- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Gastroezofageální reflux a gastroezofageální refluxní onemocnění u kojenců a batolat
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Fenylketonurie v dospělosti
- Úskalí prenatálního ultrazvukového screeningu v diagnostice závažných vrozených vývojových vad ledvin a močových cest Prospektivní studie, předběžné výsledky
- Cysta choledochu – klinické projevy, chirurgická technika a výsledky
- Kaustické poranění rektosigmatu patnáctiletého chlapce
- Preimplantační genetická diagnostika monogenně podmíněných chorob – její možnosti, úskalí a první úspěchy v České republice
- Psoriáza u dětí – co nového?
- Doporučení Společnosti lékařské genetiky ČLS JEP týkající se informovaného souhlasu pro genetická laboratorní vyšetření
- Léčení asthma bronchiale, atopického ekzému, onemocnění ledvin a močových cest v Dětské lázeňské léčebně Lázně Kynžvart
- Recenze
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Fenylketonurie v dospělosti
- Cysta choledochu – klinické projevy, chirurgická technika a výsledky
- Úskalí prenatálního ultrazvukového screeningu v diagnostice závažných vrozených vývojových vad ledvin a močových cest Prospektivní studie, předběžné výsledky
- Kaustické poranění rektosigmatu patnáctiletého chlapce
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



