-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Doporučení České revmatologické společnosti pro léčbu revmatoidní artritidy
Recommendations of the Czech Society for Rheumatology for the treatment of rheumatoid arthritis
In the last decade, there has been a significant progress in the treatment of rheumatoid arthritis (RA). This development is based on the introduction of new synthetic and biological drugs in the treatment of RA, and furthermore, improved and regular evaluation of disease activity in RA using composite scoring markers (e.g. DAS 28). Improved methods of evaluation of negative prognostic factors as well as formulation of new management strategies, such as the “Treat to target” concept are important developments. Thus the Czech Society of Rheumatology issues new recommendations reflecting these changes better than the last recommendations from 2007. Treatment of patients with active RA is based on the application of disease modifying anti-rheumatic drugs (DMARDs); with methotrexate being the drug of first choice with the best risk/benefit ratio. The treatment should be initiated at a dose of 10–15 mg per week. In case of insufficient effect, the dose should be increased to 25–30 mg weekly or the oral form should be switched to subcutaneous application. In case of insufficient efficacy or intolerance to methotrexate, there is evidence supporting use of leflunomide, sulfasalazine, and gold salts. Other DMARDs are used relatively rarely. In case of insufficient response to methotrexate therapy, methotrexate can be combined with leflunomide and cyclosporine, but this procedure should be reserved for patients who do not have negative prognostic indicators. In case of persistent high activity, short-term medium and high doses of glucocorticoids can be used. In patients with the presence of such indicators and insufficient efficacy of methotrexate, a biological agent should be added to methotrexate, preferably an inhibitor of tumor necrosis factor α (anti-TNF), namely infliximab, etanercept, adalimumab, certolizumab or golimumab. Biological therapy is indicated in case of methotrexate or other DMARD failure defined as DAS 28 higher than 3.9. The goal of a biological treatment, namely the state of remission, should be achieved within 3–6 months (DAS 28 <2.6). For long-term RA, achieving the state of low disease activity (DAS 28 <3.2) can be an alternative treatment target. In case of primary or secondary anti-TNF failure, the biological agent should be switched to either another anti-TNF agent or a biological drug with a different mechanism of action (abatacept, rituximab and tocilizumab). In patients who meet the criteria of remission during two consecutive visits, tapering of the treatment can be considered. Glucocorticoids should be slowly tapered as the first, followed by tapering of the biological drug. There is evidence supporting the benefit of long-term continuation of synthetic DMARD treatment.
Key words:
rheumatoid arthritis, treatment, biological therapy
Autoři: K. Pavelka; J. Vencovský
Působiště autorů: Revmatologický ústav, Praha
Vyšlo v časopise: Čes. Revmatol., 18, 2010, No. 4, p. 182-191.
Kategorie: Přehledné referáty
Souhrn
V poslední dekádě došlo k výraznému pokroku v léčbě revmatoidní artritidy (RA). Základními pilíři tohoto rozvoje je jednak zavedení nových syntetických i biologických léků RA. Dále pak zlepšené a pravidelné hodnocení aktivity RA pomocí kompozitních skórovacích ukazatelů (např. DAS 28). Významným faktorem je i možnost lepšího vyhodnocení negativních prognostických ukazatelů, dále pak formulace nových strategických postupů, jako je např. koncept léčba k cíli. Česká revmatologická společnost proto vydává nová Doporučení, která reflektují tyto změny lépe než poslední Doporučení z roku 2007. Základem léčby každé aktivní RA je aplikace DMARD (chorobu modifikující léky, Disease Modifying Drugs of RA), přičemž lékem první volby s nejlepším poměrem účinnost / toxicita je metotrexát. Léčba by měla být zahájena v dávce 10–15 mg týdně a v případě nedostatečného efektu by měla být dávka zvyšována do 25–30 mg ev. zaměněna perorální forma za subkutánní. Při nedostatečné účinnosti nebo nesnášenlivosti metotrexátu mají důkazy účinnosti dále leflunomid, sulfasalazin a soli zlata, ostatní DMARD jsou používána poměrně vzácně. Při nedostatečné účinnosti metotrexátu je možné léčbu metotrexátem kombinovat s přidáním leflunomidu či cyklosporinu, ale tento postup by měl být vyhrazen pro pacienty, kteří nemají negativní prognostické ukazatele. V případě přetrvávající vysoké aktivity je možné použít krátkodobě střední i vyšší dávky glukokortikoidů. U pacientů s přítomností negativních prognostických ukazatelů by při nedostatečné účinnosti měl k metotrexátu být přidán biologický lék a to nejlépe anti TNF preparát (infliximab, etanercept, adalimumab, certolizumab a golimumab). Indikací biologického léku je selhání léčby metotrexátem nebo DMARD, které je definováno jako hodnota DAS 28 vyšší než 3,9. Cíle léčby – tj. remise DAS 28 < 2,6 by mělo být dosaženo do 3–6 měsíců. U déletrvající RA může být cílem i dosažení stavu nízké aktivity (DAS 28 < 3,2). V případě primární či sekundární neúčinnosti anti TNF léčby je nutné zaměnit biologický lék (tzv. switch) a to buď záměnou za druhý anti TNF lék, nebo biologický lék s jiným mechanismem účinku (abatacept, rituximab a tocilizumab). U pacientů, kteří splňují na dvou následujících návštěvách kritéria remise je možné uvažovat o detrakci léčby, přičemž první v pořadí jsou pomalu detrahovány kortikoidy a dále pak biologická léčba. Existující důkazy, které svědčí o účelnosti pokračování v léčbě syntetickými DMARD i dlouhodobě.
Klíčová slova:
revmatoidní artritida, terapie, biologická léčbaÚvod
Revmatoidní artritida (RA) je závažné, systémové, zánětlivé autoimunitní onemocnění, které postihuje 0,5–1 % populace. RA vyvolává u pacientů chronickou bolest, ztuhlost, zhoršuje funkci a kvalitu života. RA je příčinou snížené schopnosti pracovat, vyvolává pracovní disabilitu a až v polovině případů do deseti let i trvalou invaliditu (1). RA zkracuje i život svých nositelů o 5–10 let, když příčinou předčasného úmrtí může být např. cervikální myelopatie, amyloidóza, častější výskyt závažných infekcí, malignit, kardiovaskulárních příhod a komplikací léčby (glukokortikoidy, nesteroidními antirevmatiky, imunosupresivy i biologickými léky).
V posledních 10 letech došlo k výraznému pokroku v léčbě RA. Zásadním faktorem rozvoje bylo zavedení nových léků a to jednak syntetických chorobu modifikujících léků (např. leflunomidu), ale především tzv. biologických léků revmatoidní artritidy (anti TNF preparátů, abataceptu, rituximabu a tocilizumabu). Kromě toho však došlo ke zpřesnění diagnostiky revmatoidní artritidy v časnějších stadiích (2) (tab. 1), což umožňuje dřívější nasazení účinné léčby.
Tab. 1. Nově navržená ACR/EULAR 2010 klasifikační kritéria revmatoidní artritidy. 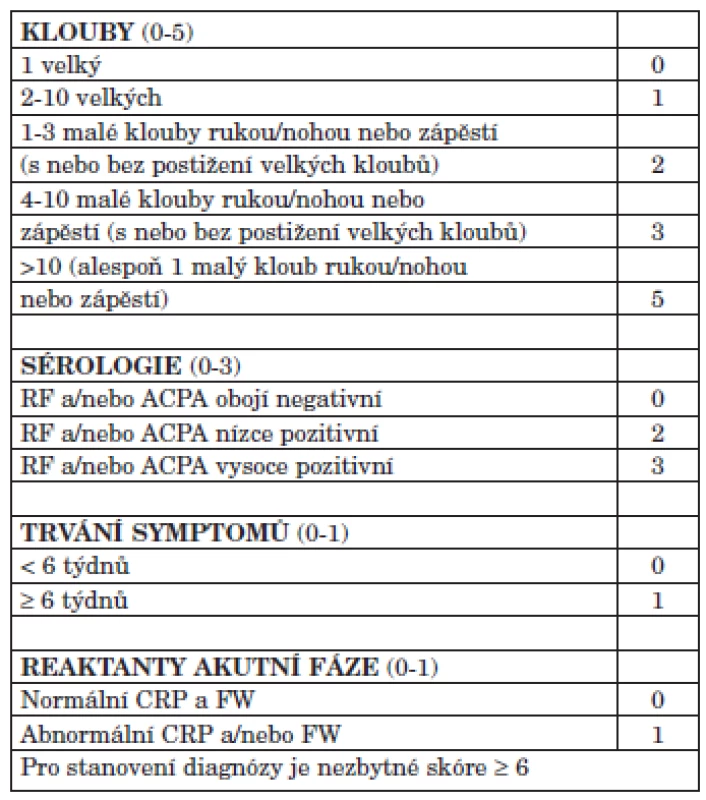
Negativní prognostické ukazatele
Druhým důležitým faktorem pokroku bylo detailnější popsání časně se vyskytujících negativních prognostických ukazatelů pro destruktivní vývoj RA. Mezi tyto faktory řadíme především přítomnost některých autoprotilátek (revmatoidní faktory, protilátky proti citrulinovaným peptidům ACPA), počet oteklých kloubů, trvale vysoké reaktanty akutní fáze (CRP, sedimentace), přítomnost některých genetických faktorů (tzv. sdílený epitop) a časný vývoj erozí detekovatelných i pomocí moderních zobrazovacích metod (sonografie, magnetická resonance) (3, 4) (tab. 2).
Tab. 2. Negativní prognostické ukazatele průběhu RA. 
Hodnocení aktivity revmatoidní artritidy
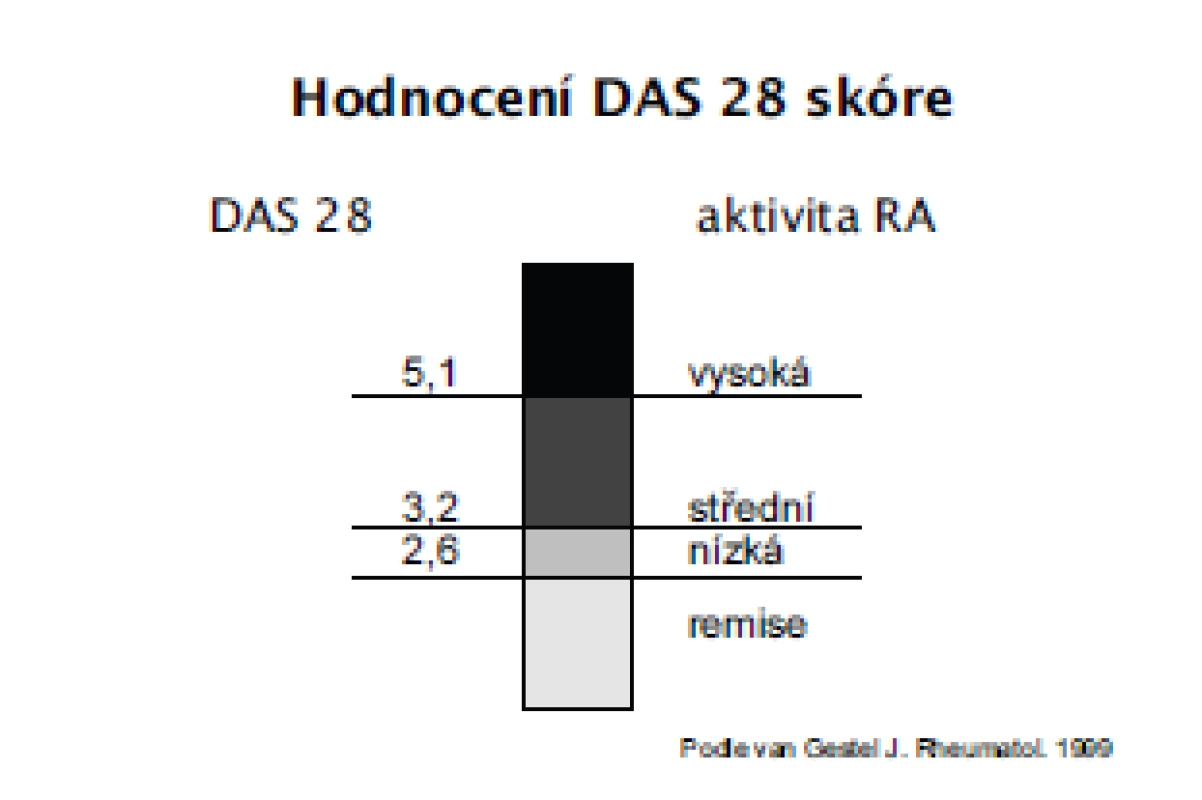
Třetím důležitým pilířem moderní léčby RA je zlepšení hodnocení aktivity RA. Byly navrženy a validizovány numerické, kompozitní indexy u kterých bylo prokázáno, že spolehlivě hodnotí aktivitu RA a jsou dostatečně senzitivní ke změně v průběhu léčby. Pro hodnocení aktivity takto byly navrženy indexy DAS 28 (Disease activity score – 28 kloubů), DAS 44, SDAI, CDAI (5, 6, 7) (tab. 3). Přestože lze doporučit používání všech těchto instrumentů a v minulosti byla prokázána i vysoká korelace mezi nimi, lze na prvním místě doporučit DAS 28, se kterým jsou v Evropě a České republice největší zkušenosti a je používán i v Národním registru ATTRA (8). Hodnocení indexu DAS 28 obsahuje počet oteklých kloubů, palpačně citlivých kloubů, globální hodnocení pacientem a sedimentaci erytrocytů (obr. 1). Hodnocení aktivity pomocí DAS 28, které je zatím používáno hlavně v klinických studiích a při indikaci a provádění biologické léčby v centrech, by se mělo rozšířit do běžné klinické praxe a stát se standardem při léčbě každého nemocného s RA. Hodnocení aktivity pomocí DAS 28 by se mělo provádět u aktivní RA a na začátku léčby v měsíčních intervalech, ve stadiu nízké aktivity nebo remise ve tříměsíčních intervalech. V případě nedostatečného efektu by se měla léčba změnit. Kromě faktorů aktivity se při rozhodování o strategii léčby zvažují ještě další aspekty každého individuálního pacienta: mimokloubní a systémové příznaky, funkční schopnosti, rentgenová progrese, vliv na kvalitu života, vliv na práceschopnost pacienta, očekávání pacienta, přítomnost dalších onemocnění, použití DMARD a biologik v minulosti a jejich případné nežádoucí účinky. Velmi důležité je hodnocení celkových funkčních schopností pacienta. I pro běžnou klinickou praxi lze doporučit používání dotazníku HAQ (9). Změny se doporučuje v běžné klinické praxi hodnotit jednou ročně, optimálně však každých 6 měsíců.
Obr. 1. Doporučený algoritmus léčby RA. 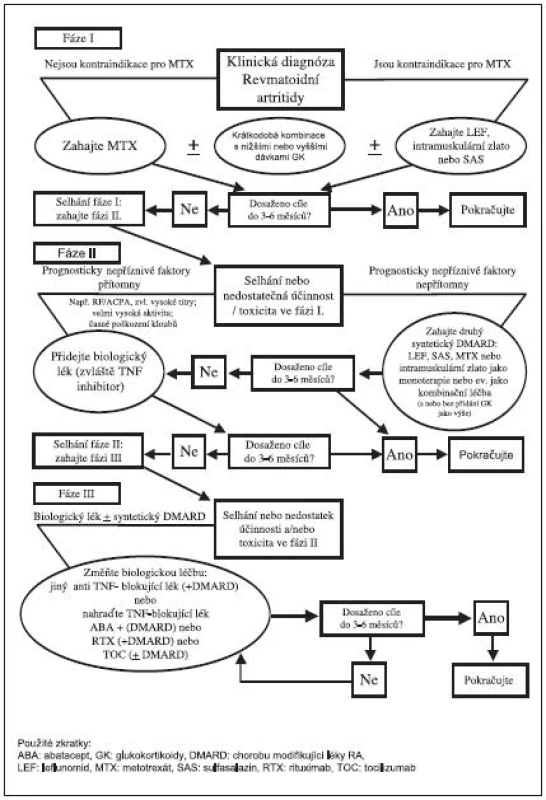
Tab. 3. Ukazatele hodnocení aktivity, funkčního stavu, kvality života a strukturální progrese u RA. 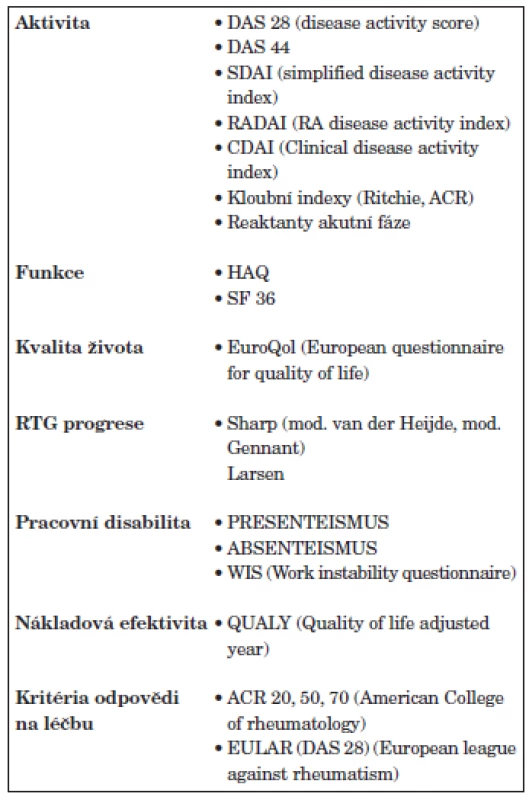
Hodnocení strukturální progrese
Strukturální progrese je rovněž důležitým aspektem hodnocení úspěšnosti léčby. V klinických studiích a vědeckých publikacích je za standardní metodu považováno tzv. Sharpovo skóre, které se nejvíce používá v modifikaci dle van der Heijde (10). Hodnotí se v něm jednak počet erozí a zúžení kloubních štěrbin vybraných kloubů, které se pak sčítají v tzv. celkovém Sharpově skóre. Optimálním stavem by bylo i v běžné klinické praxi používat k hodnocení rentgenové progrese validizovaný, numerický ukazatel jakým je právě celkové Sharpovo skóre, ale je nutné akceptovat, že hodnocení dle Sharpa je v běžné klinické praxi obtížně dosažitelné. Minimálním požadavkem však musí být alespoň semikvantitatívní posouzení, zda-li nemocný progreduje rychle, pomalu či vůbec ne. Rentgenová progrese se doporučuje hodnotit v ročních intervalech.
Komplexní terapie revmatoidní artritidy
Způsoby léčby revmatoidní artritidy lze rozdělit na nefarmakologické, farmakologické a chirurgické. Léčba by měla být vždy komplexní a obsahovat více způsobů (tab. 4). Nefarmakologická léčba není zahrnuta do obsahu těchto Doporučení, což ale neznamená její podcenění. Její účinnost byla potvrzena v intencích metody založené na důkazech (11, 12). Stručně lze shrnout: Pacient by měl na začátku nemoci být dostatečně edukován o své nemoci a zároveň být motivován k pravidelnému cvičení, jehož cílem je uchovat maximum kloubního pohybu, posílit svalové skupiny a uchovat funkční schopnost. Vhodná je konzultace fyzioterapeuta, který může indikovat celé spektrum metod fyzikální medicíny. V řadě situací může být vhodná i konzultace protetika s indikací ortéz, dlah a dalších prostředků při řešení nepříznivých biomechanických situací jako je instabilita, deformity a podobně. V současné době je základem léčby RA farmakoterapie.
Tab. 4. Možnosti léčby revmatoidní artritidy 
Farmakologická léčba revmatoidní artritidy
Cílem farmakoterapie RA je dosažení remise nebo alespoň stavu nízké aktivity. Základním lékem léčby RA jsou tzv. chorobu modifikující léky revmatoidní artritidy (Disease Modifying Anti-Rheumatic Drugs) DMARD, které se dále dělí na syntetické či chemické DMARD a na biologické léky (tab. 5). Glukokortikoidy používané systémově mají rychlý a výrazný protizánětlivý účinek, ale při dlouhodobé aplikaci i významnou toxicitu, takže jejich podávání by mělo být časově omezené. Nesteroidní antirevmatika (NSA) mají u RA účinek zcela symptomatický, přičemž jejich toxicita (především gastrointestinální a kardiovaskulární) není zanedbatelná. Proto by doba podávání a dávky NSA měly být co nejnižší.
Tab. 5. DMARD registrovaná v České republice – nástup účinku a udržovací dávky 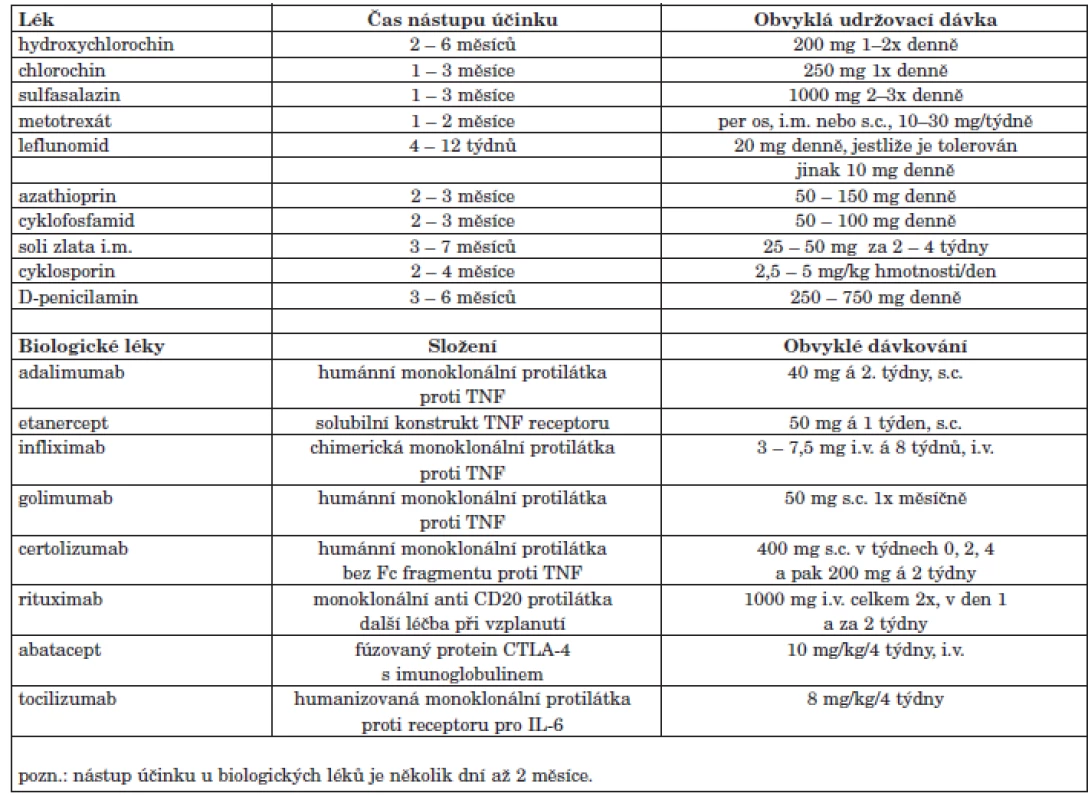
Terapie syntetickými chorobu modifikujícími léky
Terapie DMARD by měla být zahájena v okamžiku, kdy je stanovena diagnóza revmatoidní artritidy. Problémem je ale právě stanovení diagnózy RA. Při používání kritérií Americké revmatologické asociace (ACR, American College of Rheumatology) z roku 1987 docházelo ke zpoždění v nasazení DMARD. Proto v Doporučeních Evropské ligy proti revmatismu (EULAR, European League Against Rheumatism) pro léčbu časné RA je doporučeno podávání DMARD ještě před splněním kritérií pro RA a to při přítomnosti aktivního onemocnění a dále při výskytu negativních prognostických ukazatelů pro destruktivní vývoj (3). V současné době byla již publikována nová klasifikační kritéria ACR/ /EULAR 2010 pro RA, která umožňují časnější diagnostiku a proto je navrženo je používat a v případě jejich splnění neprodleně zahájit léčbu DMARD (2).
Terapie DMARD by měla tedy být nasazena časně a podávána kontinuálně a dlouhodobě, u části pacientů v podstatě celoživotně. Účinnost DMARD by měla být prokázána v období 3–6 měsíců. Při nedostatečném efektu by měl být preparát zaměněn za jiný DMARD. Druhou alternativou je ke stávajícímu DMARD přidat další (tzv. add on princip nebo tzv. step up princip).
Otázkou je, jak postupovat u pacientů v remisi onemocnění. Po vysazení DMARD se zvyšuje riziko vzplanutí RA nejméně dvakrát, proto převažuje názor, že je lepší v léčbě pokračovat, ale např. v nízkých dávkách či prodloužených intervalech, i když tento názor není podpořen mnoha důkazy.
Současné důkazy ukazují, že vysoce účinným DMARD je metotrexát (MTX), který by měl být lékem první volby u všech aktivních forem RA, pokud není kontraindikován (13, 14). Perorálně podávaný MTX by měl být zahájen v dávce 10–15 mg týdně. Při nedostatečném efektu by dávka měla být zvyšována každé 2–4 týdny do dávky 25–30 mg týdně nebo maximálně tolerované dávky, přičemž maximálně tolerované dávky MTX by mělo být dosaženo do 3 měsíců. Při nedostatečném efektu nebo nežádoucích účincích perorálně podávaného MTX je účelné změnit aplikační formu na parenterální, nejlépe subkutánní (15). Efektu léčby MTX by mělo být dosaženo mezi 3–6 měsíci. Současně s MTX je doporučováno aplikovat 5–10 mg kyseliny listové týdně, což snižuje gastrointestinální a hepatální toxicitu MTX (16). MTX je indikován pro dlouhodobou léčbu, protože pravděpodobně snižuje kardiovaskulární mortalitu u RA a má zpomalující vliv na rentgenovou progresi RA, i když ne v takové míře jako biologické léky RA. U časných forem RA je doporučován MTX jako monoterapie, protože nebylo prokázáno, že by kombinace MTX s dalším chemickým DMARD byla účinnější než monoterapie MTX. Na MTX lze pohlížet jako na tzv. kotevní lék. U části pacientů je dosaženo i dlouhodobého efektu, u části je efekt MTX pouze parciální. U těchto pacientů lze použít kombinace více DMARD syntetických a v případě vyšší aktivity i kombinace MTX s biologickými léky (viz dále).
V případě kontraindikací MTX nebo netolerance MTX jsou doporučována jako součást první terapeutické strategie tato DMARD: leflunomid a sulfasalazin (SAS) (17). Leflunomid byl ve studiích stejně účinný jako MTX (19). Doporučené dávkování leflunomidu je 20 mg denně. Zahájení léčby dávkou 100 mg denně je již opuštěno. Leflunomid zpomaluje rentgenovou progresi. Sulfasalazin má evidenci o účinnosti, vlivu na rentgenovou progresi a přijatelné bezpečnosti (18, 20).
Pro RA jsou dále registrována další DMARD, které však mají podstatně méně evidence o účinnosti, či nemají dobrý poměr účinnost / bezpečnost, takže je lze doporučit jen s výhradami jako léky druhé či třetí linie či v určitých specifických situacích.
Antimalarika (hydroxychlorochin a chlorochin) jsou u RA účinné jen slabě a neovlivňují rentgenovou progresi. Lze je použít jen u velmi málo aktivních forem (21). Jsou také používána v kombinacích (např. s MTX a SAS) (22) přičemž tyto dříve doporučované kombinace jsou nyní z hlediska aditivní účinnosti diskutovány.
Doklady o účinnosti solí zlata byly publikovány a to i nových studiích (23). Celkově se ale solí zlata užívá minimálně. Důvodem je velmi pomalý nástup účinku a výskyt nepříjemných nežádoucích účinků.
Existuje evidence o účinnosti cyklosporinu u RA (24), ale širšímu použití brání výskyt nežádoucích účinků, především hypertenze. Cyklofosfamid je potenciálně onkogenní a jeho použití lze doporučit pouze u forem RA se závažnými mimokloubními příznaky.
Kombinace syntetických DMARD
Kombinace syntetických DMARD byly uvedeny do praxe na začátku 90. let minulého století. Důvodem byl především fakt, že účinnost jednotlivých DMARD nebyla dostatečná a zvyšování dávek DMARD vedlo k většímu počtu nežádoucích účinků a přerušení léčby. Termínem kombinovaná léčba rozumíme v užším smyslu slova kombinaci více DMARD (tedy nikoliv kombinaci DMARD s glukokortikoidy nebo nesteroidními antirevmatiky). Kombinovaná léčba více DMARD může existovat v různých provedeních: paralelně zahajovaná více preparáty, zahájit jedním preparátem a při nedostatečné účinnosti přidat druhý (tzv. step up), nebo naopak zahájit více preparáty a při dosažení účinnosti léčbu postupně ukončovat a přejít na monoterapii (tzv. step down). Několik studií při paralelním způsobu léčby potvrdilo účinnost trojkombinace MTX, SAS a hydroxychlorochin, která byla účinnější než terapie dvěma preparáty nebo monoterapie (25, 26, 27). Step up strategie byla účinnější než monoterapie při přidání cyklosporinu k nedostatečně účinnému metotrexátu (23) a přidání leflunomidu k metotrexátu (28). Naopak step down strategie byla účinnější ve studii COBRA. Zde byla jedné skupině nemocných s časnou aktivní RA podávána kombinace MTX, SAS a hydroxychlorochin společně s vyššími dávkami prednisolonu (60 mg s rychlou detrakcí) oproti monoterapii SAS. Kombinovaná léčba vedla k rychlejšímu potlačení klinických symptomů, nicméně když byli nemocní po 6 měsících převedeni na monoterapii SAS nebyla po roce oproti skupině léčené od začátku SAS žádná signifikantní změna. Rentgenová progrese však byla ve skupině iniciálně intenzivní léčby po 12 měsících nižší a tento efekt přetrvával ještě po 5 letech (29). Na druhé straně je nutné konstatovat, že byla provedena i celá řada kombinačních studií s DMARD se zcela negativními výsledky. Smolen ve své přehledné práci považuje evidenci o účinnosti kombinace DMARD za nepřesvědčivou a vyzývá k dalším studiím (30). Pracovní skupina ČRS navrhuje po zvážení evidence a kontroverzních výsledků studií následující stanoviska:
- U pacientů s časnou RA, kteří zatím nebyli léčeni MTX (tzv. MTX naivních) není dostatečná evidence o tom, že by byla kombinační léčba účinnější než monoterapie MTX, navíc je spojena s vyšší toxicitou, a proto je doporučeno zahájit monoterapií MTX, ev. alternativně při nemožnosti podávat MTX zahájit léčbu leflunomidem či sulfasalazinem.
- U pacientů se selháváním MTX je vhodné přidat další DMARD, takže vznikne kombinace MTX, SAS a HCQ (hydroxychlorochin), nebo MTX a leflunomid nebo MTX a cyklosporin. Ostatní možné kombinace mají menší evidenci o účinnosti.
- Režimy kombinující DMARD s časným podáváním středních a vyšších dávek glukokortikoidů po určitou omezenou dobu jsou bezpochyby účinné.
- Při selhávání MTX jsou možné alternativní postupy. Buď přidat k MTX další syntetický DMARD, nebo biologický lék (např. anti TNF preparát nebo tocilizumab), což je postup účinnější. Vzhledem k podstatně vyšší ceně a stále omezené dostupnosti biologických léků je však doporučeno u části pacientů zvolit kombinaci chemických DMARD. Při přítomnosti přetrvávající aktivity a přítomnosti negativních predikčních faktorů progrese je vhodnější použití kombinace s biologickým lékem, při nepřítomnosti těchto faktorů pak je možné přidat syntetický DMARD.
Nežádoucí účinky DMARD a monitorování bezpečnosti
DMARD mohou mít i závažné nežádoucí účinky. Jejich přehled a monitorování jejich bezpečnosti publikovala Česká revmatologická společnost v přehledné práci Šedové a spol. (31).
Glukokortikoidy
Glukokortikoidy jsou dodnes nejúčinnější protizánětlivou léčbou, která je k dispozici. Nicméně po jejich vysazení choroba zpravidla exacerbuje. Jejich dlouhodobá aplikace je pak spojena s řadou nežádoucích účinků: osteoporóza, hypertenze, hyperglykémie, přírůstek hmotnosti, retence tekutin, katarakta, kožní fragilita a potenciace předčasné aterosklerózy. Revmatologové se ve svých ambulancích setkávají především s projevy glukokortikoidy indukované osteoporózy.
Aplikaci glukokortikoidů lze rozdělit podle denní dávky (tab. 6).
Tab. 6. Aplikace glukokortikoidů u revmatoidní artritidy. 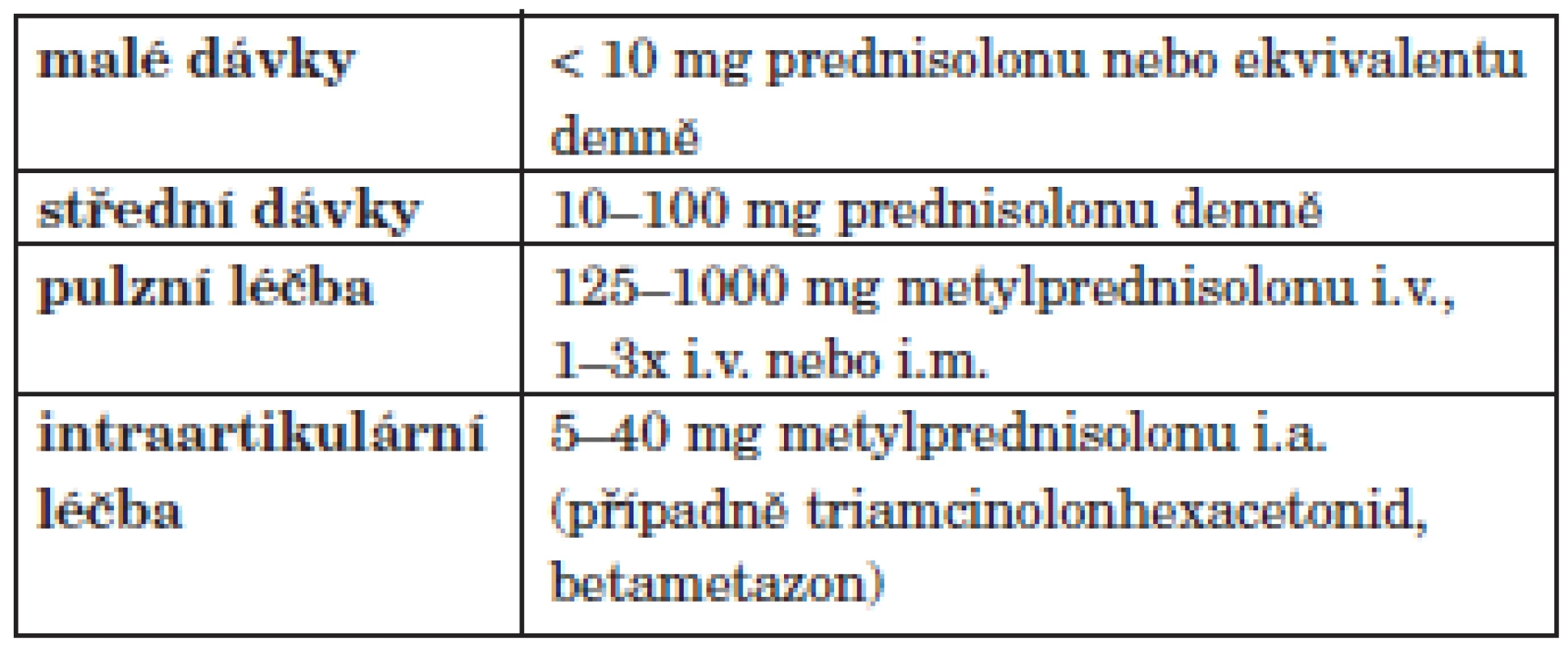
Aplikace středních dávek
Středními dávkami rozumíme ekvivalentní 10–100 mg prednisolonu denně. Tato léčba by měla být časově omezená. Může se používat k léčbě mimokloubních manifestací RA (např. perikarditidy či alveolitidy). Dávky 60 mg prednisolonu byly užity také jako součást iniciální fáze indukční léčby tzv. sestupnými kroky (29). Tyto dávky při podávání delším než několik týdnů vyvolávají osteoporózu.
Aplikace nízkých dávek
Nízkými dávkami glukokortikoidů rozumíme dávky < 10 mg prednisonu nebo jeho ekvivalentu denně. Zájem o tuto léčbu prudce stoupl po zjištění Kirwana et al. (32), že dlouhodobě aplikované dávky GK zpomalují rentgenovou progresi RA a že po jejich vysazení rentgenová progrese akceleruje. Procento pacientů dlouhodobě léčených nízkými dávkami glukokortikoidů se zvýšilo z 10–20 % kolem roku 1990 na dnešních 40–60 %.
Ale i při aplikaci těchto nízkých dávek GK musíme mít na mysli možné nežádoucí účinky a vážit poměr efekt/riziko. Vždy by měla být podávána nejnižší účinná dávka a zkracovány intervaly podávání.
Při revmatoidní artritidě existuje zvýšené riziko osteoporózy nezávisle na podávané léčbě GK. Nebyla stanovena žádná “bezpečná” hranice dávky GK, a dokonce i dávky 5 mg prednisolonu a nižší mohou zvyšovat riziko osteoporózy. Proto také např. ACR vypracovala Návody na léčbu a prevenci glukokortikoidy indukované osteoporózy, ve kterých uvedla základní principy. Při zahájení jakékoliv delší léčby (více než 3 měsíce) GK u RA je indikováno vyšetření kostní denzity (BMD) na přístroji DEXA, které by mělo být prováděno v intervalech jednoho roku. Každý pacient s RA na léčbě glukokortikoidy by měl mít zajištěn denní příjem odpovídající 1500 mg elementárního kalcia a 400–800 IU vitaminu D. U postmenopauzálních žen, které nemají kontraindikace, je možné podávat hormonální substituční léčbu, alternativou je pak podávání bisfosfonátů.
Pulzní léčba glukokortikoidy
Pulzní léčba glukokortikoidy se nejčastěji provádí aplikací intravenózní, méně často intramuskulární. Podává se zpravidla 500–1000 mg metylprednisolonu. Většinou se aplikují infuze každý druhý den, méně často pak tři dny po sobě.
Pulzy metylprednisolonu jsou většinou dobře snášeny. Nežádoucí účinky jsou převážně mírné a časově omezené: začervenání, palpitace, hořkost v ústech, psychické poruchy. Závažné nežádoucí účinky, jako významné bradykardie a infekce, byly referovány velmi vzácně. V podezření je i pozdní následek ve formě osteonekrózy, ale toto nebylo nikdy jasně prokázáno. Pulzní léčba nevyvolává nežádoucí účinky charakteristické pro dlouhodobou léčbu glukokortikoidy, tzn. útlum osy hypotalamus-hypofýza a ovlivnění kostního metabolismu.
Filozofie léčby pulzy je jasná – zlomit rychle aktivitu a překlenout období do nástupu účinku DMARD. Proto se o této léčbě hovoří jako o léčbě přemosťující (bridging). Očekávalo se, že efekt této léčby by měl vydržet nejméně 6–8 týdnů.
V současné době je pulzní léčba podávána méně často. Důvody jsou především nekonstantní délka účinku, potenciální nežádoucí účinky a nutnost provádění při hospitalizaci. Navíc moderní DMARD (např. MTX nebo TNF blokující léky) mají podstatně rychlejší nástup účinku než starší generace DMARD. Pulzy proto doporučujeme buď při závažném postižení vnitřních orgánů, nebo při extrémně vysoké aktivitě při exacerbaci RA.
Terapie biologickými léky
Biologické léky představují významný přínos v léčbě RA. Účinnost a bezpečnost biologických léků byla ověřena v řadě publikovaných randomizovaných, kontrolovaných studiích, nezaslepených pokračovacích fázích těchto studií a doplněna o data z registrů biologické léčby. Evidence byla vyhodnocena i v řadě systematických literárních přehledů, např. provedených pro potřeby EULAR (33), který pak sloužil jako podklad při formulaci Doporučení pro léčbu RA (34). V současné době jsou v České republice registrovány jednak biologické léky blokující TNF (infliximab, adalimumab, etanercept, golimumab, certolizumab), dále pak blokátor receptoru pro IL-6 tocilizumab (35), depleční terapie proti B buňkám (rituximab) (36) a blokátor kostimulace aktivace T buněk abatacept (tab. 5). Blokátory TNF a tocilizumab mají status 1. linie, zatímco abatacept a rituximab pak status 2. linie, tzn. že by měly být používány až jako druhý biologický lék v případě selhání prvního preparátu. V případě kontraindikací anti TNF léčby a tocilizumabu pak mohou být použity jako biologický lék linie první.
Tab. 7. Indikační kritéria České revmatologické společnosti pro zahájení anti TNF léčby. 
Protože nebyly provedeny přímé srovnávací studie anti TNF preparátů, je nutné považovat je za stejně účinné a bezpečné (37). Pro všechny biologické léky v ČR pak platí co se týče definice aktivity stejná indikační pravidla.
Zahájení biologické léčby je indikováno u pacientů, u kterých selhala léčba alespoň jedním syntetickým DMARD. Tímto by měl být MTX, v případě jeho kontraindikací leflunomid či sulfasalazin. MTX by měl být podáván v dostatečné dávce (pokud tolerován), kterou myslíme dávku 20–30 mg týdně, které by mělo být dosaženo v intervalu do tří měsíců. Otázkou zůstává, v jakém intervalu má být již terapeutický efekt DMARD označen za nedostatečný. V předcházejících Doporučeních ČRS byla minimální doba léčby MTX stanovena na 6 měsíců (38). V současné době se však začíná prosazovat v léčbě RA koncept léčba k cíli (Treat to target), která si klade za cíl docílit stavu remise (DAS 28 méně než 2,6) či alespoň stavu nízké aktivity (DAS 28 méně než 3,2) v intervalu 3–6 měsíců (39). V rámci tohoto konceptu lze tedy doporučit vyhodnotit eventuální nedostatečnou účinnost MTX již v intervalu 3–6 měsíců a v indikovaných případech pacientů zahájit anti TNF léčbu již v tomto intervalu. Anti TNF léčba by měla být kombinována s MTX nebo jinými DMARD, protože tyto kombinace se ukázaly být více účinnými než monoterapie anti TNF (40, 41). Adalimumab a etanercept mohou být podávány jako monoterapie na podkladě účinnosti v klinických studiích, ale jejich data o lepší účinnosti než monoterapie MTX jsou nekonzistentní, především u časnějších forem RA a pacientů dříve neléčených metotrexátem. Nedávno dokončená studie s tocilizumabem ukázala větší účinnost monoterapie tocilizumabem oproti MTX (42). Protože ve studii chyběla třetí větev kombinující tocilizumab a MTX, není jasné, který postup je u časné RA nejúčinnější.
Další otázkou zůstává prahová aktivita pro zahájení biologické léčby. V dosavadních kritériích ČRS byla udávána hodnota DAS 28 více než 5,1. Tato hodnota je příliš vysoká, protože pacienti, kteří nejsou ve stavu nízké aktivity nadále rentgenově progredují a funkčně se zhoršují a proto ČRS nově navrhuje hranici pro zahájení biologické léčby hodnotu DAS 28 více než 3,9.
Jak postupovat při výběru prvního biologického léku? V Evropě jsou licencovány jako biologické léky první linie anti TNF preparáty a tocilizumab, abatacept a rituximab pak jako biologické léky druhé linie. Abatacept je v USA licencován na základě klinických studií rovněž jako lék 1. linie (43). Nejvíce klinických zkušeností a bezpečnostních dat je však u anti TNF preparátů a proto ČRS navrhuje jako lék první linie jeden z anti TNF preparátů nebo tocilizumab. Abatacept a rituximab jako lék 2. linie při selhání biologického léku 1. linie.
Algoritmus léčby
Na základě Doporučení EULAR byl vypracován algoritmus léčby, který považuje Česká revmatologická společnost za velmi dobrý a ztotožňuje se s ním (34) (obr. 2). Algoritmus je zde rozdělen do 3 fází (strategií).
Fáze I.
Časné stanovení klinické diagnózy revmatoidní artritidy. Jestliže nejsou kontraindikace, tak nasazení MTX, v případě kontraindikací je doporučeno zahájit podávání leflunomidu, SAS nebo solí zlata. U aktivních případů se doporučuje individuálně zvážit krátkodobou aplikaci nižších, nebo středních dávek glukokortikoidů. Cíle léčby by mělo být dosaženo do 3–6 měsíců.
Fáze II.
Pokud není dosaženo cíle léčby (nedostatečná účinnost, nežádoucí účinky) ve fázi I, nastává fáze II. Zde je pro další postup důležitá přítomnost či nepřítomnost prognosticky nepříznivých faktorů. V případě nepřítomnosti nepříznivých faktorů progrese je možnost zkusit jiný syntetický DMARD nebo je případně kombinovat.
Fáze III.
Jestliže není ve fázi II dosaženo účinku v intervalu 3–6 měsíců, nastupuje fáze III.
Ve fázi III se kombinuje DMARD a biologický lék. V případě selhání biologického léku je možné aplikovat 2. anti TNF přípravek nebo použít biologický lék s jiným mechanismem účinku – abatacept, rituximab nebo tocilizumab.
Účinnost biologické léčby by měla být průkazná po 3 měsících,u abataceptu a rituximabu po 4 měsících. Léčbu lze považovat za úspěšnou, pokud je pacient v remisi (DAS 28 méně než 2,6). U pacientů s dlouhotrvající léčbou, lze považovat za úspěch i pokles do úrovně nízké aktivity, tj. DAS 28 méně než 3,2. Tyto cíle by měly být udržovány v průběhu celé léčby.
Vysazení léčby u pacientů v remisi
Strategie vysazování léčby RA u pacientů v remisi zatím není zcela jasná. O vysazování léčby by se mělo začít uvažovat u pacientů, kteří splňují kritéria remise (např. DAS 28 < 2,6) na 2 následujících návštěvách tzn. v intervalu 6 měsíců. První z léků by měly být vysazeny glukokortikoidy, protože léčba glukokortikoidy by měla být z principiálních důvodů krátkodobá, aby se předešlo nežádoucím účinkům dlouhodobé léčby glukokortikoidy. Druhým v pořadí by mělo být vysazení biologického léku. V první fázi se doporučuje snížit dávku či prodloužit interval biologického léku před jeho úplným vysazením. Udržení remise po vysazení biologického léku je pravděpodobnější u časné RA. U pacientů s déletrvajícím onemocněním je udržení remise méně pravděpodobné jako např. ve studii Brocqa vzplanulo do 1 roku až 75 % pacientů (44). Vysazení syntetického DMARD (např. MTX) se provádí až jako poslední. Existují však argumenty pro nepřerušování léčby DMARD. Např. v jedné metodologicky dobře provedené studii vzplanulo při léčbě DMARD 1/3 pacientů, zatímco při jejich vysazení 2/3 pacientů (45).
Dostatečného účinku je po prvním anti TNF léku dosaženo u 60–70 % pacientů s RA. U zbytku pacientů dochází k tzv. selhání léku a to proto, že účinek vůbec nenastane (tzv. primární selhání), nebo proto, že po počáteční příznivé odpovědi dochází k její ztrátě (tzv. sekundární selhání). U části pacientů pak dochází k přerušení léčby kvůli nežádoucím účinkům. Při selhání anti TNF léku lze použít druhý anti TNF preparát v procesu, pro který často užíváme anglický název switching. O účinnosti 2. anti TNF preparátu existují doklady především z otevřených nebo registrových studií (46). První randomizovaná, kontrolovaná studie, která potvrdila účinnost 2. anti TNF preparátu byla studie s golimumabem (47).
Většina observačních studií ukazuje, že účinnost 2. anti TNF přípravku je jen o málo nižší než účinnost 1. anti TNF, při použití 3. anti TNF již je účinnost podstatně nižší (46). Na účinnost 2. anti TNF může mít vliv i důvod, proč byla přerušena léčba prvním anti TNF. Data z některých registrů ukazují fakt, že účinnost 2. anti TNF je lepší pokud byl příčinnou přerušení léčby prvním anti TNF nežádoucí účinek než když tímto důvodem byla nedostatečná účinnost.
Alternativou po selhání prvního anti TNF preparátu může být aplikace biologického léku s jiným mechanismem účinku. Randomizované, kontrolované studie potvrdily účinnost u pacientů s TNF selháním při aplikaci rituximabu (48), abataceptu (49) a tocilizumabu (50).
Zatím nebyly provedeny přímé srovnávací studie (tzv. head to head), které by srovnávaly účinnost 2. anti TNF a biologického léku s jiným mechanismem účinku. Údaje ze švýcarského registru SQOM sice ukázaly větší účinnost a lepší adherenci k léčbě při aplikaci rituximabu než 2. anti TNF (51), nicméně jde o otevřené sledování s ne zcela srovnatelnými skupinami, které bude nutné ověřit v randomizované, kontrolované studii.
Česká revmatologická společnost tedy pro nedostatek evidence není schopná doporučit univerzální postup v případě selhání 1. anti TNF léku. Vyjmenovává pouze okolnosti, které mohou hrát při výběru 2. biologického léku roli. Mezi tyto okolnosti udáváme: důvod přerušení léčby prvním anti TNF, riziko infekce, malignita v anamnéze, další mimokloubní projevy v anamnéze (např. vaskulitida), další komorbidity, aplikace dalších léků včetně MTX, forma aplikace, přání pacienta.
Práce vznikla za podpory VZMZ 00023728.
Prof. MUDr. Karel Pavelka, DrSc
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
Zdroje
1. Pincus T, Callahan LF, Sale WG, et al. Severe functional declines, work disability and increased mortality in seventy-five rheumatoid arthritis patiens studied over nine years. Arthritis Rheum 1984; 27 : 864-872.
2. Aletaha D, Neogi T, Silman AJ, Funovits J, Felson DT, et al. 2010 Rheumatoid Arthritis Classification Criteria An American College of Rheumatology/European League Against Rheumatism Collaborative Initiative. Ann Rheum Dis 2010; 69 : 1580-1588.
3. Combe B, Dougados M, Goupile P, et al. Prognostic factors for radiographic damage in early rheumatoid arthritis: a multiparameter prospective study. Arthritis Rheum 2001; 44 : 1736-1743.
4. Smolen J, van der Heijde D, St Clair EW, et al. Predictors of joint damage in patiens with early rheumatoid arthritis treated with high-dose methotrexate without or with concomitant infliximab. Results from the ASPIRE trial. Arthritis Rheum 2006; 54 : 702-710.
5. Van Gestel AM, Prevoo MLL, van Hof M, et al. Development and validation of ACR and WHO/ILAR criteria. Arthritis Rheum 1996; 39 : 34-40.
6. Smolen J, Breedveld FC, Schiff MH, et al. A simplified disease activity index for rheumatoid arthritis for use in clinical practise. Rheumatology (Oxford) 2003; 42 : 244-257.
7. Aletaha D, Smolen JS. The simplified Disease Activity Index (CDAI) to monitor patiens in standard clinical care. Best Pract Res Clin Rheumatol 2007; 21 : 663-75.
8. Pavelka K, Gatterová J, Tegzová D, et al. Radiographic progression of rheumatoid arthritis patiens from Czech National Registry receiving infliximab treatment. Clin Exp Rheum 2007; 25 : 451-454.
9. Ramey DR, Raynalud JP, Fries JF. The health assessment questionnaire1992: status and review. Arthritis Care Res 1992; 5 : 119-129.
10. Sharp JT, Young DY, Bluem GB, et al. How many joints in the hands and wrists should be included in a score of radiologic abnormalities used to assess rheumatoid arthritis. Arthritis Rheum 1985; 28 : 1326-1385.
11. Jong Z, et al. Long-term follow-up a high-intensity exercise program in patients with rheumatoid arthritis. Clin Rheumatol 2009; 28 : 663-671.
12. Hirvonen HE, Mikkelsson MK, Kautiainen H, et al. Effectiveness of different cryotherapies on pain and disease activity in active rheumatoid arthritis. A randomised single blinded controlled trial. Clin Exp Rheumatol 2006; 24(3): 295-301.
13. Visser K, Katchmart W, Loza E, et al. Multinational evidence based recommendations for the use of methotrexate in rheumatic disorders with a focus on rheumatoid arthritis: integrating systematic literature research and expert opinion of a broad international panel of rheumatologists in the 3E initiative. Ann Rheum Dis 2009; 68 : 1086-1093.
14. Visser K, van der Heijde D. Optimal dosage and route of administration of methotrexate in rheumatoid arthritis: a systematic review of the literature. Ann Rheum Dis 2009; 68 : 1094-1099.
15. Braun J, Flaxenberg P, Waehrisch J, et al. Comparison of the clinical efficacy and safety of subcutaneous methotrexate in patiens with active rheumatoid arthritis. Arthritis Rheum 2008; 58 : 73-81.
16. van Ede AE, Laan RF, Rood MJ, et al. Effect of folic and folinic acid supplementation on the toxicity and efficacy of methotrexate in rheumatoid arthritis: a forty – eight week, multicenter, randomized, double-blind, placebo controlled study. Arthritis Rheum 2001; 44 : 1515-1524.
17. Smolen JS, Kalden J, Scott DL, et al. Efficacy and safety of leflunomide compared with placebo and sulphasalazine in active rheumatoid arthritis: a double blind, randomized, multicenter study. Lancet 1999; 353 : 259-266.
18. Plosker GL, Croom KF. Sulfasalazine: a review of its use in the management of rheumatoid arthritis. Drugs 2005; 65 : 1815-1849.
19. Strand V, Cohen S, Schiff M, et al. Treatment of active rheumatoid arthritis with leflunomide compared with placebo and methotrexate. Arch Intern Med 1999; 159 : 242-2550.
20. Weinblatt ME, Reda D, Henderson W, et al. Sulfasalazine treatment for rheumatoid arthritis: a metaanalysis of 15 randomized trials. J Rheumatol 1999; 26 : 2123-2130.
21. Suarez-Almazor ME, Belseck F, Shea B, et al. Antimalarials for treating rheumatoid arthritis. Cochrane Database Syst Rev 2000; 4: CD 000959.
22. O Dell J. Treatment of rheumatoid arthritis with methotrexate alone, sulfasalazine and hydroxychlorochine, or combination of all three medications. N Engl J Med 1996; 334 : 1287-1291.
23. Rau R, Herborn G, Menninger H, et al. Radiographic outcome after three years of patiens with early erosive rheumatoid arthritis treated with intramuscular methotrexate or parenteral gold. Extension of a one-year double blind study in 174 patients. Rheumatology (Oxford) 2002; 41 : 196-204.
24. Tugwell P, Pincus T, Yocum D, et al. Combination therapy with cyklosporine and methotrexate in severe rheumatoid arthritis. Engl J Med 1995; 333 : 137-141.
25. O Dell JR, Leff R, Paulsen G, et al. Treatment of rheumatoid arthritis with methotrexate and hydoxychloroquine, methotrexate and sulsalazine, or combination of the three medications: results of a two –year randomized, double blind, placebo controlled trial. Arthritis Rheum 2002; 46.1164-70.
26. Mottonen T, Hannonen P, Leirisalo-Repo M, et al. Comparison therapy with single-drug therapy in early rheumatoid arthritis: a randomized trial. Lancet 1999; 353 : 1568-73.
27. Calguneri M, Pay S, Caliskaner Z, et al. Combination therapy versus monotherapy for the treatment of patients with rheumatoid arthritis. Clin Exp Rheumatol 1999; 17 : 699-704.
28. Kremer JM, Genovese MC, Cannon GW, et al. Concomitant leflunomide therapy in patiens with active rheumatoid arthritis despite stable doses of methotrexate: randomized, double blind, placebo controlled trial. Ann Intern Med 2002; 137 : 726-33.
29. Boers M, Verhoeven AC, Markusse HM, et al. Randomised comparison of combined step-down prednisolone, methotrexate and sulphasalazine with sulphasalazine alone in early rheumatoid arthritis: a randomised trial. Lancet 1997; 350 : 309-318.
30. Smolen J, Aletaha D, Keystone E. Superior efficacy of combination therapy for rheumatoid arthritis. Fact or Fiction. Arthritis Rheum 2005; 52 : 2975-2083.
31. Šedová L, Štolfa J, Horák P, Pavelka K. Doporučení České revmatologické společnosti pro monitorování bezpečnosti léčby revmatoidní artritidy. Čes Revmatol 2009; 1(17): 4-15.
32. Kirwan JR. The effect of glucocorticoids in joint destruction in rheumatoid arthritis. N Engl J Med 1995; 333 : 142-146.
33. Nam JL, Winthrop KL, van Vollenhoven, et al. Current evidence for managment of rheumatoid arthritis with biological disease-modifying antirheumatic drugs: a systematic literature review informing the EULAR recommendations for the managment of RA. Ann Rheum Dis 2010; 69 : 976-986.
34. Smolen JS, Landewe R, Breedveld FC, et al. EULAR recommendations for the managment of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs. Ann Rheum Dis 2010; 69 : 964-975.
35. Maini RN, Taylor PC, Szechinski J, et al. Double blind randomized conrtolled clinical trial of the interleukin 6 receptor antagonist, tocilizumab in European patiens with rheumatoid arthritis who had an incomplete response to methotrexate. Arthritis Rheum 2006; 54 : 2817-29.
36. Edwards JC, Sczepanski L, Schechinski J, et al. Efficacy of B cell targeted therapy with rituximab in patiens with rheumatoid arthritis. N Engl J Med 2004; 350 : 2572-81.
37. Furst D, Keystone EC, Braun J, et al. Updated consensus statement on biological agents for treatment of rheumatic diseases. Ann Rheum Dis 2010, 69 (Suppl 1): 2-29.
38. Bečvář R, Vencovský J, Němec P, et al. Doporučení České revmatologické společnosti pro léčbu revmatoidní artritidy. Vnitřní Lék 2008; 54 : 84-99.
39. Smolen J, Aletaha D, Bjilsma JW, et al. Treating rheumatoid arthritis to target: recommenadations of an international task force. Ann Rheum Dis onlin, 2010; 69 : 631-7.
40. Klareskog L, van der Heijde D, de Jager JP, et al. Therapeutic effect of the combination of etanercept and methotrexate compared with each treatment alone in patiens with rheumatoid arthritis: double blind - randomised controlled trial. Lancet 2004; 363 : 675-81.
41. Breedveld F, Weisman MH, Kavanaugh, et al. The Premier study: a multicenter, randomized, double blind clinical trial of combination therapy with adalimumab plus methotrexate versus methotrexate alone or adalimumab alone in patiens with early, aggressive rheumatoid arthritis who had not previous methotrexate treatment. Arthritis Rheum 2006; 54 : 26-37.
42. Jones G, Sebba A, Gu J, et al. Comparison of tocilizumab monotherapy versus methotrexate monotherapy in patiens with moderate to severe rheumatoid arthritis. The AMBITION study. Ann Rheum Dis 2010; 69 : 88-96.
43. Westhovens R, Robles M, Ximenes AC, et al. Clinical efficacy and safety of abatacept in methotrexate naive patiens with early rheumatoid arthritis and poor prognostic factors. Ann Rheum Dis 2009; 68 : 1870-1877.
44. Brocq O, Millassean E, Albert CH, et al. Effect of discontinuity TNFα antagonist therapy in patients with remission of rheumatoid arthritis. Joint Bone Spine 2009; 76 : 350-355.
45. Ten Wolde S, Stermands J, Breedveld F, et al. Effect of resumption of second line drugs in patients with rheumatoid arthritis that flared up after treatment discombination. Ann Rheum Dis 1997; 56 : 235-9.
46. Carmona L, Oriz A, Sabad MA, et al. How good is to switch between biologics?A systematic review of the literature. Acta Reumatol Port 2007; 32 : 113-28.
47. Smolen JS, Kay J, Doyle MK, et al. Golimumab in patiens with active rheumatoid arthritis after treatment with tumour necrosis factor alfa inhibitors (GO-AFTER study) a multicentre, randomised, double blind, placebo controlled phase III.trial. Lancet 2009; 374 : 210-21.
48. Cohen SB, Emery P, Greenwald MW, et al. Rituximab for rheumatoid arthritis refractory to anti tumor necrosis factor therapy: results of a multicenter,randomized, double blind, placebo controlled phase III trial evaluating primary efficacy and safety at twenty four weeks. Arthritis Rheum 2006; 64 : 2793-806.
49. Genovese MC, Becker JC, Schiff M, et al. Abatacept for rheumatoid arthritis refractory to tumor necrosis factor alfa inhibition. N Engl J Med 2005; 353 : 1114-23.
50. Emery P, Keystone E, Tony HP, et al. IL-6 receptor inhibition with tocilizumab improves treatment outcomes in patiens with rheumatoid arthritis refractory to anti tumor necrosis factors biologicals „results from a 24 week multicentre randomised, placebo controlled trial. Ann Rheum Dis 2008; 67 : 1516-23.
51. Finckh A, Ciurea A, Brulhart L, et al. Which subgroup of rheumatoid arthritis patients benefits from switching to rituximab versus alternative anti-TNF agents after previous failure to anti-TNF agent? Ann Rheum Dis 2009; 2010; 69 : 387-93.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2010 Číslo 4- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
Najčítanejšie v tomto čísle- Plicní postižení u systémových onemocnění pojiva
- Ruptura šlachy m. tibialis posterior u pacientů s revmatoidní artritidou
- Doporučení České revmatologické společnosti pro léčbu revmatoidní artritidy
- OBSAH ROČNÍKU ČASOPISU ČESKÁ REVMATOLOGIE 18/2010
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy