-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Peroperačná biopsia: história, indikácie, kontraindikácie a kontrola kvality
Frozen section: history, indications, contraindications and quality assurance
Frozen section represents one of the most imortant procedures carried out by the pathologist. At the same time, it’s one of the most difficult and most stressful tasks in the practice of pathology. The basic rule and the only correct indication for intraoperative consultation is that the result will determine the further conduction of the surgical procedure or will change the immediate patient care after operation. Successful accomplishment of intraoperative consultation requires knowledge of clinical history, familiarity with the surgical procedure technique, a keen knowledge of gross and microscopic pathology and a perfect work of the lab. Regular participation in quality assurance programs is associated with lower discordance rates between frozen section and final section diagnoses and a lower frequency of deferred diagnoses. Both the pathologist and the surgeon should realize the limitations of frozen section technique and, although no formal absolute contraindications to the use of frozen sections exist, there are situations when frozen section should be refused, although only after communication with the surgeon.
Keywords:
frozen section – history – indications – contraindications – quality assurance
Autori: Marián Švajdler 1,2; Peter Švajdler 3
Pôsobisko autorov: Šiklův ústav patologie, Univerzita Karlova v Praze, Lékařská fakulta v Plzni a Fakultní nemocnice Plzeň, Česká republika 1; Bioptická laboratoř, s. r. o., Plzeň, Česká republika 2; Oddelenie patológie, Univerzitná nemocnica Louisa Pasteura, Košice, Slovenská Republika 3
Vyšlo v časopise: Čes.-slov. Patol., 54, 2018, No. 2, p. 58-62
Kategória: Přehledový článek
Súhrn
Peroperačná biopsia je jednou z najdôležitejších a zároveň najťažších a najstresujúcejších súčastí práce patológa. Základným pravidlom a jedinou správnou indikáciou je, že výsledok peroperačnej konzultácie priamo ovplyvní ďalší postup operácie, alebo liečbu v najbližšom pooperačnom období. Základom úspešného peroperačného vyšetrenia sú dostatočné klinické údaje, primerané vedomosti o operačnom postupe, prehľad v makroskopickej patológii, dokonalá práca patologického laboratória a široké znalosti v mikroskopickej patológii. Pravidelná kontrola kvality peroperačných vyšetrení vedie k signifikantnému znižovaniu diskordancií medzi peroperačným a definitívnym vyšetrením, ako aj k znižovaniu počtu prípadov s odloženou diagnózou. Patológ aj chirurg by mali poznať limity peroperačného vyšetrenia a aj keď formálne neexistujú žiadne absolútne kontraindikácie, v určitých situáciách by malo byť vyšetrenie odmietnuté, ale vždy po predchádzajúcej komunikácii s operatérom.
Kľúčové slová:
peroperačná biopsia – história – indikácie – kontraindikácie – kontrola kvality
Peroperačná biopsia (alebo aj „rýchla peroperačná biopsia”, slangovo „rýchla”, „peroperačka”, „zmrazák”, angl. frozen section) je jedným z najdôležitejších a zároveň najťažších a najstresujúcejších výkonov v diagnostickej patológii. Vyžaduje dostatočné skúsenosti hodnotiaceho patológa a „umenie” v niekoľkých minutách interpretovať nedokonalý preparát ofarbený iba hematoxylínom-eozínom, ktorý je zhotovený z rýchlo zmrazeného nefixovaného tkaniva. Využitie niektorých špeciálnych techník je možné (napr. imunohistochémia alebo špeciálne histochemické farbenia), ale nie úplne bežné (1). Napriek limitom v podobe samplingu (v typickom prípade je zo zaslaného tkaniva vyšetrená iba jedna excízia, alebo iba niekoľko málo excízií) a množstvu potenciálnych artefaktov, ide o najdefinitívnejšiu formu peroperačnej konzultácie (2). Slovo konzultácia treba zdôrazniť, keďže „peroperačka“ v povedomí niektorých klinikov figuruje ako bežné laboratórne vyšetrenie a preto s jeho indikáciou narábajú pomerne benevolentne. V skutočnosti ide o časovo a finančne pomerne náročné expertné lekárske vyšetrenie, ktoré hodnotiacemu patológovi zaberie najmenej 15-20 minút pracovného času, v prípade nutnosti makroskopického vyšetrenia priamo na chirurgickom sále aj podstatne viac.
V článku sa budeme venovať všeobecným aspektom peroperačnej biopsie. Ďalšie články v prehľadovej časti tohoto čísla sa venujú peroperačnej diagnostike v niektorých konkrétnych špeciálnych oblastiach diagnostickej patológie.
HISTÓRIA
Vznik peroperačnej biopsie je úzko spojený so vznikom patológie ako samostatného klinického odboru. Až do 19. storočia sa patológia venovala v podstate iba porovnávaniu symptómov u živého pacienta s makroskopickými nálezmi po smrti. V 19. storočí sa z patológie stala samostatná disciplína zameraná predovšetkým na výskum, pričom až do začiatku 20. storočia sa korelácii makro - a mikroskopických autoptických nálezov s klinikou venovali predovšetkým praktikujúci klinici, najmä chirurgovia (preto sa dodnes v angličtine používa termín „surgical pathology“) (3). Peroperačná biopsia bola do klinickej praxe rutínne zavedená skôr ako vyšetrovanie tkanív z diagnostických predoperačných biopsií tak ako ho poznáme dnes a aj napriek úvodným pochybnostiam zo strany prominentných chirurgov zásadným spôsobom viedla k prepojeniu histologického vyšetrovania tkanív patológmi s klinickým manažmentom pacientov (3,4).
Prvú zmienku o peroperačnom vyšetrení (ale bez bližších detailov) môžeme nájsť v práci Johna Collinsa Warrena (1889), chirurga známeho predovšetkým vďaka demonštrácii prvej éterovej anestézie, ale s mimoriadnym záujmom o patológiu - jeho zbierka patologických preparátov slúžila na Harvarde na výuku medikov až do 50. rokov 20. storočia (5,6). V roku 1891 vykonal William Henry Welch, prvý profesor patológie a prvý dekan Johns Hopkins University, prvé peroperačné vyšetrenie vyžiadané klinikom, slávnym chirurgom Williamom Stewartom Halstedom. Halsted odstránil tumor prsníka, ktorý makroskopicky najprv považoval za benígny, po jeho rozpolení však zneistel. Peroperačné vyšetrenie Welchovi pravdepodobne trvalo príliš dlho a v momente keď slávny patológ prišiel nahlásiť, že lézia je naozaj benígna, Halsted už operáciu dokončil (sic! aká dávna to tradícia). O ďalšie peroperačné vyšetrenie Halsted nepožiadal viac ako 25 rokov (7). Prvenstvo publikácie metodiky vyšetrenia v zmrazených rezoch je pripisované Thomasovi Stephenovi Cullenovi, profesorovi gynekológie a prvému gynekologickému patológovi v Johns Hopkins (1895). Popísal dve metodiky – prvú, kratšiu, na bežné použitie a druhú určenú pre „jemné tkanivá“, napr. kyrety endometria (trvala najmenej dve hodiny). Použitím kratšej metodiky bolo možné hlásiť diagnózu už za 15 minút (8). Následne bolo popísaných niekoľko metodík, napr. Ludwigom Pickom v roku 1897 (9). Štandardná a spoľahlivá metodika s použitím kryostatu, používaná s malými modifikáciami prakticky až dodnes, však bola popísaná až v roku 1905 Louisom Blanchardom Wilsonom, prvým šéfom patológie na Mayo Clinic v Minesote. Metodika trvala iba jeden a pol minúty od momentu položenia tkaniva na mraziacu platničku mikrotómu (10,11). Skúsenosti s peroperačnou diagnostikou neskôr Wilson zhrnul vo viacerých článkoch (12,13). V týchto prácach môžeme nájsť niekoľko zaujímavých konštatovaní, ktoré bez výnimky platia až dodnes. Wilson napr. konštatuje, že chirurg musí vedieť či je lézia zápalová alebo neoplastická ešte kým je pacient na operačnom stole, aby na základe svojich vedomostí mohol obmedziť alebo rozšíriť chirurgický výkon. Alebo upozorňuje, že peroperačné vyšetrenie má svoje limity a je nemožné počas piatich minút, ktoré je chirurg ochotný zvyčajne čakať, vyšetriť mikroskopicky každú časť zaslaného tkaniva. Alebo, že chirurg je zodpovedný za výber materiálu na mikroskopické vyšetrenie a pri tomto výbere musí predviesť excelentné zhodnotenie makroskopického patologického nálezu (12,13). V závere publikácie z roku 1913 (!) zdôrazňuje, že presná mikroskopická diagnóza prítomnosti alebo neprítomnosti karcinómu by mala byť stanovená počas trvania prvej operácie a každá nemocnica, v ktorej sa vykonávajú operácie nádorov by mala mať laboratórium, operačnú miestnosť, trénovaného patológa ako aj trénovaného chirurga. V opačnom prípade by sa to malo považovať za kriminálnu nedbanlivosť (12).
INDIKÁCIE PEROPERAČNEJ BIOPSIE
Indikácie a počet peroperačných vyšetrení sa medzi jednotlivými inštitúciami môžu značne líšiť a sú závislé od typu inštitúcie v ktorej sa vykonávajú, odbornosti a počtu chirurgov-špecialistov a typu operačných výkonov (obr. 1). V roku 1989 organizácia College of American Pathologists (CAP) zisťovala aké je používanie peroperačných biopsií v 297 inštitúciách v Severnej Amerike počas obdobia piatich mesiacov. Peroperačné biopsie boli vyžiadané celkovo v 5,6 % chirurgických prípadov (7,3 % všetkých materiálov, priemerne 1,5 peroperačných vyšetrení na prípad), pričom frekvencia peroperačných vyšetrení proporcionálne rástla s veľkosťou inštitúcie od menej ako 5% v inštitúciách s počtom postelí < 150 až po 15 % v inštitúciách s počtom postelí > 600 (14).
Obr. 1. Počet peroperačných biopsií na Oddelení patológie Univerzitnej nemocnice L. Pasteura v Košiciach v rokoch 1997-2016. Až do roku 2013 (s výnimkou roku 2003) boli každý rok peroperačné biopsie vykonané v ~ 7-9 % všetkých materiálov. V roku 2013 došlo pravdepodobne z dôvodu reorganizácie pracoviska patológie (servis pre dve nemocnice s obmedzením peroperačnej služby v jednej z nemocníc každý deň iba na obmedzený čas) k poklesu vyžiadaných vyšetrení. 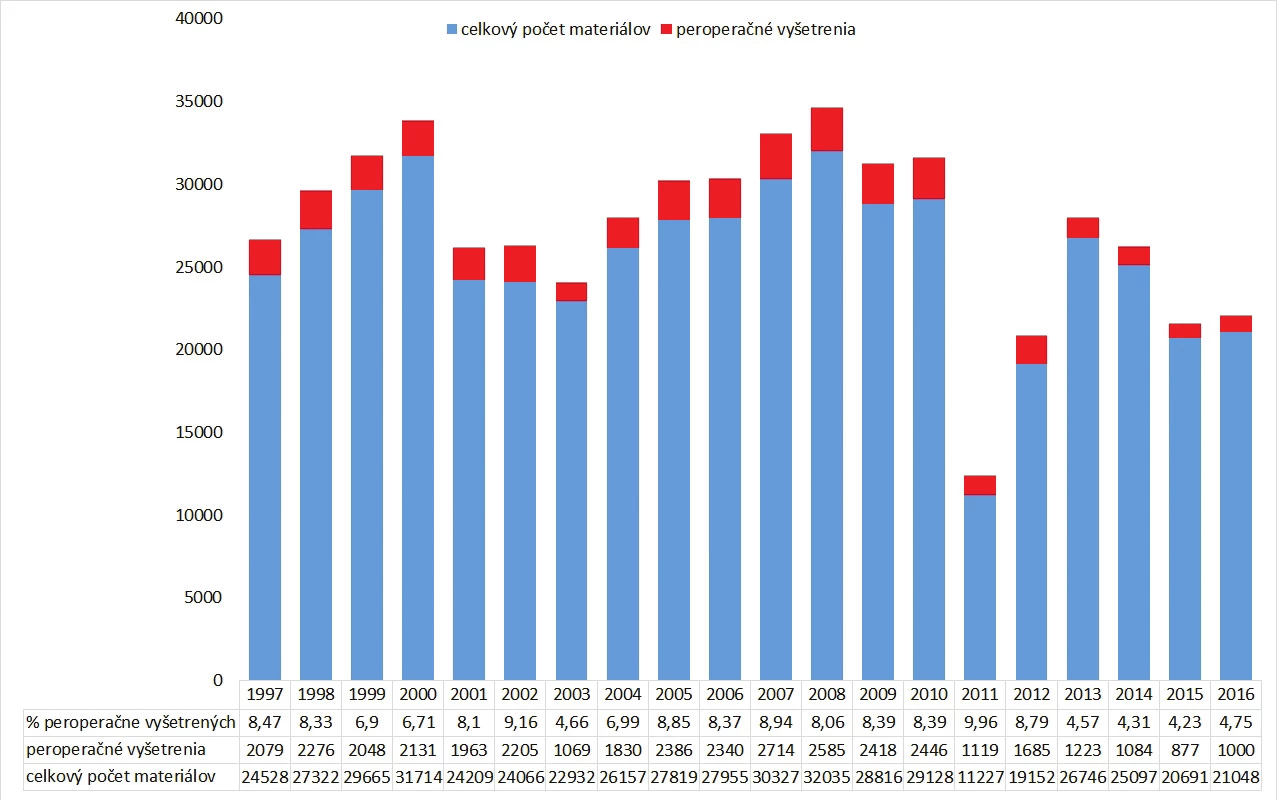
Základným pravidlom peroperačného vyšetrenia je, že výsledok ovplyvní operačný postup, alebo bezprostrednú pooperačnú starostlivosť o pacienta. To, že výsledok správne indikovanej „peroperačky“ v niektorých prípadoch postup v skutočnosti nezmení, by patológa nemalo zbytočne rozčúliť, pretože operatér sa nakoniec môže rozhodnúť postupovať iným spôsobom, napríklad na základe novovzniknutej situácie počas operácie. Patológ by mal túto skutočnosť akceptovať, pretože primárnu zodpovednosť za pacienta ležiaceho na operačnom stole má operatér.
K najtypickejším indikáciám na peroperačné vyšetrenie napríklad patrí (3,15,16):
Vyšetrenie suspektného tkaniva (nádor versus nenádorové zmeny). V prípade diagnózy nenádoru chirurg zvolí konzervatívnejší postup, prípadne ďalej hľadá predpokladaný nádor. V prípade niektorých nenádorových zmien (napríklad prítomnosť akútneho zápalu v periprotetickom tkanive pri výmene umelého kĺbu) sa taktiež operačný postup môže meniť (náhrada kĺbu až po preliečení infekcie).
Stanovenie dignity, prípadne aj histologického typu nádoru. Ak ide o benígny nádor, nie je nutný ďalší chirurgický staging a resekčné okraje nemusia byť až také dôležité. V prípade diagnózy lymfoproliferatívneho ochorenia často stačí diagnostická biopsia a v resekci sa nepokračuje.
Grading malígnych lézií. Grade a hĺbka invázie endometroidného adenokarcinómu ovplyvní rozhodovanie o vykonaní samplingu lymfatických uzlín. Prítomnosť pankreatickej intraepitelovej neoplázie 3 (PanIN-3) na resekčnom okraji pankreasu je indikáciou na rozšírenie resekcie. (PanIN-1 a PanIN-2 sú pri hodnotení okraja nepodstatné).
- Potvrdenie metastatického postihnutia v lymfatických uzlinách alebo metastázy na iných miestach. Niektoré malignity sú v prípade potvrdenej metastázy považované za chirurgicky neliečiteľné.
- Posúdenie resekčných okrajov. Má skutočný zmysel iba v prípadoch, kde je potenciálne možné ďalšie rozšírenie výkonu smerom do zdravého tkaniva.
- Zhodnotenie reprezentatívnosti tkaniva za účelom ďalšieho spracovania (flowcytometria, genetické vyšetrenie, „tissue banking“).
Patológ by v momente hodnotenia peroperačnej biopsie mal mať k dispozícii všetky relevantné klinické údaje, v dostatočnom rozsahu vedieť aký je postup operácie, akú informáciu operatér očakáva a ako bude postup výsledkom peroperačného vyšetrenia zmenený (17).
Chirurg je zodpovedný za správnu a zrozumiteľnú orientáciu tkaniva (stehy, klipy, vodiče, označenie farbou), prípadne označí aj miesto, z ktorého sa má peroperačné vyšetrenie vykonať. V určitých prípadoch je pre správnu orientáciu a sampling lézie prinajmenšom vhodné (ak nie nevyhnutné) patológovi dodať nakreslenú schému, alebo inú grafickú dokumentáciu (RTG snímok resekátu, predoperačné CT, MRI).
ČO NIE JE INDIKÁCIOU NA PEROPERAČNÉ VYŠETRENIE
Peroperačné vyšetrenie nefixovaného tkaniva môže narušiť topografiu a vždy znamená stratu časti jedinečného a nenahraditeľného diagnostického tkaniva. Zmrazené tkanivo vyšetrené po definitívnom spracovaní v parafíne vždy vykazuje morfologické artefakty (napr. nukleárny grading alebo počítanie mitóz môžu byť nemožné)(2). Zmrazené tkanivo nie je optimálne ani na imunohistochemické vyšetrenie, ktoré je v prípade mnohých nádorov povinnou zložkou diagnózy. Bezprostredný benefit pre pacienta preto musí prevyšovať tieto negatíva.
Za zneužitie práce patológa a neefektívne nakladanie s prostriedkami možno považovať situáciu, keď je peroperačné vyšetrenie indikované iba na základe zvedavosti operatéra, pacienta, alebo príbuzných. Peroperačné vyšetrenie by taktiež nemalo byť náhradou nedostatočných znalostí z anatómie alebo makroskopickej patológie (3,15,16).
Kontraindikáciou na peroperačné vyšetrenie môže byť veľmi malá lézia, ktorú nie je možné spoľahlivo rozdeliť tak, aby bola reprezentatívna časť zachovaná na vyšetrenie v definitívnej biopsii, napríklad malý tumor prsníka, najmä ak už bol vyšetrený predoperačne v ihlovej biopsii (navyše, tukové tkanivo je takmer nemožné dobre zmraziť) (18). Rovnako je nevhodné peroperačne vyšetrovať tkanivo, ak sa vyšetrením naruší orientácia a staging, nevyhnutný pre ďalší manažment (16). V prípade, že sa patológ rozhodne kompletne zmraziť malú vzorku, vždy by si mal overiť, či na definitívne vyšetrenie dostane ďalšie tkanivo, prípadne o toto tkanivo požiadať. Kontraindikované na peroperačné vyšetrenie sú aj lézie, pri ktorých často rozhodujú jemné morfologické detaily, ktoré v peroperačnej biopsii zvyčajne nie je možné spoľahlivo hodnotiť a zmrazením celej lézie dôjde iba k znehodnoteniu tkaniva. Typickým príkladom sú napríklad melanocytárne lézie (obr. 2, 3)(19). Peroperačné vyšetrenie nedáva zmysel ani v prípadoch, kedy má nízku senzitivitu alebo špecificitu, napr. hľadanie kapsulárnej invázie vo folikulárnej alebo Hürthle cell lézii štítnej žľazy, alebo hľadanie invázie v polypoch gastrointestinálneho traktu (20,21).
Obr. 2. Peroperačné vyšetrenie melanocytárnej lézie (A, B). Jednalo sa o léziu v tesnej blízkosti klinicky suspektného skvamocelulárneho karcinómu v kapilíciu (viď obr. 3). Kombinácia artefaktov (odber „teplým“ nožom + zmrazenie tkaniva) prakticky neumožňovali spoľahlivé hodnotenie morfológie. Peroperačná diagnóza: melanocytárna lézia nejasnej dignity, nemožno vylúčiť melanóm. V definitívnej biopsii po spracovaní tkaniva v parafíne (C, D) bola morfológia nehodnotiteľná a definitívna diagnóza nebola stanovená, v tomto prípade našťastie bez dôsledkov pre pacienta. 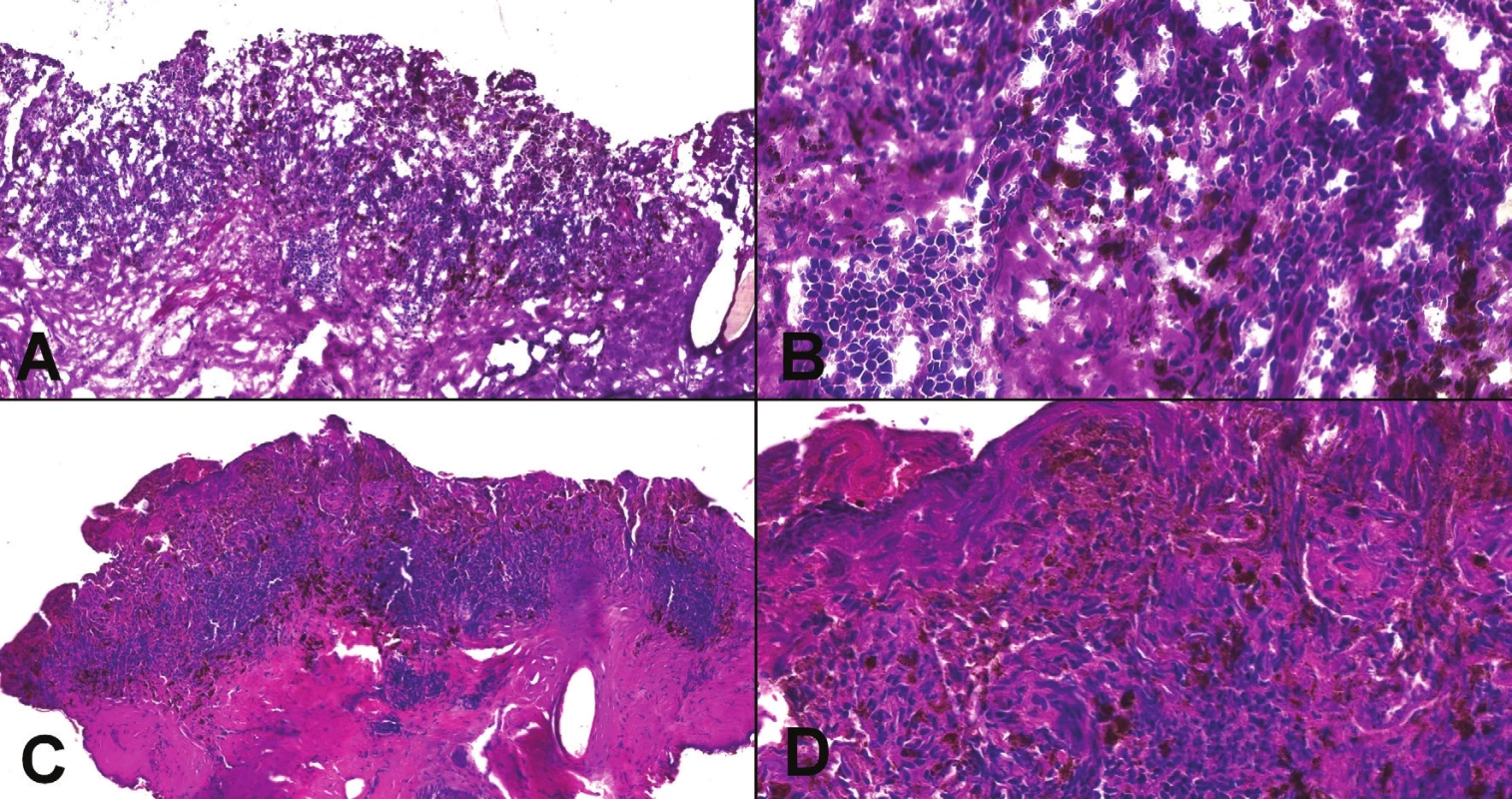
Obr. 3. Peroperačné vyšetrenie hlavnej lézie v kapilíciu, ktorá bola klinicky považovaná za skvamocelulárny karcinóm. Jednalo sa o nodulárne ložisko pod intaktnou epidermis (A). Tumor bol zložený prevažne z pleomorfných vretenitých buniek, s početnými mitózami. Celkom ojedinele nádorové bunky obsahovali hnedý pigment (B). Peroperačná diagnóza: malígny melanóm. 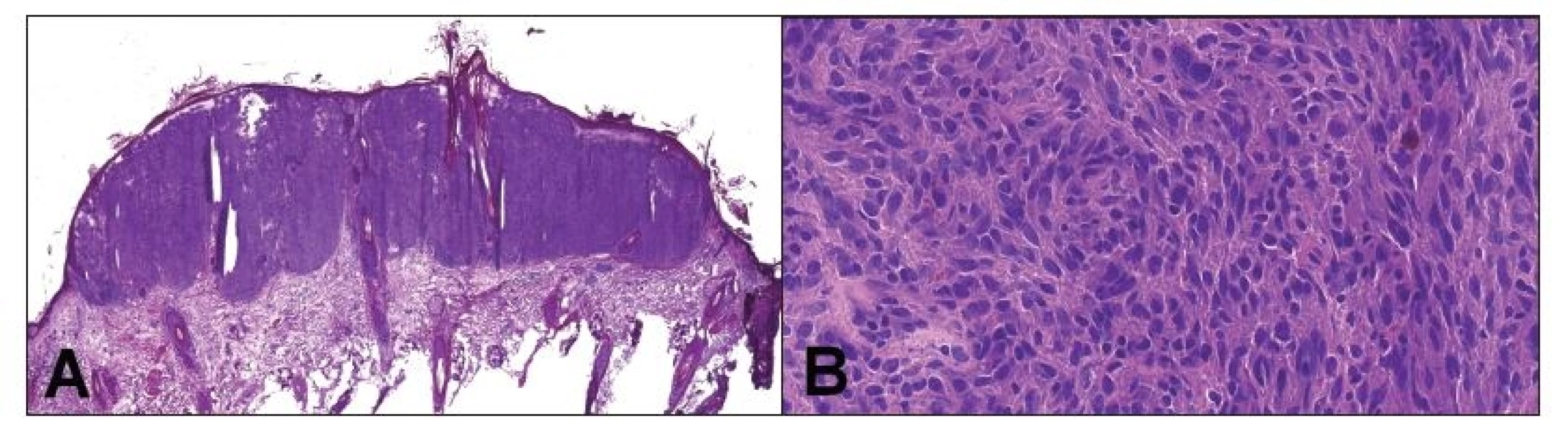
Patológ, ktorý je primárne zodpovedný za správne spracovanie tkaniva a definitívnu diagnózu, v týchto prípadoch musí hájiť predovšetkým záujem pacienta (a v konečnom dôsledku aj chirurga) a má právo peroperačné vyšetrenie odmietnuť. Zrušeniu peroperačného vyšetrenia však musí vždy predchádzať komunikácia s operatérom (3,15,16).
KONTROLA KVALITY A KOMUNIKÁCIA S KLINIKOM
Pri peroperačnom vyšetrení platia všetky všeobecné pravidlá pre manipuláciu s bioptickým materiálom. Keďže ide o materiály nefixované, je mimoriadne dôležité nepodceniť riziko infekcie. Dôležité je aj správne označenie materiálu a zhotovených preparátov, tak aby nedošlo k zámene, najmä ak sa súčasne vyšetruje viacero pacientov.
Zmrazené tkanivo musí byť vždy spracované aj tradičným spôsobom v parafíne, aby bolo možné porovnanie peroperačne vyšetrených rezov s definitívnym vyšetrením. Peroperačný nález je vždy súčasťou definitívneho bioptického záveru, pričom by mal obsahovať vysvetlenie prípadnej nezhody. Táto prax umožnuje identifikovať a vyriešiť prípadné technické alebo interpretačné problémy (3).
Aj keď je peroperačné histologické vyšetrenie často komplikované artefaktami, vyšetrená je často iba malá časť zaslaného tkaniva a patológ pracuje pod veľkým tlakom, jeho presnosť je prekvapujúco vysoká. Vo veľkej severoamerickej štúdii bola po vylúčení prípadov bez diagnózy s odkazom na definitívnu biopsiu (tvorili 4,2 %) zistená konkordacia medzi peroperačnými diagnózami a definitívnym záverom 98,3 % (14). Najčastejšími príčinami diskordantných diagnóz boli sampling lézie (44,8 %), nesprávna interpretácia (40 %), ťažkosti pri krájaní biopsie (12,7 %), nedostatočná anamnéza (5,6 %), ťažkosti s farbením (1,5 %), nesprávne označenie (0,5 %) a iné príčiny (3 %). Diagnostická nezhoda však závažne ovplyvnila manažment pacienta iba v 2,5 % prípadov, minimálne ovplyvnila manažment v 20 % a neovplyvnila manažment v 74 % prípadov (14). Podobný počet „odložených diagnóz“ (1-3,93 %) a diagnóz s nezhodou (2,03-4,6 %) bol zistený v mnohých ďalších štúdiách z rôznych častí sveta (22-28). Pravidelné sledovanie a vyhodnocovanie počtu a príčin odložených a diskordantných diagnóz je dôležitým prostriedkom na zlepšovanie peroperačnej diagnostiky. Bolo dokázané, že dlhodobá účasť v programe kontroly kvality vedie k signifikantnému znižovaniu diskordantných prípadov, ako aj prípadov s odloženou diagnózou (29).
V bioptickom náleze musí vždy byť zaznamenaný čas príjmu materiálu a čas hlásenia výsledku. Aby bolo peroperačné vyšetrenie zmysluplnou pomocou pre operatéra a neohrozovalo pacienta zbytočným predlžovaním anestézie, je nevyhnutné aby bolo vždy vykonané v čo najkratšom možnom čase. Napríklad, štandard CAP vyžaduje, aby v 90 % prípadov boli preparáty zhotovené do 15 minút a výsledok nahlásený do 20 minút od prijatia materiálu. Tento parameter by mal byť pravidelne kontrolovaný, aby sa odstránili prípadné nedostatky a príčiny neprimerane dlhého trvania vyšetrení (3).
Zapísaná podoba hlásenia výsledku musí zodpovedať verbálnemu (najčastejšie telefonickému) podaniu (17). Výsledok peroperačného vyšetrenia by mal prevziať hlavný operatér, prípadne člen operačného tímu (lekár, v krajnom prípade napr. aj anesteziológ). Je neprijateľné aby výsledok vyšetrenia sprostredkovala sestra alebo pomocný personál. Patológ by vždy mal vedieť meno chirurga, ktorému informáciu predáva, menom identifikovať pacienta, overiť či bol výsledok operatérom správne pochopený a či peroperačné vyšetrenie splnilo jeho očakávania (17). Všetky peroperačne oznámené dodatočné informácie od operatéra, ktoré ovplyvnia finálnu diagnózu, by mali byť taktiež písomne zaznamenané.
PRAKTICKÉ RADY A DOPORUČENIA (PREDOVŠETKÝM Z VLASTNÝCH SKÚSENOSTÍ)
Peroperačná diagnostika vyžaduje pomerne široké znalosti z rôznych subšpecializácií diagnostickej patológie (samozrejme závisí od typu pacientov a operácií v konkrétnej inštitúcii). Najspoľahlivejšia peroperačná diagnostika preto pravdepodobne bude na veľkých pracoviskách, kde sú k dispozícii špecialisti na jednotlivé oblasti, najlepšie vo viacnásobnom zastúpení. V našich podmienkach je však prítomnosť špecialistu často iba zbožným prianím a preto je viac ako vhodné v rámci tréningu zapájať do peroperačnej diagnostiky rezidentov od prvých dní nástupu do praxe. Takto je možné dosiahnuť, že prechod do „ostrej“ prevádzky, keď mladý patológ prvý krát samostatne rieši „zmrazák“, bude bezbolestný a bezpečný pre pacienta ako aj samotného patológa. Nie je nič stresujúcejšie, ako keď prvú peroperačnú biopsiu patológ hodnotí až po atestácii (bohužiaľ, aj to sa stále stáva).
Veľkou pomocou je dobrá príprava. Ideálne je, keď je kompletný zoznam operácií s označením potenciálnych peroperačných vyšetrení doručený na pracovisko patológie deň vopred. Umožní to patológovi pripraviť sa na peroperačné vyšetrenie v oblasti, ktorú úplne dobre neovláda, alebo sa s ňou stretáva iba zriedkavo. Prípadné nejasnosti týkajúce sa cieľov peroperačného vyšetrenia je vhodné prediskutovať ešte pred operáciou. Peroperačná biopsia by nemala byť urgentným, núdzovým, alebo náhodne indikovaným vyšetrením, ale elektívnym výkonom (15).
Nevyhnutnou podmienkou úspechu sú dobré základy z makroskopickej patológie a správny výber miesta vyšetrenia (pokiaľ nie je označené chirurgom). Pri znalosti klinickej anamnézy a radiologických nálezov sa u mnohých lézií s veľkou istotou dá určiť histologická diagnóza už samotným makroskopickým vyšetrením a mikroskopické vyšetrenie je potom iba formalitou.
Peroperačná biopsia takmer každého materiálu môže byť doplnená o cytologické vyšetrenie. Ide o presnú techniku, ktorá často umožní správnu peroperačnú diagnózu aj v prípadoch keď sú zmrazené rezy nediagnostické (30,31). Pri niektorých typoch tkanív (napríklad nádory mozgu), je cytologické vyšetrenie v podstate štandardom. Cytológia na rozdiel od zmrazených rezov poskytne dokonalé detaily buniek. V kombinácii s architektonikou tkaniva v mnohých prípadoch poskytuje dokonalý cyto-histologický obraz. Existuje viacero možností ako zhotoviť cytologický preparát. Najjednoduchší je obyčajný otlačok („imprint“), vhodný napríklad na vyšetrenie lymfatických uzlín alebo štítnej žľazy. Podľa našej skúsenosti sa však omnoho lepšie výsledky dajú dosiahnuť jemným zoškrabaním vyšetrovaného povrchu pomocou žiletky a následným natretím získaných buniek na sklo (31). Cytologické preparáty je možné peroperačne ofarbiť hematoxylínom-eozínom aj PAP-om, obe farbenia sú rovnako dobré a rýchle.
Peroperačná diagnóza je v niektorých prípadoch ťažká až nemožná (z rôznych príčin). V niektorých prípadoch pomôže konzultácia s kolegom. Niekedy je nyvyhnutné požiadať operatéra o ďalšie tkanivo. Poslednou možnosťou je odkaz na definitívnu biopsiu. Je to najbezpečnejší spôsob ako predísť chybe, ktorá by potenciálne mohla ohroziť pacienta. Odkaz na definitívnu biopsiu by však nemal byť zneužívaný (cca 4% frekvencia je prijateľná, viď vyššie) a patológ by vždy mal operatérovi aspoň stručne vysvetliť, prečo diagnóza v konkrétnom prípade nie je možná. Na druhej strane, dobre edukovaný chirurg, ktorý ovláda limity peroperačnej diagnostiky, nebude kolegu patológa nútiť aby za každých okolností povedal „akúkoľvek“ diagnózu.
PREHLÁSENIE
Autor práce prehlasuje, že v súvislosti s témou, vznikom a publikácií tohto článku nie v konflikte záujmov a vznik ani publikácia článku neboli podporené žiadnou farmaceutickou firmou. Toto prehlasenie sa týka i všetkých spoluautorov.
Adresa pre korešpondenciu:
MUDr. Marián Švajdler, Ph.D.
Bioptická laboratoř, s.r.o.
Mikulášske nám. 4
326 00 Plzeň, Česká republika
tel.: +420 737220036
e-mail: svajdler@yahoo.com
Zdroje
1. Matěj R, Vedralová J, Koukolík F. Imunohistochemický průkaz TTF-1 v peroperačních bioptických vzorcích plicních adenokarcinomů: roční zkušenosti. Cesk Patol 2008; 44(2): 41-44.
2. Taxy JB. Frozen section and the surgical pathologist: a point of view. Arch Pathol Lab Med 2009; 133(7): 1135-1138.
3. Montag AG. History of the frozen section. In: Taxy JB, Husain AN, Montag AG, eds. Biopsy interpretation: the frozen section. Philadelphia, PA, Lippincott Williams & Wilkins; 2014 : 1–15.
4. Bloodgood JC. When cancer becomes a microscopic disease, there must be tissue diagnosis in the operating room. JAMA 1927; 88(13): 1022–1023.
5. Warren JC. The early diagnosis of malignant growths. Transactions of the American Surgical Association 1889; 7 : 9-24.
6. Scully RE, Vickery AL. Surgical pathology at the hospitals of Harvard Medical School. In: Rosai J, ed. Guiding the surgeon’s hand: The History of American Surgical Pathology. Washington, DC, American Registry of Pathology; 1997 : 87–110.
7. Carter D. Surgical pathology at Johns Hopkins. In: Rosai J, ed. Guiding the Surgeon’s Hand: The History of American Surgical Pathology. Washington, DC, American Registry of Pathology; 1997 : 23–39.
8. Cullen TS. A rapid method of making permanent sections from frozen sections by the use of formalin. Johns Hopkins Hosp Bull 1895; 6(49): 67.
9. Pick L. A rapid method of preparing permanent sections for microscopical diagnosis. BMJ 1897; 1(1881): 140–141.
10. Wilson LB. A method for the rapid preparation of fresh tissues for the microscope. JAMA 1905; 45(23): 1737.
11. Woolner LB. Surgical pathology at the Mayo Clinic. In: Rosai J, ed. Guiding the Surgeon’s Hand: The History of American Surgical Pathology. Washington, DC: American Registry of Pathology; 1997 : 145–179.
12. Wilson LB. The microscopic examinations of fresh tissues for the diagnosis of early cancer. St Paul Med J 1913; 15(6): 274-278.
13. Wilson LB. Microscopic examination of fresh tissue, and necropsy service in relation to surgery. Ann Surg 1925; 81(4): 863-868.
14. Zarbo RJ, Hoffman GG, Howanitz PJ. Interinstitutional comparison of frozen-section consultation. A College of American Pathologists Q-Probe study of 79,647 consultations in 297 North American institutions. Arch Pathol Lab Med 1991; 115(12): 1187-1194.
15. Jaafar H. Intra-operative frozen section consultation: concepts, applications and limitations. Malays J Med Sci 2006; 13(1): 4-12.
16. Lechago J. The frozen section: pathology in the trenches. Arch Pathol Lab Med 2005; 129(12): 1529-1531.
17. Nakhleh RE. Quality in surgical pathology communication and reporting. Arch Pathol Lab Med 2011; 135(11): 1394-1397.
18. Wells CA. Quality assurance guidelines for pathology. Open biopsy and resection specimens. In: Perry N, Broeders M, de Wolf C, Törnberg S, Holland S, von Karsa L, eds. European Commission. European guidelines for quality assurance in breast cancer screening and diagnosis (4th ed). Luxembourg, Office for Official Publications of the European Communities; 2006 : 257-311.
19. Smith-Zagone MJ, Schwartz MR. Frozen section of skin specimens. Arch Pathol Lab Med 2005; 129(12): 1536-1543.
20. LiVolsi VA, Baloch ZW. Use and abuse of frozen section in the diagnosis of follicular thyroid lesions. Endocr Pathol 2005; 16(4): 285-293.
21. Younes M. Frozen section of the gastrointestinal tract, appendix, and peritoneum. Arch Pathol Lab Med 2005; 129(12): 1558-1564.
22. Howanitz PJ, Hoffman GG, Zarbo RJ. The accuracy of frozen-section diagnoses in 34 hospitals. Arch Pathol Lab Med 1990; 114(4): 355-359.
23. Hayes MM, Jones EA, Zhang DY. Diagnoses made by frozen-section examination of surgical specimens in a small Canadian hospital. Can J Surg 1993; 36(3): 236-240.
24. Ahmad Z, Barakzai MA, Idrees R, Bhurgri Y. Correlation of intra-operative frozen section consultation with the final diagnosis at a referral center in Karachi, Pakistan. Indian J Pathol Microbiol 2008; 51(4): 469-473.
25. Winther C, Graem N. Accuracy of frozen section diagnosis: a retrospective analysis of 4785 cases. APMIS 2011; 119(4-5): 259-262.
26. Mahe E, Ara S, Bishara M, et al. Intraoperative pathology consultation: error, cause and impact. Can J Surg 2013; 56(3): E13-18.
27. Hatami H, Mohsenifar Z, Alavi SN. The Diagnostic accuracy of frozen section compared to permanent section: a single center study in Iran. Iran J Pathol 2015; 10(4): 295-299.
28. Sams SB, Wisell JA. Discordance between intraoperative consultation by frozen section and final diagnosis. Int J Surg Pathol 2017; 25(1): 41-50.
29. Raab SS, Tworek JA, Souers R, Zarbo RJ. The value of monitoring frozen section-permanent section correlation data over time. Arch Pathol Lab Med 2006; 130(3): 337-342.
30. Scucchi LF, Di Stefano D, Cosentino L, Vecchione A. Value of cytology as an adjunctive intraoperative diagnostic method. An audit of 2,250 consecutive cases. Acta Cytol 1997; 41(5): 1489-1496.
31. Shidham V, Gupta D, Galindo LM, et al. Intraoperative scrape cytology: comparison with frozen sections, using receiver operating characteristic (ROC) curve. Diagn Cytopathol 2000; 23(2): 134-139.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek Peroperační biopsie (1. díl)Článek Lidí málo, práce hodně
Článok vyšiel v časopiseČesko-slovenská patologie

2018 Číslo 2-
Všetky články tohto čísla
- Peroperační biopsie (1. díl)
- Lidí málo, práce hodně
- Monitor aneb nemělo by vám uniknout, že...
- Peroperačná biopsia: história, indikácie, kontraindikácie a kontrola kvality
- Peroperačné vyšetrenie pankreasu, žlčníka, extrahepatálnych žlčových ciest, pečene a gastrointestinálneho traktu
- Vzpomínka na MUDr. Šimona Vagundu
- Peroperační biopsie oblasti hlavy a krku, štítné žlázy a příštitných tělísek, měkkých tkání a kostí a urogenitálního traktu
- Dysplazie a adenokarcinom jícnu: studie dvojité exprese intestinálních a gastrických markerů
- Výsledky morfologické depistáže Lynchova syndromu v období 2013-2016
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Peroperačná biopsia: história, indikácie, kontraindikácie a kontrola kvality
- Peroperačné vyšetrenie pankreasu, žlčníka, extrahepatálnych žlčových ciest, pečene a gastrointestinálneho traktu
- Peroperační biopsie oblasti hlavy a krku, štítné žlázy a příštitných tělísek, měkkých tkání a kostí a urogenitálního traktu
- Peroperační biopsie (1. díl)
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



