-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Virové hepatitidy na začátku 21. století – význam jaterní biopsie v kontextu rozvoje neinvazivních diagnostických metod a ve vztahu k moderní léčbě chronických virových hepatitid
Viral hepatitis at the beginning of the 21th century – value of liver biopsy in the context of development of new non-invasive diagnostic methods and in relation to the modern therapy of chronic viral hepatitis
The rapid progress in the development of virostatic agents over the past 15 years has changed chronic viral hepatitis from causally incurable diseases to diseases that may be treated or even cured. But, the treatment is a long-term process and it remains very expensive. Therefore, it is important to establish the correct diagnosis with the exact stratification of the disease (in terms of serological findings, regarding the activity of the inflammation and alterations of liver parenchyma) to determine the appropriate treatment schedule.
The text includes an overview of histopathological classifications of chronic hepatitis from the clinical perspective; we discuss the contribution of liver biopsy in the era of the development of non-invasive diagnostic methods for determining the degree of alteration of liver parenchyma (elastography in particular). Furthermore, the principles of modern therapy of the most common chronic viral hepatitis (i.e. B and C) are summarized with emphasis on situations where the histopathological examination of liver tissue plays a role in the indication or affects the treatment schedule.Keywords:
viral hepatitis – diagnostics – treatment of chronic hepatitis – fibrosis – liver biopsy – elastography
Autori: J. Hobstová 1,3; A. Vitouš 2,3
Pôsobisko autorov: Infekční oddělení, Fakultní nemocnice v Motole, Praha 1; Infekční oddělení, Krajská nemocnice Liberec 2; III. klinika infekčních a tropických nemocí, Univerzita Karlova v Praze, 1. lékařská fakulta a Fakultní nemocnice na Bulovce, Praha 3
Vyšlo v časopise: Čes.-slov. Patol., 47, 2011, No. 2, p. 44-49
Kategória: Přehledový článek
Súhrn
Za posledních 15 let změnil rychlý pokrok ve vývoji virostatik chronické virové hepatitidy z kauzálně neléčitelných onemocnění na nemoci, které lze u celé řady pacientů léčit a vyléčit. Léčba je však dlouhodobá a velmi nákladná. I proto je důležitá správná diagnóza s přesnou stratifikací onemocnění (z pohledu sérologického, ohledně aktivity zánětu i pokročilosti přestavby jaterního parenchymu) pro určení vhodného léčebného schématu.
V textu je podán přehled histopatologických klasifikací chronických hepatitid z klinického pohledu, diskutováno je postavení a přínos jaterní biopsie v době rozvoje neinvazivních metod pro stanovení stupně přestavby jaterního parenchymu (především elastografie). V závěru jsou shrnuty principy moderní léčby nejčastějších chronických virových hepatitid (B, C) se zdůrazněním situací, kde může histopatologické vyšetření jaterní tkáně sehrát roli v indikaci nebo ovlivnění léčebného schématu.Klíčová slova:
virová hepatitida – léčba chronických hepatitid – fibróza – biopsie jater – elastografiePosledních padesát let se bez nadsázky dá nazvat zlatou érou hepatologie. Na její scéně se odehrálo mnoho převratných objevů, od postupného objevení původců hepatitid, způsobu přenosu, vývoje účinných vakcín proti hepatitidě A a B až po současné možnosti antivirové léčby chronických forem hepatitid a jejich komplikací. V posledních několika letech byly vyvinuty zobrazovací metody, které jsou schopny detekovat stupeň fibrózy jater, a tím zejména u chronických hepatitid poněkud snížily význam jaterních biopsií a přímého mikroskopického vyšetření jaterní tkáně, i když o aktivitě zánětu tyto metody nevypovídají nic, a v diferenciální diagnostice jaterních onemocnění se bez biopsie stále neobejdeme.
Následující text bude věnován současným možnostem diagnostické stratifikace pacientů s chronickými virovými hepatitidami s návazností na moderní antivirovou léčbu.
Histologické klasifikace chronických hepatitid pohledem klinika
Objevení virů hepatitid a poznávání jejich patogeneze vyvolává již desítky let touhu po adekvátní histologické klasifikaci. První mezinárodní klasifikace byla publikována v roce 1968 a přinášela rozdělení chronických hepatitid na chronickou perzistující a chronickou aktivní (agresivní) hepatitidu na podkladě histologických nálezů (1). Obě tyto jednotky odlišuje závažnost zánětlivé infiltrace, rozsah piecemeal nekróz a strukturálních změn v parenchymu jater. Klasifikace je slovní, zánět hodnocen jako mírný, střední či těžký. Předpokládalo se, že aktivní hepatitida měla tendenci k progresi do cirhózy, perzistující nikoliv. V roce 1971 je k hodnocení přidán topografický popis (chronická lobulární, portální a periportální hepatitida). Objevují se některá histologická zjištění rozdílných nálezů hepatitid B u intravenózních uživatelů drog na rozdíl od jinak přenesených HBV infekcí, později vychází najevo, že šlo o histologii chronických hepatitid C. První numerický klasifikační systém v roce 1981 – Knodell HAI (Histological Activity Index) – zavádí pojem grading hodnotící zánětlivé změny ve třech kategoriích (dvě pro nekrotické změny, jedna pro zánětlivé) a staging klasifikující fibrotické změny v jedné kategorii (2). Předpokládalo se, že vznikne univerzální hodnotící systém využitelný pro všechny typy jaterních nemocí (metabolické, virové i autoimunitní), výhodné též bylo snažší porovnávání jednotlivých nálezů (číslo místo dlouhého slovního hodnocení). Nevýhodou tohoto systému byl sumární výsledek (jedno číslo sčítající grade i stage). Brzy však začalo být zřejmé, že cirhotická progrese je možná i u zpočátku histologicky zdánlivě „neaktivních“ nemocí, do klasifikační hry tedy vstupuje i etiologie. V roce 1991 Scheuer cítí potřebu zavedení klasifikace pouze pro hepatitidy, vydává schéma hodnotící grade (2 kategorie) a stage (1 kategorie) v jednodušším schématu (tab. 1) než Knodell (3). V roce 1994 Ishak navrhuje úpravu původního schématu (Knodell-HAI), odděluje grading (4 kategorie) a staging (3 kategorie), aktivita je hodnocena v jednotlivých prvcích ve smyslu ano/ne – přítomný, nepřítomný (4). V roce 1995 Batts a Ludwig vydávají hodnocení podobné Scheuerovi, avšak na podkladě vizuálního, nikoli slovního návodu (5). V témže roce Ishak modifikuje Knodell HAI (6), grade hodnotí ve 4 kategoriích, stage opět v jedné, zavádí pojem „interface hepatitis“ místo piecemeal nekrózy, na podkladě poznatků ukazujících spíše na apoptózu než nekrózu, jako hlavní jev vedoucí k lýze buněk (tab. 2). V roce 1996 francouzská skupina METAVIR vydává klasifikaci hodnotící chronické hepatitidy typu C (7) – grade (2 kategorie), stage (1 kategorie) (tab. 3).
Tab. 1. Klasifikační schéma chronických hepatitid <b>podle Scheuera.</b> 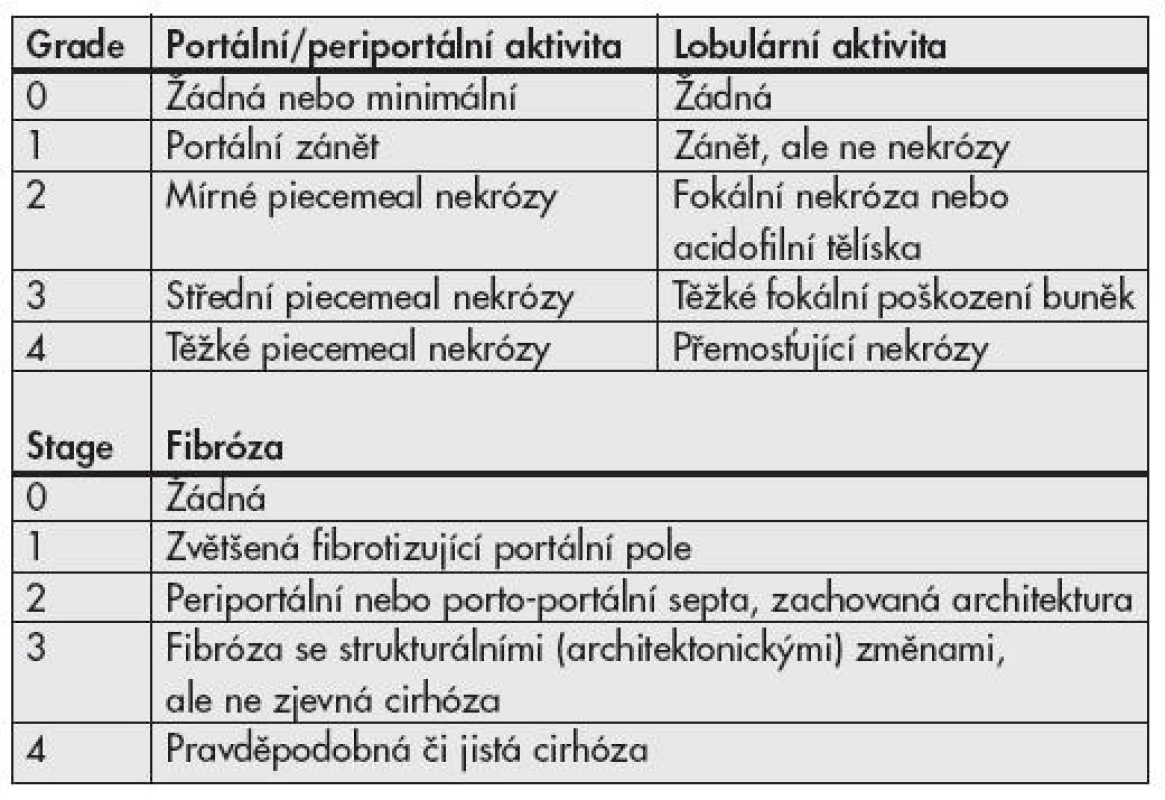
Tab. 2. Klasifikační schéma chronických hepatitid <b>Knodell HAI modifikovaný Ishakem</b> 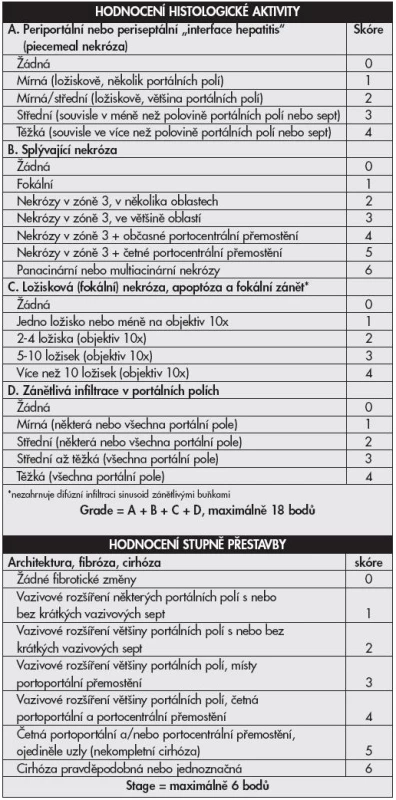
Tab. 3. Klasifikační schéma chronických hepatitid <b>METAVIR systém.</b> 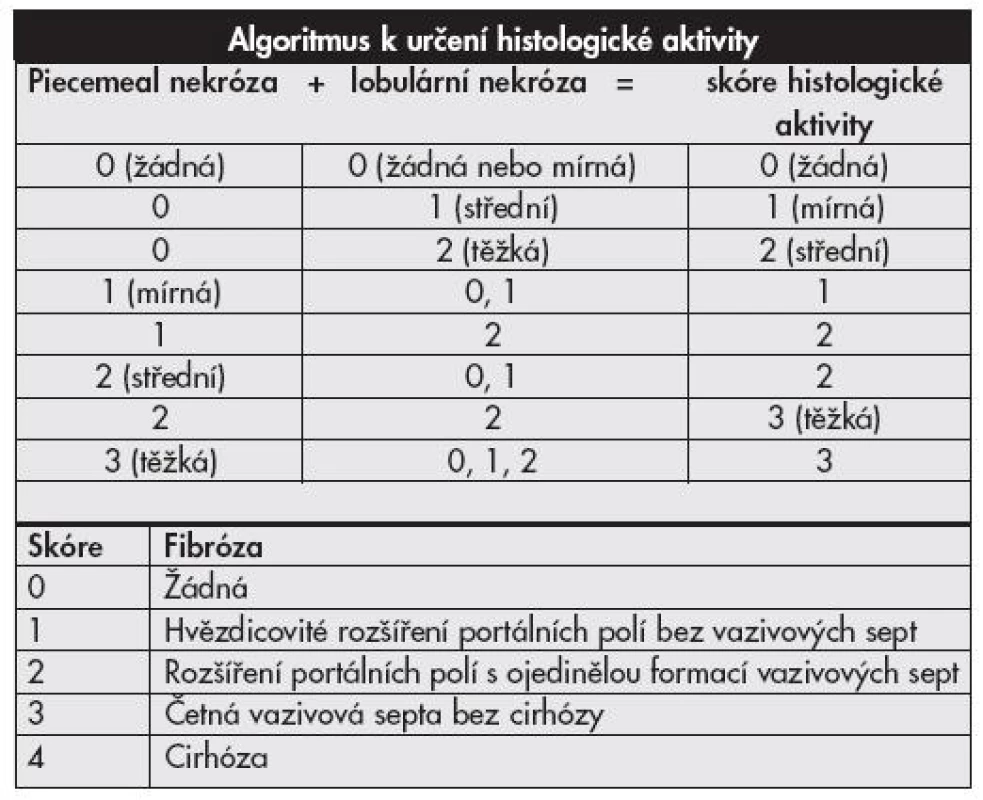
V současné době jsou nejběžněji používané klasifikace podle Ishaka (resp. modifikované Knodell-Ishak HAI schéma), Scheuera a METAVIR. Nejkomplexněji grading hodnotí Ishak (nekroticko-zánětlivé změny na škále 0–18 versus 0–4, resp. 0–3), strukturální hodnocení fibrotických změn je u všech tří systémů podobné (0–4, resp. 0–6 bodů). Bodové hodnocení bez uvedení autora klasifikace ale může být pro klinika matoucí – např. stage 4 znamená cirhózu podle Scheuera či klasifikace METAVIR, ale jen středně těžkou fibrózu podle Ishaka. Rovněž snaha o přesnou definici nemusí být vždy optimální, to se ukazuje např. u Ishakova hodnocení přítomnosti nekróz při zvětšení 10x, neboť různé mikroskopy nemají stejně velká zorná pole. Číselné skórovací systémy sčítající jednotlivé hodnocené kategorie (Ishak, METAVIR) mají určitou nevýhodu v případech, kdy v součtu stejné číslo skrývá odlišné histologické nálezy.
Je správné používat skórovací systémy vyvinuté pro virovou hepatitidu C i k hodnocení ostatních hepatitid nebo jiných jaterních onemocnění? Klasifikace užitečná v každodenní praxi nemusí být použitelná ve výzkumu či studiích a naopak. Bude tedy vyvinut další, nový a tentokrát „klasifikační džungli“ sjednocující skórovací systém nebo bude jaterní biopsie zcela nahrazena neinvazivními metodami?
Je nesporné, že klasifikovat chronickou virovou hepatitidu a stratifikovat její terapii bez dalších vyšetření hodnotících stupeň zánětu a pokročilost jaterní přestavby nelze. Ukázalo se, že zkušený klinik má při odhadu pokročilosti zánětlivých změn a přestavby jaterního parenchymu na podkladě základních klinických a laboratorních vyšetření jen poloviční senzitivitu v porovnání s biopsií (8). Otázka nutnosti provádění jaterní biopsie u chronických hepatitid se ale pravidelně vrací a současně se hledají neinvazivní vyšetřovací metody, které by se biopsii vyrovnaly, či ji zcela nahradily.
Neinvazivní metody ke stanovení stupně jaterní fibrózy
V současnosti existují dva směry neinvazivních vyšetření, které umožňují s různou úspěšností stanovit pokročilost jaterní přestavby bez nutnosti biopsie (9–11) – historicky známé biochemické markery (krevní testy) a dále nově zaváděná elastografická zobrazovací vyšetření.
Krevní testy
Biochemické markery fibrózy se dělí do dvou tříd.
Markery I. třídy jsou odvozené od molekulárně genetických principů fibrogeneze či portální hypertenze – např. kyselina hyaluronová, laminin, TGF-β, CTGF (connective tissue growth factor) nebo metaloproteinázy. Nevýhodou těchto ukazatelů je vysoká cena jejich stanovení a fakt, že se nevyskytují pouze v extracelulární matrix jater. Markery II. třídy vycházejí ze standardně prováděných laboratorních testů (např. aminotransferázy, trombocyty, α-2 makroglobulin, bilirubin) s mnohem nižší výpovědní hodnotou jejich abnormálních nálezů než u I. třídy. Byly vytvořeny algoritmy počítající s kombinací jednotlivých markerů a dalších jednoduše dostupných parametrů např. věku či pohlaví. Na předních místech v úspěšnosti se pohybuje např. Fibrotest, který hodnotí tyto markery: α-2 makroglobulin, haptoglobin, gamaglutamyltransferázu, věk, bilirubin, apolipoprotein-A1 a pohlaví (12–14).
Z provedených studií zatím vyplývá, že na podkladě biochemických markerů lze relativně spolehlivě predikovat pokročilejší fibrózu (např. METAVIR F2 a více), avšak menší strukturální změny dobře hodnotit nelze (specifita 48–100%, senzitivita 18,8–84,8%, prediktivní hodnota pozitivního testu 79,2–100%, negativního 33,1–64,3%)(12–14). Rovněž není těmito testy možné stanovit pokročilost zánětlivě-nekrotických změn.
Elastografie
V posledních letech došlo k vývoji několika elastografických metod, které neinvazivním způsobem měří elasticitu tkáně (15). Metoda je obdobou palpačního vyšetření, ale na rozdíl od něj vyšetří i nehmatné či ložiskové léze, umožňuje kvantifikaci a anatomické zobrazení. Je vhodná pro tkáně s uniformní elasticitou a využívá se k ní ultrasonografie (USG) a magnetická rezonance (MRI). K USG zobrazení elasticity jater je vyvinuta TE (transientní elastografie – přístroj Fibroscan) a ARFI (Acoustic Radiation on Force Impulse Imaging-přístroj Acuson S2000). Obě metody jsou založeny na detekci rychlosti pohybu vlny ve tkáni. TE měří rychlost šíření příčné vlny jaterní tkání (10 měření/vyšetření) pomocí vibrátoru spojeného s ultrazvukovou sondou. Rychlost propagace vlny je u TE definována Yangovým modulem pružnosti a je udávána v kPa. ARFI využívá mechanické energie ultrazvukového vlnění a touto metodou lze vytěžit jednak mapu elasticity tkáně včetně ložisek s dosahem 10 cm i kvantifikaci elasticity pomocí měření rychlosti příčné vlny v m/s s dosahem 5,5 cm. Další metodou je MR elastografie, která využívá k měření rychlost vlny fázového kontrastu (3 měření/vyšetření).
Ve smyslu hodnocení pokročilejšího stupně přestavby se zatím převážně úspěšně prezentují elastografické ultrazvukové metody. Chyb se tyto metody mohou dopouštět v přítomnosti ascitu, u pacientů obézních nebo s úzkými mezižeberními prostory. Nevýhodou je, že USG elastografie poskytuje pouze jednorozměrné anatomické zobrazení a že selhává při detekci nižších stupňů fibrózy nebo paradoxně u příliš tuhých jater (cirhóza). Chyba subjektivního hodnocení je u těchto metod malá, avšak chybí možnost hodnocení zánětlivě-nekrotických změn. Plošné využití může komplikovat i vysoká cena vyšetření (MRI elastografie).
V době medicíny založené na důkazech musejí být na pomyslnou misku vah (invazivní vs. neinvazivní vyšetřování) též přiloženy ekonomicko-etické otázky validity stanovení diagnózy jaterní cirhózy bez histologického ověření, zejména ohledně indukce další péče. Péče o pacienty s cirhózou jater, bez ohledu na etiologii, může být v čase poměrně nákladná (pravidelné USG, laboratorní vyšetřování α-fetoproteinu pro screening hepatocelulárního karcinomu, transplantační programy), někdy i pacienta obtěžující (fibroskopie jícnu pro jícnové varixy), a zatím není jisté, zda je diagnóza cirhózy neinvazivní metodou natolik validní, aby tuto péči oprávněně indukovala. Srovnání výhod a nevýhod elastografie, laboratorních markerů fibrózy a histologického vyšetření jaterní tkáně je uvedeno v tabulce č. 4.
Tab. 4. Porovnání výhod a nevýhod jaterní biopsie a neinvazivních testů pro detekci jaterní fibrózy. 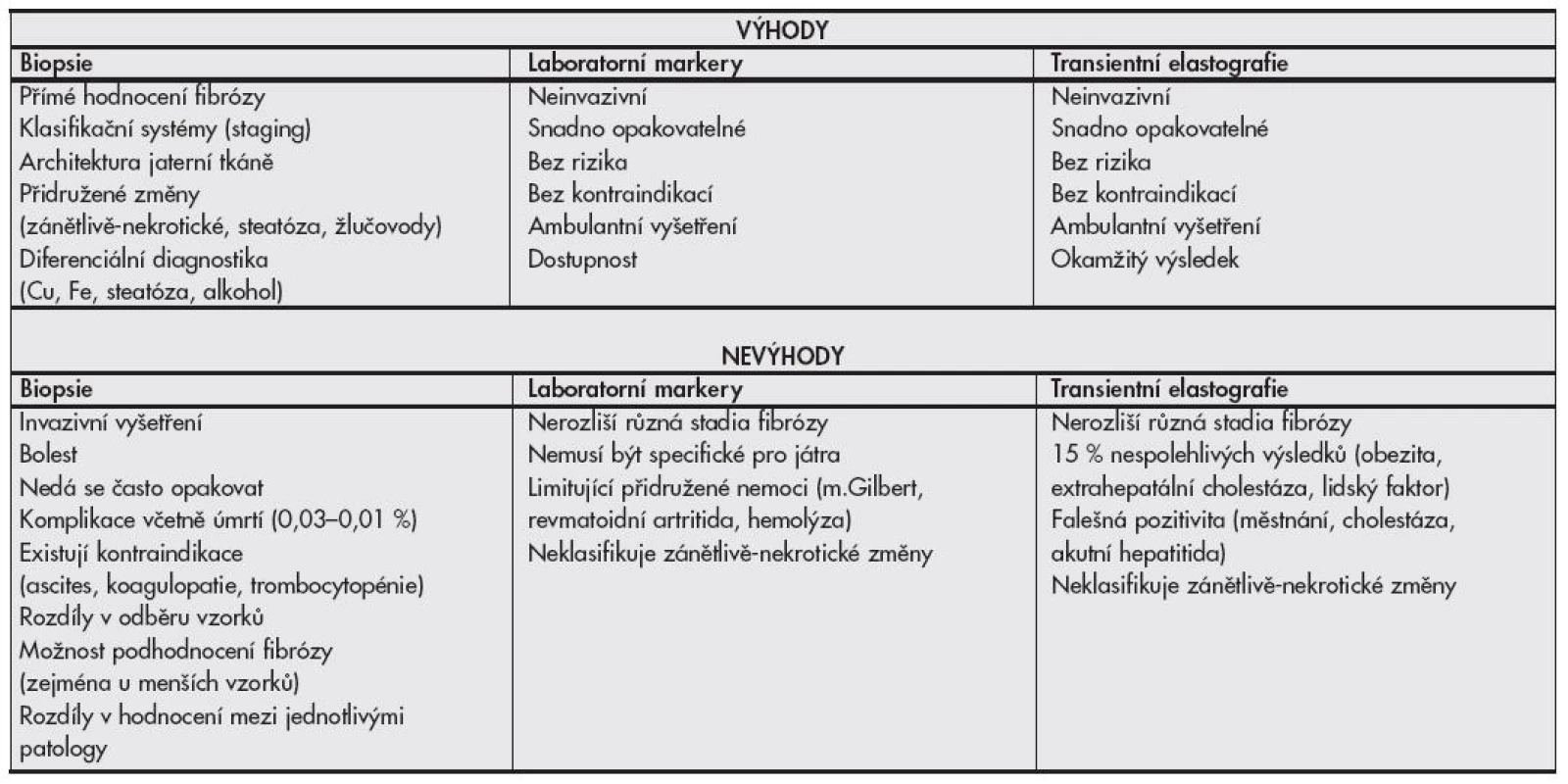
Principy moderní léčby chronických hepatitid
V následující části shrneme principy moderní léčby nejčastějších chronických virových hepatitid (VHB, VHC) a zdůrazníme místa, kde může histopatologické vyšetření jaterní tkáně sehrát roli v indikaci nebo ovlivněni léčebného schématu. Detailní informaci o současných terapeutických možnostech u všech virových hepatitid včetně možností kontroly léčebné odpovědi a komplikací naleznete v suplementárním textu na webových stránkách časopisu (16).
Virová hepatitida B (VHB)
Roční incidence v ČR, podobně jako v jiných Evropských státech, díky zavedení plošné vakcinace 12ti letých dětí v roce 2001 a v témže roce i kojenců trvale klesá (graf č. 1). Přesto celosvětové odhady říkají, že se 40 % celé lidské populace setkalo s HBV (hepatitis B virus) a přibližně 350 miliónů zůstává HBsAg pozitivních, to znamená, že trpí některou z forem chronické hepatitidy se všemi důsledky.
Graf 1. Incidence VHB v ČR 1995-2009 
Chronická VHB je charakterizována přítomností antigenu HBsAg po delší době než je 6 měsíců a může probíhat ve třech fázích:
- Fáze imunoaktivní, při které virus výrazně replikuje, zjišťujeme vysokou virémii a zároveň zvýšené hladiny aminotransferáz svědčící pro aktivní zánět.
- Fáze imunotolerantní je charakteristická vysokou virémií, ale bez hepatocelulární aktivity. Typicky se tento průběh objevuje po vertikálním přenosu HBV.
- Poslední fáze je tzv. asymptomatické nosičství, při kterém jsou enzymy jaterní cytolýzy (AST, ALT) v normě a virémie nedetekovatelná, případně nízká – cut-off virové nálože je u asymptomatického nosičství 1x 104kopií/ml (odpovídá 2 x 103 IU/ml).
Dělení na tyto tří fáze onemocnění má praktický dopad, neboť imunoaktivní forma a někdy i imunotolerantní forma je indikací k protivirové léčbě.
Imunoaktivní forma VHB je vždy indikována k antivirové léčbě. V případě imunotolerance rozhoduje o případném zahájení léčby histologický nález. Imunotolerantní forma VHB, která nesplňuje kritéria k zahájení antivirové léčby vyžaduje pravidelné kontroly, neboť je možný přechod mezi jednotlivými fázemi. Ze stejného důvodu je třeba sledovat pacienty i ve fázi asymptomatického nosičství.
Biopsie je u imunotolerantní formy VHB indikována v případě, kdy existuje i při nízké laboratorní aktivitě podezření na větší rozsah fibrózy (elastograficky lze detekovat fibrózu až od stadia METAVIR F3-4). Léčba pak není indikovaná, pokud jsou normální jaterní testy a v biopsii je aktivita zánětu nízká nebo nulová a fibróza není přítomna (tj. grade 0–1, stage 0). V ostatních případech (vyšší stage i grade) léčba indikována je a neliší se od terapie u imunoaktivní formy (viz níže). Přítomnost fibrózy má také prognostický význam – pacienti s VHB a vyšším stupněm fibrózy či cirhózou jsou předáváni do péče transplantačního centra.
Cílem antivirové léčby je utlumit virovou replikaci, udržet ji dlouhodobě na co nejnižší úrovni a tak zpomalit rozvoj fibrózy, potažmo cirhózy a jejích komplikací (17–19).
K léčbě chronické VHB se používá pegylovaný interferon (PEG-IFN) α2a v monoterapii, aplikovaný 1 x týdně subkutánně. Výhodou je, že tato léčba je časově ohraničená, trvá při dobré terapeutické odpovědi rok a neindukuje vznik rezistentních mutant. Úspěchu je ale dosahováno pouze v 25% takto léčených případů. Léčba interferonem je kontraindikována u autoimunitních onemocnění, psychiatrických onemocnění, která nejsou dobře kontrolována léčbou, a u pokročilých jaterních onemocnění.
Nemocní, u kterých nebyla monoterapie pegylovaným interferonem úspěšná nebo nemohla být z důvodu různých kontraindikací zahájena, jsou indikováni k léčbě nukleos(t)idovými analogy. Léčba těmito perorálními virostatiky je časově neomezená, tj. může probíhat i po zbytek pacientova života. Mechanismus jejich účinku je založen na inhibici reverzní transkriptázy, čímž je zabráněno kompletní dostavbě viru a tím dosaženo snížení replikace HBV. V současné době je k léčbě VHB schváleno pět přípravků s výše uvedeným mechanizmem účinku. Z nich jsou v ČR registrovány čtyři přípravky: lamivudin, adefovir dipivoxil, entecavir a tenofovir. Vývoj dalších virostatik probíhá dál, neboť podobně jako u HIV infekce používání současných virostatik vede k rozvoji rezistentních mutant HBV a ke ztrátě účinnosti podávaného virostatika. U všech virostatiky léčených pacientů pro chronickou VHB je doporučeno pravidelné sledování virové nálože, přičemž její zvýšení o 1 log10 proti nadiru (nejnižší dosažená virová nálož) již svědčí o vznikající rezistenci na podávané virostatikum a je indikací ke změně antivirové léčby.
Virová hepatitida C (VHC)
Celosvětově se počet jedinců infikovaných virem hepatitidy C (HCV) odhaduje na 170 miliónů. V ČR je každoročně hlášeno cca 850 nově diagnostikovaných onemocnění (graf č. 2). Na rozdíl od ostatních hepatitid přechází VHC téměř v 70–80% do chronického stadia, pouze 10–30% probíhá jen jako akutní hepatitida. Neléčená chronická VHC má stejné konsekvence jako chronická VHB – u 20–30% pacientů dojde během 5–20 let ke vzniku cirhózy a u 5% z nich se vyvine hepatocelulární karcinom (HCC). Incidence VHC celosvětově klesá, ale kvalifikované odhady předpovídají výrazné zvýšení s VHC souvisejících cirhóz a HCC a tudíž výrazně zvýšenou potřebu transplantací jater. To vše s sebou přinese mnohonásobně vyšší náklady na léčbu a je proto nutné snažit se o vyléčení VHC u co nejvyššího počtu pacientů dříve než u nich dojde k progresi do cirhózy.
Graf 2. Incidence VHC v ČR 1995-2009 
Indikace k antivirové léčbě. Na každého pacienta s chronickou VHC je třeba pohlížet jako na kandidáta k léčbě virostatiky. Její indikace a naléhavost je dána pokročilostí přestavby jaterního parenchymu a zvyšujícím se stupněm histologické aktivity zánětu. U chronické VHC s dlouhodobě normální hladinou ALT není jiné vyšetření, které by určilo „aktivitu“ hepatitidy, než jaterní biopsie. Až 30% pacientů s VHC a normální hladinou ALT může mít pokročilé histologické změny ve smyslu fibrotizace, což je silná indikace k protivirové léčbě.
U všech chronických VHC je nutné před zahájením antivirové léčby zjistit a) genotyp HCV, b) virovou nálož, c) laboratorní aktivitu zánětu a stupeň fibrózy.
- a) HCV má 6 genotypů (1–6, a nejméně 50 subtypů), při čemž na území ČR převažují infekce vyvolané genotypem 1. Stanovení genotypu má význam nejenom epidemiologický, ale i prognostický, u genotypu 1 a 4 se hůře dosahuje setrvalé léčebné odpovědi, zatímco u genotypu 2 a 3 je jí dosaženo v podstatně větší míře. U jednotlivých genotypů se také liší délka léčby (viz níže). Genotypizace HCV sekvenováním se vždy provádí před zahájením léčby VHC.
- b) Virová nálož se určuje kvantitativní PCR HCV RNA.
- c) Zlatým standardem k zjištění aktivity zánětu (grade) a stupně pokročilosti fibrózy či cirhózy (stage) u VHC je dnes histologické vyšetření jaterní tkáně cestou biopsie. Opakovaná jaterní biopsie nám umožňuje sledovat dynamiku pokročilosti zánětu. V poslední době je ale nutnost histologického vyšetření jater před zahájením antivirové léčby zpochybňována, zejména s ohledem k rozvoji a zvyšující se dostupnosti neinvazivních metod stanovení přestavby jaterního parenchymu.
Pacienti s pozitivní HCV RNA v séru, a věkem nad 18 let jsou indikováni k antivirové léčbě. K rozhodnutí o zahájení léčby patří zhodnocení motivace pacienta, předpokládané adherence k léčbě a absence kontraindikací. Věk, genotyp HCV, virová nálož, biochemická aktivita, histologický nález a přidružená onemocnění mají prognostický význam.
Standardní léčbou je dnes kombinace interferonu s ribavirinem (20). Ribavirin je inhibitor virové polymerázy, který umocňuje účinek interferonu indukcí interferon stimulujících cytokinů a regulací exprese řady dalších genů, a je nepostradatelným antivirotikem nejenom v kombinaci s interferonem, ale i v kombinacích s novými molekulami. Do konce 90. let byl k dispozici pouze konvenční interferon, který bylo nutno aplikovat s.c. 3x týdně. Navázáním molekuly interferonu na polyetylenglykol vznikla tzv. pegylovaná forma s prodlouženým účinkem, kterou je možno aplikovat 1x týdně s.c. K dispozici je pegylovaný interferon α2a a pegylovaný interferon α2b, oba se podávají 1 x týdně subkutánně. Oba dostupné pegylované interferony je třeba pro dosažení optimálního léčebného účinku kombinovat s perorálním ribavirinem, jehož dávka se liší v závislosti na genotypu HCV. Na genotypu HCV také záleží délka léčby – léčba VHC vyvolané genotypem 1 a 4 trvá 48 týdnů, léčba genotypů 2 a 3 trvá 24 týdnů.
Uvedenou kombinací lze dosáhnout setrvalé léčebné odpovědi (tzv. SVR – nedetekovatelná virémie 6 měsíců po ukončení léčby) cca u 60% léčených nemocných, při čemž až v 90% se daří dosáhnout SVR u genotypů 2 a 3. Zatímco u genotypů 1 a 4 se úspěchu dosahuje v necelé polovině případů.
Budoucnost antivirové léčby VHC. Vysoký počet pacientů, u kterých nebylo dosaženo SVR, motivoval vědecké týmy k vývoji nových molekul, které využívají inhibice virových enzymů, tzv. přímo působících virostatik (DAA – direct acting agens)(20,21). DAA se vyvíjejí proti několika virovým enzymům včetně virové NS3/4S proteázy, NS5B polymerázy, NS5A a NS4B. V současné době se ukončují studie ve fázi III s některými inhibitory proteáz, při čemž nejblíže ke schválení k širokému použití mají boceprevir a telaprevir. Poslední zveřejněné studie naznačují, že budou podávány do kombinace se standardní léčbou. K této nové léčbě budou pravděpodobně indikováni nemocní, kteří relabovali po standardní léčbě nebo kteří vůbec neodpověděli na standardní léčbu.
Nové molekuly jsou vyvíjeny nejenom proti virovým enzymům, ale nové poznatky o hostitelských proteinových koreceptorech (CD81, claudin-1, occludin), které umožňují vazbu a vstup do hostitelské buňky, iniciovaly vývoj molekul, které působí na opačné, tedy hostitelské straně a zasahují do životního cyklu HCV inhibicí jeho vstupu do buňky (ITX 5061). Zdá se, že hlavní roli budou tyto molekuly mít při zabránění infekce de novo naivních buněk, což by mělo velký význam po allogenních transplantacích jater k zabránění reinfekce nebo jako postexpoziční profylaxe. Klinické studie v různých fázích probíhají i s inhibitory syntézy tuků (statiny), s antagonisty cyclophyllinu (22) či inhibitory mikroRNA, která hraje klíčovou úlohu v regulování translace hostitelské mRNA (23). Výhodou molekul, které zasahují do životního cyklu HCV je vysoká bariéra k virové rezistenci, ale nevýhodou toxicita k hostitelské buňce. Studie probíhají také s terapeutickými vakcínami v kombinaci se standardní antivirovou léčbou.
Standardně používaná antivirová léčba má řadu kontraindikací a nežádoucích účinků (NÚ). Až u 75% pacientů se vyskytne jeden nebo více NÚ, z nichž některé mohou výrazně ovlivnit pacientovu adherenci k léčbě a tak potažmo výsledek léčby. Mezi nejzávažnější NÚ antivirové léčby VHC patří hematologické poruchy (neutropénie, trombocytopénie, hemolytické anémie), neuropsychiatrické poruchy (poruchy paměti, vidění, bolesti hlavy, deprese, sebevražedné tendence), flu-like syndrom (horečka, artralgie, myalgie), indukce autoimunitní thyreoiditidy nebo rozvoj intersticiální plicní fibrózy. Ribavirin je navíc teratogenní, takže po celou dobu kombinované antivirové léčba a ještě 6 měsíců po jejím ukončení není doporučena gravidita.
TRANSPLANTACE JATER U CHRONICKÉ VIROVÉ HEPATITIDY
Transplantace je indikována v době, kdy chronická virová hepatitida přejde do cirhózy. Už v první fázi kompenzované cirhózy (fáze A–B v klasifikaci jaterních cirhóz podle Childa a Pugha) je pacient veden v transplantačním centru, indikací k transplantaci je pak dekompenzace cirhózy (Child-Pugh B nebo B-C) a hepatocelulární karcinom.
ZÁVĚR
Za posledních 15 let změnil rychlý pokrok ve vývoji virostatik chronické hepatitidy z kauzálně neléčitelných onemocnění na nemoci, které lze u celé řady pacientů léčit a vyléčit. Léčba je však dlouhodobá a velmi nákladná. Pro představu, cena kombinované léčby jednoho pacienta s VHC na 48 týdnů je přibližně půl milionu korun, léčba pacientů s VHB interferonem stojí zhruba polovinu. Pokud však u VHB není terapie interferonem úspěšná, nastupuje nezřídka doživotní terapie virostatiky, která vyjde rámcově na 100–180 tisíc korun ročně. I proto je důležitá správná diagnóza s přesnou stratifikací onemocnění (z pohledu sérologického, ohledně aktivity zánětu i pokročilosti přestavby jaterního parenchymu) pro určení správného léčebného schématu.
Při plošné vakcinaci proti VHB se budeme stále méně setkávat s akutní VHB (i VHD) a výzkum v oblasti antivirových léků dává do budoucna tušit, že léčba chronických hepatitid bude úspěšnější. Velké úsilí je věnováno vývoji nejenom terapeutické, ale i preventivní vakcíny proti VHC. V příštích letech budou bohužel ve větším měřítku diagnostikovány cirhózy a HCC asociované s chronickými VHB a VHC a tím se předpokládá velký nápor na transplantační medicínu a zvýšené výdaje na léčebnou péči.
Elastografie není v ČR zatím rozšířenou metodou, protože není běžně dostupná – přístroje mají jen ojedinělá pracoviště. I když si tato metoda může dávat za cíl nahradit invazivní biopsie v hodnocení stupně fibrózy, zůstává histologickému vyšetření jaterní tkáně nezastupitelné místo u hodnocení aktivity zánětlivých a nekrotických změn a nadále je biopsie jater „zlatým standardem“ i v hodnocení stupně přestavby jaterního parenchymu. Jaterní biopsie bude i do budoucna hrát klíčovou roli v diferenciální diagnostice nejasných případů a v případě diagnostických rozpaků.
Adresa pro korespondenci:
prim. MUDr. Jiřina Hobstová, CSc.
Infekční oddělení, Fakultní nemocnice v Motole,
V Úvalu 84, 150 06 Praha 5 Motol
Tel. +420 224 436 901
e-mail: jirina.hobstova@lfmotol.cuni.czNa stránkách www.CSpatologie.cz naleznete suplementární článek k této publikaci (eSupplementum):
Hobstová J, Vitouš A. - Virové hepatitidy na začátku 21. století - „State of the Art“.
Zdroje
1. De Groote J, Desmet VJ, Gedigk P, et al. A classification of chronic hepatitis. Lancet 1968; 2 : 626–628.
2. Knodell RG, Ishak KG, Black WC, et al. Formulation and application of a numerical scoring system for assessing histological activity in asymptomatic chronic active hepatitis. Hepatology 1981; 1 : 431–435
3. Scheuer PJ. Classification of chronic viral hepatitis: a need for reassessment. J Hepatol 1991; 13 : 372–374.
4. Ishak KG. Chronic hepatitis: morphology and nomenclature. Mod Pathol 1994; 7 : 690–713.
5. Batts KP, Ludwig J. Chronic hepatitis. An update on terminology an reporting. Am J Surg Pathol 1995; 19 : 1409–1417.
6. Ishak KG, Babtista A, Bianchi L, et al. Histological grading and staging of chronic hepatitis. J Hepatol 1995; 22 : 696–699.
7. Bedossa P, Poynard T and the French METAVIR Cooperative Study Group. An algorithm for grading activity in chronic hepatitis C. Hepatology 1996; 24 : 289–293.
8. Bain VG, Bonacini M, Govindarajan S, et al. Usefulness of liver biopsy. J Viral Hepat 2004; 11(4): 375–382.
9. Denzer UW, Lüth S. Non-invasive diagnosis and monitoring of liver fibrosis and cirrhosis. Best Pract Res Clin Gastroenterol 2009; 23(3): 453–60.
10. Patel K. Noninvasive tools to assess liver disease. Curr Opin Gastroenterol 2010; 26(3): 227–33.
11. Friedrich-Rust M, Müller C, Winckler A, et al. Assessment of liver fibrosis and steatosis in PBC with FibroScan, MRI, MR-spectroscopy, and serum markers. J Clin Gastroenterol 2010; 44(1): 58–65.
12. Sebastiani G, Vario A, Guido M, et al. Comparison of Performance of Noninvasive Markers for Liver Fibrosis in Normal Alanine Aminotrasferase and Elevated Alanine Aminotrasferase Groups. J Viral Hepat 2008; 15(3): 212–218.
13. Wai CT, Greenson JK, Fontana RJ, et al. A simple noninvasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C. Hepatology 2003; 38 : 518–526.
14. Poynard T, Munteanu M, Imbert-Bismut F, et al. Prospective analysis of discordant results between biochemical markers and biopsy in patients with chronic hepatitis C. Clin Chem 2004; 50 : 1344–1355.
15. Scott DR, Levy MT. Liver transient elastography (Fibroscan): a place in the management algorithms of chronic viral hepatitis. Antivir Ther 2010; 15(1): 1–11.
16. Hobstová J, Vitouš A. Virové hepatitidy na začátku 21. století - “State of the Art”. Cesk Patol 2011; 47(Suppl1): 1–7.
17. Chien RN, Liaw YF. Nucleos(t)ide analogues for hepatitis B virus: strategies for long-term success. Best Pract Res Clin Gastroenterol 2008; 22(6): 1081–92.
18. Jafri SM, Lok AS. Antiviral therapy for chronic hepatitis B. Clin Liver Dis 2010; 14(3): 425–38.
19. Hynicka LM, Yunker N, Patel PH. A review of oral antiretroviral therapy for the treatment of chronic hepatitis B. Ann Pharmacother 2010; 44(7–8): 1271–86.
20. Shimakami T, Lanford RE, Lemon SM. Hepatitis C: recent successes and continuing challenges in the development of improved treatment modalities. Curr Opin Pharmacol 2009; 9(5): 537–544.
21. Michaels AJ, Nelson DR. New therapies in the management of hepatitis C virus. Curr Opin Gastroenterol 2010; 26(3): 196–201.
22. Flisiak H, Horan A, Gallay P, et al. The cyclophillin inhibitor Debio-025 shows potent anti-hepatitis C effect in patiens coinfected with hepatitis C and human immunodeficiency virus. Hepatology 2008; 47 : 817–826.
23. Lanforf RE, Hildebrandt-Eriksen ES, Petri A, et al. Therapeutic silencing of microRNA-122 in primates with chronic hepatitis C infection. Science 2010; 327 : 198–201.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek Pokroky v hepatopatologiiČlánek JAKÁ JE VAŠE DIAGNÓZA?
Článok vyšiel v časopiseČesko-slovenská patologie

2011 Číslo 2-
Všetky články tohto čísla
- Pokroky v hepatopatologii
- Vždy som bol a aj som optimistom
- Jak v praxi zlepšit histopatologickou diagnostiku hepatocelulárního karcinomu
- Virové hepatitidy na začátku 21. století – význam jaterní biopsie v kontextu rozvoje neinvazivních diagnostických metod a ve vztahu k moderní léčbě chronických virových hepatitid
- Prague Hepatology Meeting 2010 – novinky z hepatopatologie
- JAKÁ JE VAŠE DIAGNÓZA?
- Fibrotizující cholestatická hepatitida – onemocnění nejen transplantovaných pacientů
- Pseudoangiomatózna stromálna hyperplasia s obrovskými viacjadrovými bunkami: lézia ženského prsníka bez asociácie s neurofibromatózou?
- Imunohistochemická detekce 3-nitrotyrosinu vázaného na proteiny u zánětlivých myopatií
- Histologický registr mamárních karcinomů - MAGISTER
- Patologie na území Ostravy v proměnách času
- 70-roční jubileum Doc. MUDr. Jaroslava Horáčka, CSc.
- Životní jubileum prof. Josefa Špačka
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Fibrotizující cholestatická hepatitida – onemocnění nejen transplantovaných pacientů
- JAKÁ JE VAŠE DIAGNÓZA?
- 70-roční jubileum Doc. MUDr. Jaroslava Horáčka, CSc.
- Životní jubileum prof. Josefa Špačka
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



