-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Komorbidity u spondyloartritid
Comorbidities in spondyloarthritits
The term spondyloarthritis (SpA) includes inflammatory rheumatic diseases affecting mainly the axial skeleton. Based on the predominant involvement of the axial or peripheral skeleton, we distinguish between peripheral and axial spondyloarthritis. The axial form is characterized by inflammatory back pain developing before the age of 45. In axial spondyloarthritis, we further distinguish between the radiographic form, when sacroiliitis is present on the X-ray image, and the non-radiographic form, when sacroiliitis is captured only on MRI of the sacroiliac joint. Extraspinal manifestations of spondyloarthritis include peripheral articular manifestations, enthesitis, as well as skin, eye, and intestinal involvement (psoriasis, uveitis, inflammatory bowel disease). In addition to these manifestations directly related to SpA, we see some other diseases more often than in the general population (so-called comorbidities). The most important comorbidities in spondyloarthritis include osteoporosis, cardiovascular disease, lung involvement, infections, malignancies, peptic ulcers, and depression. Among the risk factors for cardiovascular diseases, arterial hypertension, smoking, dyslipidemia, and diabetes play an important role. The occurrence of comorbidities is closely Komorbidity u spondyloartritid Adresa pro korespondenci: MUDr. Kateřina Mintálová Revmatologický ústav Na Slupi 4 128 50 Praha 2 e-mail: mintalova@revma.cz Autorka prohlašuje, že není v konfliktu zájmů. Do redakce doručeno: 31. 7. 2022 Čes. Revmatol. 2022; 30(3): 106–113 Mintálová K. Revmatologický ústav Praha 107 related to the activity and duration of the underlying disease, functional disability, and mortality. Screening and care for comorbidities in patients with SpA should be as important as therapy for the underlying disease in optimizing patient care.
Keywords:
ankylosing spondylitis – comorbidities – spondyloarthritis
Autori: K. Mintálová
Pôsobisko autorov: Revmatologický ústav Praha
Vyšlo v časopise: Čes. Revmatol., 30, 2022, No. 3, p. 106-113.
Kategória: Přehledový článek
Súhrn
Pojem spondyloartritidy (SpA) zahrnují zánětlivá revmatická onemocnění postihující převážně axiální skelet. Na základě predominantního postižení osového či periferního skeletu rozlišujeme spondyloartritidy periferní a axiální. Axiální forma se vyznačuje zánětlivou bolestí zad vzniklou do 45. roku věku. Dále rozlišujeme u axiálních spondyloartritid formu radiografickou, kdy je přítomna sakroiliitida na RTG snímku, a formu neradiografickou, kdy sakroiliitida je zachycena pouze na MR sakroiliakálního skloubení.Mezi extraspinální manifestace spondyloartritid řadíme periferní artikulární projevy, entezitidy, dále postižení kůže, oka a střev (psoriáza, uveitida, nespecifický střevní zánět). Kromě těchto projevů přímo spjatých se SpA vídáme některá další onemocnění častěji než v běžné populaci (tzv. komorbidity). Mezi nejdůležitější komorbidity u spondyloartritid řadíme osteoporózu, kardiovaskulární onemocnění, onemocnění plic, infekce, malignity, peptické vředy a deprese. Z rizikových faktorů kardiovaskulárních onemocnění hraje důležitou roli arteriální hypertenze, kouření, dyslipidemie a diabetes. Výskyt komorbidit je úzce spjat s aktivitou a délkou trvání základního onemocnění, funkčním postižením a mortalitou. Screening a péče o komorbidity u pacientů se SpA by měly být v rámci optimalizace péče o pacienta stejně důležité, jako terapie základního onemocnění.
Klíčová slova:
ankylozující spondylitida – komorbidity – spondyloartritida
ÚVOD
Spondyloartritidy patří do skupiny zánětlivých revmatických onemocnění postihujících převážně axiální skelet, ale i periferní klouby, šlachy a mohou mít řadu extraskeletálních projevů, například očních, kožních, intestinálních a dalších (1). Mimo tyto manifestace rozlišujeme dále tzv. komorbidity, což jsou onemocnění, vyskytující se u pacientů se SpA častěji než v běžné populaci.
Komorbidity u spondyloartritid jsou další zátěží pro pacienta. Komorbidity přispívají k aktivitě onemocnění, zvyšují funkční deficit, mortalitu, snižují pracovní schopnost i celkovou kvalitu života (2, 3). Příčinou je zvýšené kardiovaskulární riziko, komplikace osteoporózy nebo zvýšené riziko závažných infekcí u pacientů na biologické terapii atd. Proto by jim měla být věnována zvýšená pozornost a jejich screening a péče o ně konzultovány s příslušnými specialisty.
U pacientů se SpA souvisí riziko komorbidit se zánětlivou aktivitou, samotnou léčbou SpA i dalšími rizikovými faktory. Alespoň jednu komorbiditu má většina pacientů se spondyloartritidou (4). V neposlední řadě jsou některé komorbidity (např. kardiovaskulární, renální, gastrointestinální nemoci a infekce) rozhodujícím faktorem pro volbu strategie léčby spondyloartritid (5).
Většina dosavadních výzkumů se zaměřovala na jednu nebo několik málo souvisejících komorbidit, např. kardiovaskulární nemoci. Tento přístup ale nereflektuje skutečný obraz typického pacienta se SpA, který trpí zpravidla více komorbiditami. Výzkumy sledující více komorbidit využívají různých metod ke zhodnocení vlivu komorbidit na pacienta, např. Charlson Comorbidity Index vyjadřující funkční změny nebo RDCI – Rheumatic Disease Comorbidity Index či Elixhauser Index) (6). Proto se i výsledky jednotlivých výzkumů mohou v důsledku lišit.
Prevalenci komorbidit a jejich dopad na pacienty s axiální spondyloartritidou (axSpA) popisuje ve své populační studii Imke Redekerová. U 1776 pacientů s axSpA byly nejčastějšími komorbiditami (tab. 1) arteriální hypertenze (51,6 %), deprese (25,6 %) a chronická plicní onemocnění (23,4 %). Počet komorbidit byl spjat s BASDAI (Bath Ankylosing Spondylitis Disease Activity Index) a BASFI (Bath Ankylosing Spondylitis Functional Index). V této studii byl průměrný věk pacienta s axSpA 56 let, 46 % byly ženy, každý pacient měl v průměru dvě komorbidity. Pacienti bez komorbidit byli zhruba o 20 let mladší a s krátkou dobou trvání spondyloartritidy než pacienti s pěti a více komorbiditami. Prevalence psoriázy byla signifikantně vyšší u pacientů s více než pěti komorbiditami než u pacientů bez komorbidit (19 % vs. 9 %). S rostoucím počtem komorbidit se zvyšoval rovněž BASDAI a BASFI. Pacienti s více než pěti komorbiditami měli nižší příjmy, horší socioekonomický status, vyšší body mass index. Předpisnesteroidních antiflogistik (NSA) a chorobu modifikujících antirevmatik (DMARDs) byl srovnatelný. Biologická terapie převažovala u pacientů bez přidružených chorob. Prevalence převážné většiny všech sledovaných komorbidit byla vyšší u pacientů se spondyloartritidou než u kontrolní skupiny pacientů bez diagnózy SpA (13).
Tab. 1. Komorbidity pacientů se spondyloartritidou (n = 1776), užití Elixhauserova indexu 
(upraveno dle Redeker et al. (13)) Stejných výsledků dosáhla i tchajwanská studie, která zjišťovala prevalenci komorbidit u pacientů s ankylozující spondylitidou ve srovnání s běžnou populací (15).
Dále byl zaznamenán významný rozdíl v prevalenci osteoporózy mezi běžnou populací a kohortou pacientů se spondyloartritidou (4 % vs. 13 %) (13) (obr. 1).
Obr. 1. Nejčastější komorbidity pacientů s diagnózou axSpA ve srovnání s běžnou populací (v %) 
(upraveno dle Redeker et al. (13)) OSTEOPORÓZA
Základem kostních lézí u spondyloartritid je kostní produkce vedoucí postupně k ankylóze a ve svém důsledku k permanentnímu funkčnímu postižení pacientů. Paradoxně osteoporóza a nízká kostní denzita patří mezi nejčastější komorbidity u pacientů se SpA (7). Osteoporóza u pacientů s revmatoidní artritidou (RA) je již dobře prostudována a je dávána do souvislosti s fenotypem typického pacienta s RA (postmenopauzální ženy), dále s terapií glukokortikoidy (poměrně často zde indikovanými, na rozdíl od SpA) a rovněž s aktivitou zánětu. Osteoporózu u pacientů se spondyloartritidou nemůžeme dávat do souvislosti s pacientovým fenotypem (častěji mladší muži) a ani s terapií glukokortikoidy (u axiálních forem SpA bez intersticiálního střevního zánětu nejsou indikovány) (8).
U pacientů s již delším průběhem axiální spondyloartritidy (axSpA) bývá osteoporóza spjata s imobilizací. Prevalence osteoporózy u pacientů s radiografickou formou axSpA kolísá od 19 % do 50 % v závislosti na použité metodologii (9, 10). Rizikovými faktory zde jsou například ankylóza páteře a delší doba trvání nemoci. Ve studii s osmdesáti pacienty s radiografickou axSpA, s průměrnou délkou trvání onemocnění 10,8 let, byla doba trvání nemoci úzce spjata se vznikem osteoporózy. Inverzní korelace byla pozorována u body mass indexu (BMI) (11). Osteoporóza byla ale v jiné studii pozorována i u časných stadií SpA (12). Ve studii pracující s kohortou DESIR byla prevalence osteoporózy u 332 pacientů s časnou SpA (do 3 let trvání) 13 %. Mezi další faktory ovlivňující vznik osteoporózy můžeme řadit zánětlivou aktivitu, jak systémovou (elevace CRP nebo sedimentace), tak lokální (edém kostní dřeně na MR) (14) (tab. 2).
Tab. 2. Rizikové faktory pro vznik osteoporózy u spondyloartritid (14) 
Vertebrální fraktury
Výskyt vertebrálních fraktur u pacientů se spondyloartritidou ve studiích dosti kolísá z rozličných důvodů. Uvádí se, že je diagnostikována asi jen jedna čtvrtina fraktur, protože spinální bolesti jsou přičítány aktivitě základního onemocnění a RTG snímek páteře není proto proveden. Na druhou stranu ve studiích často používané semiautomatizované morfometrické metody vyhodnotí (u SpA pacientů časté) vertebrální deformity již jako fraktury a tím nadhodnotí prevalenci osteoporózy u těchto pacientů (16, 17).
Jedna prospektivní, 4 roky probíhající studie s 298 pacienty s ankylozující spondylitidou uvádí incidenci vertebrálních fraktur po 4 letech 13,6 %. Rizikovými faktory byla již verifikovaná vertebrální fraktura v anamnéze a elevace CRP (18). Avšak jiná pětiletá analýza incidence vertebrálních fraktur u 433 pacientů s časnou formou axSpA z kohorty DESIR, kdy snímky páteře byly provedeny v roce 0 a 5, odhalila incidenci u pouhého 1,6 % pacientů. V této studii nebyly k hodnocení fraktur použity semiautomatizované metody, ale hodnocení expertem (19).
Pacienti s axSpA mají vyšší riziko VF (obr. 2) například vzhledem k vyššímu riziku pádů (z důvodu horší spinální mobility), dále z důvodu nižší kostní denzity (při snížené fyzické aktivitě) (10).
Obr. 2. Vertebrální fraktura u pacienta s ankylozující spondylitidou 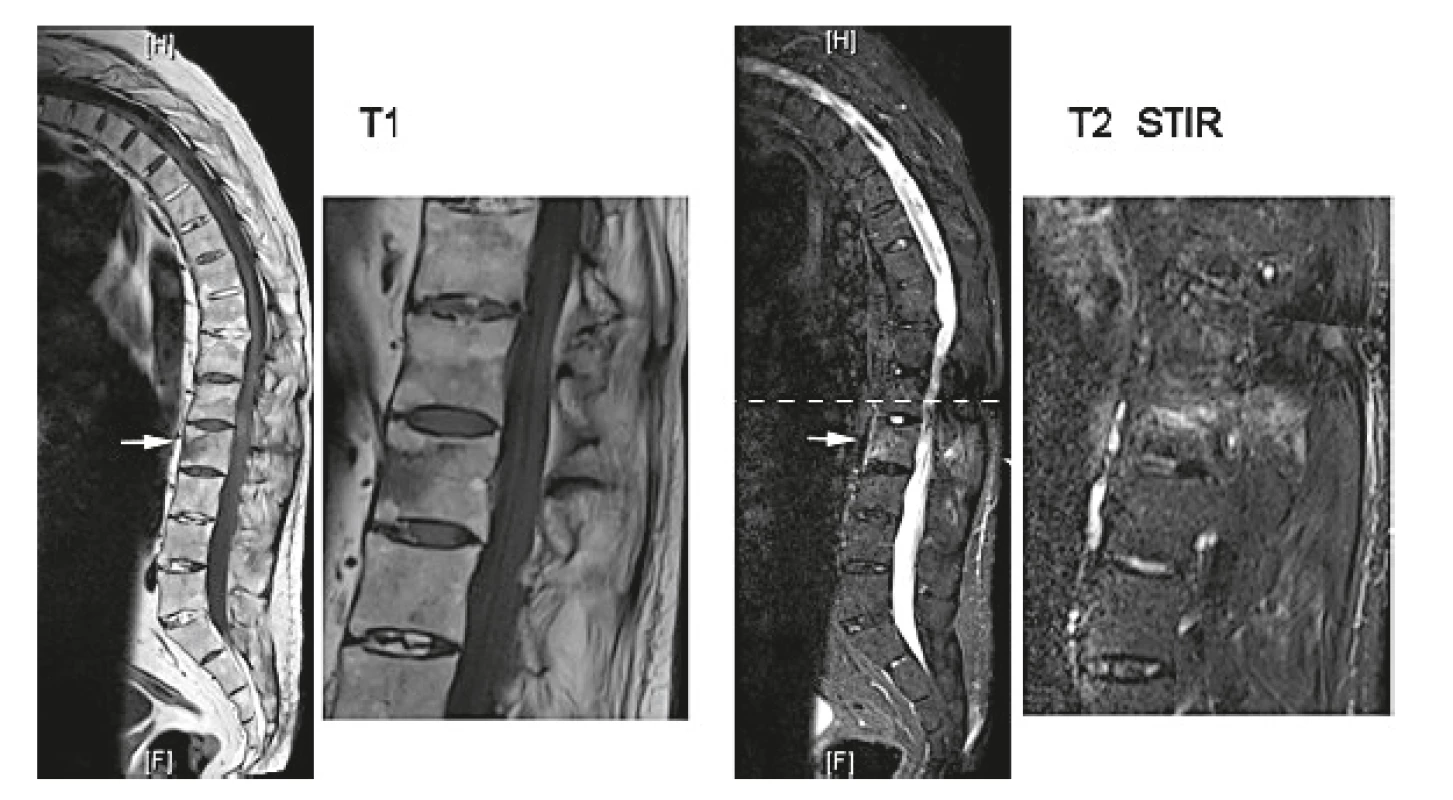
(https://ars.els-cdn.com/content/image/1) Vliv terapie spondyloartritid na vznik osteoporózy
Nesteroidní antiflogistika jsou nedílnou součástí terapie spondyloartritid. Výsledky dostupných studií sledujících jejich vliv na vznik osteoporózy a vertebrálních fraktur jsou však rozporuplné. Prospektivní studie čítající 265 pacientů s časnou spondyloartritidou (54 % mužů, průměrný věk 34,4 let) prokázala protektivní efekt na snižování kostní hmoty po 2 letech pravidelného užívání NSA (20). Nicméně studie z roku 2015 s pacienty s ankylozující spondylitidou užívajících NSA prokázala vyšší riziko zlomenin než u pacientů bez NSA (21).
U biologické terapie je znám pozitivní vliv inhibitorů tumor nekrotizujícího faktoru a inhibitorů interleukinu 17 na kostní denzitu (20, 22, 23, 64).
Na základě výsledků velké mezinárodní studie ASAS - -COMOSPA se doporučuje provést denzitometrické vyšetření alespoň jednou v průběhu onemocnění spondyloartritidou (7).
KARDIOVASKULÁRNÍ ONEMOCNĚNÍ
Kardiovaskulární onemocnění (KVO) jsou nejčastější příčinou úmrtí u nemocných s chronickým revmatickým zánětlivým onemocněním, respektive spondyloartritidou (30–50 %). Můžeme si to vysvětlit zvýšenou prevalencí KVO u SpA, ale také nárůstem kardiovaskulárních rizik u SpA ve srovnání s běžnou populací (24). Svou roli hraje rovněž věk pacienta, aktivita a délka trvání onemocnění. Významným ukazatelem je C-reaktivní protein (CRP), jehož zvýšená hladina je asociována s vyšším rizikem KVO i v běžné populaci (36). Pravděpodobně přispívá k aterogenezi aktivací komplementu a indukcí uvolňování prozánětlivých cytokinů (37, 38).
Mezi další kardiální manifestace spondyloartritid, které přispívají ke vzniku kardiovaskulárních komorbidit, patří například poruchy vedení, insuficience aortální chlopně a dysfunkce levé komory (39).
V čínské studii byla zaznamenána poměrně vysoká prevalence chlopenních vad (24,2 %) u pacientů se SpA, mnohonásobně vyšší byla u pacientů HLA B27 pozitivních (25). Studie dále prokazují vyšší prevalenci ischemické choroby srdeční a riziko infarktu myokardu u pacientů se spondyloartritidou než v běžné populaci (26, 27).
Arteriální hypertenze se řadí mezi nejčastější kardiovaskulární rizikové faktory u spondyloartritid (okolo 50 %). Prevalence arteriální hypertenze u pacientů s axSpA je ve srovnání s běžnou populací vyšší (28).
Kouření je dalším častým rizikovým faktorem KVO. U pacientů s axSpA je kouření častější (30–40 %) než v běžné populaci (15 %) (29, 30). Rovněž zvyšuje aktivitu onemocnění a urychluje strukturální progresi, což vede ke snížení fyzické aktivity – dalšímu rizikovému faktoru KVO.
Dyslipidemie a obezita jsou rovněž častými rizikovými faktory KVO. Obezita je častější u pacientů s periferními projevy spondyloartritid a u pacientů s psoriatickou artritidou (31). Při vysoké aktivitě onemocnění dochází ke snížení HDL i celkového cholesterolu, v remisi naopak k nárůstu (41). Prevalence metabolického syndromu u pacientů s psoriatickou artritidou je dvou až trojnásobná než v běžné populaci (40).
Recentní studie se rovněž zabývají aterosklerózou u pacientů s revmatickými chorobami. Je prokázáno, že chronická zánětlivá aktivita urychluje tvorbu ateromových plátů a tím zvyšuje riziko KVO (32, 33). Ateroskleróza byla dříve považována za degenerativní onemocnění cévního systému. Podle posledních výzkumů se jedná spíše o imunitně zprostředkovaný proces s podílem humorální a buněčné složky. Imunitní pochody provázejí charakteristické změny lipidového metabolismu, proces proliferace buněk hladké svaloviny a tvorba aterosklerotických plátů se zúžením průsvitu arterií a následnou typickou klinickou manifestací. Tradiční rizikové faktory, popsané již v roce 1991 (34), vysvětlují pouze 75 % nových případů KVO, 25 % je přičítáno tzv. netradičním rizikovým faktorům souvisejícím zejména se zánětlivým procesem v organismu. Netradiční rizikové faktory lze rozdělit na faktory geneticky podmíněné, související s autoimunitním onemocněním a na smíšené (35).
Terapie spondyloartritid a kardiovaskulárních onemocnění
Terapie revmatických onemocnění nepřímo ovlivňuje kardiovaskulární mortalitu a morbiditu. Na jedné straně zánět, jakožto rizikový faktor KVO tlumí, na druhé straně některé vedlejší účinky léků riziko naopak zvyšují (41, 42). Nesteroidní antirevmatika v běžné populaci riziko KVO zvyšují, nicméně u pacientů se spondyloartritidou, dle dostupných studií riziko nezvyšují, respektive dokonce snižují (43, 44). Je to dáno nejspíše lepší kontrolou zánětlivé aktivity a zlepšením fyzické aktivity při užívání NSA. Avšak u těchto léků je vždy vhodné zvážit riziko a přínos pro pacienta.
Glukokortikoidy ovlivňují kardiovaskulární riziko dvěma hlavními způsoby: jednak zhoršují glukózovou toleranci a inzulinovou rezistenci, prohlubují dyslipidemii, akcentují krevní tlak a predisponují k centrální obezitě (45) a jednak svým imunosupresivním působením tyto rizikové faktory paradoxně snižují (46, 47). Kardiovaskulární riziko je vyšší u dávek dlouhodobě vyšších než 7,5 mg/den. Efekt nízkých dávek není jednoznačný. Evropská asociace revmatologických společností (EULAR) proto doporučuje podávat glukokortikoidy co nejkratší možnou dobu v co nejnižší dávce (46).
Sulfasalazin a methotrexát by mohly mít pozitivní vliv na kardiovaskulární riziko, zejména u časného zahájení léčby (48). Inhibitory tumor nekrotizujícího faktoru (iTNF-α) snižují KV rizika svým protizánětlivým a antiaterogenním účinkem (49, 50).
Vzhledem k prokázané zvýšené kardiovaskulární mortalitě a morbiditě u pacientů se spondyloartritidou by hodnocení kardiovaskulárního rizika mělo být běžnou součástí péče o pacienta. V roce 2016 byla publikována aktualizovaná doporučení EULAR pro hodnocení a kontrolu pacientů s revmatickými chorobami s důrazem na časnou diagnostiku a hodnocení rizikových faktorů. U pacientů s nízkou aktivitou nemoci postačí hodnocení kardiovaskulárního rizika jednou za 5 let (51).
INFEKCE
Data z dostupných studií prokazují u pacientů s spondyloartritidou mírně zvýšené riziko infekcí u pacientů bez imunosupresivní terapie a zvýšené riziko infekcí u pacientů užívajících chorobu modifikující terapii (DMARDs) (52). Vzhledem k tomuto zjištění byla vydána doporučení k očkování (proti chřipce, pneumokokům) pacientů nejlépe ještě před zahájením biologické terapie. Pokud je pacient již léčen, tak v období minimální aktivity onemocnění (53).
Více studií zkoumalo riziko tuberkulózy (TBC) u pacientů se spondyloartritidou. Prevalence TBC je u těchto pacientů vyšší než v běžné populaci, pacienti užívající biologickou terapii jsou zhruba ve dvojnásobném riziku než pacienti bez ní. Pročež před zavedením biologické terapie je doporučován screening latentní tuberkulózy. Rizikové faktory dále zahrnují mužské pohlaví, kouření, předchozí anamnézu TBC a preexistující chronické plicní onemocnění (54, 55).
MALIGNITY
U pacientů se spondyloartritidou nebyl prokázán dle recentních výsledků studií vyšší výskyt malignit než v běžné populaci (56, 57).
U pacientů s idiopatickým zánětem střev je však udáváno asi dvojnásobně vyšší riziko kolorektálního karcinomu (58), nicméně vyšší výskyt kolorektálního karcinomu u pacientů s enteropatickou spondyloartritidou potvrzen nebyl.
Onkologický screening by se měl řídit standardními doporučeními pro všeobecnou populaci s možnými úpravami dle rizikovosti pacienta.
Otázkou je riziko rakoviny kůže u pacientů s psoriatickou artritidou absolvujících P-UVA terapii, neboť některé studie zvýšené riziko potvrzují, jiné naopak (59).
Co se týče anti-TNF a anti-IL17 terapie, není u pacientů se spondyloartritidou popisován vyšší výskyt malignit, tak jak je tomu například u revmatoidní artritidy. Nicméně pro zaujetí jasného postoje bude potřeba více dat (60).
DEPRESE
Deprese u axiálních spondyloartritid jsou zcela běžné, nicméně poddiagnostikované. Výskyt depresí se udává 11–64 % v závislosti na použité metodice výzkumu. Míra depresí koreluje s aktivitou onemocnění, je častější u pacientů v produktivním věku (61).
Zdá se, že terapie inhibitory TNF-α má pozitivní vliv na snížení deprese u pacientů s psoriázou a psoriatickou artritidou (62). Nicméně pro vztah anti-TNF léčby k depresím je potřeba dalších studií.
Glukokortikoidy naopak mají depresogenní potenciál. Kortikoidy indukované změny psychiky zahrnují široké spektrum psychiatrických reakcí – od pocitů euforie až po úzkosti a depresivní stavy. Riziko výskytu deprese roste s dávkou a délkou léčby. S ekvivalentem prednisonu v dávce 60 mg denně se vyskytují deprese u 20 % pacientů. Typická bývá setrvačnost deprese, která může přetrvávat až měsíce po vysazení. I proto je důležitá pomalá detrakce kortikoidů.
Deprese jako poměrně častý nežádoucí účinek je popisována i u některých NSA (indometacin), jako vzácný pak u diklofenaku a ibuprofenu (62).
VÝZNAM HLA B27 ANTIGENU U KOMORBIDIT SPONDYLOARTRITID
Osteoporóza se vyskytuje častěji u HLA B27 pozitivních pacientů (dle španělské studie 13,5 % vs. 8,8 % u HLA B27 negativních). Role antigenu HLA B27 u kostního metabolismu nebyla u lidí dosud studována. Stran kardiovaskulárních rizik není pozorován rozdíl ve skupinách HLA B27 pozitivních a HLA B27 negativních jedinců (63).
ZÁVĚR
Komorbidity u spondyloartritid jsou příčinou jak zvýšené morbidity, tak mortality. Snižují kvalitu života. Alespoň jednou komorbiditou trpí v průměru 51 % pacientů se spondyloartritidou. Přítomnost komorbidit ovlivňuje ukazatele aktivity BASDAI, BASFI a ASDAS. V klinické praxi jsou komorbidity a rizikové faktory sledovány v méně než polovině případů. Mezi nejčastější komorbidity patří kardiovaskulární onemocnění, která významně přispívají k mortalitě pacientů. Zde jsou nutné pravidelné kontroly, včasná prevence a případně intervence. Asociací EULAR proto byla vytvořena doporučení k hodnocení a kontrole rizikových faktorů.
V tomto směru by spolupráce revmatologa s jinými specialisty v prevenci a monitorování komorbidit měla být samozřejmostí.
Adresa pro korespondenci:
MUDr. Kateřina Mintálová
Revmatologický ústav
Na Slupi 4
128 50 Praha 2e-mail: mintalova@revma.cz
Autorka prohlašuje, že není v konfliktu zájmů.
Do redakce doručeno: 31. 7. 2022Čes. Revmatol. 2022; 30(3): 106–113
Zdroje
- Dougados M Spondyloarthritis. Lancet 2011; 377 : 2127–2137.
- Sizheng Steven Zhao et al. Prevalence and impact of comorbities in axial spondyloarthritis: systematic review and meta-analysis. Rheumatology 2020; 59: iv47–iv57.
- Nikiphorou E, Ramiro S, va der Heide D, et al. Association of comorbidities in spondyloarthritis with poor function, work disability and quality of life: results from the assessment of Spondyloarthritis International Society Comorbidities in Spondyloarthritis Study. Arthritis Care Res 2018; 70 : 1257–1262.
- Zhao S, Radner H, Siebert S et al. Comorbidity burden in axial spondyloarthritis: a cluster analysis. Rheumatology 2019; 58 : 1746–1754.
- Gonzáles C, Curbelo R R, Torre Alonso JC, et al. Recommendations for the management of comorbidity in patients with axial spondyloarthritis in clinical practice. Reumato Clinica Engl Ed 2018; 14 : 346–359.
- Michaud K, Wolfe F. Comorbities in rheumatoid arthritis. Best pract Res Clin Rheumatol 2007; 21(5): 885–906.
- Moltó A,Etcheto A, van der Heijde D, et al. Prevalence of comorbidities and evaluation of their screening in spondyloarthritis: results of the international cross-sectional ASAS-COMOSPA study. Ann Rheum Dis 2016; 75 : 1016–1023.
- van der Heijde D, Ramiro S, Landewé R, Baraliakos X, van den Bosch, et al. 2016 update of the ASAS-EULAR management recommendations for axial spondyloarthritis. Ann Rheum Dis 2017; 76(6): 978–991.
- El Maghraoui A, Borderie D, Cherruau B, Edouard R, Dougados M, Roux C. Osteoporosis, body composition,and bone turnover in ankylosing spondylitis. J Rheumatol 1999; 26 : 2205–2209.
- Ghozlani I, Ghazi M, Nouijai A, Mounach A, et al. Prevalence and risk factors of osteoporosis and vertebral fractures in patients with ankylosing spondylitis. Bone 2009; 44 : 772–776.
- van der Weijden MA, Claushuis TA, Nazari T, et al. High prevalence of low bone mineral density in patients within 10 years of onset of ankylosing spondylitis: a systematic review. Clin Rheumatol 2012; 31 : 1529–1535.
- Briot K, Durnez A, Paternotte S, Miceli-Richard C. Bone oedema on MRI is highly associated with low bone mineral density in patients with early inflammatory back pain: results from the DESIR cohort. Ann Rheum Dis 2013; 72 : 1914–1919.
- Redeker I, Callhoff J, Falk H, et al. The prevalence and impact of comorbidities on patients with axial spondyloarthritis: results from a nationwide population-based study. Arthritis Res Ther 2020; 22 : 210.
- Kang J-H, Chen Y-H, Lin H-C. Comorbidity profiles among patients with ankylosing spondylitis: a nation wide population-based study. Ann Rheum Dis 2010; 69(6): 1165–1168.
- Vosse D, Heijckmann C, Landewe R, van der Heijde D, van der Linden S. Comparing morphometric X-ray absorptiometry and radiography in defining vertebral wedge fractures in patients with ankylosing spondylitis. Rheumatology (Oxford) 2007; 46 : 1667–1671.
- Briot K, Roux C. Inflammation, bone loss and fracture risk in spondyloarthritis. RMD Open 2015; 1: e000052.
- Kang KY, Kim IJ, Jung SM, Kwok SK, Ju JH, Park KS, et al. Incidence and predictors of morphometric vertebral fractures in patients with ankylosing spondylitis. Arthritis Res Ther 2014; 16(3): R124.
- Sahuguet J, Fechtenbaum J, Molto A, Etcheto A, Richette P, Dougados M, et al. OP0054 Low incidence of vertebral fractures in early spondyloarthritis: 5-year prospective data of the DESIRE cohort. Ann Rheum Dis 2018; 78(1): 60–65.
- Briot K, Etcheto A, Miceli RC, Dougados M, Roux C. Bone lossin patients with earlyinflammatory back pain suggestive of spondyloarthritis: results from the prospective DESIR cohort. Rheumatology Oxford 2016; 55 : 335–342.
- Prieto-Alhambra D, Munoz Ortego J, De Vries F, Vosse D, Arden NK, Bowness P, et al. Ankylosing spondylitis confers substantiallyincreased risk of clinical spine fractures: a nationwide case control study. Osteoporos Int 2015; 26 : 85–91.
- Briot K, Gossec L, Kolta S, Dougados M, Roux C. Prospective assessment of body weight, body composition and bone density changes in patients with spondyloarthropathy receiving anti-tumor necrosis factor-alpha treatment. J Rheumatol 2008; 35 : 855–861.
- Durnez A. Paternotte S, Fechtenbaum J, Landewé RBM, Dougados M, Roux C, et al. Increase in bone density in patients with spondyloarthritis during anti-tumour necrosis alpha therapy: 6-year followup study. J Rheumatol 2013; 40 : 1712–1718.
- Prati C, Claudepierre P, Pham T, Wendling D. Mortality in spondylarthritis. Joint Bone Spine 2011; 78 : 466–470.
- Exarchou S, Lie E, Lindström U, Askling J, Forsblad-d’Elia H, Turesson C, et al. Mortality in ankylosing spondylitis: results from a nationwide population-based study. Ann Rheum Dis 2016; 75 : 1466–1472.
- Lai Y, Zhang Y, Mo S, et al. Prevalence of comorbidities and risk factors in spondyloarthritis: results of cross-sectional study. Ann Rheum Dis 2020; 81: e43.
- Mathieu S, Gossec L, Dougados M, Soubrier M. Cardiovascular profile in ankylosing spondylitis: a systematic review and meta - -analysis. Arthritis Care Res (Hoboken) 2011; 63 : 557–563.
- Bengtsson K, Forsblad-d’Elia H, Lie E, Klingberg E, Dehlin M, Exarchou S, et al. Are ankylosing spondylitis, psoriatic arthritis and undifferentiated spondyloarthritis associated with an increased risk of cardiovascular events? A prospective nationwide population - based cohort study. Arthritis Res Ther 2017; 19(1): 102.
- Heslinga SC, Van den Oever IA, van Sijl AM, Peters MJ, van der Horst-Bruinsma IE, Smulders YM, et al. Cardiovascular risk management in patients with active ankylosing spondylitis: a detailed evaluation. BMC Musculoskelet Disord 2015; 16 : 80.
- Jamal A, King BA, Neff LJ, Whitmill J, Babb SD, Graffunder CM. Current cigarette smoking among adults — United States, 2005–2015. MMWR Morb Mortal Wkly Rep 2016; 65 : 1205–1211.
- Glintborg B, Højgaard P, Lund Hetland M, Steen Krogh N, Kollerup G, Jensen J, et al. Impact of tobacco smoking on response to tumour necrosis factor-alpha inhibitor treatment in patients with ankylosing spondylitis: results from the Danish nationwide DANBIO registry. Rheumatology (Oxford) 2016; 55 : 659–668.
- Nurmohamed MT, Heslinga M, Kitas GD. Cardiovascular comorbidity in rheumatic diseases. Nat Rev Rheumatol 2015; 11 : 693–704.
- Sari I, Okan T, Akar S, Cece H, Altay C, Secil M, et al. Impaired endothelial function in patients with ankylosing spondylitis. Rheumatology (Oxford) 2006; 45 : 283–286.
- Peters MJL, van Eijk IC, Smulders YM, Serne E, Dijkmans BAC, van der Horst-Bruinsma IE, et al. Signs of accelerated preclinical atherosclerosis in patients with ankylosing spondylitis. J Rheumatol 2010; 37 : 161–166.
- Anderson KM, Odell PM, Wilson PW, Kannel WB. Cardiovascular disease risk profiles. Am Heart J 1991; 121 : 293–298.
- Sarmiento-Monroy JC, Amaya-Amaya J, Espinosa-Serna JS, et al. Cardiovascular disease in rheumatoid arthritis: a systematic literature review in Latin America. Arthritis 2012; 2012 : 371909.
- Kaptoge S, di Angelantonio E, Lowe G, et al. C-reactive protein concentration and risk of coronary heart disease, stroke, and mortality: an individual participant meta-analysis. Lancet 2010; 375 : 132–140.
- Paul A, Yeh ET, Chan L. A proatherogenic role for C-reactive protein in vivo. Curr Opin Lipidol 2005; 16(5): 512–517.
- Zwaka TP., Hombach V., Torzewski J. C-reactive protein-mediated low density lipoprotein uptake by macrophages: implications for atherosclerosis. Circulation 2001; 103 : 1194–1197.
- Nurmohamed MT, van der Horst-Bruinsma I, Maksymowych WP. Cardiovascular and cerebrovascular diseases in ankylosing spondylitis: current insights. Current Rheumatol Rep 2012; 14 : 415–421.
- Mok CC, Ko GT, Ho LY, et al. Prevalence of atherosclerotic risk factors and the metabolic syndrome in patients with chronic inflammatory arthritis. Arthritis Care Res 2011; 63 : 195–202.
- Ramonda R, Lo Nigro A, Modesti V, et al. Atherosclerosis in psoriatic arthritis. Autoimmunity Rev 2011; 10 : 773–778.
- Husni ME. Comorbidities in psoriatic arthritis. Rheumatic Dis Clinics North America 2015; 41 : 677–698.
- Rivière E, Etcheto A, den Bosch FV, der Heijde DV, Landewé R, Dougados M, et al. Effect of nsaid consumption on cardiovascular events in spondyloarthritis. Ann Rheum Dis 2017; 76 : 336–346.
- Haroon NN, Paterson JM, Li P, Inman RD, Haroon N. Patients with ankylosing spondylitis have increased cardiovascular and cerebrovascular mortality: a population-based study. Ann Intern Med 2015; 163 : 409–416.
- Panoulas VF, Douglas KM, Stavropoulos-Kalinoglou A, et al. Long-term exposure to medium-dose glucocorticoid therapy associates with hypertension in patients with rheumatoid arthritis. Rheumatology (Oxford) 2008; 47(1): 72–75.
- Eters MJ, Symmons DP, McCarey D, et al. EULAR evidence-based recommendations for cardiovascular risk management in patients with rheumatoid arthritis and other forms of inflammatory arthritis. Ann Rheum Dis 2010; 69 : 325–331.
- Hallgren R, Berne C. Glucose intolerance in patients with chronic inflammatory diseases is normalized by glucocorticoids. Acta Med Scand 1983; 213 : 351–355.
- Mercer E, Rekedal L, Garg R, et al. Hydroxychloroquine improves insulin sensitivity in obese non-diabetic individuals. Arthritis Res Ther 2012; 14(3): R135.
- Deyab G, Hokstad I, Whist JE, Smastuen MC, Agewall S, Lyberg T, et al. Methotrexate and anti-tumor necrosis factor treatment improves endothelial function in patients with inflammatory arthritis. Arthritis Res Ther 2017; 19(1): 232.
- van Sijl AM, van Eijk IC, Peters MJL, Serné EH, van der Horst - Bruinsma IE, Smulders YM, et al. Tumour necrosis factor blocking agents and progression of subclinical atherosclerosis in patients with ankylosing spondylitis. Ann Rheum Dis 2015; 74 : 119–123.
- Agca R, Heslinga SC, Rollefstad S, et al. EULAR recommendations for cardiovascular disease risk management in patients with rheumatoid arthritis and other forms of inflammatory joint disorders: 2015/2016 update. Ann Rheum Dis 2017; 76(1): 17–28.
- Fouque-Aubert A, Jette-Paulin L, Combescure C, Basch A, Tebib J, Gossec L. Serious infections in patients with ankylosing spondylitis with and without TNF blockers: a systematic review and meta-analysis of randomised placebo-controlled trials. Ann Rheum Dis 2010; 69 : 1756–1761.
- van Assen S, Agmon-Levin N, Elkayam O, Cervera R, Doran MF, Dougados M, et al. EULAR recommendations for vaccination in adult patients with autoimmune inflammatory rheumatic diseases. Ann Rheum Dis 2011; 70 : 414–422.
- Ciang N. Chu-Oi, et al. Risk of tuberculosis in patients with spondyloarthritis: data from a centralized Electronic database in Hong Kong. BMC Musculosceletal Dis 2020; 21 : 832.
- de Vries MK, Arkema EV, Jonsson J, Bruchfeld J, et al. Tuberculosis risk in ankylosing spondylitis, other spondyloarthritis, and psoriatis arthritis in Sweden: a population based cohort study. Arthritis Care Res 2018; 70 : 1563–1567.
- Hellgren K, Smedby KE, Backlin C, Sundstrom C, Feltelius N, Eriksson JK, et al. Ankylosing spondylitis, psoriatic arthritis, and risk of malignant lymphoma: a cohort study based on nationwide prospectively recorded data from Sweden. Arthritis Rheumatol 2014; 66 : 1282–1290.
- Askling J, Klareskog L, Blomqvist P, Fored M, Feltelius N. Risk for malignant lymphoma in ankylosing spondylitis: a nationwide Swedish case-control study. Ann Rheum Dis 2006; 65 : 1184–1187.
- Söderlund S, Granath F, Broström O, Karlén P, Löfberg R, Ekbom A, et al. Inflammatory bowel disease confers a lower risk of colorectal cancer to females than to males. Gastroenterology 2010; 138 : 1697–1703.
- Archier E, Devaux S, Castela E, Gallini A, Aubin F, Le Maître M, et al. Carcinogenic risks of psoralen UV-A therapy and narrowband UV-B therapy in chronic plaque psoriasis: a systematic literature review. J Eur Acad Dermatol Venereol 2012; 26(3): 22–31.
- Atzeni F, Carletto A, Foti R, Sebastiani M, Panetta V, Salaffi F, et al. Incidence of cancer in patients with spondyloarthritis treated with anti-TNF drugs. Joint Bone Spine 2018; 85(4): 455–459.
- Sizheng Zhao, et al. The prevalence of depression in axial spondloarthritis and its association with disease activity, Arthritis Res Ther 2018; 20(1): 140.
- Hroudová J. Iatrogenně navozené deprese. Praktické lékárenství 2018; 14(2): 63–66.
- Arévalo M, Lopéz-Medina C, Martinez-Losa M, Moltó A, Font P, et al. Role of HLA-B27 in the comorbidities observed in axial spondyloarthritis: Data from COMOSPA. Joint Bone Spine 2020; 87 : 445–448.
- Tang M, Lu L, Yu X. Interleukin-17A interweaves the skeletal and immune systems. Front Immunol 2021; 11 : 625034.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2022 Číslo 3- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Výhody subkutánně podávaného methotrexátu
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
-
Všetky články tohto čísla
- Úvodník
- Prof. MUDr. Eduard Cmunt – průkopník české revmatologie
- Riziko kardiální a oční toxicity syntetických antimalarik u revmatických chorob
- Komorbidity u spondyloartritid
- Prevalence spondyloartritidy u pacientů s akutní přední uveitidou
- Intersticiální plicní procesy u systémových chorob pojiva – rizikové faktory, diagnostika a léčba
- Porucha fertility spojená s nediferencovaným onemocněním pojiva
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Intersticiální plicní procesy u systémových chorob pojiva – rizikové faktory, diagnostika a léčba
- Riziko kardiální a oční toxicity syntetických antimalarik u revmatických chorob
- Porucha fertility spojená s nediferencovaným onemocněním pojiva
- Prof. MUDr. Eduard Cmunt – průkopník české revmatologie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



