-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Spontánní potrat v prvním trimestru gravidity
Spontaneous abortion in the first trimester of pregnancy
Spontaneous abortions in the first trimester of gravidity represent a clinically significant problem that can affect up to 15% of recognized pregnancies. The
causes of early pregnancy loss are very heterogeneous and include genetic, environmental and immunological factors. Although the pathologist‘s main task
is to exclude molar pregnancy, in some cases conventional histological examination can also contribute to the elucidation of the cause of miscarriage and the
management of subsequent pregnancies, especially in the case of lesions with a high risk of recurrence that may lead to habitual abortion.Keywords:
inflammation – trisomy – spontaneous abortion – first trimester – hydropic abortion – abnormal karyotype
Autori: Magdaléna Daumová 1,2; Šárka Hadravská 1,2; Martina Putzová 2
Pôsobisko autorov: Šiklův ústav patologie LFP UK a FN Plzeň 1; Bioptická laboratoř s. r. o., Plzeň 2
Vyšlo v časopise: Čes.-slov. Patol., 59, 2023, No. 2, p. 60-63
Kategória: Přehledový článek
Súhrn
Spontánní potraty v prvním trimestru představují klinicky významný problém, který může postihnout až 15 % rozpoznaných gravidit. Příčiny časných těhotenských ztrát jsou velmi heterogenní a zahrnují faktory genetické, environmetální i imunologické. Ačkoli je hlavním úkolem patologa především vyloučení molární gravidity, může i konvenční histologické vyšetření v některých případech přispět k objasnění příčiny abortu a managementu další gravidity, zvláště v případě lézí s vysokým rizikem recidivy, které mohou vést k habituálnímu potrácení.
Klíčová slova:
spontánní potrat – první trimestr – hydropický potrat – abnormální karyotyp – trisomie - zánět
Z morfologického i klinického hlediska lze časné těhotenské ztráty rozdělit na ztráty embryonální (potraty v 1. - 8. týdnu vývoje, což odpovídá 3. - 10. týdnu gestace) a ztráty fetální (potraty v období od 9. týdne vývoje, resp. 11. týdne gestace). Histologicky nacházíme v materiálu z potratu v časných stádiích prvního trimestru (< 8 týdnů) nedokonale vaskularizované choriové klky s edématózním stromatem bez signifikantní kolagenizace. V polovině prvního trimestru (8 - 10 týdnů) je již patrná počínající kolagenizace choria a proximálních choriových klků a relativně homogenní populace klků distálních s jasně patrnými vilózními kapilárami. Ke konci prvního trimestru (> 10 týdnů) lze pozorovat fúzi choria a amnia, kmenové klky s kolagenizací stromatu, silnostěnnými fetálními cévami a také početnější distální klky (1,2).
Příčiny spontánního abortu v prvním trimestru jsou velmi heterogenní. Z praktických důvodů lze aborty rozdělit do dvou velkých kategorií; a to na aborty s abnormálním karyotypem a aborty s normálním karyotypem.
Aborty s abnormálním karyotypem
Více než 50 % potracených konceptů v prvním trimestru má abnormální karyotyp (3). Nejvyšší podíl abortů s abnormálním karyotypem se vyskytuje v časných fázích prvního trimestru (4). V širším slova smyslu lze do této kategorie zařadit i hydatidózní molu, které je věnován samostatný prostor.
Klinický obraz bývá nespecifický, jedním z projevů může být příliš nízká anebo naopak zvýšená hladina lidského choriového gonadotropinu (hCG), omezení růstu plodu nebo jeho abnormální srdeční frekvence či průkaz prázdného gestačního váčku (anembryomola) při ultrazvukovém vyšetření. Materiál z abortu je většinou tvořený poměrně velkým množstvím hemoragického korporálního endometria, krevními koaguly a částmi choria. Pokud je přítomno embryo/plod, bývá často autolyzované, menší, než by odpovídalo udávanému gestačnímu věku a v některých případech vykazuje určité známky dysmorfie (4).
Mikroskopicky nacházíme ve většině případů rovněž řadu nespecifických změn. U časných potratů jsou to objemné, málo rozvětvené choriové klky s chudou vaskularizací a edémem stromatu. Distální klky obvykle úplně postrádají fetální cévy a jsou hydropicky změněné (v důsledku přetrvávajícího transportu tekutin a elektrolytů z mateřského krevního oběhu). Pokud je konceptus po odumření delší dobu retinován v dutině děložní, dochází k hyalinizaci choriových klků. U potratů v pokročilejších fázích fetoplacentárního vývoje pozorujeme obvykle kombinaci hydropických a fibrózních změn distálních klků, často bývají patrná rezidua involujících fetálních cév (2,5). Přibližně v jedné čtvrtině případů lze pozorovat charakteristické změny, které jsou vysoce specifické pro aneuploidie a podle některých studií nález dvou a více těchto změn až v 90 % případů pozitivně koreluje s výsledky genetického vyšetření (2). Mezi tyto změny patří především nepravidelný tvar choriových klků s různě velkými zářezy a invaginacemi („irregularly irregular pattern“) (obr. 1) (6), dále přítomnost trofoblastických inkluzí (obr. 2) (7), nepravidelně větvené vilózní kapiláry (obr. 3) nebo neobvykle velké fetální cévy s muskularizací stěny (8), stromální buňky s velkými jádry (obr. 4) (9), hydropické změny (2,8) a v neposlední řadě nespecifická hyperplázie vilózního trofoblastu (obr. 5) (10). Většina aneuploidií vzniká sporadicky, nemá maligní potenciál a ani nepředstavuje zvýšené riziko recidivy v následující graviditě. Vzhledem k tomu, že některé znaky tyto „běžné“ aneuploidie sdílí s hydatidózní molou, je vhodné, zvláště při klinické suspekci na molární graviditu, doplnit molekulárně genetické vyšetření.
Obr. 1. Trizomie chromozomu 21. Nepravidelný tvar choriových klků („irregularly irregular pattern“) (HE, 50x). 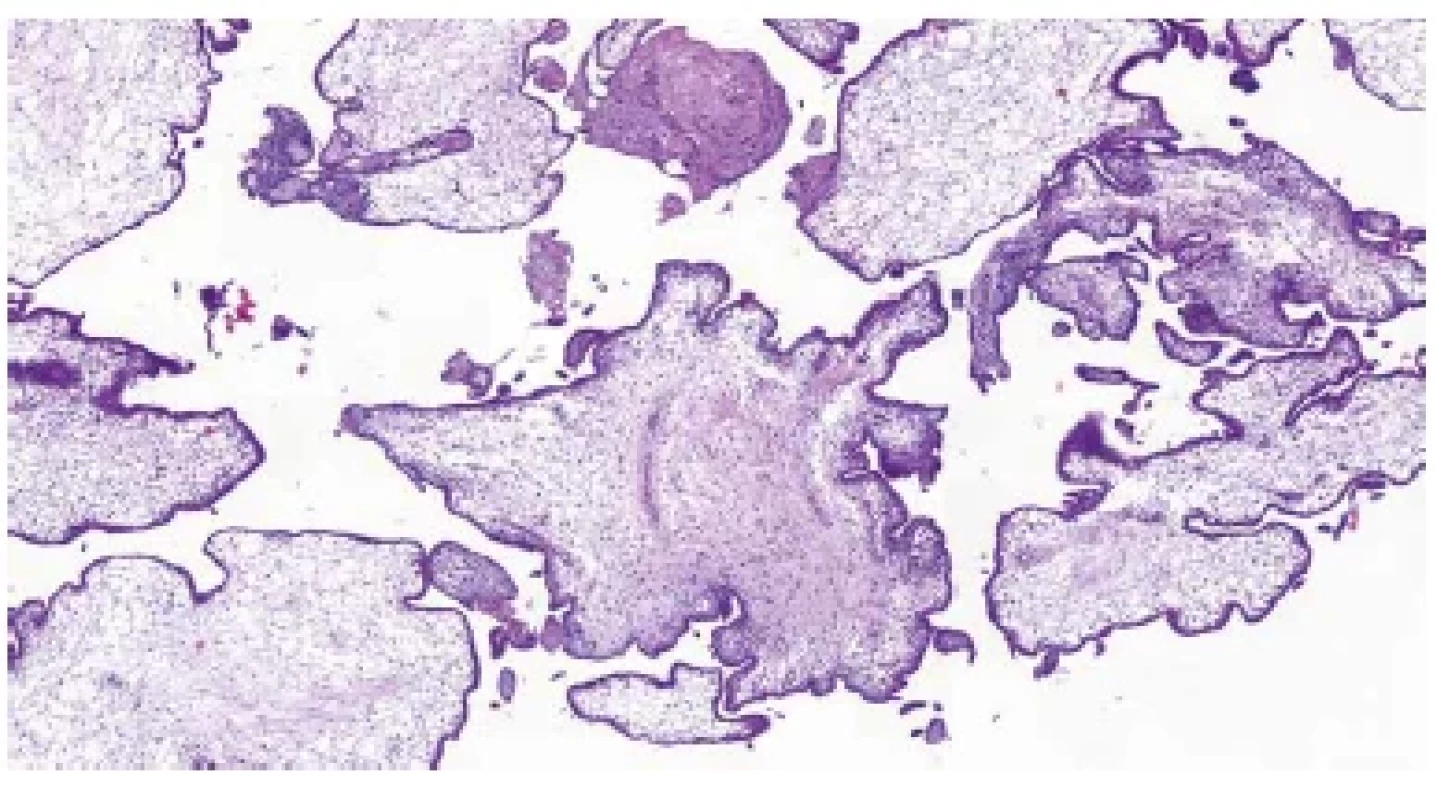
Obr. 2. Hydropický potrat. Edématózní choriové klky s trofoblastickými inkluzemi (HE, 100x). 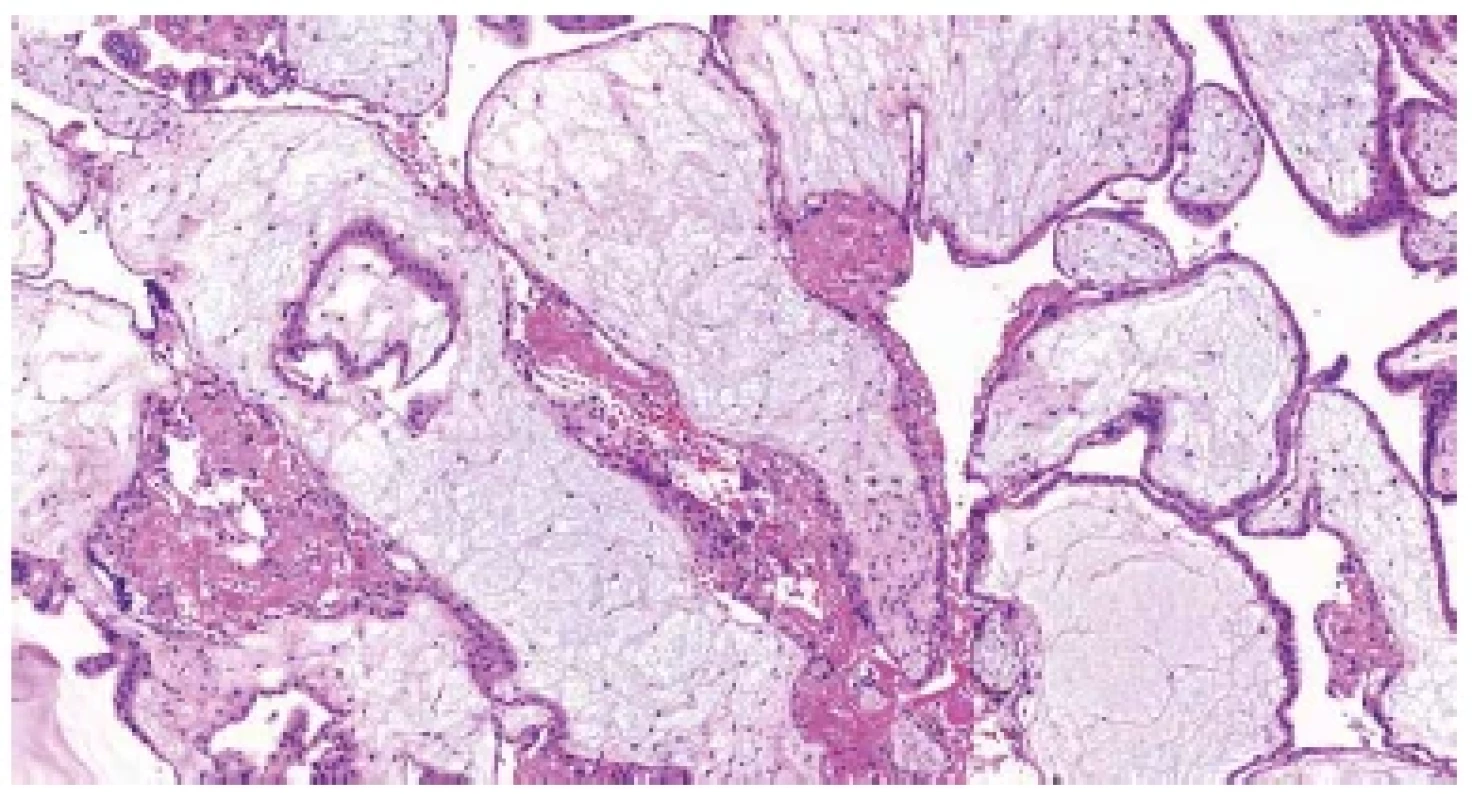
Obr. 3. Trizomie chromozomu 21. Nepravidelně větvené kapiláry s fetálními erytroblasty v luminu (HE, 200x). 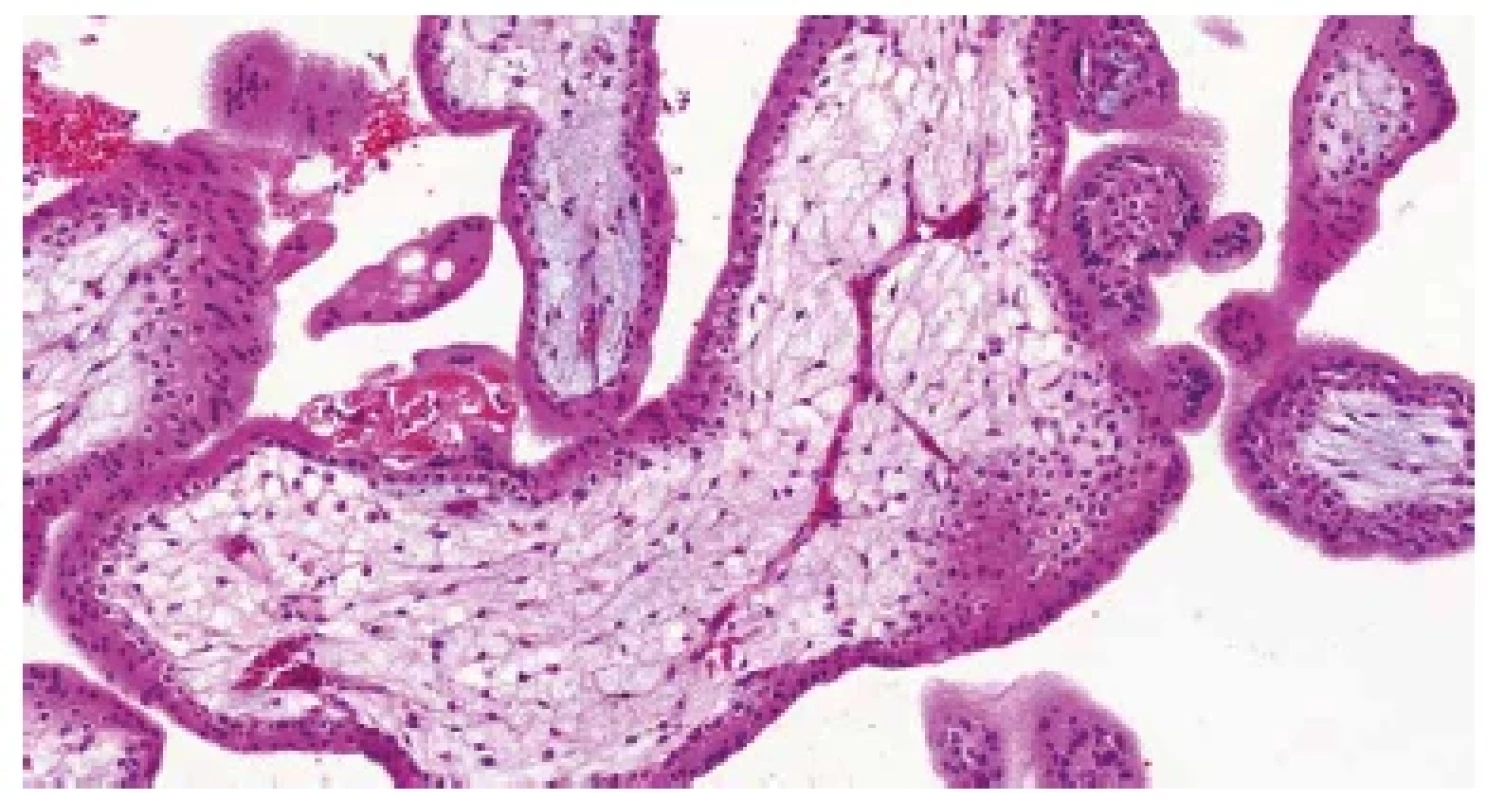
Obr. 4. Trizomie chromozomu 18. Buňky s abnormálně velkými jádry ve stromatu choriového klku (HE, 400x). 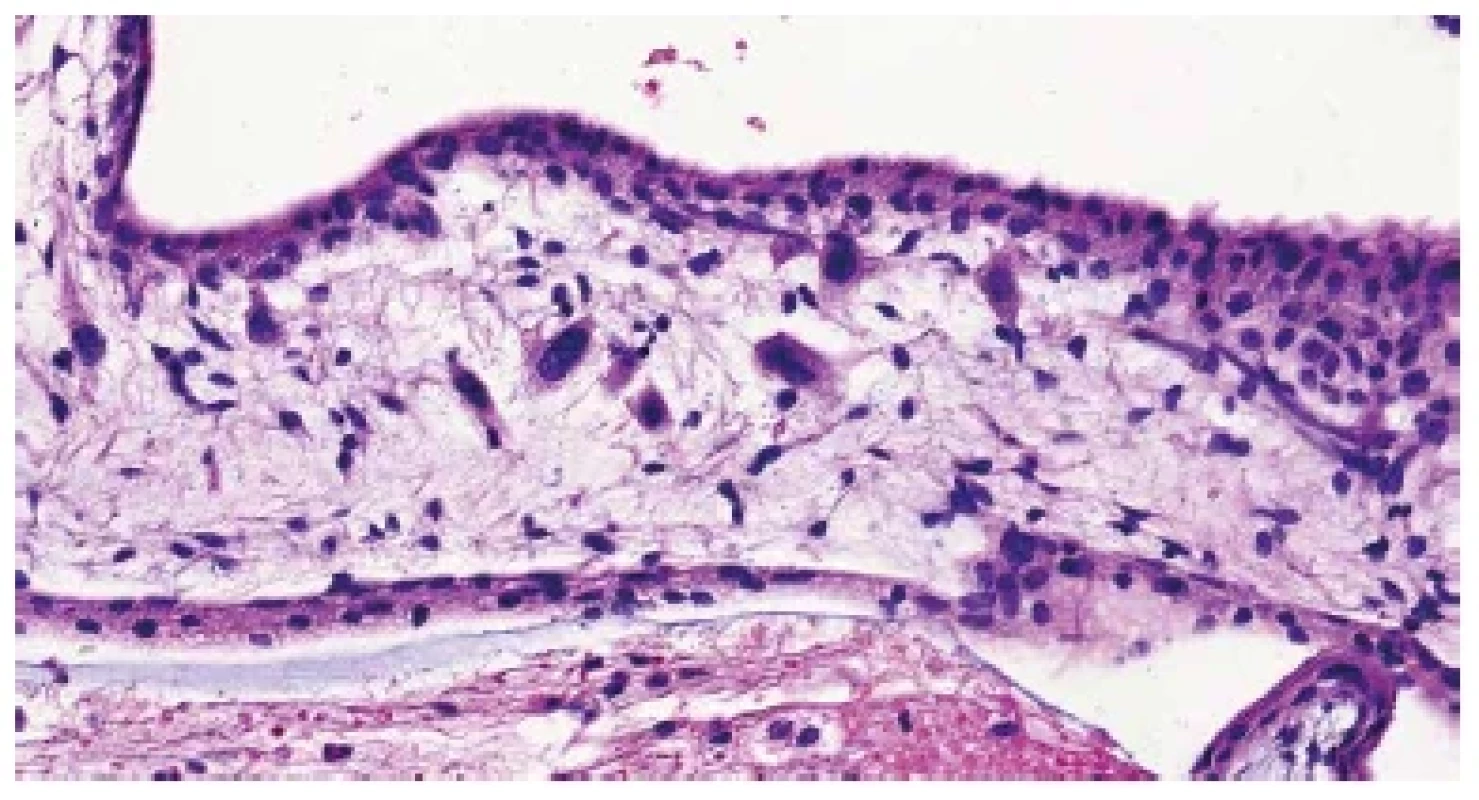
Obr. 5. Trizomie chromozomu 21. Nepravidelné choriové klky s mírným edémem stromatu, trofoblastickými inkluzemi a fokální hyperplázií trofoblastu (HE, 50x). 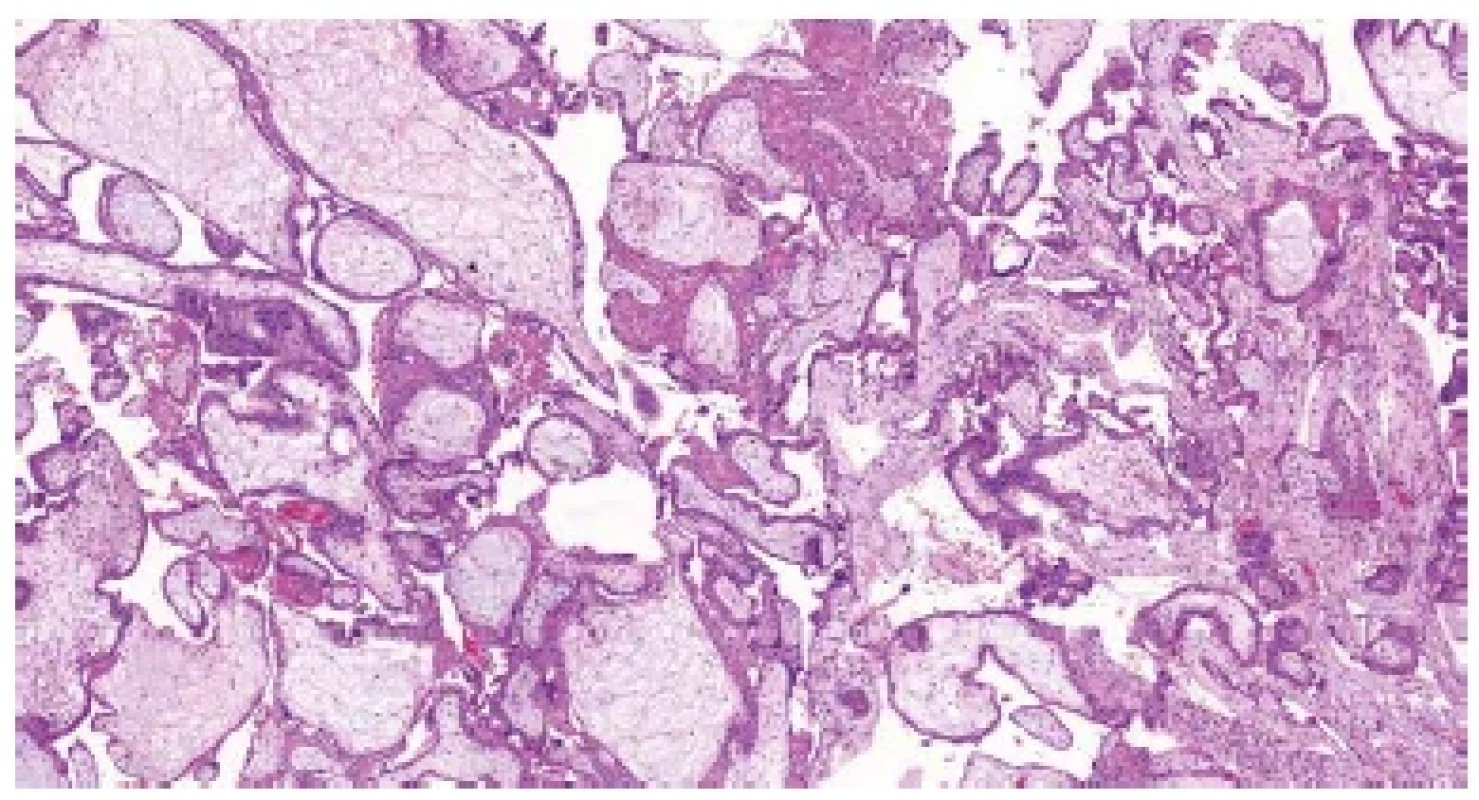
Aborty s normálním karyotypem
Časné těhotenské ztráty konceptu s normálním karyotypem bývají častěji asociovány s rizikovými faktory, mezi něž patří velmi nízký nebo naopak vysoký věk matky, in vitro fertilizace (IVF), obezita, maternální choroby (především maternální diabetes mellitus, hypertenze, hypothyreóza, autoimunní choroby a trombofilní stavy), strukturální abnormality dělohy a předchozí těhotenské komplikace (preeklampsie, abrupce placenty, předchozí potrat nebo porod mrtvého plodu) (11). Možnými příčinami abortu jsou různé environmetální faktory včetně poruch výživy či infekcí (12,13), dále imunopatologicky podmíněné léze (14) a v neposlední řadě i genetické či epigenetické abnormality (mutace, delece, inzerce, abnormální methylace DNA apod.), které nelze detekovat při rutinním cytogenetickém vyšetření. Podle výsledků menších studií mohou tyto genetické události vysvětlit 10 - 20 % časných těhotenských ztrát konceptů s normálním karyotypem (15,16).
Klinický obraz a morfologický nález bývá často nespecifický. Pokud od nitroděložního odumření a vypuzení konceptu z dutiny děložní uplynula krátká doba, lze v materiálu mikroskopicky pozorovat časný karyorrhektický rozpad fetálních erytroblastů a endotelových buněk fetálních cév. V některých případech mohou být v intervilózních prostorách patrné poměrně rozsáhlé čerstvé hemoragie, jejichž přítomnost naznačuje inadekvátní okluzi spirálních arteriol extravilózním trofoblastem v časných stádiích gravidity. Pokud není konceptus delší dobu vypuzen z dutiny děložní, vyvíjí se sekundární hydropické a fibrózní změny choriových klků (obr. 6). Těhotenská decidua bývá regresivně změněná a nacházíme v ní nespecifickou smíšenou zánětlivou celulizaci (2,5). Některé záněty infekčního původu mohou mít poměrně charakteristickou morfologii (Tab. 1). Ve většině případů však lze na původce z histologického vyšetření usuzovat jen vzácně. U některých infekcí navíc bývají typické změny vyjádřeny až v pozdějších stádiích gravidity (17).
Obr. 6. Zamlklý potrat. Hydropické a fibrózní změny choriových klků (HE, 50x). 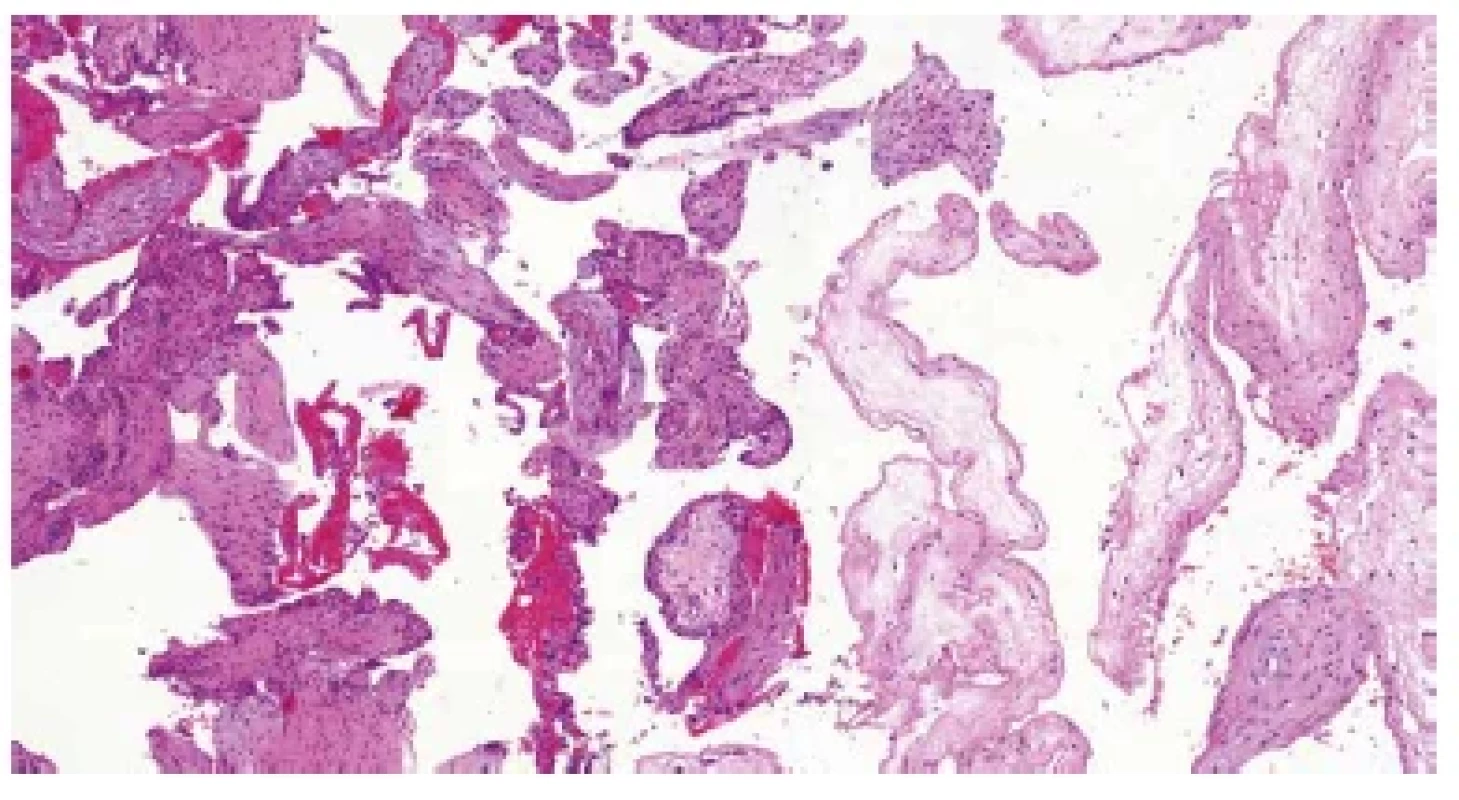
Tab. 1. Charakteristické morfologické nálezy v placentě při infekci vybranými mikroorganismy. 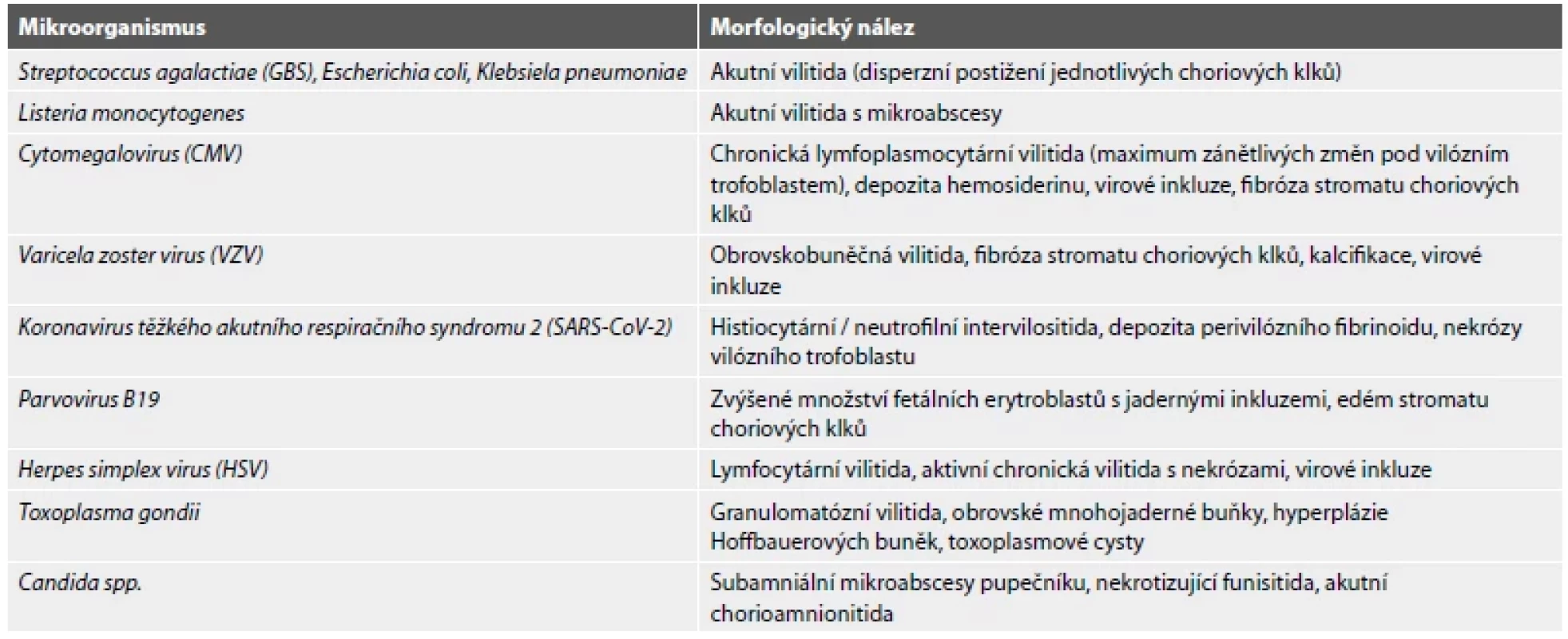
Důležitou kategorií možných příčin abortu v prvním trimestru jsou imunopatologicky podmíněné procesy, mezi něž patří masivní depozita perivilózního fibrinoidu (Massive Perivillous Fibrin Deposition, MPFD), chronická histiocytární intervilositida (Chronic Histiocytic Intervillositis, CHIV), lymfoplasmocytární deciduitida a chronická neinfekční vilitida (Villitis of Unknown Etiology, VUE). Tyto patologické stavy jsou způsobeny reakcí mateřského imunitního systému na antigeny plodu. Vyšší frekvence těchto lézí byla zaznamenána u matek s autoimunními chorobami či primárním antifosfolipidovým syndromem (2,18). Všechny zmíněné jednotky jsou zatíženy poměrně vysokým rizikem recidivy a mohou být příčinou habituálního potrácení. MPFD je stav charakterizovaný zvýšeným ukládáním fibrinoidu v intervilózních prostorách. Tento amorfní materiál zcela obklopuje choriové klky a znemožňuje efektivní výměnu látek mezi maternálním a fetálním krevním řečištěm. Choriové klky obklopené fibrinoidem jsou regresivně změněné a časem zanikají. Ačkoli patogene MPFD není dosud zcela objasněna, je známa častá asociace tohoto stavu s vrozenými i získanými mateřskými trombofilními stavy (19,20). CHIV je zánět neinfekčního původu, v jehož patogenezi se uplatňuje maternální imunitní odpověď na antigeny plodu. Tento zánět lze identifikovat přibližně ve 4,4 % placent plodů potracených v prvním trimestru gravidity. Mikroskopicky nacházíme v intervilózních prostorách chronickou zánětlivou celulizaci, jejíž dominantní komponentu tvoří CD68 pozitivní histiocyty. Zánět může být doprovázen zmnožením perivilózního fibrinoidu (18,21). Chronická deciduitida je zánět neinfekčního původu, který lze najít až u 20 % spontánně potracených konceptů. I v tomto případě se předpokládá, že příčinou zánětu je mateřská anti-fetální reakce. Tato léze častěji komplikuje graviditu z darovaného oocytu. Mikroskopicky je zánět charakterizován přítomností lymfocytů a plasmatických buněk v deciduy (22). Poslední jednotkou z této skupiny je VUE. Tento chronický destruktivní zánět choriových klků se v časných stádiích gravidity vyskytuje vzácně (spíše bývá pozorován v placentách plodů porozených v termínu) (23). Proto je při nálezu chronické vilitidy v materiálu z abortu v prvním trimestru vhodné vyloučit infekční etiologii procesu.
ZÁVĚR
Příčinu spontánního potratu není možné stanovit za všech okolností. Při vyšetření bioptického materiálu z abortu spočívá hlavní úkol patologa především ve vyloučení hydatidózní moly. Přesto může konvenční histologické vyšetření v některých případech přispět k objasnění důvodů, které k abortu vedly.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i spoluautorů.
Adresa pro korespondenci:
MUDr. Magdaléna Daumová, Ph.D.
Šiklův ústav patologie LFP a FN Plzeň
Edvarda Beneše 1128/13, 305 99 Plzeň
tel.: 377 402 089
e-mail: daumovam@fnplzen.czCesk Patol 2023; 59(2): 60–63
Zdroje
1. The American College of Obstetricians and Gynecologists Practice Bulletin no. 150. Early pregnancy loss. Obstet Gynecol 2015; 125(5): 1258-1267.
2. Redline RW, Zaragoza M, Hassold T. Prevalence of developmental and inflammatory lesions in nonmolar first-trimester spontaneous abortions. Hum Pathol 1999; 30(1): 93 - 100.
3. Burgoyne PS, Holland K, Stephens R. Incidence of numerical chromosome anomalies in human pregnancy estimation from induced and spontaneous abortion data. Hum Reprod 1991; 6(4): 555-565.
4. Pinar MH, Gibbins K, He M, Kostadinov S, Silver R. Early Pregnancy Losses: Review of Nomenclature, Histopathology, and Possible Etiologies. Fetal Pediatr Pathol 2018; 37(3): 191-209.
5. Jindal P, Regan L, Fourkala EO, et al. Placental pathology of recurrent spontaneous abortion: the role of histopathological examination of products of conception in routine clinical practice: a mini review. Hum Reprod 2007; 22(2): 313-316.
6. Genest DR, Roberts D, Boyd T, Bieber FR. Fetoplacental histology as a predictor of karyotype: a controlled study of spontaneous first trimester abortions. Hum Pathol 1995; 26(2): 201-209.
7. Kliman HJ, Segel L. The placenta may predict the baby. J Theor Biol 2003; 225(1): 143 - 145.
8. Redline RW, Hassold T, Zaragoza MV. Prevalence of the partial molar phenotype in triploidy of maternal and paternal origin. Hum Pathol 1998; 29(5): 505-511.
9. Ornoy A, Salamon-Arnon J, Ben-Zur Z, Kohn G. Placental findings in spontaneous abortions and stillbirths. Teratology 1981; 24(3): 243-252.
10. Redline RW, Hassold T, Zaragoza M. Determinants of villous trophoblastic hyperplasia in spontaneous abortions. Mod Pathol 1998; 11(8): 762-768.
11. Gunnarsdottir J, Stephansson O, Cnattingius S, Akerud H, Wikstrom AK. Risk of placental dysfunction disorders after prior miscarriages: a population-based study. Am J Obstet Gynecol 2014; 211(1): 34 e31-38.
12. Brosens I, Pijnenborg R, Vercruysse L, Romero R. The “Great Obstetrical Syndromes” are associated with disorders of deep placentation. Am J Obstet Gynecol 2011; 204(3): 193 - 201.
13. Jauniaux E, Hustin J. Histological examination of first trimester spontaneous abortions: the impact of materno-embryonic interface features. Histopathology 1992; 21(5): 409-414.
14. PrabhuDas M, Bonney E, Caron K, et al. Immune mechanisms at the maternal-fetal interface: perspectives and challenges. Nat Immunol 2015; 16(4): 328-334.
15. Rajcan-Separovic E, Qiao Y, Tyson C, et al. Genomic changes detected by array CGH in human embryos with developmental defects. Mol Hum Reprod 2010; 16(2): 125-134.
16. Shimokawa O, Harada N, Miyake N, et al. Array comparative genomic hybridization analysis in first-trimester spontaneous abortions with ‘normal’ karyotypes. Am J Med Genet A 2006; 140(18): 1931-1935.
17. Megli CJ, Coyne CB. Infections at the maternal - fetal interface: an overview of pathogenesis and defence. Nat Rev Microbiol 2022; 20(2): 67-82.
18. Boyd TK, Redline RW. Chronic histiocytic intervillositis: a placental lesion associated with recurrent reproductive loss. Hum Pathol 2000; 31(11): 1389-1396.
19. Katzman PJ, Genest DR. Maternal floor infarction and massive perivillous fibrin deposition: histological definitions, association with intrauterine fetal growth restriction, and risk of recurrence. Pediatr Dev Pathol 2002; 5(2): 159-164.
20. Faye-Petersen OM, Ernst LM. Maternal Floor Infarction and Massive Perivillous Fibrin Deposition. Surg Pathol Clin 2013; 6(1): 101-114.
21. Mekinian A, Costedoat-Chalumeau N, Masseau A, et al. Chronic histiocytic intervillositis: outcome, associated diseases and treatment in a multicenter prospective study. Autoimmunity 2015; 48(1): 40-45.
22. Khong TY, Bendon RW, Qureshi F, et al. Chronic deciduitis in the placental basal plate: definition and interobserver reliability. Hum Pathol 2000; 31(3): 292-295.
23. Redline RW. Villitis of unknown etiology: noninfectious chronic villitis in the placenta. Hum Pathol 2007; 38(10): 1439-1446.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článok vyšiel v časopiseČesko-slovenská patologie

2023 Číslo 2-
Všetky články tohto čísla
- Mola či nemola, toť otázka
- Na patologii mě baví, jak to dohromady pasuje a když nepasuje, tak člověk musí přemýšlet proč
- Monitor aneb nemělo by vám uniknout, že...
- Mola hydatidosa
- Krvácení po porodu / potratu – praktické poznámky k vyšetření bioptického materiálu
- Spontánní potrat v prvním trimestru gravidity
- Molekulární diagnostika kompletní a parciální hydatidózní moly
- Kostní dysplázie: přehled problematiky a deset let zkušeností s diagnostikou u plodů a novorozenců
- Kazuistika: Akutní poškození ledvin s progresí do chronicity u starší pacientky
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Mola hydatidosa
- Spontánní potrat v prvním trimestru gravidity
- Kostní dysplázie: přehled problematiky a deset let zkušeností s diagnostikou u plodů a novorozenců
- Molekulární diagnostika kompletní a parciální hydatidózní moly
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



