-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Molekulární diagnostika kompletní a parciální hydatidózní moly
Molecular diagnosis of complete and partial hydatidiform moles
Complete and partial hydatidiform moles are abnormal products of conception that can be identified by clinical, ultrasonographic, morphologic, histologic, and genetic methods. The diagnosis is usually confirmed only by histological examination. However, accurate diagnosis based on morphological criteria is difficult and some studies have shown that misclassifications are common, even when analysed by highly experienced pathologists. Misdiagnosis may mean that women are either not included in adequate β-hCG follow-up with the risk that the hydatidiform mole progresses to choriocarcinoma or, conversely, are included in follow-up unnecessarily. A reliable complementary method to pathological interpretation may be genetic analysis of the conceptus to eliminate the diagnostic dilemma by distinguishing non-molar spontaneous abortions from hydatidiform moles and defining the type of hydatidiform mole. The aim of our short paper is to introduce the routine molecular analysis used in our laboratory to a wider range of clinical pathologists.
Keywords:
Aneuploidy – hydatidiform mole – molecular genetic analysis – STR
Autori: Martina Putzová 1; Šárka Hadravská 1,2; Magdaléna Daumová 1,2
Pôsobisko autorov: Bioptická laboratoř s. r. o., Plzeň 1; Šiklův ústav patologie LF UK a FN Plzeň 2
Vyšlo v časopise: Čes.-slov. Patol., 59, 2023, No. 2, p. 64-67
Kategória: Přehledový článek
Súhrn
Kompletní a parciální hydatidózní mola jsou abnormální produkty koncepce, které mohou být identifikovány klinickými, ultrasonografickými, morfologickými, histologickými a genetickými metodami. Diagnóza bývá v běžných případech potvrzena pouze histologickým vyšetřením. Přesná diagnóza založená na morfologických kritériích je však obtížná a některé studie ukazují, že chybné klasifikace jsou časté, a to i při analýze velmi zkušenými patology. Chybná diagnóza může znamenat, že ženy buď nejsou zařazeny do adekvátního β‐hCG sledování s rizikem, že hydatidiformní mola progreduje do choriokarcinomu, nebo jsou naopak zařazeny do sledování zbytečně. Spolehlivou doplňkovou metodou k patologické interpretaci může být genetická analýza konceptu k odstranění diagnostického dilematu odlišením non-molárních spontánních potratů od hydatidiformní moly a definováním typu hydatidiformní moly. Cílem našeho krátkého příspěvku je představit rutinní molekulární analýzu, kterou používáme v Bioptické laboratoři s.r.o., širšímu okruhu klinických patologů.
Klíčová slova:
aneuploidie – hydatidózní mola – molekulárně genetická analýza – STR
Kompletní hydatidozní mola (CHM) a parciální hydatidozní mola (PHM) jsou chromozomálně abnormální těhotenství, která mohou být charakterizována různými metodami - klinicky, ultrasonograficky, makroskopicky, morfologicky, histologicky a geneticky (1). Rozdíl mezi těmito dvěma entitami je pro management následné péče o pacientku velice důležitý, protože CHM má větší maligní potenciál než PHM, a proto se sledování a doporučení pacientkám mohou lišit.
Genetická podstata hydatidozních mol byla zjištěna již v 70. letech 20. století (2). Všechny CHM mají pouze diandrický otcovský genom; neobsahují žádnou maternální genetickou informaci. Většina CHM je proto homozygotní a pochází z enukleovaného vajíčka, které bylo oplodněno haploidní 23,X spermií (monospermie), která poté replikuje své vlastní chromozomy, což vede ke karyotypu 46,XX (uniparentální paternální izodisomie). Menší množství případů zahrnuje oplodnění enukleovaného vajíčka dvěma spermiemi (dispermie) současně, což může vést ke karyotypu 46,XX nebo 46,XY (uniparentální paternální heterodisomie) (3). Velmi vzácnými formami CHM je tetraploidie (4) a familiární případy recidivujících CMH. Bylo rovněž reportováno, že diploidizace může vzniknout z původně triploidního konceptu; CHM vznikne v případě, kdy dojde ke ztrátě haploidního maternálního příspěvku (5). Abnormalita ve vývoji plodu a placenty u CHM je v podstatě způsobena abnormálními genomickými imprintingovými efekty. Ztráta mateřského epigenetického imprintu a zisk exprese genů paternálně imprintovaných společně, vedou ke globální hypometylaci genomu a abnormální genové expresi. Ta vede k abnormálnímu vývoji placentárního trofoblastu (6).
Většina případů CHM je sporadická. Velmi zřídka se však mohou vyskytnout moly recidivující. Recidivující hydatidozní moly (RHM) zahrnující nejméně dva případy CMH u pacientky, často jsou to případy familiární. Takové moly jsou obvykle diploidní a jsou na rozdíl od ostatních CMH biparentální (obsahují obě sady rodičovských chromozomů). V některých rodinách s RHM byly zjištěny homozygotní a složené heterozygotní recesivní genové mutace v dvou kauzálních genech NLRP7 a KHDC3L (7). NLRP7 (rodina NLR, doména pyrinu obsahující 7) umístěná na 19q13.4 je členem rodiny proteinů NLR s rolí při zánětu a apoptóze (8). KHDC3L (doména KH obsahující 3-like) je umístěný na 6q13 a je členem rodiny proteinů KHDC1 (9). Přesný kauzální mechanismus zahrnující tyto dva geny v rodinách RHM není plně objasněn, nicméně deregulace imprintovaných genů přispívá k patogenezi, což vede k aberantní buněčné proliferaci a diferenciaci (7).
Přestože ultrasonografie a hladina β‐hCG jsou užitečnými diagnostickými nástroji při identifikaci hydatidiformní moly (HM), konečná diagnóza je často potvrzena až histologickým vyšetřením. Z některých studií je však patrné, že s klasifikací těchto diagnoz mohou mít problémy i zkušení patologové a některé atypické případy není snadné definitivně klasifikovat pouze na základě morfologických kritérií. Míra shody mezi patology pro diagnostiku molárních těhotenství (CHM nebo PHM) se pohybuje v rozmezí 55–75 % (10, 11). PHM může být obzvláště obtížné identifikovat, protože má společné rysy s normální placentou i CHM.
Tyto chybné klasifikace lze přičíst absenci přísných morfologických kritérií pro odlišení HM a také faktu, že některé charakteristiky se významně překrývají. Užitečným doplňkem patologické interpretace proto může být molekulárně-genetická analýza DNA tkáně. Abychom se vyhnuli chybné analýze, je vhodné paralelně s tkání plodu analyzovat rovněž referenční materiál matky – lze použít mateřskou tkáň identifikovanou patologem ve fixovaném materiálu (těhotenská decidua), případně lze tento referenční materiál nahradit bukálním stěrem pacientky.
Postup analýzy vzorků
Způsob zpracování vzorků po dodání do genetické laboratoře je schematicky znázorněn na obrázku (obr. 1). Většina analyzovaných tkání pochází z FFPE bloků. U vzorku plodu a kontrolního vzorku mateřské tkáně je po příjmu do laboratoře tkáň dle zakreslení patologem nejprve makrodisekována pomocí mikrotonu z bloku, řez je oddělen a přenesen do zvláštních zkumavek. Izolace je prováděna strojovou izolací Qia-Symphony. Po izolaci je nejdříve provedena kontrola kvality a integrity DNA – tu provádíme analýzou fragmentů house-keepingových genů o délce 100 – 600 bp (12). Po kontrole integrity je u optimálních, nedegradovaných (amplifikují se u nich všechny fragmenty house-keepingových genů), nebo málo degradovaných vzorků (amplifikují se u nich fragmenty house-keepingových genů do délky 400bp včetně) provedena analýza metodou multiplexní QF-PCR pomocí vysoce informativních STR markerů. Analýzu jsme původně prováděli kitem AmpFLSTR™ Identifiler™ Plus PCR Amplification Kit (ThermoFisher Scientific, US), v současné chvíli preferujeme diagnostický kit SuperSTAR Optima (CE marked IVD kit, CyberGene AB, Sweden), který obsahuje STR markery specifické pro chromozomy 13, 18, 21, X a Y. Celkový obraz amplifikovaných markerů u obou kitů umožňuje kvalitní detekci kompletní či parciální moly (obr. 2, obr. 3). Kit SuperSTAR Optima využívá STR markery lokalizované výhradně na chromozomech 13, 18, 21, X a Y a je proto schopen detekovat aneuploidie těchto chromozomů (minimálně jsou vyžadovány dva plně informativní markery pro každý z testovaných chromozomů).
Obr. 1. Postup analýzy vzorků v Bioptické laboratoři s.r.o. 
Obr. 2. Průkaz CHM vzniklé kompletní endoreduplikací chromozomální sady jedné spermie. Analyzováno kitem SuperSTAR Optima (CE marked IVD kit, Cyber- Gene AB, Sweden). Karyotyp odpovídá 46, XX, ale všechny chromozomy jsou od otce a v páru shodné. Porovnání profilu plodu a kontrolního materiálu matky: jednu kopii by plod vždy dědil od matky – u zakroužkovaných markerů je ale patrné, že nemohou pocházet od matky (není u ní stejně dlouhý ekvivalent markeru). Rovněž všechny markery mají jen jednu délku STM markeru, což u takového množsví markerů v normální tkáni nenalezneme. 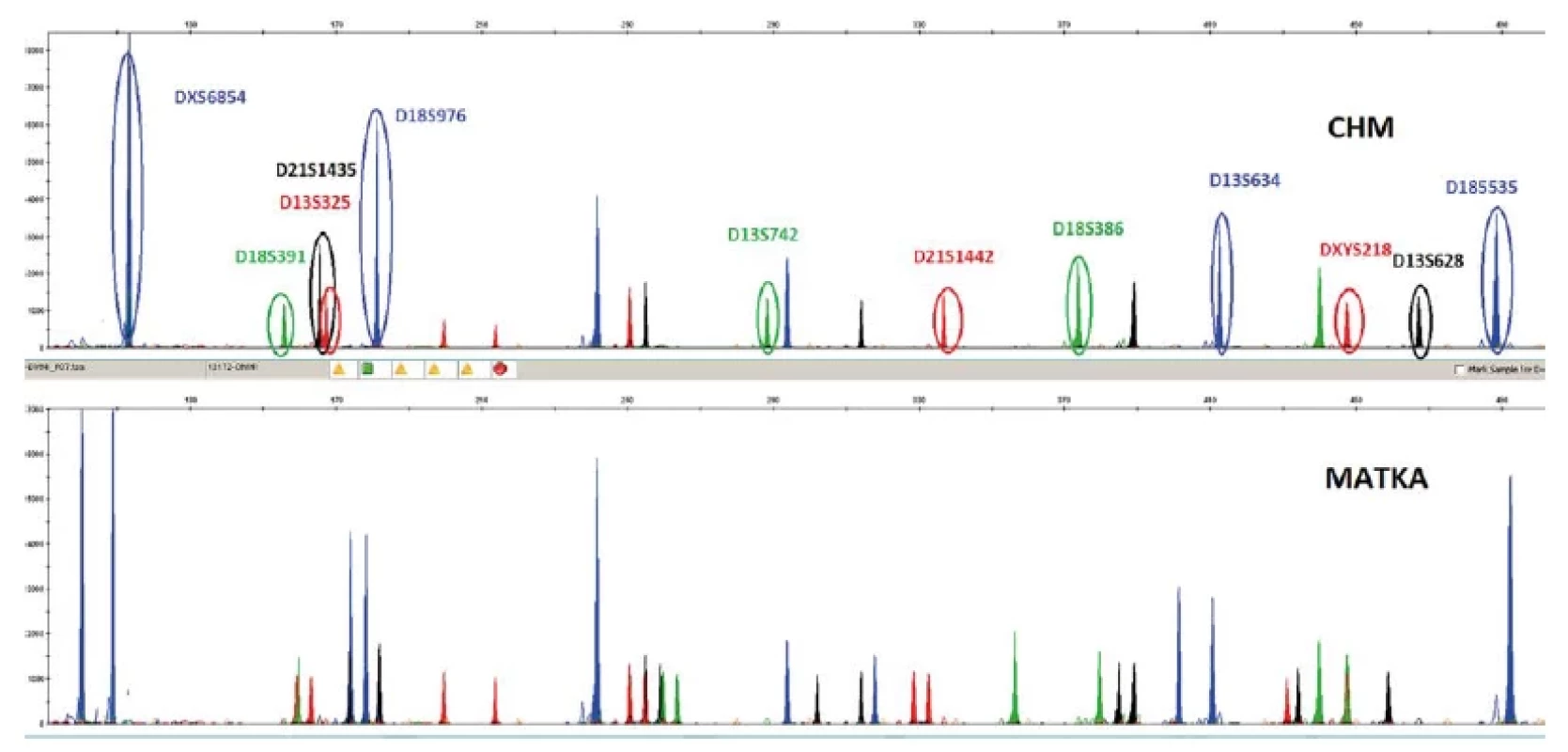
Obr. 3. Průkaz PHM: karyotyp plodu: 69, XXX. Analyzováno kitem AmpFLSTR™ Identifiler™ Plus PCR Amplification Kit (ThermoFisher Scientific). Porovnání profilu plodu a kontrolního materiálu matky: jednu kopii plod dědí od matky – u zakroužkovaných markerů je vidět, že nemohou pocházet od matky (není u ní stejně dlouhý ekvivalent markeru), jedna chromozomální sada od matky pochází. Plod v tomto případě vznikl dispermií (vidíme jednu sadu od matky a dvě různé sady od otce) 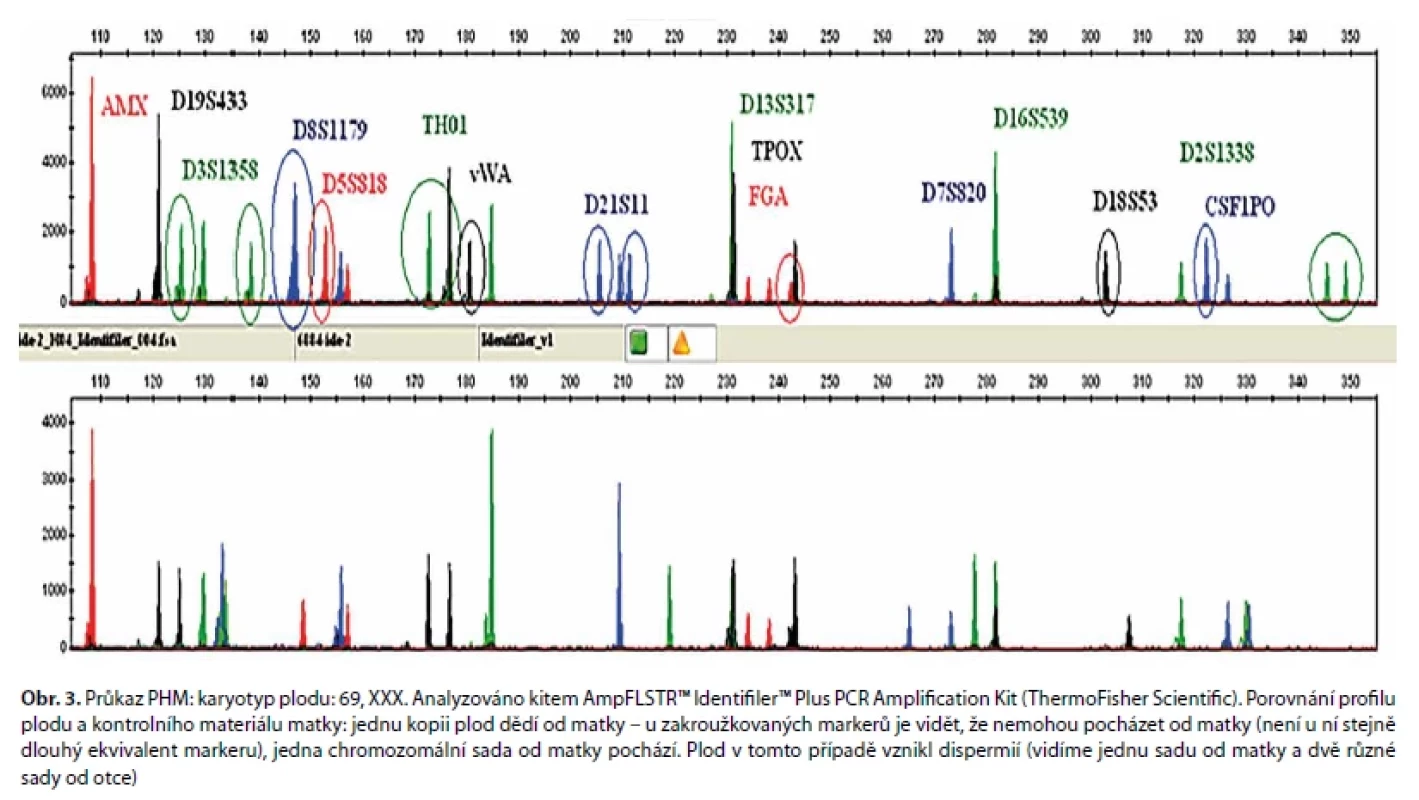
V případě, že je vzorek vysoce degradovaný - (při kontrole integrity se amplifikují fragmenty house-keepingových genů do délky 300 bp včetně) je provedena analýza kitem MiniFiler (AmpFLSTR™ MiniFiler™, ThermoFisher). Kit využívá STR markery lokalizované na různých autozómech (po jednom STR markeru) – celkový obraz amplifikovaných markerů umožňuje kvalitní detekci kompletní či parciální moly. Kvalita analýzy aneuploidií jednotlivých chromozomů je omezená (nejsou k dispozici dva informativní markery pro každý z analyzovaných chromozomů).
Výše uvedený přístup má tu výhodu, že je schropen odlišit CHM a PHM od ostatních stavů, jako jsou nemolární hydropický potrat (HP), trizomie, nebo monozomie analyzovaných chromozomů a digynická triploidie.
ZÁVĚR
Od 70. let 20. století bývala hlavním vyšetřovacím nástrojem produktů koncepce konvenční cytogenetika, která dokáže odhalit širokou škálu chromozomálních abnormalit, včetně triploidních parciálních molárních těhotenství. Nedokáže však rozlišit mezi CHM a non-molárními těhotenstvími. K detekci molárních těhotenství by měly být použity molekulární cytogenomické přístupy včetně genotypizace pomocí STR případně SNP microarray analýzy. Rovněž byla popsána diagnostická užitečnost genotypizace pro přesnou klasifikaci hydatidozních mol (13). Genotypizace může pomoci při klinickém řízení a genetickém poradenství. CHM je vzácný nález, může se však rozvinout v gestační trofoblastickou neoplazii, maligní a život ohrožující onemocnění. Proto je použití molekulárního genotypování důležité a pokud by bylo použito u všech produktů koncepce, umožní identifikaci velké většiny CHM. U vzácných recidivujících (2 nebo více) biparentálních kompletních mol by mělo být rovněž zváženo testování mutace v genech NLRP7 a KHDC3L.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i spoluautorů
Adresa pro korespondenci:
RNDr. Martina Putzová, Ph.D.
Bioptická laboratoř s.r.o.
Mikulášské nám. 4, 326 00 Plzeň
e-mail: putzova@biopticka.czCesk Patol 2023; 59(2): 64–67
Zdroje
1. Berkowitz RS, Goldstein DP. Clinical practice. Molar pregnancy. N Engl J Med 2009; 360 : 1639-1645.
2. Kajii T, Ohama K. Androgenetic origin of hydatidiform mole. Nature 1977; 268 : 633-634.
3. Lawler SD, Fisher RA, Dent J. A prospective genetic study of complete and partial hydatidiform moles. Am J Obstet Gynecol 1991; 164 : 1270-1277.
4. Hui P. Molecular diagnosis of gestational trophoblastic disease. Expert Rev Mol Diagn 2010; 10 : 1023-1034.
5. Golubovsky MD. Postzygotic diploidization of triploids as a source of unusual cases of mosaicism, chimerism and twinning. Hum Reprod 2003; 18 : 236-242.
6. Bestor TH, Bourc’his D. Genetics and epigenetics of hydatidiform moles. Nat Genet 2006; 38 : 274-276
. 7. Nguyen NM, Slim R. Genetics and Epigenetics of Recurrent Hydatidiform Moles: Basic Science and Genetic Counselling. Curr Obstet Gynecol Rep 2014; 3 : 55-64.
8. Murdoch S, Djuric U, Mazhar B, et al. Mutations in NALP7 cause recurrent hydatidiform moles and reproductive wastage in humans. Nat Genet 2006; 38 : 300-302.
9. Parry DA, Logan CV, Hayward BE, et al. Mutations causing familial biparental hydatidiform mole implicate c6orf221 as a possible regulator of genomic imprinting in the human oocyte. Am J Hum Genet 2011; 89 : 451 - 458.
10. Javey H, Borazjani G, Behmard S, Langley FA. Discrepancies in the histological diagnosis of hydatidiform mole. BJOG: An Internat J of Obstet & Gynaecol 1979; 86.6 : 480-483.
11. Messerli ML, Parmley T, Woodruff JD, Lilienfeld AM, Bevilacqua L, Rosenshein NB. Inter-and intra-pathologist variability in the diagnosis of gestational trophoblastic neoplasia. Obstet Gynecol 1987; 69.4 : 622-626.
12. Van Dongen, JJM, Langerak AW, Brüggemann M, et al. Design and standardization of PCR primers and protocols for detection of clonal immunoglobulin and T-cell receptor gene recombinations in suspect lymphoproliferations: report of the BIOMED-2 Concerted Action BMH4-CT98-3936. Leukemia 2003; 17.12 : 2257-2317.
13. Furtado LV, Paxton CN, Jama MA, et al. Diagnostic utility of microsatellite genotyping for molar pregnancy testing. Arch Pathol Lab Med 2013; 137 : 55-63.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článok vyšiel v časopiseČesko-slovenská patologie

2023 Číslo 2-
Všetky články tohto čísla
- Mola či nemola, toť otázka
- Na patologii mě baví, jak to dohromady pasuje a když nepasuje, tak člověk musí přemýšlet proč
- Monitor aneb nemělo by vám uniknout, že...
- Mola hydatidosa
- Krvácení po porodu / potratu – praktické poznámky k vyšetření bioptického materiálu
- Spontánní potrat v prvním trimestru gravidity
- Molekulární diagnostika kompletní a parciální hydatidózní moly
- Kostní dysplázie: přehled problematiky a deset let zkušeností s diagnostikou u plodů a novorozenců
- Kazuistika: Akutní poškození ledvin s progresí do chronicity u starší pacientky
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Mola hydatidosa
- Spontánní potrat v prvním trimestru gravidity
- Kostní dysplázie: přehled problematiky a deset let zkušeností s diagnostikou u plodů a novorozenců
- Molekulární diagnostika kompletní a parciální hydatidózní moly
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



