-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Prognostické faktory metastatického karcinomu prostaty
Prognostic factors in metastatic prostate cancer
Metastatic prostate cancer (mPC) is a heterogeneous group of diseases with a median survival of 42 months. The basic treatment of mPC is always a combined treatment with androgen deprivation therapy (ADT – androgen deprivation therapy) with new antiandrogens (ARTA – androgen receptor targeted agents) such as enzalutamide, apalutamide, darolutamide or with the new testosterone synthesis blocker abiraterone acetate (AA) or with chemotherapy (docetaxel, cabazitaxel). To determine prognosis, we use prognostic factors that correlate with survival independent of systemic therapy. In this article, we provide an overview of the currently used prognostic factors.
Keywords:
prostate cancer – prognostic factors – metastatic prostate cancer – prognosis.
Autori: Alžběta Kantorová; Viktor Soukup; Otakar Čapoun
Pôsobisko autorov: Urologická klinika VFN a 1. LF UK, Praha
Vyšlo v časopise: Ces Urol 2023; 27(2): 86-94
Kategória: Přehledový článek
Súhrn
Metastatický karcinom prostaty (mKP) je heterogenní skupinou onemocnění s mediánem přežití 42 měsíců. Základ léčby mKP tvoří vždy kombinace androgen deprivační terapie (ADT – androgen deprivation therapy) s novými antiandrogeny (ARTA – androgen receptor targeted agents), jako jsou enzalutamid, apalutamid, darolutamid, nebo s novým blokátorem syntézy testosteronu abirateron acetátem (AA) či s chemoterapií (docetaxel, kabazitaxel). Pro stanovení prognózy užíváme prognostické faktory, které korelují s délkou přežití bez ohledu na systémovou terapii. V této práci podáváme přehled aktuálně využívaných prognostických faktorů.
Klíčová slova:
karcinom prostaty – prognostické faktory – metastatický karcinom prostaty – prognóza.
ÚVOD
Karcinom prostaty (KP) je nejčastějším nádorovým onemocněním u mužů. Přestože lokalizovaný nebo lokálně pokročilý KP má velmi dobrou prognózu, u pacientů s nově diagnostikovaným metastatickým karcinomem prostaty (mKP) je při samotné androgen deprivační terapii (ADT – androgen deprivation therapy) medián přežití pouze 42 měsíců (1). Současná léčba mKP nabízí již několik linií, avšak základem je vždy účinná hormonální léčba, která snižuje hodnotu testosteronu do kastračních hladin (≤ 1,7 nmol/l nebo ≤ 50 ng/dl). V posledních letech se dostala do popředí kombinovaná léčba, tedy kombinace ADT s novými antiandrogeny (ARTA – androgen receptor targeted agents) jako jsou enzalutamid, apalutamid, darolutamid nebo s novým blokátorem syntézy testosteronu abirateron acetátem (AA) či s chemoterapií (docetaxel, kabazitaxel). Metastatický karcinom prostaty je však velmi heterogenní skupinou onemocnění a pro stanovení optimální individualizované léčby musíme stanovit prognózu pacienta. K tomu používáme prognostické faktory, které korelují s délkou přežití bez ohledu na systémovou terapii a určují rizikové pacienty. Ty dělíme do tří základních skupin na sérové, tkáňové a klinické. V této práci podáváme přehled aktuálně využívaných prognostických faktorů u mKP.
SÉROVÉ PROGNOSTICKÉ FAKTORY
PSA, PSA velocita, čas zdvojení hodnoty PSA
Prostatický specifický antigen (PSA) je enzym produkovaný buňkami prostatických žlázek (2).
Jedná se o orgánově specifický marker, avšak ne nádorově specifický. Zvýšené hladiny můžeme detekovat jak při KP, tak i u benigní hyperplazie prostaty, prostatitidě, infekci močových cest či při močové retenci (3). Iniciální hladinu PSA (baseline PSA) používáme jako jeden ze základních prognostických faktorů. Již v roce 2010 studie na 4 568 mužích prokázala, že iniciální hodnota PSA je spolehlivý prognostický faktor. Muži s iniciální hodnotou PSA ≥ 4 ng/ml měli prokazatelně vyšší riziko úmrtí na KP (4). Další, přesnější, prognostickou výpověď mají specifické výpočtové jednotky – PSA velocita (PSA‑V) a čas do zdvojení PSA (PSA‑DT – PSA doubling time). Absolutní roční nárůst hladiny PSA udáváme jako PSA‑V. Čas do zdvojení hodnoty PSA vypočítáme pomocí kalkulátorů a udáváme jej v měsících nebo letech (5). Musíme však pamatovat na to, že výpočet těchto jednotek je důležitý pro určení prognózy již léčeného pacienta a neměli bychom je užívat v rámci diagnostiky KP. Otázkou zůstává jejich spíše teoretický význam při určení prognózy před zahájením léčby (6).
Hladina PSA po sedmi měsících léčby
Ve studii South West Oncology Group (SWOG) 9346 bylo rozděleno 1 134 pacientů s mKP dle hladiny PSA po sedmiměsíčním „indukčním“ cyklu ADT goserelinem a bicalutamidem do tří prognostických skupin. Medián přežití byl 13 měsíců u pacientů s hladinou PSA > 4 ng/ml, 44 měsíců u pacientů s hladinou PSA 0,2–4 ng/ml a 75 měsíců u pacientů s hladinou PSA < 0,2 ng/ml (7).
Tekutá biopsie
Tekutá biopsie z periferní krve pacienta představuje jednu z nejšetrnějších metod získání informací o typu a povaze nádorových buněk. Zahrnuje nejen vyšetření krevních elementů, ale také vyšetření cirkulujících nádorových buněk (CTC – circulating tumor cells) nebo cirkulující nádorové DNA (ctDNA – circulating tumor DNA). Jako CTC označujeme buňky, které se oddělily od primárního tumoru nebo metastáz a vstoupily do krevního oběhu a svým průchodem krevním řečištěm mohou založit metastázy v dalších orgánech (8). Celkem 276 pacientů s metastatickým kastračně rezistentním KP (mCRPC – metastatic castration‑resistant prostate cancer) vstoupilo do studie, jejímž cílem bylo potvrdit vztah mezi počtem CTC po léčbě a celkovým přežitím (OS – overall survival). V rámci studie došlo k odběru periferní krve před a po zahájení nové linie chemoterapie. Stratifikace proběhla podle předem stanovených příznivých (< 5 CTC/7,5 ml krve) nebo nepříznivých výsledků (≥ 5 CTC/7,5 ml krve). Z 276 zařazených pacientů bylo hodnoceno 231 pacientů. Pacienti s nepříznivým počtem CTC před léčbou měli kratší OS (medián 11,5 vs. 21,7 měsíců). Nepříznivý počet CTC po léčbě také predikoval kratší OS v období dvou až 20 týdnů (medián OS: 6,7–9,5 vs. 19,6–20,7 měsíců). U pacientů s iniciálně nepříznivým počtem CTC, u kterých byl po léčbě zjištěn příznivý počet CTC, se OS prodloužil (6,8 až 21,3 měsíců). Tato studie tedy stanovila přítomnost ≥ 5 CTC v 7,5 ml krve jako nepříznivý prognostický faktor, zatímco pokles počtu CTC po léčbě jako příznivý prognostický faktor (9, 10). V další rozsáhlé prospektivní studii Scher et al. hodnotili potenciál počtu CTC jako zástupného markeru účinnosti léčby u 711 pacientů s mCRPC předléčených docetaxelem. Počet CTC ≥ 5/7,5 ml po 12 týdnech léčby abirateron acetátem (AA) byl spojen s horším OS. Navíc kombinace počtu CTC a hladiny laktátdehydrogenázy (LDH) představovala zástupný marker celkového přežití – dvouletý OS byl ve skupině s nízkým rizikem 46 % (CTC < 5/7,5 ml a LDH < 250 U/l) oproti dvěma procentům ve vysoce rizikové skupině (≥ 5 CTC/7,5 ml krve a LDH > 250 U/l) (11, 12). Lze předpokládat, že hodnocení počtu CTC může stanovit prognózu pacientů s mCRPC jak před, tak i během léčby, a také, že počet CTC může být použit společně s hladinou PSA jako zástupný marker při určení OS (13).
Obr. 1. Celkové přežití dle hladiny prostatického specifického antigenu (PSA, ng/ml) po ukončení indukčního cyklu androgen deprivační terapie (ADT) (7)
Fig. 1. Overall survival by prostate-specific antigen (PSA, ng/mL) status at the end of induction course with androgen deprivation therapy (7)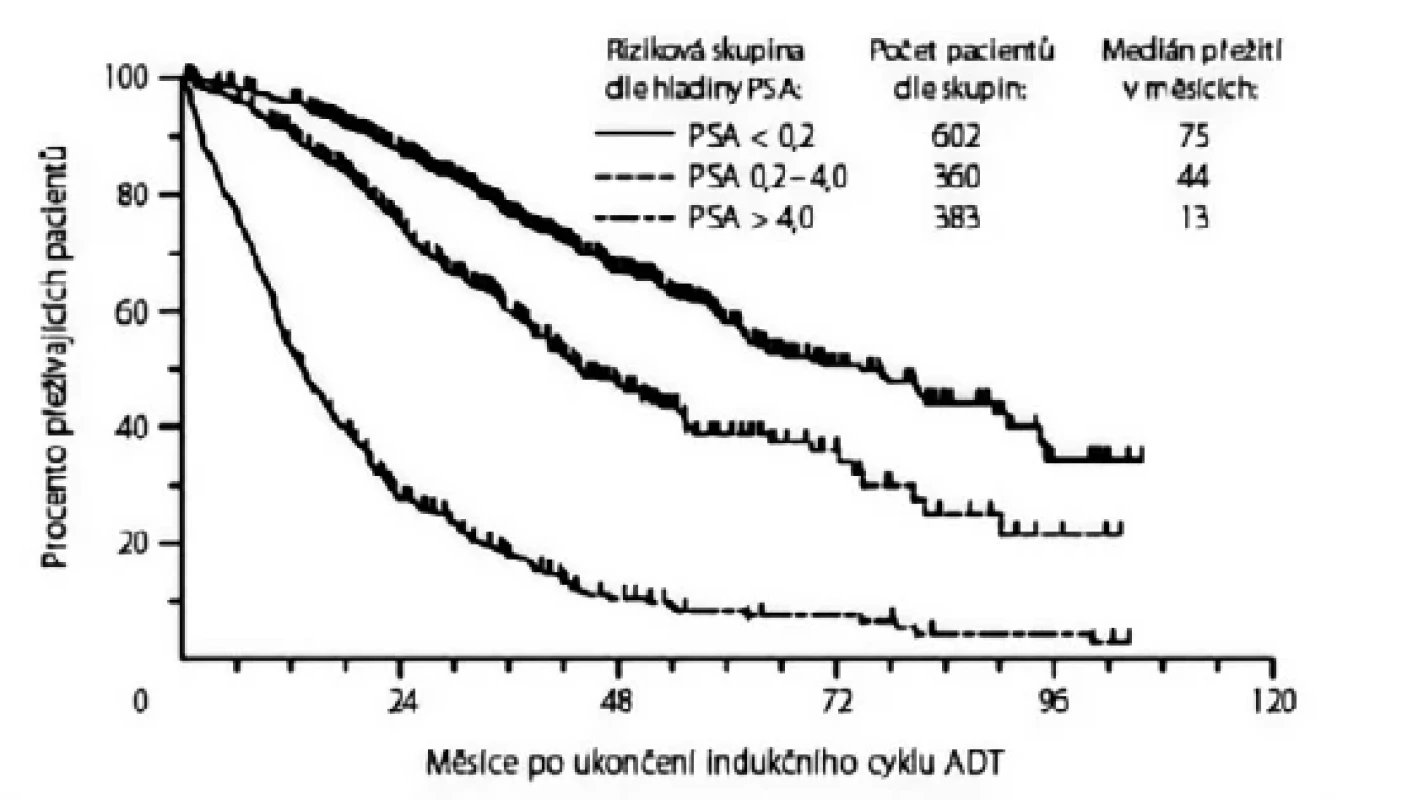
Hladina laktát dehydrogenázy
Je známo, že nádorové buňky mají odlišný metabolismus od zdravých buněk, což jim poskytuje selektivní výhodu v jejich proliferaci a přežití. Vzhledem k rychlému dělení jsou nádorové buňky často nuceny využívat jako hlavní energetický metabolismus anaerobní glykolýzu, což je spojeno se závislostí na glukóze a vyšší produkcí laktátu. Enzym LDH v této reakci katalyzuje redukci pyruvátu na laktát a její zvýšená hladina proto bývá často zvýšená u agresivních tumorů (14). Mnoho studií prokázalo, že kromě zásadní role v metabolismu nádorových buněk dochází k elevaci LDH i při proliferaci, invazi a metastazování buněk. Vysokou koncentrací LDH v séru proto pozorujeme u řady onkologických onemocnění (15). Li at al. zkoumali, zda vysoká koncentrace LDH koreluje s negativní prognózu u pacientů s mKP. Autoři provedli rozsáhlou metaanalýzu, do které zahrnuli 9 813 pacientů s mKP z celkem 38 studií. Potvrdili, že vyšší hladiny LDH u pacientů s mKP významně korelují s horším OS a horším přežitím bez progrese (PFS – progression free survival). Analýza jednotlivých podskupin prokázala, že negativní prognostický dopad vyšších hladin LDH na onkologické výsledky mKP byl významný bez ohledu na etnickou příslušnost, rok publikace, velikost vzorku, typ analýzy, typ léčby, věk a stav onemocnění. Výše uvedené studie potvrdily, že vysoká koncentrace LDH souvisí s negativní prognózou u pacientů s mKP (16).
TKÁŇOVÉ PROGNOSTICKÉ FAKTORY
Gleasonovo skóre/International Society of Urological Pathology Grading KP popisujeme pomocí Gleasonových stupňů 3–5. Z dříve užívaného rozmezí Gleasonových stupňů 1–5 byly po modifikaci skóre v roce 2005 Mezinárodní společností pro urologickou patologii (ISUP – International Society of Urological Pathology) stupně 1 a 2 vyřazeny. Gleasonovo skóre (GS) následně představuje součet nejčastějšího a pak druhého nejčastějšího stupně. Pokud detekujeme přítomen pouze jeden stupeň, pak se GS rovná dvojnásobku stupně a pokud ve vzorcích pozorujeme tři různé stupně, tak GS zahrnuje nejčastější plus nejvyšší stupeň bez ohledu na procento z celé nádorové tkáně (17). Další zásadní modifikace skóre nastala v roce 2014, kdy se nově začaly používat třídy dle ISUP od 1 do 5, které rozlišují nejasnosti gradingu u pacientů s GS 7. Nově dle konsenzu ISUP z roku 2019 do gradingu zařazujeme přítomnost intraduktálního karcinomu, která představuje negativní prognostický faktor. Vysoké GS řadíme mezi negativní prognostické faktory.
Tab. 1. Grading karcinomu prostaty podle International Society of Urological Pathology (ISUP 2014)
Tab. 1. Grading of the prostate cancer according to the International Society of Urological Pathology (ISUP 2014)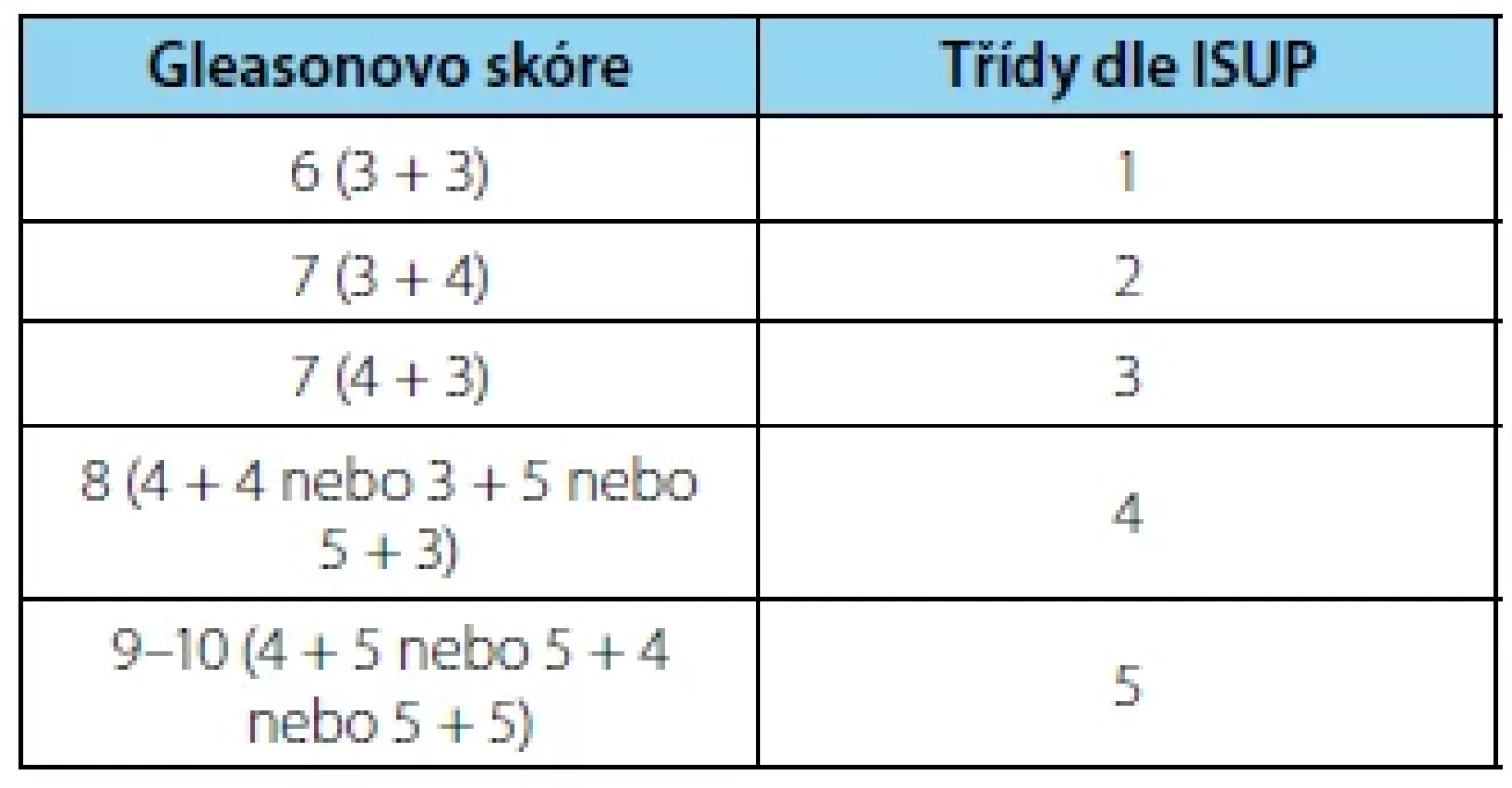
KLINICKÉ PROGNOSTICKÉ FAKTORY
Performance status
Performance status (PS) slouží ke zhodnocení celkového stavu pacienta. Nejčastěji používané škály jsou:
- Karnofského performance status (KPS) od 0 do 100 bodů (18)
- Eastern Cooperative Oncology Group (ECOG) od 0 do 5 bodů (19)
ČÍM NIŽŠÍHO SKÓRE PACIENT DOSÁHNE, TÍM HORŠÍ PROGNÓZU MÁ
Bolest spojená s nádorovým postižením skeletu
Bolest spojená s nádorovým postižením skeletu u KP (PCIBP – prostate cancer induced bone pain) je ochromující, chronický, morbidní stav, který významně zasahuje do funkční kapacity a kvality života (20). Nádorové buňky, buňky kostní matrix a také zánětlivé buňky produkují mediátory, které aktivují nociceptory, poškozují nervová vlákna a vylučují růstové faktory odpovědné za patologický růst a reorganizaci senzorických a sympatických nervových vláken, která inervují kosti, a za tvorbu neuromu. Všechny tyto procesy vedou k periferní a centrální senzibilizaci, a tím k refrakterní bolesti (21). Metastázy ve skeletu jsou nejčastěji lokalizovány v obratlích (69 %), dále v pánevních kostech (41 %), dlouhých kostech (obvykle proximální femur) (25 %) a lebce (14 %) (22). Přesné mechanismy, které způsobují metastazování KP přednostně do kostí, nejsou jasné. Jeden z aspektů představuje krevní zásobení. Krev z prostaty odtéká do plexus venosus prostaticus, z něhož se krev vlévá do vena iliaca interna, která se propojuje s plexus venosi vertebrales (Batsonovou pletení) (23, 24). Je třeba zdůraznit, že lokalizace a množství metastatických kostních lézí ne vždy koreluje s intenzitou pociťované bolesti. Někteří pacienti s diseminovaným onemocněním pociťují slabou až střední bolest, zatímco jiní pacienti s jedinou lézí uvádějí silnou nebo velmi silnou bolest (25). Proto je nutné ke každému pacientovi s PCIBP přistupovat individuálně. Vztah mezi prognózou pacientů s mCRPC a PCIBP studovali Halabi a spol. Ve studii hodnotili 599 mužů s mCRPC, PS dle ECOG 0-2, kteří vyplnili standardizovaný dotazník Brief Pain Inventory (BPI), který posuzuje dopad bolesti na řadu každodenních činností a kvalitu života. Mezi skórem intenzity bolesti z dotazníku BPI a rizikem úmrtí byla statisticky významná souvislost. Medián doby přežití byl 17,6 měsíce u mužů se slabou bolestí a 10,2 měsíce u mužů udávající vysokou bolest. Intenzita bolesti byla nepřímo spojena s pravděpodobností poklesu PSA. Tato analýza potvrdila, že přítomnost bolesti je statisticky významným negativním prognostickým faktorem (26).
Sarkopenie
Sarkopenii (SP) definujeme jako progresivní a generalizované postižení skeletálních svalů spojené s větší pravděpodobností nepříznivých událostí včetně pádů, zlomenin, fyzické nemohoucnosti a mortality (27). Z klinického hlediska dělíme SP na primární a sekundární. Primární SP představuje proces spojený se stárnutím organismu, u kterého neidentifikujeme další příčiny. Oproti tomu se na sekundární SP, kromě stárnutí, podílejí i další faktory, jako jsou onemocnění (malignity, zánětlivé stavy, neurologická onemocnění a další), fyzická inaktivita nebo malnutrice (podvýživa, malabsorpce, anorexie vyvolaná léčbou, obezita) (28). K rychlé diagnostice využíváme jednoduchý dotazník SARC‑F. Ten se skládá z pěti částí, které značí zkratka dotazníku: S – strenght (síla), A – assistance in walking (asistence při chůzi), R – rise from a chair (vstávání ze židle), C – climb stairs (chůze do schodů), F – falls (pády). Každá část je obodována 0–2 body. Maximální počet je 10 bodů, minimum 0 bodů, pokud je součet bodů ≥ 4, můžeme u pacienta predikovat vznik SP (29). Ohataka et al. analyzovali soubor 77 pacientů s mCRPC, kteří podstoupili chemoterapii docetaxelem. Cílem studie bylo objasnění korelace mezi podáním chemoterapie a SP a dále zjistit vliv SP na dobu přežití. Sarkopenii definovali stanovením indexu kosterního svalstva (SMI – skeletal muscle index), který se určuje pomocí plochy kosterního svalstva na CT vztažené na druhou mocninu výšky pacienta. Cutoff v této studii byl stanoven na index musculus psoas major v úrovni obratle L3 < 5,7 cm2/m2. Autoři zjistili SP u 26 (34 %) pacientů. Střední doba sledování byla 499 dní a během tohoto období zemřelo 35 (45 %) pacientů, přičemž pacienti se SP vykazovali po zahájení léčby významně kratší dobu přežití. Tato studie potvrdila, že SP je negativním prognostickým faktorem tolerance léčby docetaxelem, a také zvyšuje riziko úmrtí (30).
Tab. 2. Karnofského performance status
Tab. 2. Karnofsky performance status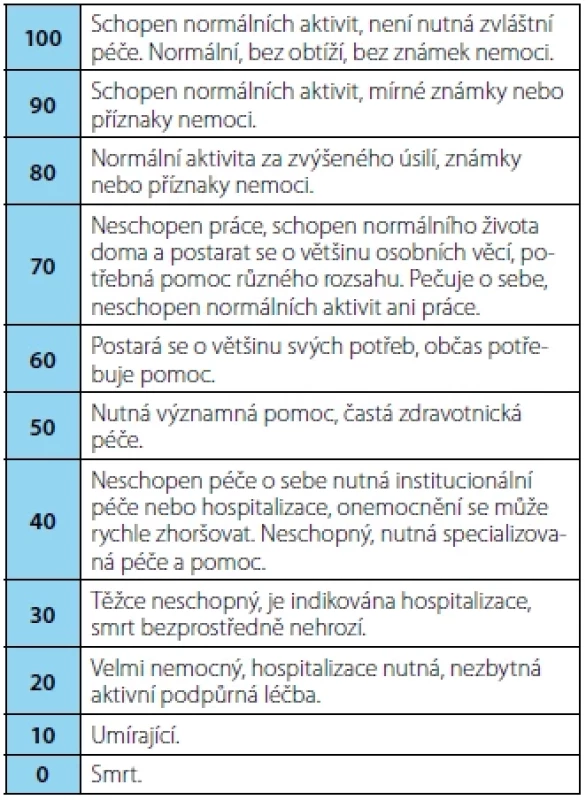
Tab. 3. Eastern Cooperative Oncology Group (ECOG)
Tab. 3. Eastern Cooperative Oncology Group (ECOG)
Tab. 4. SARC-F dotazník pro sarkopenii (překlad z anglického originálu)
Tab. 4. SARC-F Screen for Sarcopenia (translation from the English original)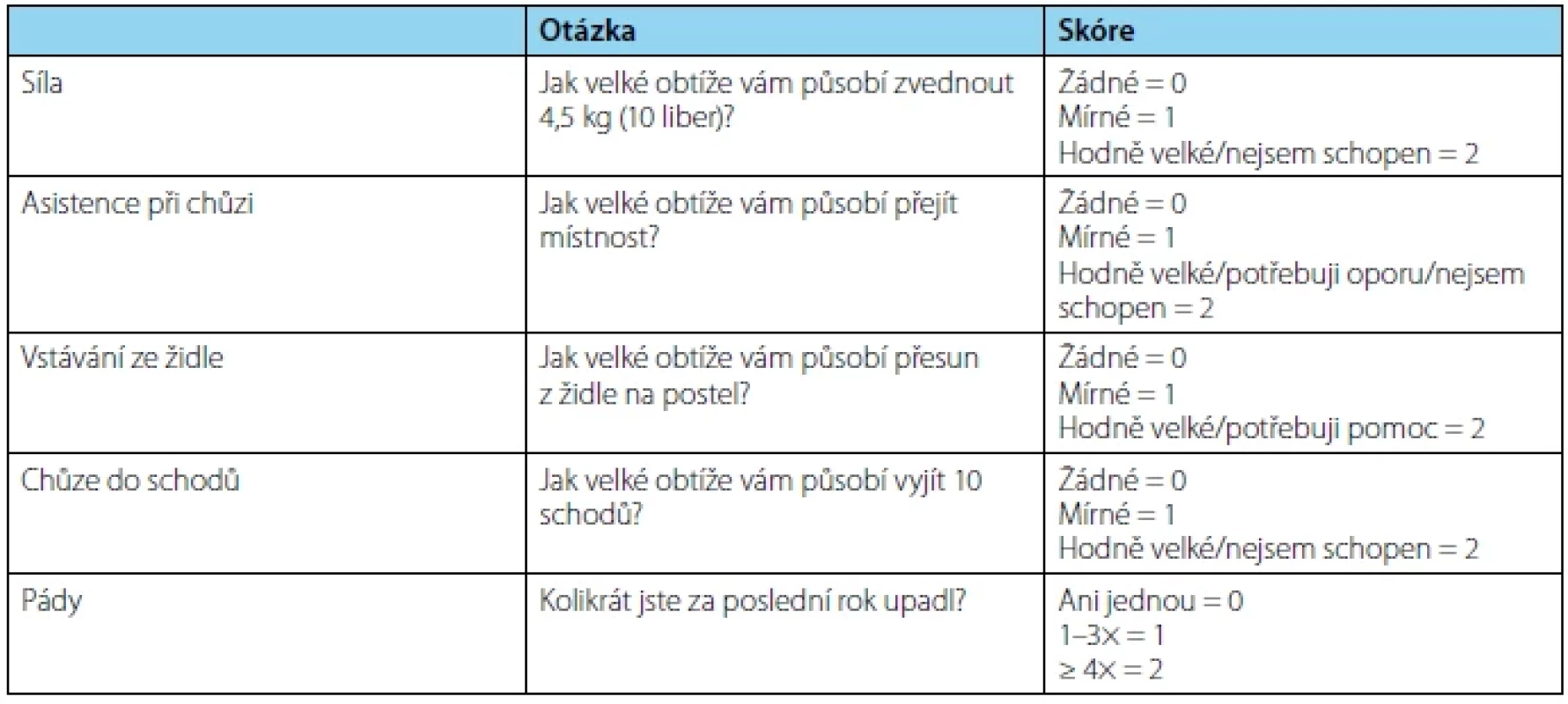
Vznik kostních příhod
Karcinom prostaty má nejvyšší výskyt kostních metastáz ze všech urologických malignit (31).
Růstem metastatických nádorových buněk a jejich kostní destrukcí může docházet ke kostním příhodám (SREs – skeletal related events). Mezi SREs řadíme patologické zlomeniny a s nimi spojené operační výkony na kostech, kompresi míchy, paliativní radioterapii skeletu a nutnost užívání antiresorpční léčby (32, 33). Vzhledem k tomu, že se KP vyskytuje především u starší populace pacientů, u které je vysoká prevalence osteoporózy, použití ADT jako léčebné metody má kumulativní škodlivé účinky na kostní minerální hmotu, což zvyšuje riziko zlomenin skeletu (34). To prokázala i práce z roku 2005, ve které autoři analyzovali záznamy více než 50 000 mužů s diagnózou KP a incidencí SREs s následnou nutností hospitalizace. U pacientů, kteří splnili podmínku pětiletého přežití, prodělalo SREs 19,4 % pacientů na ADT, ve srovnání s 12,6 % mužů, kteří ADT neměli. V analýzách proporcionálních rizik, upravených pro charakteristiky pacienta a nádoru, existoval statisticky významný vztah mezi ADT a následným rizikem zlomeniny (35). Další autoři hodnotili korelaci výskytu patologické fraktury s OS u 195 pacientů s KP na ADT. Pomocí vícerozměrné analýzy bylo zjištěno, že medián OS dosáhl 121 vs. 160 měsíců u mužů s anamnézou vs. bez anamnézy fraktury skeletu od diagnózy KP (36).
CHAARTED kritéria
Americká studie Chemo‑hormonal Therapy versus Androgen Ablation Randomized Trial for Extensive Disease in Prostate Cancer (CHAARTED) publikovaná v roce 2018 zahrnovala 790 pacientů s metastatickým hormonsenzitivním KP (mHSPC – metastatic hormone sensitive prostate cancer) ≤ 2 s ECOG. Pacienti byli randomizováni 1 : 1 k podání docetaxelu a ADT nebo k ADT samotné. Primární cíl předpokládal, že pacienti v rameni s docetaxelem budou mít o 33 % delší OS ve srovnání s kontrolní skupinou. Efekt docetaxelu však byl prokázán pouze ve skupině pacientů s tzv. vysokoobjemovým onemocněním (HV – high volume), které autoři definovali jako přítomnost viscerálních metastáz nebo čtyř a více kostních metastáz, z nichž alespoň jedna metastáza byla lokalizována mimo osový skelet. U těchto pacientů dosáhl medián OS signifikantně vyšších hodnot (49,2 měsíců vs. 32,2 měsíců). Ostatní pacienty autoři zařadili do skupiny s nízkoobjemovým onemocněním (LV – low volume) a v této skupině nebyl rozdíl statisticky významný. Díky této studii nově vzniklo rozdělení pacientů do dvou prognostických skupin dle tzv. CHAARTED kritérií. Z této studie vyplývá, že pacienti s HV onemocněním mají horší prognózu (37).
High Risk vs. Low Risk onemocnění
Studie LATITUDE randomizovala celkem 1 199 pacientů s mHSPC, k podání AA a prednisonu s ADT nebo ADT s dvojím placebem. Zařazeni byli pacienti spadající do prognosticky rizikové skupiny (high risk) s PS 0–2, mKP a splňující nejméně dvě z následujících kritérií: GS 8–10, nejméně tři kostní ložiska nebo přítomnost měřitelných viscerálních metastáz. Primární cíle této studie sledovaly OS a přežití bez radiografické progrese (rPFS – radiographic progression free survival). Po střední době sledování autoři zjistili, že AA snížil riziko úmrtí o významných 38 %. Střední doba rPFS byla také signifikantně nižší, a to o 53 %. Studii proto brzo otevřeli a všem pacientům, kteří užívali dvojí placebo, nabídli léčbu AA (40).
Metachronní vs. synchronní (de novo) metastatické onemocnění
Další americká retrospektivní studie, publikovaná v roce 2018, analyzovala kohortu pacientů, léčených na Dana‑Farber Cancer Institutu, Boston, USA v letech 1990–2013, které rozdělili do následujících skupin: pacienti s LV a HV onemocněním a dále na pacienty s metachronními metastázami (metastázy zjištěné s časovým odstupem od zjištění primární diagnózy) a pacienty se synchronními (nebo-li de novo) metastázami. Bylo prokázáno, že pacienti s LV onemocněním a metachronními metastázami měli významně delší OS (92,4 vs. 25,6 měsíců), a také delší čas do progrese do mCRPC (43,2 vs. 12,2 měsíců). Z výše uvedeného vyplývá, že synchronní onemocnění zhoršuje prognózu (41).
ZÁVĚR
V současné době neexistuje žádná standardizovaná klasifikace pacientů s mKP dle prognostických skupin. Pacienty zařazujeme do těchto skupin dle prognostických faktorů, které dělíme do tří skupin – sérové (PSA, PSA‑V, PSA‑DT, hladina PSA po sedmi měsících ADT > 4 ng/ml, tekutá biopsie, hladina LDH), tkáňové (vysoké Gleasonovo/ISUP skóre) a klinické (nízké skóre PS, přítomnost PCIBP, přítomnost SP, výskyt SREs, zařazení pacienta do skupiny high volume a do skupiny high risk onemocnění a synchronní onemocnění).
Střet zájmů: Autorka prohlašuje, že má následující možný konflikt zájmů: přednášející Ipsen.
Prohlášení o podpoře: Podpořeno projektem MZ ČR – RVO‑VFN64165.
Došlo: 20. 2. 2023
Přijato: 28. 4. 2023Kontaktní adresa:
MUDr. Alžběta Kantorová
Urologická klinika VFN a 1. LF UK
Ke Karlovu 6
128 00 Praha 2
e‑mail: alzbeta.kantorova@vfn.czCes Urol 2023; 27(2): 86-94
Zdroje
1. Scher HI. Observed Advantages of the STAMPEDE Study Design. Eur Urol. 2015; 67(6): 1039–41.
2. Romero Otero J, Garcia Gomez B, Campos Juanatey F, Touijer KA. Prostate cancer biomarkers: An update. Urol Oncol Semin Orig Investig. 2014; 32(3): 252 – 60.
3. Veselý Š. Current clinical utility of prostate cancer markers. Onkologie. 2019; 13(2): 78–82.
4. Tang P, Sun L, Uhlman MA et al. Baseline PSA as a predictor of prostate cancer specific mortality over the past 2 decades: Duke University experience. Cancer. 2010; 116(20): 4711–7.
5. Řezáč J, Čapoun O, Soukup V. Serum oncomarkers for prostate cancer. Ces Urol. 2021; 25(4): 236–243.
6. Vickers AJ, Brewster SF. PSA Velocity and Doubling Time in Diagnosis and Prognosis of Prostate Cancer. Br J Med Surg Urol. 2012; 5(4): 162–8.
7. Hussain M, Tangen CM, Higano C, et al. Absolute Prostate‑Specific Antigen Value After Androgen Deprivation Is a Strong Independent Predictor of Survival in New Metastatic Prostate Cancer: Data from Southwest Oncology Group Trial 9346 (INT-0162). J Clin Oncol. 2006; 24(24): 3984–90.
8. Lozar T, Gersak K, Cemazar M, Kuhar CG, Jesenko T. The biology and clinical potential of circulating tumor cells. Radiol Oncol. 2019; 53(2): 131–47.
9. Dathathri E, Isebia KT, Abali F, et al. Liquid Biopsy Based Circulating Biomarkers in Metastatic Prostate Cancer. Front Oncol. 2022; 12 : 863472.
10. de Bono JS, Scher HI, Montgomery RB, et al. Circulating Tumor Cells Predict Survival Benefit from Treatment in Metastatic Castration‑Resistant Prostate Cancer. Clin Cancer Res. 2008; 14(19): 6302–9.
11. Scher HI, Heller G, Molina A, et al. Circulating Tumor Cell Biomarker Panel as an Individual‑Level Surrogate for Survival in Metastatic Castration‑Resistant Prostate Cancer. J Clin Oncol. 2015; 33(12): 348–55.
12. Vasseur A, Kiavue N, Bidard F, Pierga J, Cabel L. Clinical utility of circulating tumor cells: an update. Mol Oncol. 2021; 15(6): 1647–66.
13. Čapoun O, Soukup V, Mikulová V, et al. Cirkulující nádorové buňky a prognóza karcinomu prostaty. Čas. Lék. čes. 2014; 152 : 72–77.
14. Petrelli F, Cabiddu M, Coinu A, et al. Prognostic role of lactate dehydrogenase in solid tumors: A systematic review and meta‑analysis of 76 studies. Acta Oncol. 2015; 54(7): 961–70.
15. Koukourakis MI, Giatromanolaki A, Sivridis E, Gatter KC, Harris AL. Lactate Dehydrogenase 5 Expression in Operable Colorectal Cancer: Strong Association with Survival and Activated Vascular Endothelial Growth Factor Pathway A Report of the Tumour Angiogenesis Research Group. J Clin Oncol. 2006; 24(26): 4301–8.
16. Li F, Xiang H, Pang Z, et al. Association between lactate dehydrogenase levels and oncologic outcomes in metastatic prostate cancer: A meta‑analysis. Cancer Med.2020; 9(19): 7341–51.
17. Epstein JI, Egevad L, Srigley JR, Humphrey PA. The 2014 International Society of Urological Pathology (ISUP) Consensus Conference on Gleason Grading of Prostatic Carcinoma. Am J Surg Pathol. 2016; 40(2): 244–52.
18. Karnofsky DA, Burchenal JH. Present status of clinical cancer chemotherapy. Am J Med. 1950; 8(6): 767–88.
19. Oken MM, Creech RH, Tormey DC, et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol. 1982; 5(6): 649–55.
20. Kapoor R, Saxena AK, Vasudev P, Sundriyal D, Kumar A. Cancer induced bone pain: current management and future perspectives. Med Oncol. 2021; 38(11): 134.
21. Zajączkowska R, Kocot‑Kępska M, Leppert W, Wordliczek J. Bone Pain in Cancer Patients: Mechanisms and Current Treatment. Int J Mol Sci. 2019; 20(23): 6047.
22. Yoong J, Poon P. Principles of cancer pain management: An overview and focus on pharmacological and interventional strategies. Aust J Gen Pract. 2018; 47(11): 758–62.
23. Batson OV. The function of the vertebral veins and their role in the spread of metastases: Ann Surg. 1940; 112(1): 138–49.
24. Smith AE, Muralidharan A, Smith MT. Prostate cancer induced bone pain: pathobiology, current treatments and pain responses from recent clinical trials. Discov Oncol. 2022; 13(1): 108.
25. Yoneda T, Hiasa M, Nagata Y, Okui T, White FA. Acidic microenvironment and bone pain in cancer‑colonized bone. Bonekey Rep. 2015; 4 : 690.
26. Halabi S, Vogelzang NJ, Kornblith AB, et al. Pain Predicts Overall Survival in Men with Metastatic Castration‑Refractory Prostate Cancer. J Clin Oncol. 2008; 26(15): 2544–9.
27. Jenšovský J. Sarkopenie: definice a diagnostika nové nemoci. Clin Osteol. 2019; 24(1): 14–18.
28. Cruz‑Jentoft AJ, Baeyens JP, Bauer JM, et al. Sarcopenia: European consensus on definition and diagnosis: Report of the European Working Group on Sarcopenia in Older People. Age Ageing. 2010; 39(4): 412–23.
29. Malmstrom TK, Morley JE. SARC‑F: A Simple Questionnaire to Rapidly Diagnose Sarcopenia. J Am Med Dir Assoc. 2013; 14(8): 531–2.
30. Ohtaka A, Aoki H, Nagata M, et al. Sarcopenia is a poor prognostic factor of castrationresistant prostate cancer treated with docetaxel therapy. Prostate Int. 2019; 7(1): 9–14.
31. Parkin DM, Bray F, Ferlay J, Pisani P. Global Cancer Statistics, 2002. CA Cancer J Clin. 2005; 55(2): 74–108.
32. Ibrahim A, Scher N, Williams G, et al. Approval Summary for Zoledronic Acid for Treatment of Multiple Myeloma and Cancer Bone Metastases. Clin Cancer Res. 2003; 9(7): 2394–9.
33. Katolická J. Bisfosfonáty u urologických malignit. Onkologie. 2013 : 7(1): 18–21.
34. Sharma A, Sinha RJ, Singh V, et al. Implications of the Fracture Risk Assessment Algorithm for the assessment and improvement of bone health in patients with prostate cancer: a comprehensive review. Türk Ürol DergisiTurkish J Urol. 2019; 45(4): 245–53.
35. Shahinian VB, Goodwin JS. Risk of Fracture after Androgen Deprivation for Prostate Cancer. N Engl J Med. 2005; 352(2): 154–64.
36. Oefelein MG, Ricchiuti V, Conrad W, Resnick MI. Skeletal fractures negatively correlate with overall survival in men with prostate cancer. The Journal of Urology. 2002; 168(3): 1005–1007.
37. Sweeney CJ, Chen YH, Carducci M, et al. Chemohormonal Therapy in Metastatic Hormone‑Sensitive Prostate Cancer. N Engl J Med. 2015; 373(8): 737–46.
38. Kyriakopoulos CE, Chen YH, Carducci MA, et al. Chemohormonal Therapy in Metastatic Hormone‑Sensitive Prostate Cancer: Long‑Term Survival Analysis of the Randomized Phase III E3805 CHAARTED Trial. J Clin Oncol. 2018; 36(11): 1080–7.
39. Gravis G, Boher JM, Chen YH, et al. Burden of Metastatic Castrate Naive Prostate Cancer Patients, to Identify Men More Likely to Benefit from Early Docetaxel: Further Analyses of CHAARTED and GETUG‑AFU15 Studies. Eur Urol. 2018; 73(6): 847 – 55.
40. Fizazi K, Tran N, Fein L, et al. Abiraterone plus Prednisone in Metastatic, Castration Sensitive Prostate Cancer. N Engl J Med. 2017; 377(4): 352–60.
41. Francini E, Gray KP, Xie W, et al. Time of metastatic disease presentation and volume of disease are prognostic for metastatic hormone sensitive prostate cancer (mHSPC). The Prostate. 2018; 78(12): 889–95.
Štítky
Detská urológia Nefrológia Urológia
Článok vyšiel v časopiseČeská urologie
Najčítanejšie tento týždeň
2023 Číslo 2- Aktuálne európske odporúčania pre liečbu renálnej koliky v dôsledku urolitiázy
- MUDr. Šimon Kozák: V algeziológii nič nefunguje zázračne cez noc! Je dôležité nechať si poradiť od špecialistov
- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Urologie a elektronizace zdravotnictví
- Robotizovaná laparoskopická pyeloplastika
- Novinky WHO klasifikace z roku 2022: klasifikace renálních tumorů
- 5. edice WHO klasifikace karcinomu prostaty z roku 2022: změny a novinky v „Blue Book“
- Prognostické faktory metastatického karcinomu prostaty
- Výsledky zavádění punkční nefrostomie pod ultrazvukovou kontrolou
- Dlouhodobé sledování žijících dárců ledviny – zkušenosti jednoho centra
- Časné komplikace po radikální cystektomii před zavedením konceptu ERAS (Enhanced Recovery After Surgery) u pacientů podstupujících radikální cystektomii
- Priapismus při substituční terapii testosteronem centrálního hypogonadismu
- Postřehy z CEM23 (Central European Meeting 2023)
- Česká urologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Prognostické faktory metastatického karcinomu prostaty
- 5. edice WHO klasifikace karcinomu prostaty z roku 2022: změny a novinky v „Blue Book“
- Časné komplikace po radikální cystektomii před zavedením konceptu ERAS (Enhanced Recovery After Surgery) u pacientů podstupujících radikální cystektomii
- Výsledky zavádění punkční nefrostomie pod ultrazvukovou kontrolou
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



