-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Novinky WHO klasifikace z roku 2022: klasifikace tumorů vývodných cest močových
The WHO Classification of Urinary and Male Genital Tumours 2022: news in the urinary tract neoplasms classification
The classification of urinary tract neoplasms (so-called blue book) only slightly modifies the last WHO version from 2016. The major change is the modification of the arrangement of the chapters and only minor changes occurred in the nomenclature. The aim of this review is to outline and comment on the changes in the new edition of the WHO classification 2022 of the urinary tract.
Keywords:
classification – urothelial carcinoma – urinary tract – WHO
Autori: Tomáš Pitra 1; Adriena Bartoš Veselá 1; Josef Skopal 2; Milan Hora 1; Ondřej Hes 2,3; Ondřej Fiala 4; Kristýna Pivovarčíková 2,3
Pôsobisko autorov: Urologická klinika, Lékařská fakulta Plzeň, Univerzita Karlova a Fakultní nemocnice Plzeň 1; Šiklův ústav patologie, Lékařská fakulta Plzeň, Univerzita Karlova a Fakultní nemocnice Plzeň 2; Bioptická laboratoř, s. r. o., Plzeň 3; Onkologická a radioterapeutická klinika, Lékařská fakulta Plzeň, Univerzita Karlova a Fakultní, nemocnice Plzeň a Biomedicínské centrum, Lékařská fakulta Plzeň, Univerzita Karlova, †zesnulý 4
Vyšlo v časopise: Ces Urol 2023; 27(1): 9-16
Kategória:
Súhrn
V minulém roce vyšlo již 5. vydání „modré knihy“ klasifikace nádorů močových cest a mužského genitálu Světové Zdravotnické Organizace (WHO). Nová WHO klasifikace nádorů vývodných močových cest jen lehce upravuje předchozí verzi WHO z roku 2016. Největší změnou je tak modifikace uspořádání kapitol a dále zde najdeme pouze zcela drobné změny v nomenklatuře. Toto sdělení si klade za cíl přehledně okomentovat nejvýznamnější změny v rámci klasifikace nádorů dutých vývodných močových cest.
Klíčová slova:
klasifikace – uroteliální karcinom – močový trakt – WHO
ÚVOD
Na rozdíl od tumorů ledvin, kde v současnosti dochází k častějšímu využití molekulárně‑genetických technik v každodenní diagnostické praxi, v diagnostice neoplazií vývodných cest močových si patologové v drtivé většině případů vystačí s pouhou histologií – morfologie tak zůstává zlatým standardem klasifikace neoplazií vývodných močových cest (1). Zároveň však v posledních letech i na poli lézí močových cest přibývá snah o molekulární subklasifikaci nádorů urotelu (i ve světle snah o implementaci moderních léčebných postupů personalizované medicíny do léčebné praxe). Bohužel, i přes přibývající důkazy, při nekonzistentnosti a překryvu výsledků různých studií a vysoké ceně vyšetření, zatím nelze generalizovaně začlenit tyto nálezy do současné rutinní klinické praxe a tedy i do oficiální klasifikace. Potenciál k využití má genetická klasifikace zejména u svalovinu infiltrujících karcinomů, kde bylo akceptováno dělení na šest molekulárních subtypů (2), z nichž některé by měly vykazovat horší prognózu.
Významným milníkem je příklon WHO klasifikace 2022 k Pařížské klasifikaci močové cytologie (3). Ta od roku 2016, kdy byla uvedena do praxe, zaznamenala široké rozšíření, a zdá se, že přinesla i klinický dopad (4). Hlavním přínosem a změnou oproti dřívějším klasifikacím močové cytologie byl fakt, že se Pařížská klasifikace orientuje na záchyt pacientů s high grade lézí (3) a prakticky rezignovala na snahy o záchyt low grade lézí urotelu, které bohužel v drtivé většině případů z podstaty močovou cytologií odhalit nelze (5).
Vydání nové WHO klasifikace nádorů vývodného močového traktu předcházelo uveřejnění doporučených postupů odborné společnosti „Genitourinary Pathology Society/GUPS“ (6, 7), ze kterých nová WHO klasifikace vychází. V porovnání se změnami, které se dotkly klasifikace renálních neoplazií, představují změny v klasifikaci nádorů urotelu v podstatě pouze „kosmetické úpravy“. V obecné rovině pak mezi tyto lehké úpravy patří ne příliš významné změny v rámci nomenklatury (např. pojem „varianty“ byl nahrazen pojmem „subtypy“, či pojem „infiltrující“ nahrazen označením „invazivní“) a změny ve členění kapitol. Konkrétní změny týkající se jednotlivých jednotek pak budou blíže nastíněny níže v textu. Tato práce nebude komentovat kompletně celou aktuální WHO klasifikaci nádorů vývodných močových cest, ale představí pouze okruhy, v nichž oproti předchozí WHO klasifikaci došlo ke změnám. Nádory horních močových cest již ve WHO nejsou komentovány separátně, ani zde tedy nebudou samostatně komentovány.
NOVINKY WHO 2022 KLASIFIKACE – KONKRÉTNÍ ZMĚNY
Koncept a hlavní kostra uroteliálních neoplazií močového traktu, tedy kapitoly čítající drtivou většinu nádorů této lokality, zůstává prakticky beze změn – rozlišovány jsou neinvazivní uroteliální neoplazie a invazivní uroteliální karcinom.
U neinvazivních uroteliálních lézí klasifikace nedoznala výraznějších změn (Tab. 1), komentovány jsou zde zejména tři úskalí – invertovaný růst, fokální high‑grade morfologie a změny týkající se plochých lézí urotelu. Je známým faktem, že neinvazivní uroteliální léze (uroteliální papilom, papilární uroteliální neoplazie nízkého maligního potenciálu/ PUNLMP, neinvazivní low grade papilární uroteliální karcinom, neinvazivní high grade papilární uroteliální karcinom) mohou vykazovat predominantně či dokonce kompletně endofytický/invertovaný růst. Klinicky pak tyto endofytické léze mohou během cystoskopie vypadat velmi neobvykle (Obr. 1). Proto WHO klasifikace doporučuje reportovat přítomnost endofytické komponenty patologem, označení „invertovaný“ by mělo být zahrnuto v patologické zprávě (1). Dochází‑li k rozvoji invazivního uroteliálního karcinomu v invertované lézi, některé studie prokázaly častější frekvenci recidiv a možnost přítomnosti pokročilého onemocnění u těchto pacientů (8). Kromě aspektu klinického pak přibývá ještě aspekt patologický – u invertovaných lézí může být někdy velice obtížné odlišit invertované neinvazivní čepy tumoru (tj. pTa) od již invazivního růstu (tj. pT1 a více) (9).
Tab. 1. Přehled uroteliálních neoplazií WHO klasifikace 2022 (1)
Tab. 1. The new WHO classification 2022 – urothelial tumour classification (1)
Obr. 1. Invertovaný uroteliální papilom při cystoskopickém vyšetření (A), mikroskopický nález (B)
Fig. 1. Inverted urothelial papiloma on cystoscopy (A), histological appearance of inverted papilloma, staining hematoxylin-eosin (B)
Páté vydání „modré knihy“ nově upravuje též grading neinvazivních uroteliálních karcinomů. Je totiž relativně častým jevem, že predominantně low grade neinvazivní papilární uroteliální karcinom vykazuje okrsky, kde tumor přechází ve výrazné high grade partie. Přístup jednotlivých patologů k takovýmto lézím se ještě do nedávna dost lišil, WHO nechávala volnou ruku a bez ohledu na procento high grade komponenty byly většinou tyto tumory podle pravidla „nejhoršího gradu“ klasifikovány jako high grade. Nová WHO klasifikace však jasně určila, jak s těmito lézemi nakládat. Jako „neinvazivní high grade papilární renální karcinom“ by měly být diagnostikovány nádory, u nichž high grade složka tvoří ≥ 5 % tumoru. Naopak „low grade“ zůstávají pouze tumory, kde high grade komponenta představuje < 5 % s tím, že přítomnost této high grade komponenty by měla dostat místo v názvu, nádory by tak měly být reportovány jako „neinvazivní low grade papilární uroteliální neoplazie s < 5 % high grade komponenty“ (1).
Změnou koncepční i faktickou je, že původně samostatně udávané jednotky ve WHO 2016 „uroteliální dysplazie“ a „uroteliální proliferace nejasného maligního potenciálu/UPUMP“ již nejsou samostatnou entitou. Uroteliální dysplazie je zmiňována v kapitole uroteliálního carcinoma in situ. Jedná se o lézi s vágní patologickou definicí (léze vykazující atypie, které věříme, že by měly mít původ v neoplazii, atypie však nejsou dostatečné, aby splnily kritéria pro kategorii in situ karcinomu) a stejně tak nejistým klinickým dopadem pro pacienta. Uroteliální dysplazie je léze bez pevně daných diagnostických kritérií, a tím i léze se špatnou reprodukovatelností a vysokou interobservační variabilitou. Zároveň některé práce udávají překryv uroteliální dysplazie se změnami urotelu někdy zahrnovanými pod popisný termín „atypiemi nejistého významu“, což výrazně podkopává důvěryhodnost této diagnózy (10). Uroteliální proliferace nejistého maligního potenciálu/UPUMP (dříve léze nazývaná uroteliální hyperplazie) již vůbec ve WHO nefiguruje (1). Plochý podtyp UPUMP (dříve „plochá hyperplazie urotelu“) je patrně pouze benigní lézí, která s největší pravděpodobností ani s rozvojem uroteliálního karcinomu nemusí mít souvislost. Papilární UPUMP (dříve „papilární hyperplazie urotelu“) je dnes již považována za časné stadium low grade neinvazivního papilárního uroteliálního karcinomu, či „undersampling“ low grade neinvazivního uroteliálního papilárního karcinomu nacházejícího se v okolí (fenomén též někdy nazývaný jako odběr z místa „shoulders“ uroteliálního karcinomu – tedy vlastně odběr z velmi periferních partií low grade neinvazivního uroteliálního papilárního karcinomu, kde není vlastní morfologie nádoru pěkně patrná/ zcela vyjádřena).
V rámci neinvazivních lézí si též letmý komentář zaslouží neinvazivní high grade plochá léze urotelu – uroteliální carcinoma in situ (CIS). Z pohledu patologa existuje řada morfologických subtypů uroteliálního CIS (1, 11), jejich rozeznávání však nemá žádný klinický význam a pro urologa je tak zcela nepodstatné. Je však třeba upozornit na jeden lehce zavádějící pojem vyskytující se v nové WHO klasifikaci právě v souvislosti s rozlišováním různých subtypů CIS – morfologický subtyp označovaný jako „denuding cystitis/clinging CIS pattern“. Je třeba rozlišovat tento „denuding cystitis/clinging pattern CIS“ (vyznačující se výrazně dyskohezivním způsobem růstu, „olupováním“ jednotlivých high grade atypických buněk až téměř kompletní či úplně kompletní denudací/„oloupáním“/chybění high grade dysplastického epitelu CIS) od léze označované jako „denudující cystitida“. Pojem „denudující cystitida“ je některými patology používán v situaci, kdy posuzují studenou biopsii od pacienta, kde povrchový urotel kompletně chybí (nejčastěji je arteficiálně stržen při odběru) (12). V takovémto případě patolog nemůže hodnotit eventuální přítomnost high grade atypií uroteliálních buněk (při absenci urotelií) a tedy není schopen nepřítomný urotel posoudit – v takovéto situaci někdy sáhne k diagnóze „denudující cystitida“. Pro urologa by pak diagnóza „denudující cystitida“ měla být signálem, že urotel (a eventuální atypie urotelu) nebyl ve vzorku zastižen a patolog není schopen potvrdit ani vyloučit možnou přítomnost high grade ploché léze urotelu. Pojmy „denudující cystitida“ a „denuding cystitis/clinging pattern CIS“ tak nejsou jedno a to samé a je třeba mezi nimi rozlišovat – „denudující cystitida“ vyjadřuje nejistotu patologa a nemožnost objektivně a s jistotou posoudit zaslaný vzorek, naopak „denuding cystitis/clinging pattern CIS“ je pojem jasně označující přítomnost uroteliálního CIS u pacienta.
Invazivní uroteliální karcinom je notoricky znám svou možnou heterogenitou morfologického vzhledu, existencí divergentních diferenciací a histologických subtypů. To vše jsou aspekty důležité zejména pro hodnotícího patologa, neboť znalost morfologického spektra dané léze patologem je základem pro správné stanovení diagnózy uroteliálního karcinomu (uroteliální karcinom s divergentní diferenciací dokáže věrně napodobovat např. primární dlaždicobuněčný karcinom či adenokarcinom, některé subtypy uroteliálního karcinomu dokonce můžou být snadno mylně diagnostikovány jako léze benigní – tzv. nested subtyp uroteliálního karcinomu). Přítomnost jiné než „tradiční“ morfologie uroteliálního karcinomu je však i důležitým gradovacím paramentem – všechny uroteliální karcinomy s divergentní diferenciací a subtypy uroteliálního karcinomu by měly být nově automaticky klasifikovány jako high grade tumory. Zároveň, z pohledu urologa, je důležitým faktem, že některé subtypy uroteliálních karcinomů jsou považovány za agresivnější a často již v době diagnózy high‑stage tumory. V rámci subtypů uroteliálního karcinomu nedošlo s novou klasifikací ke změně (rozlišujeme suptyp mikropapilární, nested, tubulární a mikrocystický, large nested, plazmocytoidní, sarkomatoidní, lipid‑rich, lymphoepithelioma‑like, světlobuněčný, obrovskobuněčný a špatně diferenciovaný). Pokud uroteliální karcinom vykazuje i jinou morfologii než tu „tradiční“, tj. je/jsou přítomny některé ze subtypů či diferenciací, informace by se měla objevit v popisu histologie se snahou o procentuální kvantifikaci. I když je známým faktem, že většina invazivních uroteliálních karcinomů spadá do high grade spektra, i nadále zůstává v platnosti doporučení WHO gradovat i invazivní karcinom (opět však absentují diagnostická kritéria pro low grade invazivní uroteliální karcinom).
Dlaždicobuněčné/skvamózní neoplazie vyskytující se v močovém traktu jsou oproti výše komentovaným uroteliálním lézím výrazně vzácnější. Jejich klasifikace se ve srovnání s předchozí WHO (z roku 2016) prakticky nemění – rozlišuje se „čistý uroteliální dlaždicobuněčný karcinom (SCC) močového traktu“, „verrukózní karcinom močového měchýře“ a „dlaždicobuněčný papilom močového traktu“ (1). Ačkoli je doporučován grading SCC v močovém traktu, WHO jasně nestanovuje gradingový systém a jeho kritéria (pouze doporučuje rozlišovat dobře/středně/špatně diferencovaný SCC). Grading SCC močového traktu patrně nebude mít žádný klinický význam. Asi nejdůležitější je však odlišit primární „čistý“ SCC od uroteliálního karcinomu s divergentní (skvamoidní) diferenciací, který je výrazně častější a při predominantní přítomnosti skvamózní komponenty dokáže SCC věrně napodobovat.
Glandulární neoplazie, mezi které patří primární adenokarcinomy (rozlišujeme enterický/ kolonický typ, mucinózní/koloidní typ, adenokarcinom z prstenčitých buněk, smíšený typ a blíže nespecifikovaný typ/NOS) a vilózní (event. zcela vzácný tubulární) adenom, nedoznaly prakticky žádných změn. Gradingový systém u adenokarcinomů i nadále není stanoven (využívá se klasifikace na dobře/středně/špatně diferencované podle cytologických charakteristik). Opět nejdůležitější je u těchto adenokarcinomů odlišit vzácné primární adenokarcinomy od uroteliálního karcinomu s mohutnou divergentní (glandulární) diferenciací a zejména pak i od možného sekundárního postižení urotraktu adenokarcinomem z jiných lokalit (tj. prorůstání adenokarcinomu per continuitatem z okolí – tj. zejména z kolorekta, či možnost distantní metastázy ze vzdálených lokalit).
Dělení a základní charakteristiky karcinomu urachu zůstávají oproti dřívější WHO klasifikaci nedotčeny (Tab. 2) – i nadále je diagnóza karcinomu urachu určená per exclusionem po korelaci klinických a radiologických nálezů (Obr. 2). V rámci stagingu léze se upřednostňuje Sheldonův stagingový systém (z roku 1984) (13) před TMN systémem (14).
Tab. 2. Přehled klasifikace urachálního karcinomu (1)
Tab. 2. Urachal carcinoma classification (1)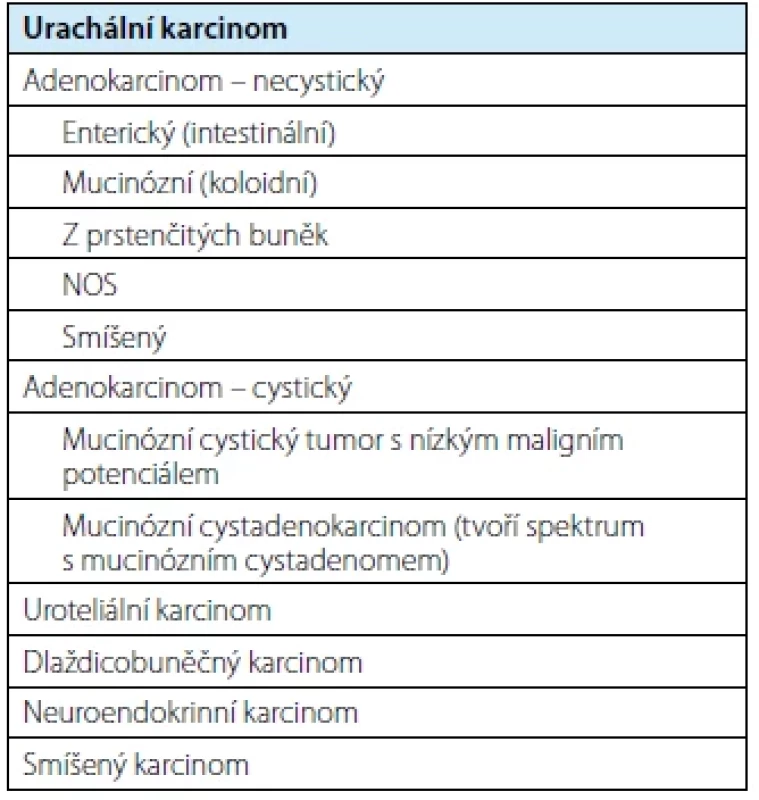
Obr. 2. Urachální non-cystický mucinózní (koloidní) adenokarcinom na CT (A), při cystoskopickém vyšetření (B), resekát tumoru (C) a histologický nález – barveno hematoxylin-eosinem (D)
Fig. 2. Urachal non-cystic mucinous (colloid) adenocarcinoma on computer tomography (A), during cystoscopic examination (B) macroscopic specimen after resection (C) and histological appearance of the tumour, staining hematoxylin-eosin (D)
Nově vyčleněnou jednotkou WHO klasifikace je divertikulární karcinom, jednotka jejíž diagnostickou modalitou je vznik tumoru v divertiklu/ech močových cest. Jednotka „divertikulární karcinom“ je vlastně heterogenní skupinou zahrnující spektrum různých histologických typů neoplazií, jejichž společným jmenovatelem je právě přítomnost a vznik v oblasti divertiklu (1). Důležitým konstatováním je fakt, že divertikl močových cest nikdy neobsahuje svalovinu (muscularis propria/detrusor), proto stadium pT2 u divertikulárních karcinomů nelze stanovit (15). To je patrně i důvod, proč byla tato jednotka vyčleněna jako samostatná kategorie.
Kategorie „neuroendokrinní neoplazie“ a „mezenchymální tumory“ nefigurují v nové WHO jako kapitoly v sekci nádorů vývodných cest, ale byly WHO vyčleněny a předřazeny jako samostatné kapitoly pojednávající o neuroendokrinních a mezenchymálních tumorech v rámci celého genitourinárního (GU) traktu. V rámci neuroendokrinních tumorů (mezi nimiž rozlišujeme dobře diferencovaný neuroendokrinní tumor/NET, malobuněčný neuroendokrinní karcinom, velkobuněčný neuroendokrinní karcinom a smíšená neuroendokrinní neoplazie (1)) si komentář zaslouží nově zavedený pojem „smíšená neuroendokrinní neoplazie“. Tento tumor má neuroendokrinní a non‑endokrinní komponentu, doporučováno je udávat procentuální zastoupení obou komponent v tumoru. U NET GU WHO jasně nestanovuje gradingový systém, ovšem doporučuje užívat systém zavedený pro gastrointestinální a pankreatické NET (16). Jedná se však o lézi v GU traktu zcela raritní. Z mezenchymálních tumorů vyskytujících se v močovém traktu si pak v rámci nové WHO zaslouží komentář inflamatorní myofibroblastický tumor (IMT), u nějž byla prokázána rearanže genu ALK (17). Zajímavý (a tak trochu otazný) je vztah IMT k lézím nazývaným „pseudosarkomatoidní myofibroblastickou proliferací“, které mají identický histologický vzhled jako IMT, avšak absenci rearanže ALK genu. Pro definitivní charakterizaci těchto lézí tak jsou potřeba další studie.
Neoplazie akcesorních žlázek uretry (karcinom z Littrého žlázek, karcinom z Cowperových žlázek, karcinom ze Skeneho žlázek) a tumory Mülleriánského typu (světlobuněčný adneokarcinom močového traktu a endometroidní karcinom močového traktu) zůstávají bez větších změn.
ZÁVĚR
U nádorů vývodných cest močových nová WHO klasifikace přinesla jen drobné změny. Pro klinickou praxi je pak důležité, že doporučené postupy EAU pro snazší implementaci výsledků histologického vyšetření do klinické praxe a pro adekvátní rozhodování o léčebném postupu u pacienta doporučují v rámci gradingu uroteliálního karcinomu uvádět kromě novější WHO klasifikace i klasifikaci výrazně starší (WHO z roku 1973) (18).
Došlo: 5. 2. 2023
Přijato: 1. 3. 2023Kontaktní adresa:
doc. MUDr. Kristýna Pivovarčíková, Ph.D.
Šiklův ústav patologie LF UK a FN Plzeň
Alej Svobody 80, 304 60 Plzeň
e‑mail: pivovarcikovak@fnplzen.czStřet zájmů: Žádný.
Prohlášení o podpoře: Karlova Univerzita Praha, Lékařská fakulta Plzeň (Cooperation Program, SURG), Institucionální výzkum Fakultní nemocnice Plzeň (FNPl 00669806).
Ces Urol 2023; 27(1): 9–16
Zdroje
1. Tsuzuki T, Compérat E, Netto G, et al. Tumours of the urinary tract. In: WHO Classification of Tumours Editorial Board. Urinary and male genital tumours. Lyon (France): International Agency for Research on Cancer WHO classification of tumours series, 5th ed.; vol. 8; 2022.
2. Kamoun A, de Reyniès A, Allory Y, et al. A Consensus Molecular Classification of Muscle‑invasive Bladder Cancer. Eur Urol. 2020; 77(4): 420–33.
3. Rosenthal D, Wojcik E, Kurtycz D. The Paris system for reporting urinary cytology. Switzerland: Springer; 2016.
4. Wojcik EM, Kurtycz DFI, Rosenthal DL. We’ll always have Paris The Paris System for Reporting Urinary Cytology 2022. J Am Soc Cytopathol. 2022; 11(2): 62–6.
5. Pitra T, Dikanová M, Hora M, et al. Porovnání výsledků invazivních vyšetření a močové cytologie: Zkušenosti jednoho urologického centra po prvním roce užívání Pařížské klasifikace pro hodnocení močových cytologií. Ces Urol. 2018; 22(4): 275–84.
6. Amin MB, Comperat E, Epstein JI, et al. The Genitourinary Pathology Society Update on Classification and Grading of Flat and Papillary Urothelial Neoplasia With New Reporting Recommendations and Approach to Lesions With Mixed and Early Patterns of Neoplasia. Adv Anat Pathol. 2021; 28(4): 179–95.
7. Compérat E, Amin MB, Epstein JI, et al. The Genitourinary Pathology Society Update on Classification of Variant Histologies, T1 Substaging, Molecular Taxonomy, and Immunotherapy and PD‑L1 Testing Implications of Urothelial Cancers. Adv Anat Pathol. 2021; 28(4): 196–208.
8. Gutierrez CM, Alemozaffar M, Osunkoya AO. Invasive high‑grade urothelial carcinoma of the bladder, renal pelvis, ureter, and prostatic urethra arising in a background of urothelial carcinoma with an inverted growth pattern: a contemporary clinicopathological analysis of 91 cases. Hum Pathol. 2019; 92 : 18–24.
9. Amin MB, Smith SC, Reuter VE, et al. Update for the practicing pathologist: The International Consultation On Urologic Disease‑European association of urology consultation on bladder cancer. Mod Pathol. 2015; 28(5): 612–30.
10. McKenney JK. Precursor lesions of the urinary bladder. Histopathology. 2019; 74(1): 68–76.
11. McKenney JK. Urothelial carcinoma in situ: diagnostic update. Pathology. 2021; 53(1): 86–95.
12. Parwani AV, Levi AW, Epstein JI, Ali SZ. Urinary bladder biopsy with denuded mucosa: denuding cystitis‑cytopathologic correlates. Diagn Cytopathol. 2004; 30(5): 297–300.
13. Sheldon CA, Clayman RV, Gonzalez R, Williams RD, Fraley EE. Malignant urachal lesions. J Urol. 1984; 131(1): 1–8.
14. Brierley JD, Gospodarowicz MK, Wittekind C. TNM Classification of malignant tumours, 8th edition. Wiley‑Blackwell; 2016 : 272.
15. Idrees MT, Alexander RE, Kum JB, Cheng L. The spectrum of histopathologic findings in vesical diverticulum: implications for pathogenesis and staging. Hum Pathol. 2013; 44(7): 1223–32.
16. Lloyd R, Osamura R, Kloppel G, Rosai J. WHO Classification of Tumours of Endocrine Organs (4th Edition). Lyon (France): International Agency for Research on Cancer (IARC); 2017.
17. Acosta AM, Demicco EG, Dal Cin P. Pseudosarcomatous myofibroblastic proliferations of the urinary bladder are neoplasms characterized by recurrent FN1-ALK fusions. Mod Pathol. 2021; 34(2): 469–77.
18. Babjuk M, Burger M, Compérat EM, et al. European Association of Urology Guidelines on Non‑muscle‑invasive Bladder Cancer (TaT1 and Carcinoma In Situ) – 2019 Update. Eur Urol. 2019; 76(5): 639–57.
Štítky
Detská urológia Nefrológia Urológia
Článek Editorial
Článok vyšiel v časopiseČeská urologie
Najčítanejšie tento týždeň
2023 Číslo 1- Aktuálne európske odporúčania pre liečbu renálnej koliky v dôsledku urolitiázy
- MUDr. Šimon Kozák: V algeziológii nič nefunguje zázračne cez noc! Je dôležité nechať si poradiť od špecialistov
- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Editorial
- Novinky WHO klasifikace z roku 2022: klasifikace tumorů vývodných cest močových
- Algoritmus konzervativní léčby erektilní dysfunkce
- Obezita a její vliv na karcinom prostaty
- Vzácné komplikace po intravezikálních aplikacích Bacillus‑Calmette Guérin (BCG) vakcíny
- Nefrostomický drén zavedený do dolní duté žíly
- Raritní trombóza plexu pampiniformis u covid-19 pozitivního pacienta – kazuistika
- Roboticky asistovaná resekce tumoru ledviny provedená se superselektivní teplou ischemií
- Zpráva ze stáže Evropské společnosti pro sexuální medicínu Surgical Academy v německém Kielu
- Česká urologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Novinky WHO klasifikace z roku 2022: klasifikace tumorů vývodných cest močových
- Vzácné komplikace po intravezikálních aplikacích Bacillus‑Calmette Guérin (BCG) vakcíny
- Raritní trombóza plexu pampiniformis u covid-19 pozitivního pacienta – kazuistika
- Obezita a její vliv na karcinom prostaty
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



