-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Inhibitory protonové pumpy – známe je dobře? Jsou skutečně tak bezpečné? – část 1
Proton pump inhibitors – do we know them well and are they really that safe? – part 1
Proton pump inhibitors (PPIs) are one of the most commonly used drug groups. More than 10% of patients being chronically treated in the adult population. Often patients with a high risk of vascular or renal impairment. In addition to the unquestionable effect in the treatment and in the prophylaxis of gastroduodenal diseases, PPIs have been promoted in combination with antithrombotic therapy in order to reduce bleeding in the gastrointestinal tract. In both of these indications, this is a chronic treatment, often for several years. Drug regulatory agencies (EMAs or FDA) warn against chronic PPIs use, warning of a number of serious side effects. However, chronic administration of PPIs is a common practice. It is therefore time to evaluate the benefit and risk of this important drug group. First of all, it should be noted that PPIs operate not only at the level of the classical gastric proton pump (H+/K+ ATPase), but also block the activity of the sister vacuolar proton pump (V-H+-ATPase) in a number of other organs or organelles, namely lysosomes of all somatic cells. Similarly, PPIs block the activity of a number of transporters and metabolic enzymes. Action at this level is likely to surprise the gastroenterologist. There is no doubt about the benefits of PPIs in the indication of treatment and prevention of ulcerative or reflux disease. However, what are the evidence to reduce the risk of gastriontestinal bleeding in antithrombotic treatment? In this area we have data at the level of observational studies, the decrease in the risk of bleeding by about a third is significant. However, with a relatively low incidence of bleeding in the gastrointestinal tract, the absolute decrease in risk is small, hovering at 0.3%. The observed number need to treat is around 250, i.e. for every 250 PPIs treated, we will prevent one bleeding (usually not critical). On the other hand, there are increasingly work that finds a higher incidence of cardiovascular events, renal failure, bronchial asthma and nervous disabilities in chronic PPIs treatment. In a population at high cardiovascular risk, i.e. in a typical population where we add antithrombotic treatment to PPIs, the risk is significant. The number need to harm value is around 50. Thus, in the chronic use of PPIs, the risk outweighs the benefit.
Keywords:
proton pump inhibitors – H2 receptor blockers – adverse events – atherothrombotic diseases – renal failure – overview
Autori: Bultas J.
Pôsobisko autorov: Ústav farmakologie, 3. LF UK Praha
Vyšlo v časopise: Gastroent Hepatol 2020; 74(5): 431-441
Kategória: Vybrané kapitoly z vnitřního lékařství: přehledová práce
Súhrn
Inhibitory protonové pumpy (IPP) jsou jednou z nejčastěji užívaných lékových skupin, v dospělé populaci je jimi chronicky léčeno více než 10 % nemocných, často nemocných starších s vysokým rizikem cévního či renálního postižení. Vedle nezpochybnitelného efektu v léčbě a v profylaxi gastroduodenálních onemocnění, se IPP prosadily v kombinaci s antitrombotickou léčbou s cílem snížit krvácení do trávicího traktu. V obou těchto indikacích se jedná o chronickou léčbu, často po dobu více let. Lékové regulační agentury (EMA či FDA) před neodůvodněným chronickým užíváním IPP varují, upozorňují na řadu závažných nežádoucích účinků. Nicméně chronické podávání IPP je běžnou praxí. Je tedy na čase zhodnotit přínos a riziko této důležité lékové skupiny. Předně je nutno uvést, že IPP nepůsobí pouze na úrovni klasické žaludeční protonové pumpy (H+/K+ ATPázy), ale že blokují aktivitu též sesterské vakuolární protonové pumpy (V-H+-ATPázy) v řadě dalších orgánů, resp. organel, konkrétně lysozomů všech somatických buněk. Podobně IPP blokují aktivitu řady transportérů a metabolických enzymů. Působení na této úrovni pravděpodobně gastroenterologa překvapí. V indikaci léčby a prevence vředové či refluxní choroby není o přínosu IPP pochyb. Jaké jsou však doklady o snížení rizika gastriontestinálního krvácení při antitrombotické léčbě? V této oblasti máme data na úrovni observačních studií, pokles rizika krvácení asi o třetinu je významný. Nicméně při relativně nízkém výskytu krvácení do trávicího traktu je absolutní pokles rizika malý, pohybuje se na úrovni 0,3 %. Pozorovaná hodnota number need to treat se pohybuje kolem 250, tedy na každých 250 léčených IPP zabráníme jednomu krvácení (zpravidla nikoli kritickému). Na straně druhé se stále častěji objevují práce, které nacházejí při chronické léčbě IPP vyšší výskyt kardiovaskulárních příhod, renálního selhání, astma bronchiale i nervového a smyslového postižení. Toto riziko je doloženo nejen při srovnání aplikace IPP proti stavu bez jejich podávání, tak i při léčbě IPP proti užití blokátorů H2 receptorů. Tedy i v situaci, kdy obě srovnávané skupiny mají podobné postižení trávicího traktu. V populaci s vysokým kardiovaskulárním rizikem, tj. v typické populaci, kdy k antitrombotické léčbě IPP v rámci komedikace přidáváme, je riziko významné. Hodnota number need to harm se pohybuje kolem 50. Tedy riziko převažuje nad přínosem.
Klíčová slova:
inhibitory protonové pumpy – blokátory H2 receptorů – nežádoucí účinky – aterotrombotická onemocnění – kardiovaskulární mortalita – renální selhání
Úvod
Inhibitory protonové pumpy (IPP) patří do jedné z nejčastěji indikovaných lékových skupin. V České republice je ročně předepsáno asi 300 mil. denních dávek, jedná se zpravidla o chronickou léčbu asi 10 % populace. V ostatních okolních zemích je spotřeba IPP obdobná. Vedle klasické indikace, tj. léčby vředové či refluxní gastroesofageální choroby, jsou IPP stále častěji indikovány v profylaxi krvácení při antitrombotické léčbě. Zatímco v gastroenterologické indikaci léčíme převážně populaci s nízkým kardiovaskulárním rizikem, pak při užití IPP jako komedikace k protidestičkové či antikoagulační léčbě, léčíme převážně populaci již s významným kardiovaskulárním rizikem. Plošné rozšíření IPP je dáno jejich nepochybnou účinností, snadnou dostupností (v indikaci pyrózy je volný prodej), nízkou cenou a deklarací vysoké bezpečnosti. Jak souhrn údajů o přípravku (SPC – summary of product characteristics) jednotlivých molekul, tak „velké učebnice farmakologie“ uvádějí dobrou snášenlivost a nízké riziko nežádoucích účinků. Tak také vnímáme IPP i my, klinici. Je tomu však skutečně tak?
Nejprve uveďme, že během 30leté historie IPP lze v databázi PubMed nahledat pod heslem „proton pump inhibitors“ téměř 30 tis. článků. Přidáme-li omezení „adverse events“, dostateme téměř 11 tis. odkazů. Zájem o nežádoucí účinky IPP přitom stoupá, v posledním roce je z celkem z 2 500 článků o IPP věnována nežádoucím účinkům polovina.
Čemu vděčí IPP, resp. jejich nežádoucí účinky, za tento zájem? V posledních letech se objevují observační studie, často i velkého rozsahu s expozicí více než milion pacient/roků, které naznačují, že IPP nemusí být při déletrvající léčbě tak zcela bezpečné. Řada studií ukazuje nejen zvýšený výskyt kardiovaskulárních příhod či renálního postižení, ale i vzestup mortality, a to nejen mortality kardiovaskulární. Obdobně vyznívají i analýzy, např. z databáze hlášení nežádoucích účinků FDA, že u nemocných léčených IPP je zvýšeno riziko renálního selhání a dalších nefropatií, resp. že se objevují i poruchy vyšší nervové činnosti a smyslových orgánů.
Skutečnost, že u nemocných léčených IPP se objevují aterotrombotické příhody, by se dala vysvětlit nikoli vlastním podáváním IPP, ale přítomností choroby, pro které je léčba indikována. Chronické zánětlivé onemocnění (např. ezofagitida či gastritida) aktivuje reparační pochody v rámci zánětlivé kaskády, a akceleruje tak aterogenezi či aktivuje hemostázu. Toto vysvětlení však má významnou slabinu: zvýšení rizika závažných vaskulárních, renálních či jiných komplikací se objevuje i při srovnání s jinými „gastroprotektivy“, tj. s inhibitory receptorů H2 (H2R-I). Při porovnání dvou skupin se stejnou indikací odpadá vliv odlišného iniciálního rizika. To vše vede k položení otázky: „Jsou inhibitory protonové pumpy skutečně bezpečné i při dlouhodobém podávání? Nemají negativní vliv na výskyt vaskulárních příhod a kardiovaskulární mortalitu? Nemají negativní vliv na výskyt renálního selhání? Nemají negativní vliv na centrální a periferní nervový systém? Nemají negativní vliv na respirační ústrojí?“ Pokud bude odpověď na některou otázku pozitivní, pak je nutno položit i otázky další: „Jaké mechanizmy by mohly toto riziko zvyšovat?“
Vlastnosti inhibitorů protonové pumpy
Pro pochopení širších souvislostí, je vhodné rekapitulovat základní vlastnosti IPP: mechanizmus účinku, farmakokinetické a farmakodynamické vlastnosti.
Vlastnosti farmakodynamické
Nejprve vlastnosti farmakodynamické. Podmínkou působení IPP, podávaných jako proléčiva, je jejich aktivace v kyselém prostředí. Všechny IPP velmi dobře prostupují membránami a rychle se absorbují. V kyselém prostředí vytvářejí sulfonamid s volnou sulfhydrilovou skupinou. Její vytvoření je podmínkou účinku, neboť se kovalentně váží přímo na protein protonové pumpy, čímž ji ireverzibilně inaktivují. K vlastní aktivaci musí dojít až v sekrečním acinu parietální buňky, kam se dostává IPP z cirkulace, koncentrace IPP v acinu je asi 1 000× větší než v plazmě. Tak je dosaženo dostatečné lokální koncentrace léčiva. Aby nedošlo k nežádoucí aktivaci molekuly již v lumen žaludku, jsou IPP podávány v acidorezistentní formě. Limitní hodnota pH pro vytvoření sulfenamidu se mírně liší, nejvyšší (kolem 3,5) je u rabeprazolu, u ostatních je pod pH 3. To znamená, že při léčbě IPP, kdy pH stoupá nad 3, je bioaktivace omezena. Kyselost žaludečních šťáv je tak regulována na stejné úrovni – při poklesu pH se vytvoří více aktivního metabolitu (pH stoupá nad 3), naopak tento vzestup sníží aktivaci mateřské látky (pH klesá). Díky tomuto mechanizmu, kdy je účinek regulován v úzkém rozmezí nezávisle na koncentraci, mají IPP velmi široké terapeutické okno.
K tomu, aby došlo k inaktivaci žaludeční H+/K+ ATPázy, je nutné, aby byla pumpa v aktivním stavu, což je zejména po jídle. Potřebná koncentrace IPP v plazmě, resp. v acinu je krátká, jen 1–2 hod. K dosažení optimálního efektu je tak třeba podat léčivo 30–60 min před jídlem a požití potravy následně protonové pumpy aktivuje. Tak je zajištěno, že vrcholová koncentrace IPP se kryje s obdobím maximální stimulace pumpy. Tak je umožněna ireverzibilní blokáda co největšího počtu ATPáz. Jednorázová aplikace IPP v běžné dávce inhibuje asi 60 % funkčních pump. Teprve opakované podání zajistí plný efekt.
V nástupu efektu se IPP liší, nejkratší aktivaci na účinnou molekulu na úrovni acinu má rabeprazol (asi 20 min), nejdelší pantoprazol (asi 2 hod). Při jednorázovém podání při potížích je tak rabeprazol nejvýhodnější. Délka účinku je u všech IPP stejná, pumpy jsou resyntetizovány po více než 24 hod. Při podání ve farmakoekvivalentních dávkách nejsou praktické rozdíly v dosaženém efektu, tj. vzestupu pH žaludeční šťávy. Eliminace IPP je hepatální s přispěním polymorfního izoenzymu CYP 2C19. Jedinci s vysokou aktivitou (rychlí metabolizátoři) mají významně nižší expozici IPP, a tak i nižší účinek, než metabolizátoři pomalí a střední. Oxidáza CYP 2C19 je všemi inhibitory protonové pumpy, zejména však omeprazolem, inhibována. Slabší inhibice byla popsána u rabeprazolu a pantoprazolu, i tak je však klinicky významná.
Protonová pumpa, čili H+/K+ ATPáza, je transportérem aktivně směňujícím protony za draslíkové kationty. Souhrou s paralelním transportérem (K+/Cl– symportem), pumpujícím kationty kalia zpět do buňky a chloridové anionty naopak do acinu, vzniká kyselina chlorovodíková. Po stimulaci protonové pumpy klesá pH v žaludku na hodnoty 1–2. Mluvíme-li o „protonové pumpě“ typu H+/K+ ATPázy, měli bychom mít na mysli celou funkční jednotku H+/K+ ATPázu a K+/Cl– symport, protonové pumpy v jiných orgánech mají zcela odlišnou strukturu (obr. 1). Primárním efektem IPP na úrovni parietálních buněk žaludku je inhibice protonové pumpy, čili H+/K+ ATPázy. Vlastní kovalentní vazba IPP je cílena na podjednotku pumpující protony. Ta je obdobná i u jiných protonových pump, konkrétně u V-ATPázy. Naopak jiná skupina – draslík-kompetitivních inhibitorů acidity (potassium-competitive acid blockers) – se váže na podjednotku přenášející kationt draslíku. Tento protein již v pumpách typu V-ATPázy není, účinek této nové skupiny (představované např. vonoprazanem) je tak daleko cílenejší, omezený na parietální buňky žaludku.
Obr. 1. Funkce H+/K+ ATPázy na úrovni parietální buňky žaludku. Po stimulaci histaminových receptorů H2 (H2R), muskarinových receptorů M3 (M3R) či cholecystokininových receptorů 2 (CCK2R) je pumpa aktivována. Pokles pH inhibuje sekreci gastrinu. Část účinku inhibitorů protonové pumpy je dána vzestupem pH, část vyšší nabídkou gastrinu. Vazba IPP je cílena na podjednotku zajišťující přesun protonů; ta je společná i protonovým pumpám jiných orgánů. Naopak prazany, čili draslík-kompetitivní inhibitory acidity se váží na podjednotku pumpující kationty draslíku. Ta je specifická jen pro žaludeční ATPázu.
Fig. 1. Function H+/K+ ATAse at the parietal cell level of the stomach. After stimulation of histamine receptors H2 (H2R), muscarinic rec. M3 (M3R) or cholecystokinin rec. 2 (CCK2R), the pump is active. The decrease in pH inhibits the secretion of gastrin. Part of the eff ect of PPIs is due to the rise in pH, part of a higher supply of gastrin. The link of PPIs is targeted at a subunit ensuring the movement of protons, which is common to the proton pumps of other organs. On the contrary, potassium- competitive acidity inhibitors bind to a subunit pumping potassium cations. This is specific only to the ATPase in parietal cells.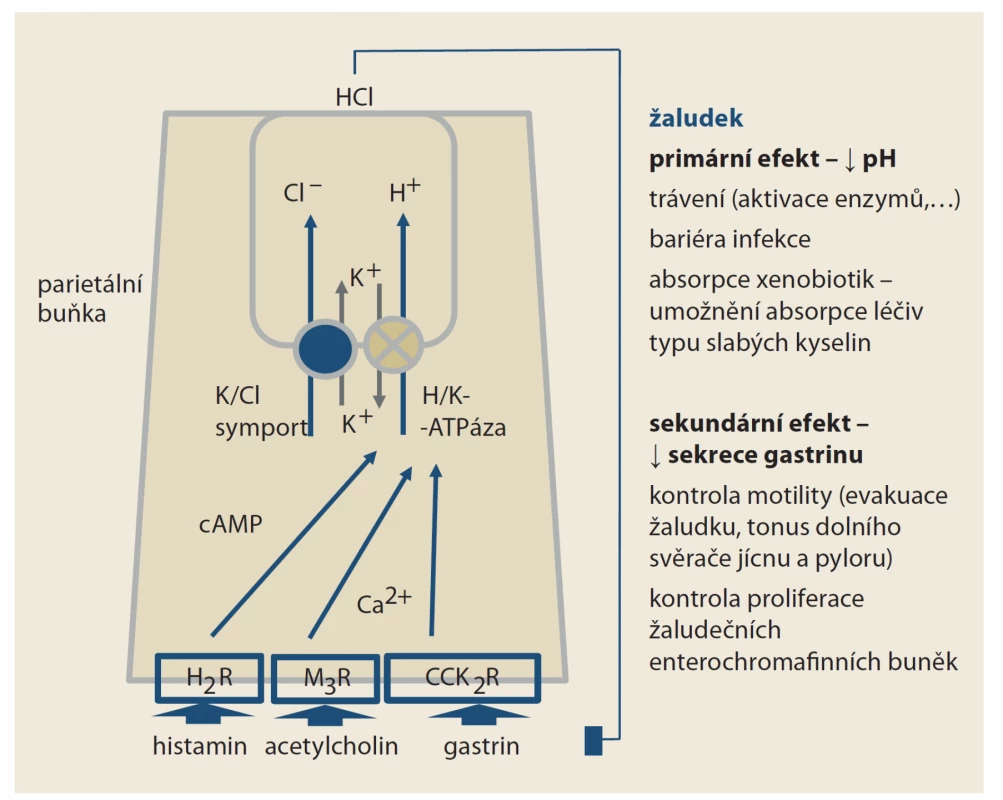
Protonové pumpy nejsou pouze v parietálních buňkách žaludku, ale též v tubulárních buňkách nefronu, v osteoklastech, epiteliích nadvarlete a v lysozomech všech buněk (tab. 1, obr. 2). Funkce je obdobná, jen struktura je odlišná, přidružený draslíkový i chloridový kanál chybí. Paralelní sekrece aniontů (pro zachování elektrické neutrality) je zajištěna zpravidla anionty organických kyselin. Tento typ protonových pump označujeme jako vakuolární H+-ATPázy (V-ATPázy). Podstatné je, že PPI blokují funkci též pump tohoto typu [1].
Tab. 1. Funkce protonových pump. V různých tkáních se nacházejí dva typy protonové pumpy, v kanalikulu parietálních buňkách žaludku je typ H+/K+ ATPázy, v epiteliích tubulárního systému nefronu, nadvarlete či v acinech osteoklastu je izotransportér vakuolární H+-ATPáza. Podle lokalizace je odlišná též funkce. Obě pumpy/transportéry jsou inhibovány inhibitory protonové pumpy.
Tab. 1. Function of proton pumps. In diff erent tissues there are two types of proton pump, in the acinus of the parietal cells of the stomach there is type H+/K+ ATPase, in the epithelium of the tubular nephron system, in epitelial of epidimis or in the osteoklasts there is an iso-transporter of vacular H+-ATPase. According to localization, the function is also diff erent. Both pumps/transporters are inhibited by PPIs.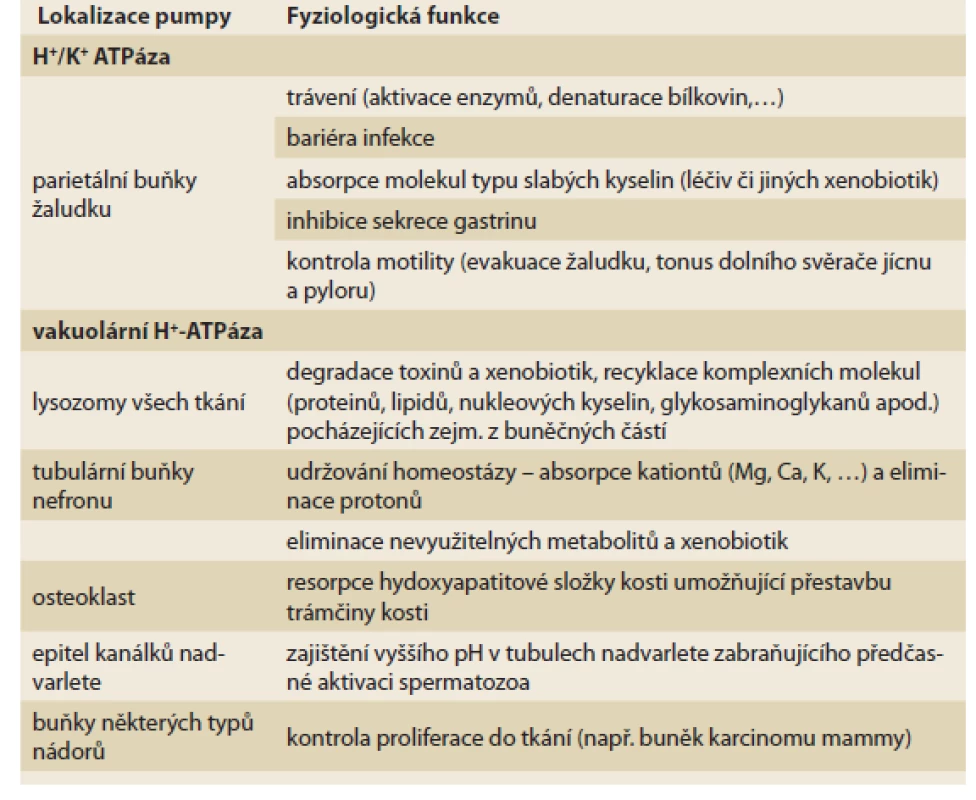
Obr. 2. Funkce vakuolární H+-ATPázy (V-ATPázy). Jak je patrné, její funkce je doslova pleiotropní. Její blokáda inhibitory protonové pumpy se tak projeví na více místech. Léčiva typu draslík-kompetitivních inhibitorů acidity (prazanů) či blokátorů H2 receptorů tento typ protonové pumpy neovlivňují; jejich efekt je tak specifičtější, vázán na žaludek.
Fig. 2. Vacuolar H+-ATAse function (V-ATAse). As you can see, its function is literally pleiotropic. Its blockade of PPIs will thus take eff ect in more places. Drugs of the type of potassium-competitive acidity inhibitors (prazans) or H2 receptor blockers do not aff ect this type of proton pump, their effect is so more specific, tied to the stomach.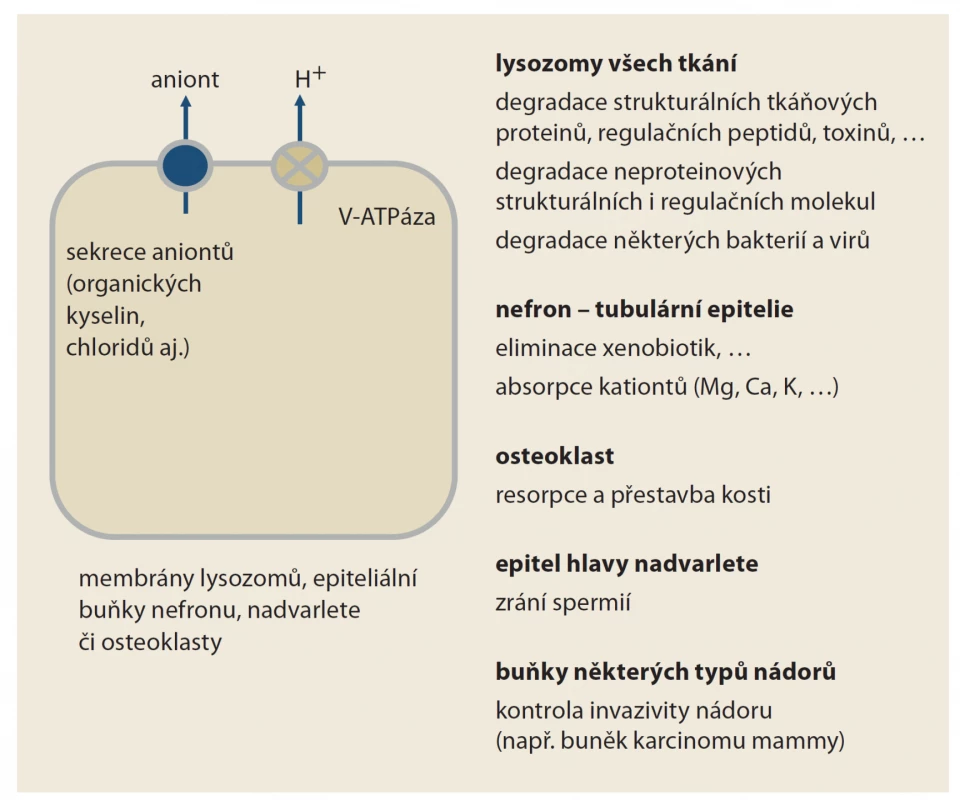
Význam inhibice žaludeční H+/K+ ATPázy
V žaludku má kyselina solná řadu biologických funkcí. Kyselé pH denaturuje proteiny a usnadňuje jejich degradaci, aktivuje trávicí enzymy (zejm. pepsinogenu na pepsin), umožňuje absorpci léčiv typu slabých hydrofilních kyselin v neionizovaném stavu (např. kyselinu acetylasalicilovou [ASA] či dabigatran etexilátu) a v neposlední řadě je důležitou obranou před invazí řady patogenních organizmů do střev. Vzestup pH (např. při léčbě IPP) má malý efekt na vlastní trávení, snížení aktivity žaludečních enzymů je dostatečně kompenzováno enzymy v nižších etážích traktu. Naopak ztráta prvé bariery infekce se uplatňuje, riziko infekčních chorob přestupujících do organizmu trávicím traktem (např. „cestovatelských průjmů“) je zvýšeno. Stejně tak má význam změna (zpravidla snížení) dostupnosti řady léčiv, minerálů či vitaminů.
Nižší koncentrace protonů v žaludeční šťávě má vliv i na kinetiku žaludku. Vzestup sekrece gastrinu v antrálních G-buňkách žaludku významně zvýší nejen motilitu žaludku, ale i tonus dolního svěrače jícnu, naopak napětí pyloru klesá. Léčebně využíváme tento účinek v léčbě gastroesofageální refluxní choroby (GERD – gastroesophageal reflux disease).
Význam inhibice vakuolární H+-ATPázy (V-ATPázy)
Jak bylo řečeno, protonová pumpa, v tomto případě její sesterský transportér – V-ATPáza, má též extragastrickou funkci. Uplatní se všude tak, kde organizmus potřebuje kyselé prostředí z důvodu optimální absorpce, resoprpce či eliminace molekul, z důvodů optimálního zrání buněk či při invazi buněk do tkání [2].
Protonová pumpa typu V-ATPázy se účastní degradace řady látek v lysozomech všech buněk organizmu. Významná je především v buňkách defenzivních systémů kontrolujících mimo jiné onkogenezi či obranyschopnost proti infekci (obr. 2). Vakuolární ATPáza v lysozomech má význam v proliferaci nádorových buněk, její blokáda pomocí IPP či jiných látek je intenzivně studována [3]. Při inhibici této protonové pumpy je popsána porucha degradace řady komplexních molekul. Příkladem je protein typu beta-amyloidu, jeho střádání např. v kochleárních buňkách či nervovém systému může mít vztah k poruchám sluchu či neuropatiím, jejichž výskyt je při dlouhodobé léčbě IPP častější.
V poslední době se stále více zdůrazňuje význam V-ATPázy v endoteliálních lysozomech cév. Inhibice její funkce je provázena řadou negativních dějů – akumulací agregátů proteinů, zvýšením oxidačního stresu, endoteliální dysfunkcí, porušenou neoangiogenezí a fibrotizací cévní stěny [4]. Výsledkem je akcelerace aterogeneze, aktivace hemostázy či vývoj nefrosklerózy.
Protonová pumpa typu V-ATPázy je též v resorpční kavitě osteoklastu, kyselé prostředí pomáhá rozpouštět hydroxyapatit kostní matrix. Správná funkce osteoklastů je podmínkou fyziologické přestavby kosti [5]. Vzhledem k tomu, že přestavba je velmi pomalá, projeví se efekt – vyšší lomivost – až po více než 5 letech expozice IPP.
Podobně je protonová pumpa typu V-ATPázy součástí tubulárních transportních kanálů nefronu. Zde ovlivňuje aciditu moči a tím i vylučování celé řady léčiv. Klinický význam změny acidity moči na eliminaci léčiv je sice v řadě prací konstatován, konkrétních dat dokládajících význam změny pH na kinetiku léčiv po inhibici pumpy, je málo. Je tomu tak pravděpodobně i proto, že IPP inhibují funkci tubulárních transportérů organických kationtů (OAT 1–3), které ovlivňují eliminaci léčiv více než je tomu u V-ATPázy. Sledovat izolovaně jen jednu složku je tak obtížné.
Dalším místem, kde má přítomnost protonové pumpy typu V-ATPázy význam, je epitel hlavy nadvarlete. Ke konečné maturaci spermatozoa je potřeba kyselé prostředí. Jen tak nedojde k předčasné aktivaci ještě nezralé spermie. Vzestup pH v nadvarleti při léčbě IPP může vést k omezení pohyblivosti spermie po ejakulaci a jejich nízká aktivita při pronikání spermie do oocytu [6].
Význam inhibice transportéru bivalentních kationtů TRPM6/7
Podobně, jako celá řada klasických léčiv, též IPP působí i na jiné struktury než pouze na protonovou pumpu. Zatím blíže neobjasněným mechanizmem PPI inhibují transportní kanál bivalentních kationtů TRPM6/7 (transient receptor potential ion channel 6/7) v tubulu nefronu a v epiteliích tračníku (obr. 3). Minimálně u některých nemocných, pravděpodobně při polymorfizmu transportéru, se tak objevuje deplece magnezia a kalcia. Tyto kationty se tak omezeně vstřebávají a více eliminují. Popsány jsou arytmie při takto navozené depleci, častěji pouze v rámci současné léčbě diuretiky, kdy se efekt na pokles koncentrace zejména magnezia sčítá.
Obr. 3. Funkce transportního kanálu bivalentních kationtů TRPM6/7 na úrovni nefronu a enterocytu. Inhibice transportéru na úrovni tubulární epitelie nefronu snižuje reabsorpci kationtů magnezia a kalcia z primární moči, na úrovni enterocytu jejich facilitovanou absorpci ze střevního obsahu.
Fig. 3. Function of the transport channel of bivalent cations TRPM6/7 at the level of nephron and enterocyte. Inhibition of the transporter at the level of tubular epithelium of nephron reduces the reabsorption of magnesium cations and calcium from primary urine, at the level of enterocyte reduces their facilitated absorption from intestinal contents.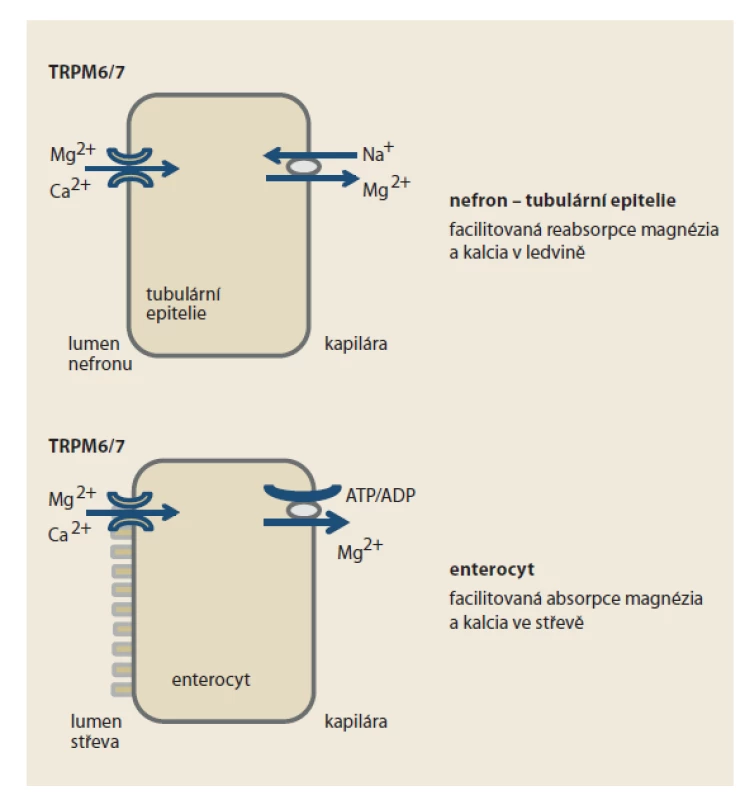
Význam blokády dalších transportérů a enzymů
Vedle transportéru TRPM6/7 inhibují IPP také transmembranózní proteiny přenášející organické kationty, transportéry z rodiny OCT 1, OCT 2 a OCT 3 [7]. I tato skutečnost má klinický význam, např. metformin je v ledvinách aktivně eliminován zejména OCT 2. Blokáda efluxního transportéru různými IPP zvyšuje expozici metforminu v řádu desítek procent. Jaké jsou rozdíly v inhibici mezi jednotlivými IPP, není zřejmé.
Na úrovni enzymů, konkrétně oxidázy CYP 2C19, působí IPP též inhibičně. Zde jsou doloženy významné rozdíly mezi molekulami, podrobněji se problému budeme věnovat v rámci lékových interakcí.
Dalším účinkem IPP, tentokrát s nejasným klinickým významem, je inhibice dimetylarginin dimetylaminohydrolázy (DDAH). Tento enzym degraduje asymetrický dimetylarginin (ADMA), významný inhibitor NO-syntázy [8]. Zpomalení biodegradace ADMA vede k jeho vyšší koncentraci, nižší aktivitě NO-syntázy a omezené nabídce oxidu dusnatého vedoucí ke zvýšení cévního tonu a aktivaci trombocytů. Inhibitory protonové pumpy jsou jen slabým inhibitorem, proto většina studií nenachází významně vyšší koncentraci ADMA při léčbě, resp. neprokazuje sníženou vazoreaktivitu [9]. Tento efekt má hraniční význam, nevysvětluje negativní dopad léčby IPP na výskyt aterotrombotických příhod, který provází dlouhodobou léčbu IPP.
Jak je nastíněno, IPP nejsou jen gastroprotektivy, jejich efekt je širší a jak bude dále ukázáno, jejich nežádoucí účinky vycházejí nejen z trávicího traktu. Nejsou omezeny jen na důsledky vzestupu pH v žaludečním obsahu.
Vlastnosti farmakokinetické
Všechny IPP velmi dobře prostupují membránami a rychle se absorbují. Jídlo snižuje jejich dosažitelnost asi na polovinu. Jak bylo řečeno, IPP jsou proléčiva, aktivace na účinný sulfenamid je vázána až na místo působení v acinu parietální buňky. Kovalentní vazba sulfhydrilové skupiny na sulfhydrilovou skupinu cysteinu protonové pumpy blokuje sekreci kyseliny solné, dokud nedojde k přirozené obnově pump, tj. déle než 24 hod. Proteiny pumpy mají poločas obnovy kolem 50 hod, denně se syntetizuje asi 20 % pump. Skutečnost, že poločas plazmatické eliminace IPP je krátký (pohybuje se mezi 1 a 2 hod), je z klinického pohledu nepodstatná. Rozdíly v kinetice uvnitř skupiny IPP jsou malé. Při podání ve farmakoekvivalentních dávkách nenacházíme rozdíly v dosaženém efektu, tj. kontrole pH žaludečních šťáv. Eliminace IPP je hepatální s přispěním polymorfního izoenzymu CYP 2C19. Nutno uvést, že aktivita enzymu ovlivňuje plazmatickou koncentraci a expozici IPP, u nosičů genotypu loss of function, tedy pomalých metabolizátorů, je expozice 3 až 10násobná proti nosičům genotypu gain of function, tedy rychlých metabolizátorů [10]. Ovlivněn je i efekt léčby, úspěšnost eradikace se může u rychlých a pomalých metabolizátorů lišit. Oxidáza CYP 2C19 je inhibitory protonové pumpy, zejména omeprazolem, inhibována. Tato skutečnost má přímý dopad na lékové interakce.
Lékové interakce IPP
Jako u ostatních léčiv se lékové interakce IPP dělí na farmakodynamické (ovlivňující účinek léku) a farmakokinetické (ovlivňující absorpci, aktivaci/inaktivaci a eliminaci léčiva) (tab. 2). Interakce na úrovni ovlivnění farmakodynamiky mají u IPP omezený praktický význam. Z hlediska případného vlivu IPP na poruchy srdečního rytmu by mohlo být významné riziko navození hypomagnezemie a hypokalcemie při inhibici transportního kanálu TRPM6/7 (transient receptor potential). Tento transportér kontroluje absorpci bivalentních kationtů magnezia a kalcia na úrovni enterocytu a jejich eliminaci tubulárními epiteliemi ledvin. Inhibitory protonové pumpy, stejně jako diuretika, tento kanál významně inhibují – diuretika na úrovni nefronu, inhibitory protonové pumpy též na úrovni enterocytu. Léčba IPP může vést k významné depleci zejména magnezia. Lze si dobře představit, že se tento mechanizmus může podílet na vyšším výskytu srdečního selhání, poruch srdečního rytmu a zhoršení prognózy u nemocných léčených IPP.
Tab. 2. Typy klinicky významných lékových interakcí inhibitorů protonové pumpy (Na+/K+ ATPázy).
Tab. 2. Types of clinically signifi cant drug interactions of proton pump inhibitors (inhibitors of Na+/K+ ATPase).
Daleko větší význam mají lékové interakce zvyšující či snižující koncentraci léčiv, tedy interakce na farmakokinetickém podkladě. Mechanizmus, kterým IPP ovlivní kinetiku jiných léčiv, je pestrý. Prvým je působení na absorpci slabých hydrofilních kyselin. Ty se zpravidla vstřebávají prostou difuzí v nedisociovaném stavu. Vzestup pH (snížení acidity) při léčbě IPP pak vede k disociaci molekuly léčiva. Negativní náboj zhoršuje transmembranózní přestup léčiva a snižuje jeho absorpci. Naopak slabé zásady, např. alkaloidy, se lépe vstřebávají v prostředí zásaditém. Vzestup pH tak jejich absorpci zvyšuje. Tento typ interakce – ovlivnění dostupnosti změnou pH v žaludku a v proximálním duodenu – je specifický pro skupinu léčiv ovlivňujících sekreci kyseliny solné. Buď přímo inhibicí H+/K+ ATPázy (protonové pumpy), či nepřímo snížením její aktivace (např. H2R-I). Vedle snížení dostupnosti ASA či dabigatranu, které se budeme věnovat, snižují IPP tímto mechanizmem dostupnost celé řady dalších léčiv, např. inhibitorů tyrosin-kináz a dalších multikináz, užívaných v onkologii [11].
Druhým mechanizmem ovlivňujícím koncentraci léčiva je interakce na úrovni eliminace, konkrétně eliminace tubulární sekrecí. Ta je závislá na pH primární moče, inhibice protonové pumpy kyselost mění, a tak zvyšuje či snižuje renální eliminaci léčiva. Na rozdíl od absorpce je eliminace léčiv užívaných v kardiologii ovlivněna IPP méně významně. Podílí se však na výskytu nežádoucích účinků, zejména nefropatií (vč. renálního selhání) a nefrolitiázy [12]. Změny pH na úrovni žaludečních šťáv či moče vlivem IPP nejsou závislé na konkrétním léčivu, jedná se o skupinový efekt [12].
Naproti tomu ovlivnění transformace léčiv na úrovni inhibice izoenzymu CYP 2C19 je u jednotlivých IPP různě významné. Všechny IPP jsou transformovány oxidázou CYP 2C19. Tato oxidáza je polymorfní, podle aktivity rozeznáváme pomalé, střední a rychlé metabolizátory. Změny v expozici IPP se odráží i v klinické účinnosti např. u rychlých metabolizátorů s nízkou expozicí IPP – je doložena menší účinnost v eradikaci Helicobacter pylori. Na úrovni lékových interakcí má význam skutečnost, že IPP jsou významnými inhibitory izoenzymu CYP 2C19. Nejsilnějším je omeprazol, esomeprazol, deslansoprazol a lansoprazol, středně silným pantoprazol a nejslabším rabeprazol [13,14]. Nicméně i u „slabších“ inhibitorů je snížení aktivity CYP 2C19 klinicky významné. Konkrétně se tento typ interakce projeví při snížené bioaktivaci klopidogrelu vedoucí k oslabení efektu či zpomalené biodegradaci některých antidepresiv s případnými toxickými projevy.
Shrnutí: IPP ovlivňují absorpci, eliminaci a biotransformaci léčiv třemi způsoby. Změna pH v žaludku a proximálním duodenu mění disociaci slabých kyselin a bazí, a tak ovlivňuje jejich vstřebávání. Změna pH moče v tubulárním systému ovlivňuje jejich vylučování. Inhibice izoenzymu CYP2C19 zpomaluje metabolizmus řady léčiv (jak aktivaci, tak degradaci).
Praktický význam lékových interakcí
Jaký je praktický význam lékových interakcí IPP? Dominantní cílovou skupinou, které indikujeme IPP, jsou beze sporu senioři. Tedy nemocní často polymorbidní a léčení řadou léků. Otázka lékových interakcí je v tomto případě velmi aktuální. Lékové interakce jsou významné zejména u léčiv s úzkým terapeutickým oknem, kdy již mírné snížení koncentrace či zkrácení doby působení vede ke snížení až selhání efektu, naopak vyšší expozice vedou k nežádoucím účinkům až toxickému působení. Toto zadání, tedy úzké terapeutické okno, splňují zejména antitrombotika, snížení expozice vede ke zvýšenému výskytu trombotických komplikací, naopak zvýšení vede ke krvácení. Lékové interakce IPP s antitrombotiky jsou na podkladě farmakokinetiky. Omezena je buď jejich absorpce (dabigatran či ASA), nebo je snížena jejich bioaktivace (klopidogrel).
Podobně jako při antikoagulační léčbě jsou IPP často podávány v rámci protidestičkové léčby, zejména při léčbě duální, kombinující ASA s blokátory trombocytárních ADP receptorů (s klopidogrelem, prasugrelem či tikagrelorem). Dle dat z řady databází, např. Oxford Vascular Study, je v Evropě současně léčeno IPP v rámci komedikace s protidestičkovou léčbou více než 20 % pacientů, u nemocných užívajících duální protidestičkovou léčbu je to pak polovina [15]. Dle starší analýzy DrugAgency a. s. není situace v ČR odlišná (ústní sdělení). Uvědomíme-li si, že ASA užívá v ČR téměř milion osob a klopidogrel kolem 100 tis., je komedikace IPP s protidestičkovou léčbou velmi rozšířena. V případě protidestičkové léčby se jedná řádově o 200 tisíc nemocných, u antikoagulancií o několik desítek tisíc pacientů. Tedy číslo blížící se čtvrt milionu nemocných, množství jistě významné, kterým stojí za to se zabývat.
Nejprve se podívejme na interakci IPP s přímými antikoagulancii. Není známa léková interakce s xabany, ty je možno s IPP kombinovat volně. Naopak, klinicky významná je léková interakce s dabigatranem. Dabigatran je podáván ve formě soli, dabigatran etexilátu. Jeho absorpce je vázána na kyselé prostředí žaludku a duodena, současně je absorpce omezena eliminačním transportérem glykoproteinem P (P-gp). Výsledná biologická dostupnost dabigatranu je nízká, pohybuje se mezi 5 a 8 %. Jak vzestup pH v žaludku, tak aktivace P-gp dostupnost dabigatranu snižují. V japonské studii léčba IPP vedla ke snížení vrcholové i minimální koncentrace dabigatranu o třetinu, nebyl rozdíl mezi jednotlivými IPP [16]. Pro evropskou populaci máme data firemní studie a slovenské studie. Prvá studie dokládá snížení expozice dabigatranu při kombinaci s IPP o čtvrtinu [17]. Ve druhé byly rozdíly výraznější, minimální i vrcholová koncentrace dabigatranu klesla při léčbě IPP o polovinu [18]. Všechny rozdíly byly vysoce statisticky signifikantní, klinická relevance poklesu koncentrací téměř na polovinu byla rovněž významná. Nutno zdůraznit velkou interindividuální variabilitu působení léčby IPP. Také SPC Pradaxa konstatuje 30% snížení koncentrace dabigatranu při občasném podávání IPP, nález reflektuje výsledky populační farmakokinetiky provedené ve studii RELY [19,20]. Dá se konstatovat, že kombinace dabigatranu s IPP vede ke snížení koncentrace dabigatranu o 30–50 %, resp. u některých nemocných i o více než 100 %. Takovéto snížení je jistě klinicky významné. Data ze studie RELY u nemocných s fibrilací síní, kde byly užity dvě dávky dabigatranu (2× 110 mg a 2× 150 mg), vedl 40% rozdíl v plazmatických koncentracích ke 30% rozdílu účinnosti [21].
Druhou interakcí IPP v oblasti antitrombotik je ovlivnění absorpce ASA. Jak bylo řečeno, slabé kyseliny se vstřebávají v nedisociované podobě pasivní difuzí, konkrétně v kyselém prostředí žaludku a duodena. Vzhledem k disociační konstantě 3,5 je ASA dobře vstřebávána pouze při pH pod 3,5. Při léčbě IPP je absorpce nedostatečná, ASA se dostává do střeva, kde je z převážné části deacetylována karbo-esterázami (tzv. aspirinové esterázy) a absorbována již jako ASA. Ta již nemá acetylovou skupinu a není schopna acetylovat serin v katalytickém místě cyklo-oxygenázy [22]. Podobně tomu je při podání enterosolventní formy ASA [23]. Salicylová kyselina je sice biologicky aktivní, potlačuje projevy zánětu, nicméně protidestičkový efekt postrádá. Jediná data, dokládající snížení protidestičkového efektu ASA při kombinaci s IPP, máme z dánského Národního registru nemocných po infarktu myokardu [24]. Tato práce byla první, která vzbudila pochybnosti o vhodnosti komedikace IPP s ASA. Do retrospektivní analýzy mortality a morbidity bylo zařazeno téměř 20 tis. nemocných po prvním infarktu myokardu (IM), kteří nebyli léčeni duální protidestičkovou léčbou. ASA reprezentovala klasická rychle rozpustná forma v dávce 75 mg. Ve skupině léčené ASA v kombinaci s IPP se objevilo 23 % příhod typu MACE (úmrtí z kardiovaskulárních příčin, IM či iktus), ve skupině neléčené IPP se těchto komplikací objevilo 15 %. Při analýze rizika Coxovým modelem byl doložen vzestup kardiovaskulárního rizika o 46 % (HR 1,46; CI 1,33–1,61; p < 0,001), absolutní riziko vzrostlo významně o 7,7 %. Vzhledem k tomu, že příhod bylo téměř 3,5 tis., je analýza dostatečně robustní. Nemocní, kteří byli léčeni H2R-I (kdy pH v žaludku nestoupá nad 3,5), neměli prognózu negativně ovlivněnou. Na základě této studie nelze jednoznačně říci, že komedikace IPP s ASA je nebezpečná, pochybnosti však jsou více než opodstatněné. A v kontextu dalších studií, které budou prezentovány, je důležitým kamínkem celé mozaiky.
Interakce IPP s klopidogrelem má jiný mechanizmus, je inhibována aktivace proléčiva na aktivní metabolit. V tomto ději má klíčovou úlohu oxidáza CYP 2C19, kterou IPP v různé míře tlumí. V procesu bioaktivace hraje dominantní úlohu rychlá přeměna mateřské látky na 2-oxo klopidogrel. Mateřská látka je totiž substrátem dvou enzymů – karboesterázy CES-1 a oxidázy CYP 2C19. Prvý enzym vede k hydrolýze na neúčinné metabolity, naopak působení oxidázy je prvým krokem pro vznik aktivních metabolitů. Není-li oxidáza CYP 2C19 dostatečně aktivní, je konverze příliš pomalá a klopidogrel je téměř všechen inaktivován hydrolýzou. Vázne-li konverze na aktivní metabolit, snižuje se protidestičkový efekt. Na výslednou koncentraci aktivního metabolitu má vliv nejen inhibice CYP 2C19, ale též farmakogenetické vlivy na úrovni absorpce klopidogrelu (aktivita transportéru P-gp), aktivita CES-1 či aktivita polymorfního enzymu CYP 2C19. Proto je obtížné sledovat izolovaně vliv pouze IPP.
Klinický význam inhibice izoenzymu CYP 2C19 komedikací IPP s klopidogrelem je diskutován téměř 20 let. Problémem je, že nejsou validní kontrolované prospektivní studie. Velikost několika mála kontrolovaných studií byl malý, počet velkých vaskulárních příhod ve všech dohromady nedosáhl ani 50.
Zbývají tedy studie retrospektivní a post-hoc analýzy. V roce 2018 vyšla velká metaanalýza 27 studií (více než 150 tis. probandů) sledující výskyt velkých vaskulárních příhod typu MACE, kardiovaskulární mortalitu a samostatně výskyt IM při léčbě klopidogrelem s či bez komedikace IPP [25]. Při zařazení všech prospektivních i observačních studií stouplo riziko MACE při léčbě IPP o více než pětinu (HR 1,22; CI 1,06–1,396; p = 0,004). Riziko kardiovaskulární mortality se zvýšilo rovněž o pětinu, výsledek však nedosáhl signifikance (HR 1,21; CI 0,97–1,50; p 0,09). Riziko IM stouplo o více než 40 % (HR 1,43; CI 1,24–1,66; p < 0,001). Při samostatném hodnocení randomizovaných studií (vč. post-hoc analýz studií, v nichž byly IPP užívány jen nepravidelně) signifikance vymizela, nicméně např. u kardiovaskulární mortality trend přetrvával a vzestup o dvě třetiny (HR 1,67; CI 0,40–7,0) byl varující. Problémem této i dalších analýz je absence rozdělení efektu podle užitého inhibitoru protonové pumpy.
Třetí generace blokátorů ADP receptorů – prasugrel, tikagrelor či kangrelor již nevyžadují bioaktivaci problematickou oxidázou CYP 2C19 a lékové interakce s IPP nejsou známy.
Z klinického hlediska má největší význam interakce IPP s duální protidestičkovou léčbou. Tato komedikace je velmi častá, užívá ji nejméně polovina pacientů léčených kombinací ASA s klopidogrelem. Jsou to nemocní, kteří mají největší riziko aterotrombotické příhody, resp. její recidivy. Lze předpokládat, že interakce by zde měla mít aditivní nežádoucí efekt, uplatní se nižší dostupnost ASA a omezená bioaktivace klopidogrelu. Jaká tedy jsou klinická data?
I pro tento typ protidestičkové léčby máme málo dat z kontrolovaných studií. Jediná studie COGENT s větším počtem probandů (n = 3 800) sice doložila snížení krvácení z horní části traktu bez vzestupu výskytu velkých vaskulárních příhod, ale léková forma vyvinutá firmou Cogent umožnila asymetrické uvolnění IPP a klopidogrelu [26]. Aktivace proléčiva tak mohla být inhibována méně. Tato skutečnost se pravděpodobně uplatnila na zachování efektu klopidogrelu, bohužel tato léková forma není dostupná. Enterosolventní forma ASA, užitá ve studii, rovněž brání validní analýze, efekt ecASA není dostatečný, proto ani přidání IPP jej dále nesníží. Platnost studie je omezena i tím, že nebyl zařazen potřebný počet nemocných a doba sledování byla předčasně ukončena.
Druhou randomizovanou studii, pantoprazolovou větev studie COMPASS, nelze užít. V této megastudii byla opět použita enterosolventní forma ASA, duální léčba byla postavena na kombinaci s přímým antikoagulanciem – riva - roxabanem [27].
Zbývá tedy opět analýza studií observačních. K dispozici je relativně čerstvá metaanalýza 35 studií sledujících efekt přidání IPP k duální protidestičkové léčbě [28]. Analýza observačních studií (s více než 250 tis. probandů) našla významný nárůst rizika velkých vaskulárních příhod typu MACE o třetinu již po roce komedikace IPP k duální léčbě (HR 1,35; CI 1,18–1,54). Stejný byl nárůst výskytu IM (HR 1,33; CI 1,15–1,55), iktu téměř o 50 % (HR 1,49; CI 1,2–1,84) či trombózy ve stentu o třetinu (HR 1,34; CI 1,16–1,55). Celková mortalita stoupla po 6 letech léčby o třetinu (HR 1,32; CI 1,00–1,73). Při analýze efektu samotného omeprazolu, proti ostatním IPP, nebyl pozorován rozdíl, jedná se tedy o skupinový efekt.
Podobná, zcela recentní metaanalýza, zařadila do výběru, vedle kombinace klopidogrel/ASA, též studie s kombinací tikagrelor/ASA či prasugrel/ASA [29]. Opět byl analyzován výskyt příhod s či bez komedikace IPP. Data ze 4 studií randomizovaných (opět většinu dat reprezentovala studie COGENT) byla postavena na analýze několika tisících pacient/roků, kdežto data z 35 observačních studií byla získána na základě stovek tisíc pacient/roků. Výsledky jsou pro přehlednost prezentovány v grafu zvlášť pro studie randomizované a zvláště pro observační (graf 1, 2).
Graf 1. Ovlivnění účinnosti, tj. snížení výskytu krvácení do trávicího traktu, a ovlivnění bezpečnosti, tj. mortality a vaskulárních příhod, při komedikaci IPP k DAPT (ASA/klopidogrel) ve čtyřech randomizovaných studiích (n < 2 tis. pacient/roků). Data převážně reprezentují výsledky studie COGENT. Není patrný dopad na vaskulární příhody, vzestup celkové mortality nebyl statisticky významný. Pokles gastrointestinálního krvácení byl významný jak klinicky, tak statisticky [29].
CMP – cévní mozková příhoda, DAPT – duální protidestičková léčba, GI – gastrointestinální, KV mort. – kardiovaskulární mortalita, IM – infarkt myokardu, IPP – inhibitory protonové pumpy, NS – statisticky nevýznamné.
Graph 1. The effi cacy (reduction in gastrointestinal bleeding) and safety (mortality and vascular events) of PPI comedication with DAPT (ASA/clopidogrel) in four randomised studies. The data mostly represents the results of the COGENT study. There is no noticeable impact on vascular events, the increase in overall mortality was not statistically signifi cant. The decrease in gastrointestinal bleeding was signifi cant both clinically and statistically [29].
CMP – stroke, DAPT – dual antiplatelet therapy, GI – gastrointestinal, KV mort. – cardiovascular mortality, IM – myocardial infarction, PPI – proton-pump inhibitors, NS – nonsignifi cant.![Ovlivnění účinnosti, tj. snížení výskytu krvácení do trávicího traktu, a ovlivnění bezpečnosti, tj. mortality a vaskulárních
příhod, při komedikaci IPP k DAPT (ASA/klopidogrel) ve čtyřech randomizovaných studiích (n < 2 tis. pacient/roků).
Data převážně reprezentují výsledky studie COGENT. Není patrný dopad na vaskulární příhody, vzestup
celkové mortality nebyl statisticky významný. Pokles gastrointestinálního krvácení byl významný jak klinicky, tak statisticky
[29].<br>
CMP – cévní mozková příhoda, DAPT – duální protidestičková léčba, GI – gastrointestinální, KV mort. – kardiovaskulární
mortalita, IM – infarkt myokardu, IPP – inhibitory protonové pumpy, NS – statisticky nevýznamné.<br>
Graph 1. The effi cacy (reduction in gastrointestinal bleeding) and safety (mortality and vascular events) of PPI comedication
with DAPT (ASA/clopidogrel) in four randomised studies. The data mostly represents the results of the COGENT study. There
is no noticeable impact on vascular events, the increase in overall mortality was not statistically signifi cant. The decrease in
gastrointestinal bleeding was signifi cant both clinically and statistically [29].<br>
CMP – stroke, DAPT – dual antiplatelet therapy, GI – gastrointestinal, KV mort. – cardiovascular mortality, IM – myocardial infarction,
PPI – proton-pump inhibitors, NS – nonsignifi cant.](https://pl-master.mdcdn.cz/media/image_pdf/93e646a41f3b9888766ec9bec4508c50.png?version=1609712327)
Graf 2. Ovlivnění účinnosti, tj. snížení výskytu krvácení do trávicího traktu a ovlivnění bezpečnosti, tj. mortality a vaskulárních příhod při komedikaci IPP k DAPT (ASA/klopidogrel) ve 35 observačních studiích (n > 500 tis. parientů/roků). Je patrný vzestup celkové i vaskulární mortality, stejně jako zvýšení vaskulárních příhod. Pokles gastrointestinálního krvácení nebyl statisticky významný [29].
CMP – cévní mozková příhoda, DAPT – duální protidestičková léčba, GI – gastrointestinální, KV mort. – kardiovaskulární mortalita, IM – infarkt myokardu, IPP – inhibitory protonové pumpy, NS – statisticky nevýznamné.
Graph 2. The effi cacy (reduction in gastrointestinal bleeding) and safety (mortality and vascular events) of PPI comedication with DAPT (ASA/clopidogrel) in 35 observational studies. There is a noticeable increase in both general and vascular mortality, as well as an increase of vascular events. The decrease in gastrointestinal bleeding was not statistically signifi cant [29].
CMP – stroke, DAPT – dual antiplatelet therapy, GI – gastrointestinal, KV mort. – cardiovascular mortality, IM – myocardial infarction, PPI – proton-pump inhibitors, NS – nonsignifi cant.![Ovlivnění účinnosti, tj. snížení výskytu krvácení do trávicího traktu a ovlivnění bezpečnosti, tj. mortality a vaskulárních
příhod při komedikaci IPP k DAPT (ASA/klopidogrel) ve 35 observačních studiích (n > 500 tis. parientů/roků). Je
patrný vzestup celkové i vaskulární mortality, stejně jako zvýšení vaskulárních příhod. Pokles gastrointestinálního krvácení
nebyl statisticky významný [29].<br>
CMP – cévní mozková příhoda, DAPT – duální protidestičková léčba, GI – gastrointestinální, KV mort. – kardiovaskulární
mortalita, IM – infarkt myokardu, IPP – inhibitory protonové pumpy, NS – statisticky nevýznamné.<br>
Graph 2. The effi cacy (reduction in gastrointestinal bleeding) and safety (mortality and vascular events) of PPI
comedication with DAPT (ASA/clopidogrel) in 35 observational studies. There is a noticeable increase in both general and
vascular mortality, as well as an increase of vascular events. The decrease in gastrointestinal bleeding was not statistically signifi
cant [29].<br>
CMP – stroke, DAPT – dual antiplatelet therapy, GI – gastrointestinal, KV mort. – cardiovascular mortality, IM – myocardial infarction,
PPI – proton-pump inhibitors, NS – nonsignifi cant.](https://pl-master.mdcdn.cz/media/image_pdf/e9600241d764e432ca3395ce368e8d55.png?version=1609712370)
Shrneme-li data o lékových interakcích IPP s protidestičkovou léčbou, trvá naléhavé podezření na významné snížení efektu ASA (je-li podáván v účinné rychle rozpustné formě). Efekt enterosolventních tablet, které doložitelný efekt postrádají, tak ovlivněn není. Současně trvá naléhavé podezření na významné snížení účinku klopidogrelu i na významné snížení efektu duální protidestičkové léčby. Snaha snížit výskyt krvácení do trávicího traktu tak vede i ke ztrátě terapeutického efektu, minimálně jeho části. Vlastní snížení rizika krvácení do horní části trávicího traktu se zdá být zcela logické, nicméně bylo přítomno jen v části retrospektivních studií. Kontrolovaná randomizovaná megastudie COMPASS – pantoprazolová větev však významný efekt na pokles hemoragických příhod neprokázala, tato studie bude diskutována dále.
Doručeno/Submitted: 19. 6. 2020
Přijato/Accepted: 15. 7. 2020
prof. MUDr. Jan Bultas, CSc.
Ústav farmakologie 3. LF UK v Praze
Ruská 87
100 00 Praha 10
Konflikt zájmů: Autor deklaruje, že text článku odpovídá etickým standardům, byla dodržena anonymita pacientů a prohlašuje, že v souvislosti s předmětem článku nemá
finanční, poradenské ani jiné komerční zájmy.
Publikační etika: Příspěvek nebyl dosud publikován ani není v současnosti zaslán do jiného časopisu pro posouzení. Autor souhlasí s uveřejněním svého jména a e-mailového
kontaktu v publikovaném textu.
Dedikace: Článek není podpořen grantem ani nevznikl za podpory žádné společnosti.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Conflict of Interest: The author declares that the article/manuscript complies with ethical standards, patient anonymity has been respected, and he states that he has no
financial, advisory or other commercial interests in relation to the subject matter.
Publication Ethics: This article/manuscript has not been published or is currently being submitted for another review. The author agrees to publish his name and e-mail in the
published article/manuscript.
Dedication: The article/ manuscript is not supported by a grant nor has it been created with the support of any company.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Zdroje
1. Spugnini EP, Citro G, Fais S. Proton pump inhibitors as anti vacuolar-ATPases drugs. J Exp Clin Cancer Res 2010; 29 (1): 44. doi: 10.1186/1756-9966-29-44.
2. Beyenbach KW, Wieczorek H, The V-type H+ ATPase: molecular structure and function, physiological roles and regulation. J Exp Biol 2006; 209 (Pt 4): 577–589. doi: 10.1242/jeb.02 014.
3. Whitton B, Okamoto H, Packham G et al. Vacuolar ATPase as a potential therapeutic target and mediator of treatment resistence in cancer. Cancer Med 2018; 7 (8): 3800–3811. doi: 10.1002/cam4.1594.
4. Ariel H, Cooke JP. Cardiovascular risk of proton pump inhibitors. Methodist Debakey Cardiovasc J 2019; 15 (3): 214–219. doi: 10.14797/mdcj-15-3-214.
5. Duan X, Yang S, Zhang L et al. V-ATPases and osteoclasts: ambiguous future of V-ATPases inhibitors in osteoporosis. Theranostics 2018; 8 (19): 5379–5399. doi: 10.7150/thno.28391.
6. Huijgen NA, de Ridder MAJ, Verhamme KM et al. Are proton-pump inhibitors harmful for the semen quality of men in couples who are planning pregnancy? Fertil Steril 2016; 106 (7): 1666–1672. doi: 10.1016/j.fertnstert. 2016.09.010.
7. Wright SH. Molecular and cellular physiology of organic cation transporter 2. Am J Physiol Renal Physiol 2019; 317 (6): F1669–F1679. doi: 10.1152/ajprenal.00422.2019.
8. Tommasi S, Elliot DJ, Hulin JA et al. Human dimethylarginine dimethylaminohydrolase 1 inhibition by proton pump inhibitors and the cardiovascular risk marker asymmetric dimethylarginine: in vitro and in vivo significance. Sci Rep 2017; 7 (1): 2871. doi: 10.1038/s41598-017-03069-1.
9. Kruszelnicka O, Swierszcz J, Bednarek J et al. Asymmetric dimethylarginine versus proton pump inhibitors usage in patients with stable coronary artery disease: a cross-sectional study. Int J Mol Sci 2016; 17 (4): 454. doi: 10.3390/ijms1704 0454.
10. Shin JM, Kim N, Pharmacokinetics and pharmacodynamics of the proton pump inhibitors. J Neurogastroenterol Motil 2013; 19 (1): 25–35. doi: 10.5056/jnm.2013.19.1.25.
11. Hussaarts GAM, Marijn Veerman GD, Jansman FGA et al. Clinically relevant drug interactions with multikinase inhibitors: a review. Ther Adv Med Oncol 2019; 11 : 1758835918818347. doi: 10.1177/1758835918818347.
12. Makunts T, Cohen IV, Awdishu L et al. Analysis of postmarketing safety data for proton-pump inhibitors reveals increased propensity for renal injury, electrolyte abnormalities, and nephrolithiasis. Sci Rep 2019; 9 (1): 2282. doi: 10.1038/s41598-019-39335-7.
13. Wedemeyer RS, Blume H. Pharmacokinetic drug interaction profiles of proton pump inhibitors: an update. Drug Saf 2014; 37 (4): 201–211. doi: 10.1007/s40264-014-0144-0.
14. Strand DS, Kim D, Peura DA. 25 years of proton pump inhibitors: a comprehensive review. Gut Liver 2017; 11 (1): 27–37. doi: 10.5009/ gnl15502.
15. Zvyaga T, Chang SY, Chen C et al. Evaluation of six proton pump inhibitors as inhibitors of various human cytochromes P450: focus on cytochrome P450 2C19. Drug Metab Dispos 2012; 40 (9): 1698–1711. doi: 10.1124/dmd.112.045575.
16. Li L, Geraghty OC, Mehta Z et al. Age-specific risks, severity, time course, and outcome of bleeding on long-term antiplatelet treatment after vascular events: a population-based cohort study. Lancet 2017; 390 (10093): 490–499. doi: 10.1016/S0140-6736 (17) 30770-5.
17. Kuwayama T, Osanai H, Ajioka M et al. Influence of proton pump inhibitors on blood dabigatran concentrations in Japanese patients with non-valvular atrial fibrillation. J Arrhythm 2017; 33 (6): 619–623. doi: 10.1016/j.joa.2017.07. 013.
18. Stangier J, Stähle H, Rathgen K et al. Pharmacokinetics and pharmacodynamics of the direct oral thrombin inhibitor dabigatran in healthy elderly subjects. Clin Pharmacokinet 2008; 47 (1): 47–59. doi: 10.2165/00003088-200 847010-00005.
19. Bolek T, Samoš M, Stančiaková L et al. The impact of proton pump inhibition on dabigatran levels in patients with atrial fibrillation. Am J Ther 2019; 26 (3): e308Apr 25. doi: 10.1097/MJT.0000000000000599.
20. Pradaxa 75 mg, SUMMARY OF PRODUCT CHARACTERISTICS [online]. Available from: https: //www.ema.europa.eu/documents/ product-information/pradaxa-epar-product-information_cs.pdf.
21. Connolly SJ, Ezekowitz MD, Yusuf S et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361 (12): 1139–1151.
22. Bultas J. Kyselina acetylsalicylová – stále neotřesitelné postavení i v roce 2018? Remedia 2018; 28 : 127–136.
23. Bultas J, Karetová D. Enterosolventní forma kyseliny acetylsalicylové – ano, či ne? Remedia 2017; 27 : 145–151.
24. Charlot M, Grove EL, Hansen PR et al. Proton pump inhibitor use and risk of adverse cardiovascular events in aspirin treated patients with first time myocardial infarction: nationwide propensity score matched study. BMJ 2011; 342: d2690. doi: 10.1136/bmj.d2690.
25. Demcsak A, Lantos T, Balint ER et al. PPIs are not responsible for elevating cardiovascular risk in patients on clopidogrel – a systematic review and meta-analysis. Front Physiol 2018; 9 : 1550. doi: 10.3389/fphys.2018.01550.
26. Bhatt DL, Cryer BL, Contant CF et al. Clopidogrel with or without omeprazole in coronary artery disease. N Engl J Med 2010; 363 (20): 1909–1917. doi: 10.1056/NEJMoa1007964.
27. Moayyedi P, Eikelboom JW, Bosch J et al. Pantoprazole to prevent gastroduodenal events in patients receiving rivaroxaban and/or aspirin in a randomized, double-blind, placebo-controlled trial. Gastroenterology 2019; 157 (2): 403–412. doi: 10.1053/j.gastro.2019.04.041.
28. Melloni C, Washam JB, Jones WS et al. Conflicting results between randomized trials and observational studies on the impact of proton pump inhibitors on cardiovascular events when coadministered with dual antiplatelet therapy: a systematic review. Circ Cardiovasc Qual Outcomes 2015; 8 (1): 47–55. doi: 10.1161/CIRCOUTCOMES.114.001177.
29. Khan SU, Lone AN, Asad ZU et al. Meta-analysis of efficacy and safety of proton pump inhibitors with dual antiplatelet therapy for coronary artery disease. Cardiovasc Revasc Med 2019; 20 (12): 1125–1133. doi: 10.1016/j.carrev.2019.02.002.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Gastroenterologie v době pandemie covid-19
- Gastrointestinální onkologie
- Kvíz z klinické praxe
- Surveillance of hepatocellular carcinoma in Slovakia
- Prediktory pokročilé kolorektální neoplazie ve screeningu kolorektálního karcinomu – průběžné výsledky multicentrické prospektivní studie
- Současné možnosti predikce léčebné odpovědi na neoadjuvantní chemoradioterapii u karcinomu konečníku
- Fenotyp akútneho hepatálneho zlyhania pri inaparentnom malobunkovom karcinóme pľúc
- Prevalencia hypovitaminózy D a poruchy glukózovej tolerancie u pacientov s neuroendokrinnými tumormi podstupujúcich liečbu somatostatínovými analógmi
- Covid-19 a hepatogastroenterologie
- Srdeční selhání u pacientky s cirhotickou kardiomyopatií jako neobvyklá indikace k transplantaci jater
- První použití single-use duodenoskopu v České republice
- Inhibitory protonové pumpy – známe je dobře? Jsou skutečně tak bezpečné? – část 1
- Kreditovaný autodidaktický test: gastrointestinální onkologie
- Prof. MUDr. Jiří Ehrmann, CSc., osmdesátiletý
- Nová členka redakční rady MUDr. Kristýna Zárubová
- Výběr z mezinárodních časopisů
- Budesonid v léčbě idiopatických střevních zánětů
- Primární biliární cholangitida – zacíleno na farnesoidní X receptor
- Správná odpověď na kvíz Endometrióza postihující serózní povrch (okruží) terminálního ilea
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Inhibitory protonové pumpy – známe je dobře? Jsou skutečně tak bezpečné? – část 1
- Budesonid v léčbě idiopatických střevních zánětů
- Nová členka redakční rady MUDr. Kristýna Zárubová
- Prediktory pokročilé kolorektální neoplazie ve screeningu kolorektálního karcinomu – průběžné výsledky multicentrické prospektivní studie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



