-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Možnosti nefarmakologické léčby epilepsie u dětí
Non-pharmacological treatment methods in children with epilepsy
Over 70,000 people with active epilepsy, of which 30% with drug-resistant form – that‘s the situation in the Czech Republic, which makes epilepsy a serious health and socio-economic problem. However, even most of these patients can be helped by non-pharmacological treatment – surgically (= epileptosurgery) or using a ketotherapy. Both modalities are fully established in therapeutic management of epilepsies and their provision falls within the competence of specialized epilepsy centres.
Following article briefly summarizes the basic principles, efficacy, limitations and practical aspects
of treatment in both areas.Keywords:
Epilepsy – pharmacoresistance – drug-resistance – epilepsy surgery – ketotherapy – ketogenic diet
Autori: O. Horák
Pôsobisko autorov: Klinika dětské neurologie LF MU a FN Brno, Centrum pro epilepsie Brno, EU referenční centrum
Vyšlo v časopise: Čes-slov Pediat 2019; 74 (3): 146-152.
Kategória: Sympozium: dětská neurologie
Súhrn
Přes 70 000 lidí s aktivní epilepsií, z toho 30 % s epilepsií farmakorezistentní – to je současná situace v České republice, která činí z epilepsie závažný problém zdravotní, sociální i ekonomický. I většině těchto pacientů však lze významně pomoci správně zvolenou a vhodně načasovanou léčbou nefarmakologickou – operační (= epileptochirurgie) nebo dietní (= ketoterapie). Obě modality jsou dnes standardní součástí terapeutického managementu epilepsií a náleží do kompetence specializovaných epileptologických center.
Následující text stručně sumarizuje základní principy, účinnost, limitace i praktické aspekty léčby v obou oblastech.
Klíčová slova:
epilepsie – farmakorezistence – odolnost vůči lékům – epileptochirurgie – ketoterapie – ketogenní dieta
ÚVOD
Epilepsie je nejčastější ze všech závažných neurologických onemocnění, a to jak v dospělosti, tak v dětství. Incidence se ve vyspělých zemích pohybuje mezi 24–53/100 000 za rok, v rozvojových zemích v hodnotách až trojnásobně vyšších. Prevalence aktivní epilepsie, tzn. poměrný počet pacientů s epilepsií, kteří v posledních pěti letech prodělali alespoň jeden epileptický záchvat, je v populaci asi 0,5–1 %. V České republice tak v současnosti žije přes 70 000 pacientů s aktivní epilepsií, přičemž nezanedbatelné procento z tohoto vysokého čísla tvoří děti všech věkových kategorií. Je tedy neoddiskutovatelné, že epilepsie představují významný zdravotnický, sociální i ekonomický problém [1], což je umocněno obzvláště u epilepsií obtížně kompenzovatelných, resp. farmakorezistentních.
Jak naznačuje plurál v předchozí větě, epilepsií a epileptických syndromů je celá řada. Liší se typem záchvatů, etiologií, věkem manifestace (a ev. i věkem spontánní remise), komorbiditami a dalšími aspekty vč. těch prognostických. Současná, mezinárodní ligou proti epilepsii (International League Against Epilepsy; ILAE) recentně významně revidovaná klasifikace epilepsií rozlišuje epilepsie „v první linii“ podle povahy záchvatů na fokální, generalizované, kombinované (generalizované a fokální) a neznámého typu, a podle etiologie na strukturální, genetické, metabolické, autoimunitní, infekční a neznámé (= neobjasněné) [2]. „Druhou linií“ klasifikačního algoritmu je pak (pokud je to možné) zpřesnění diagnózy zařazením do některého z definovaných epileptických syndromů – ať již věkově vázaných (typicky dětské a adolescentní elektro-klinické syndromy jako např. benigní sporadické/familiární novorozenecké záchvaty, benigní epilepsie s centro-temporálními hroty, myoklonicko-atonická epilepsie, dětské absence, Westův či Lennox-Gastautův syndrom, juvenilní myoklonická epilepsie aj.), nebo sdružujících charakteristický klinický obraz se specifickým etiologickým substrátem (typicky např. mesiotemporální epilepsie na podkladě hipokampální sklerózy; MTLE/HS). Formální ILAE klasifikace epileptických syndromů sice neexistuje, povětšinou jsou ale tyto syndromy vcelku jasně definované a v klinické praxi dobře zaužité.
Správná syndromologická diagnóza není zdaleka vždy možná, je ale velmi užitečná, a proto bychom se o ni vždy měli maximálně snažit. V mnoha případech totiž významně ovlivňuje volbu terapeutického postupu a více či méně determinuje i celkovou prognózu, tzn. napomáhá mj. v následujících rozvahách:
- jedná se o epileptický syndrom se spontánní remisí x epileptickou encefalopatii se všemi neblahými kognitivně-behaviorálními konsekvencemi x celoživotní epilepsii s/bez komorbidit?
- je předpoklad farmakoresponzivity x farmakorezistence?
- lze předpokládat benefit konkrétního antiepileptika x časné epileptochirurgie x paliativní epileptochirurgie x ketoterapie?
OBECNÉ PRINCIPY LÉČBY EPILEPSIÍ A STANOVENÍ FARMAKOREZISTENCE
Metodou volby u všech pacientů s nově diagnostikovanou epilepsií je farmakoterapie – v prvním kroku monoterapie antiepileptikem první volby ve vztahu k typu epileptického záchvatu a/nebo ve vztahu k zvažovanému epileptickému syndromu (s výjimkou některých dětských syndromů s obecně příznivou prognózou, kde dlouhodobá antiepileptická léčba není mandatorní). Samozřejmostí jsou i často podceňovaná režimová opatření, která nabývají na důležitosti především v adolescenci, resp. u pacientů s idiopatickými generalizovanými epilepsiemi (IGE), u kterých jsou záchvaty poruchami životosprávy často provokované. V případě selhání první monoterapie volíme pak buď alternativní monoterapii, nebo léčbu kombinovanou. Správně vedená farmakoterapie dosahuje vysoké účinnosti – za předpokladu vhodné volby antiepileptika a dobré adherence pacienta dosahuje dlouhodobé kompenzace přibližně 70 % léčených pacientů [3]. U zbývajících cca 30 % však záchvaty navzdory adekvátní terapii přetrvávají a šance na dosažení dlouhodobé remise strmě klesá s počtem použitých (= neúčinných) antiepileptik – při nutnosti volby třetího léku se pohybuje kolem 10 %, podle některých prací dokonce mezi 3–9 % [4]. Proto již v případě selhání dvou vhodně zvolených, tolerovaných a řádně užívaných antiepileptik má být pacient v souladu s aktuálně platnou definicí ILAE považován za farmakorezistentního [5], a má být zvažován jako možný kandidát nefarmakologické léčby (NFL).
Mezi nefarmakologické postupy řadíme léčbu operační (= epileptochirurgie) a léčbu ketogenní dietou či jejími modifikacemi (= ketoterapie; KT). Obě modality jsou dnes standardní součástí terapeutického managementu u pečlivě vybraných dětí i dospělých s epilepsií, s dobře dokumentovanou účinností. Navzdory tomuto faktu je mezi pacienty stále vysoké procento těch, kteří jsou k NFL referováni pozdě, nebo dokonce vůbec. Přitom právě časové hledisko je u dětí s epilepsií velmi důležitým faktorem ovlivňujícím úspěšnost NFL, a to jak ve smyslu redukce počtu záchvatů, tak i v zajištění příznivého kognitivně-behaviorálního vývoje [6].
INDIKACE A DOSTUPNOST NEFARMAKOLOGICKÉ LÉČBY
Základním indikačním předpokladem NFL je naplnění kritérií farmakorezistence, ani to však neplatí zcela dogmaticky – typicky např. v případě resekčních operačních výkonů u benigních tumorů asociovaných s epilepsií, tzv. LEAT (Long-term Epilepsy-Associated Tumors), nebo v případě terapie ketogenní dietou u pacientů s myoklonicko-atonickou epilepsií, kde farmakorezistence již není striktní podmínkou; je tomu tak proto, že tyto jednotky mají obecně vysoké riziko rozvoje farmakorezistence a uvedená modalita NFL má u nich podstatně vyšší léčebný potenciál než léčba farmakologická) [7].
Jak epileptochirurgie, tak ketoterapie spadají do kompetencí specializovaných epileptologických center, disponujících zkušeným multioborovým týmem a komplementem vysoce specializovaných vyšetření. V České republice jsou toho času tři, Ministerstvem zdravotnictví uznaná centra vysoce specializované péče o pacienty s farmakorezistentní epilepsií (CVSP), z nichž dvě se zaměřují nejen na adultní, ale i dětskou epileptochirurgii – Centrum pro epilepsie Brno a Centrum pro epilepsie Motol [6]. Tato centra nabízejí kompletní paletu epileptochirurgických výkonů a samozřejmě také kvalitní předchirurgickou diagnostiku, která je pro výsledný efekt operace zcela zásadní.
Ketoterapii se v České republice nejdéle a „tradičně“ věnují také tři pracoviště – Klinika dětského a dorostového lékařství 1. LF UK a VFN v Praze, Neurologické oddělení Thomayerovy nemocnice v Praze a Klinika dětské neurologie LF MU a FN v Brně, přičemž první jmenované se zaměřuje na KT u vybraných dědičných metabolických chorob, druhá dvě pak na KT již přímo v epileptologii.
Důležitou úlohou menších center a ambulantních dětských neurologů (popř. i pediatrů) je prvotní selekce potenciálních kandidátů NFL mezi dispenzarizovanými pacienty a jejich včasné odeslání do center k bližšímu posouzení. Důraz je přitom kladen zejména na včasnost, a to především u pacientů s předpokladem možnosti operačního výkonu s kurativním záměrem. Zkrácení doby trvání epilepsie do podstoupení operačního výkonu je totiž jeden z nejsilnějších prediktorů úspěšnosti [7].
EPILEPTOCHIRURGIE
Moderní epileptochirurgie nabízí možnost pomoci většině pacientů s refrakterní epilepsií, a to i u dětí nejmladších věkových kategorií [6]. Úspěšnost resekčních výkonů je ve specializovaných centrech vysoká – jako Engel Ia, tzn. zcela bez záchvatů, je dva roky po operaci klasifikováno 70–74 % pacientů [8, 9], v pět let sledovaných souborech pak s podstatně větší variabilitou 50–60 % pacientů [10, 11]. Nejlepší prognózu mají obecně pacienti s LEAT, tj. pacienti s epilepsií na podkladě benigních glioneurálních tumorů, kteří dosahují dlouhodobé klinické remise v 80–90 % případů [6]. Příznivou prognózu mají také pacienti s mesiotemporální epilepsií na podkladě hipokampální sklerózy, ti však bývají operovaní častěji v dospělém než dětském věku. Úspěšnost funkční hemi-
sferektomie se pohybuje mezi 61–80 % [12].Tato čísla jsou v posledních třech dekádách prakticky neměnná, což by na první pohled mohlo být považováno za neúspěch nebo jakousi stagnaci namísto přirozeně očekávaného progresu v duchu všeobecného medicínského pokroku. Vysvětlení spočívá v nepochybném proporcionálním poklesu „jednodušších“ temporálních resekcí a naopak nárůstu složitějších výkonů u pacientů s extratemporálními nelezionálními (přesněji MR-negativními) epilepsiemi a epilepsiemi na podkladě fokální kortikální dysplazie II. typu (FCD II). Tento trend je obecný a je nejspíše zapříčiněn technickým pokrokem v zobrazovacích a funkčních metodách, větší dostupností invazivního EEG monitorování a v neposlední řadě také „odvážnější“ strategií epileptologických center [6].
Dalším obecným trendem je narůstající počet epileptochirurgických výkonů v mladších věkových kategoriích, což souvisí s pravděpodobně nejvýraznější tendencí v epileptochirurgii vůbec. Tou je snaha o zkrácení doby trvání epilepsie před operačním zákrokem (tzv. časná epileptochirurgie) – ta je nezávislým prediktorem jak dosažení bezzáchvatovosti [9, 13], tak i příznivého kognitivního vývoje [6, 14].
ROZDĚLENÍ EPILEPTOCHIRURGICKÝCH VÝKONŮ
Epileptochirurgické zákroky dělíme „dle cíle a očekávání“ na kurativní a paliativní. Mezi kurativní zákroky, jejichž cílem je odstranění epileptických záchvatů a tudíž úplné vyléčení pacienta, řadíme především zákroky resekční a hemisferektomie. Mezi paliativní zákroky, jejichž primárním cílem je snížení počtu záchvatů
a/nebo redukce záchvatů pacienta nejvíce ohrožujících, patří tradičně různé typy stimulací – vagová (vagus nerve stimulation, VNS) nebo hluboká mozková (deep brain stimulation, DBS), kalosotomie a mnohočetné subpiální transsekce (multiple subpial transections, MST) [15]. Paliativní výkony obvykle nevedou ke 100% klinické remisi, mohou však významně zlepšit kvalitu života (QoL) pacienta [7]. Přehled epileptochirurgických výkonů je uveden v tabulce 1.Tab. 1. Rozdělení epileptochirurgických výkonů 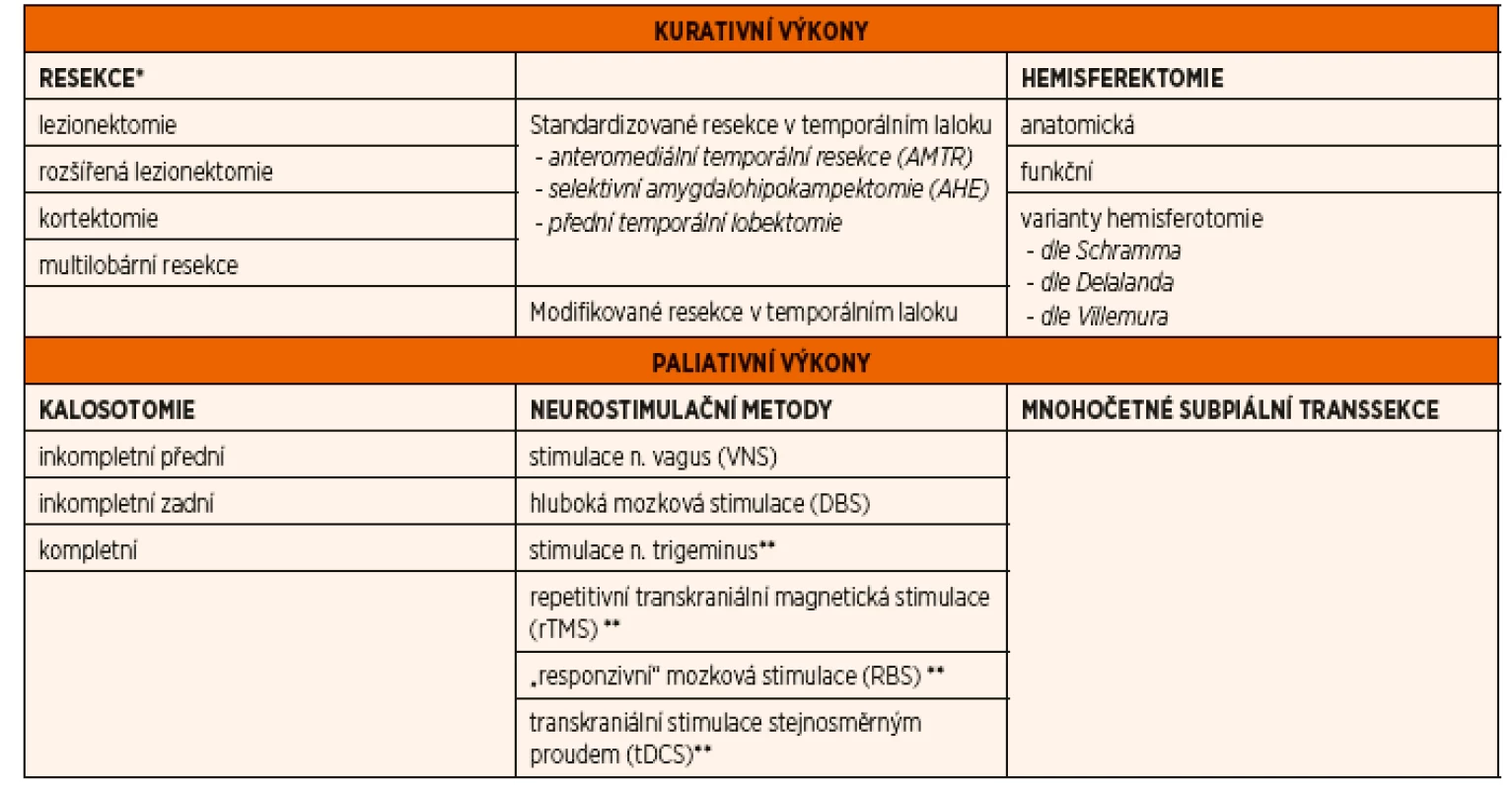
*v prvním sloupci je uvedeno obecné dělení podle typu výkonu, tzn. platné pro extratemporální (exTLE) i temporální (TLE) epilepsie
**experimentální metodyRESEKČNÍ ZÁKROKY A ZÁKLADNÍ PRINCIPY PŘEDOPERAČNÍ DIAGNOSTIKY
(upraveno dle [7])
Podstatou resekčních výkonů je úplné odstranění tzv. epileptogenní zóny (EZ) – funkčně změněné části mozku, přímo zodpovědné za generování klinických epileptických záchvatů. Cílem resekčních výkonů je dosažení bezzáchvatovosti, ovšem bez způsobení nepřijatelného neurologického deficitu. Předoperační diagnostika proto spočívá v co nejpřesnějším vymezení předpokládané EZ a jejího vztahu k elokventním oblastem, tzn. oblastem, které by měly být výkonem ušetřeny [15]. EZ je hypotetický koncept, neexistuje tudíž žádné vyšetření, které by její rozsah přesně stanovilo.
V předchirurgické přípravě proto využíváme informací z celé řady „standardních“ i vysoce specializovaných vyšetření, z nichž za naprosto základní a tudíž nutné považujeme:
- neinvazivní video-EEG monitoraci (popř. semiinvazivní video-EEG monitoraci s přídatnými sfenoidálními elektrodami) se záchytem pro pacienta habituálních záchvatů,
- MRI mozku (minimálně 1,5 T) ve speciálním epileptologickém protokolu a
- psychologické vyšetření.
Často využívané jsou také různé funkčně zobrazovací metody (pozitronová emisní tomografie – PET, iktální/interiktální jednofotonová emisní tomografie – SPECT, magnetická rezonanční spektroskopie – MRS, funkční magnetická rezonance – fMRI), resp. koregistrační a pokročilé zobrazovací metody, z nichž nejcennější ve smyslu lokalizace epileptického záchvatu je SISCOM (subtrakce iktálního a interiktálního SPECT vyšetření, koregistrovaná na MRI – obr. 1).
Obr. 1. SISCOM – lokalizuje do levé frontální krajiny (v době vyšetření 14letá pacientka s farmakorezistentní epilepsií levého frontálního laloku; zóna počátku záchvatů dominantně v oblasti primárního motorického kortexu – verifikováno při následné invazivní EEG monitoraci pomocí subdurálního gridu; resekční výkon neindikován z důvodu jisté pooperační hemiparézy).
Fig. 1. SISCOM – localizes to the left frontal area (at the time of examination 14-y old girl with refractory left-sided frontal-lobe epilepsy; seizure onset zone predominantly in primary motor cortex – verified by subsequent invasive EEG exploration using subdural grid; resection was not performed for certain right-sided paretic deficit).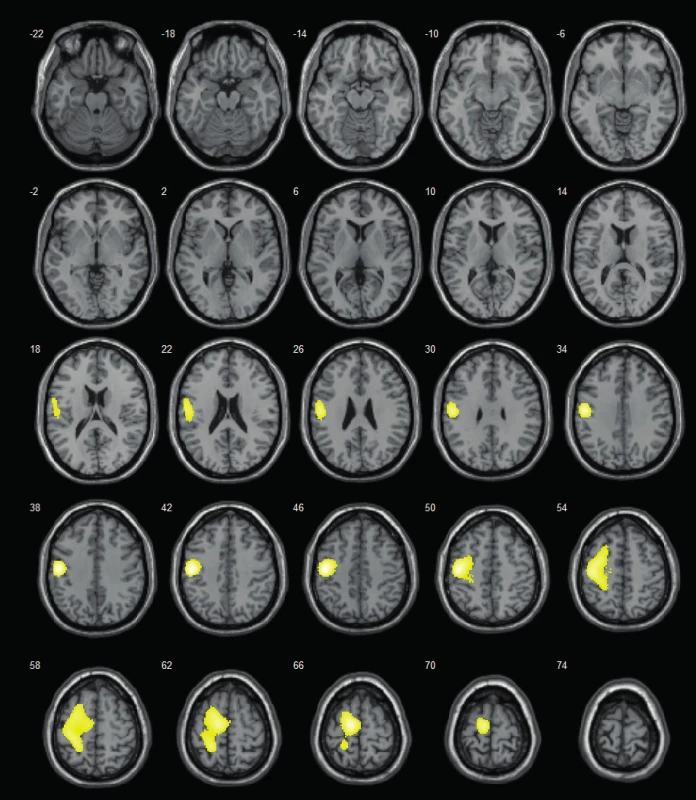
Naopak, fMRI patří mezi vyšetření, která napomáhají identifikovat elokventní oblasti mozku a tím spoluurčovat rozsah „bezpečné“ resekce. Ani s využitím těchto a dalších moderních neinvazivních metod (např. electrical souce imaging (ESI), voxel-based morfometry (VBM), cortical thickness analysis) nelze však často EZ stanovit s dostatečnou jistotou, a je proto nutná invazivní EEG monitorace.
Do invazivních EEG technik řadíme akutní (= peroperační) a dlouhodobou (= předoperační) monitoraci za pomocí:
- foramen ovale elektrod (4–6 kontaktů, lokalizace v blízkosti parahipokampálních gyrů, využití zejména u stranově nejasných meziotemporálních epilepsií),
- hlubokých (intracerebrálních – IC) elektrod (5–18 kontaktů, zavádění z jednotlivých návrtů jednostranně či oboustranně, využití u temporálních i extratemporálních epilepsií) (obr. 2–3) a/nebo
- subdurálních (SD) elektrod (tzv. stripy a gridy, 4–64 kontaktů, zavádění z otevřené kraniotomie, zpravidla pouze jednostranně, využití zejména u extratemporálních epilepsií a obecně v rámci peroperační elektrokortikografie – ECoG).
Obr. 2. Intracerebrální EEG elektrody krátce po implantaci (11letá pacientka s farmakorezistentní epilepsií pravého frontálního laloku na podkladě FCD II. typu).
Fig. 2. The intracerebral (depth) EEG electrodes shortly after implantation (11-y old girl with refractory right-sided frontal-lobe epilepsy conditioned by FCD II).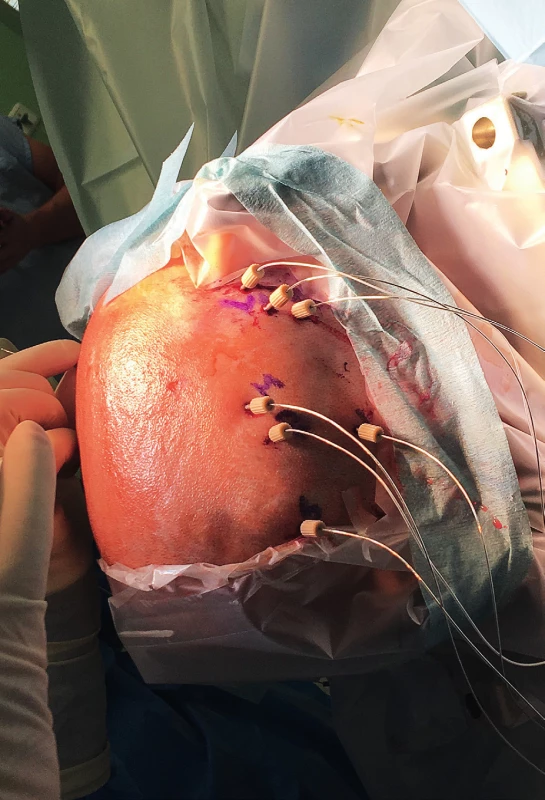
Obr. 3. Pozice intracerebrálních EEG elektrod na MRI mozku ve vztahu ke koregistrovanému maximu loko-regionálního FDG hypometabolismu dle SPM-PET analýzy metodikou asymmetry index (stejná pacientka jako na obr. 2).
Fig. 3. Position of intracerebral EEG electrodes on brain MRI scan in relation to co-registered regional FDG hypometabolism acc. to SPM-PET analysis by Assymetry Index Method (the same patient as on the fig. 2).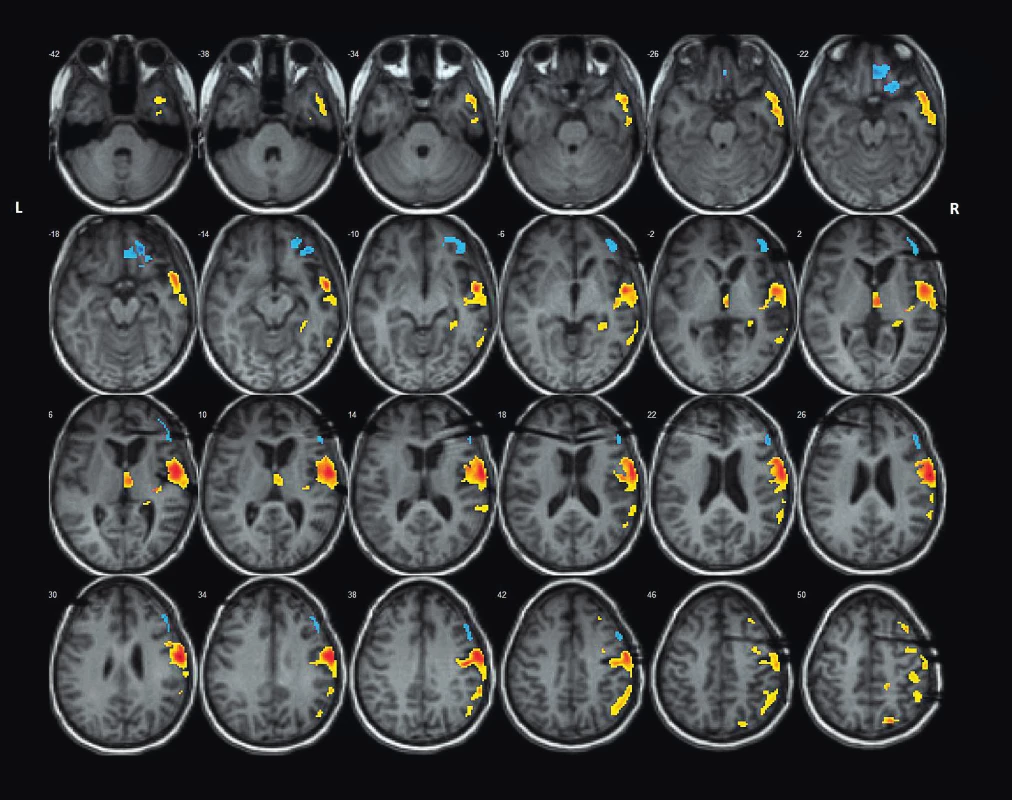
Volba konkrétního postupu a typu elektrod u konkrétního pacienta závisí na mnoha faktorech. Mezi nejpodstatnější z nich patří předpokládaná lokalizace EZ, potřeba funkčního mapování kortexu a současně také tradice a zkušenosti daného pracoviště [16]. Současný trend však významně favorizuje použití hlubokých elektrod před subdurálními.
Jako prostou lezionektomii označujeme odstranění makroskopicky (resp. pomocí operačního mikroskopu) detekovatelné abnormní tkáně, např. tumoru či kavernomu.
Rozšířená lezionektomie zahrnuje navíc resekci i přilehlého, makroskopicky nezměněného kortexu, který je součástí EZ. Součástí takového výkonu je logicky peroperační ECoG, která má klíčový význam v určení rozsahu kortikální resekce. Pod pojmem kortektomie pak rozumíme odstranění části kortexu, která je identifikována jako pravděpodobná EZ, nevykazuje však signálové MRI změny (hovoříme o „MRI-negativní“ epilepsii). Pro podrobný popis standardizovaných resekcí v temporálním laloku odkazuji na knihu Farmakorezistentní epilepsie [1, 15–18].
HEMISFEREKTOMIE/HEMISFEROTOMIE
Anatomická hemisferektomie, tj. chirurgické odstranění celé jedné mozkové hemisféry, byla v 70. letech minulého století pro závažné pozdní komplikace opuštěna a nahrazena hemisferektomií funkční, založené na preferenci diskonekčního principu nad anatomickou resekcí. Tato původní Rasmussenova technika byla pak v 90. letech dále modifikována do tzv. variant hemisferotomie (blíže viz tab. 1), které jsou v současnosti upřednostňovány ve většině center.
Jedná se o technicky náročné, radikální, na první pohled drastické a tudíž jen obtížně akceptovatelné výkony, které však mají nezastupitelné místo v léčbě některých katastrofických epileptických encefalopatií. Profitovat z nich mohou především pacienti s tzv. epileptickými hemisyndromy, charakterizovanými rozsáhlou hemisferální lézí (ať již statickou či progresivní, jako např. u Rasmussenovy encefalitidy), pre-existující kontralaterální hemiparézou a fokální epilepsií s vysokým rizikem rozvoje farmakorezistence a progresivní epileptogeneze se všemi důsledky [7]. Hemisferektomie v těchto případech představuje mnohdy jedinou možnost, jak zamezit pokračující celkové deterioraci dítěte a umožnit normální vývoj potenciálně zdravé hemisféry. I v „úspěšných“ případech však většina pacientů zůstává kognitivně v pásmu významného deficitu [17].
Celkový výsledek operace je dán i charakterem hemisferální léze (obecně nejlepší u časně destruktivních lézí, nejhorší u rozsáhlých malformací kortikálního vývoje) a v závislosti na něm také správným načasováním výkonu. S tím pak souvisí i ev. prohloubení paretického a/nebo řečového deficitu, nicméně, většina pacientů je samostatně chodící. Procento dosažení bezzáchvatovosti bylo uvedeno výše.
KALOSOTOMIE
Kalosotomie spočívá v úplném či většinovém protětí (= diskonexi) kalózního tělesa. Její účinnost je nejvyšší u atonických a tonických záchvatů (s difuzním, resp. bilaterálně synchronním EEG korelátem) u pacientů s Lennox-Gastautovým syndromem, kde ji však v posledních letech do značné míry nahrazuje vagová stimulace (VNS). Jde o paliativní metodu léčby, jejímž cílem bývá nejčastěji redukce výše zmíněných typů záchvatů, resultující v časté pády se zraněním.
STIMULACE NERVUS VAGUS
Dlouhodobá stimulace nervus vagus (VNS) je určena pro dětské i dospělé pacienty s refrakterní epilepsií, u kterých není možné indikovat resekční výkon. Jejím principem je přímá elektrická stimulace levého bludného nervu prostřednictvím bipolární elektrody, která je napojená na pulzní generátor uložený subkutánně v podklíčkové krajině. Elektrické impulzy jsou přenášeny aferentními vlákny nervus vagus do mozkového kmene, limbického systému a thalamo-kortikálních okruhů, kde ovlivňují synaptické aktivity různých neuronálních subpopulací, což je pravděpodobně podkladem protizáchvatového účinku [18].
Samotná implantace systému nepředstavuje náročný výkon. Nastavení stimulačních parametrů se provádí bezkontaktní přenosnou programovací hlavou, tedy bezbolestně a neinvazivně. Počet respondérů (tedy pacientů, u nichž dojde k více než 50% redukci záchvatů) po jednom roce od operace se pohybuje kolem 50 % a s délkou trvání chronické stimulace se mírně zvyšuje – u pacientů léčených v ČR dosáhlo procento respondérů po 5 letech vagové stimulace 64 % [19]. Šance na kompletní vymizení záchvatů je však velmi malá (kolem 5 % pacientů) [18]. U dětí jsou výsledky podobné nebo dokonce ještě o něco příznivější než u dospělých. Snížení počtu záchvatů není ale jediným kritériem hodnocení účinnosti – i u „non-respondéra“ může totiž dojít k zmírnění průběhu záchvatů, vymizení např. nejvíce limitujícího typu záchvatu a/nebo k pozitivnímu ovlivnění nálady či pozornosti [7].
KETOGENNÍ DIETA A JEJÍ MODIFIKACE (= KETOTERAPIE)
Všechny dietní režimy, založené na restrikci sacharidů a zvýšeném zastoupení tuků ve stravě, indukující v organismu alternativní energetický metabolismus spojený s navozením a dlouhodobým udržení ketózy, jsou dnes souhrnně označovány pojmem ketoterapie (KT) nebo také „metabolism-based therapy“ (MBT). Jedná se o klasickou ketogenní dietu (Ketogenic Diet – KD), dietu s triacylglyceroly se středně dlouhým řetězcem (Medium-chain Triglyceride Diet – MCT Diet), dietu s nízkým glykemickým indexem (The Low-Glycaemic Index Treatment – LGIT) a modifikovanou Atkinsovu dietu (Modified Atkins Diet – MAD).
Všechny uvedené typy KT více či méně odporují zásadám zdravé, racionální výživy a nelze je proto považovat za dietu v hovorovém slova smyslu, nýbrž za skutečnou a náročnou léčbu s mnoha riziky [20]. Klasická KD je známá téměř 100 let, širšího použití a uznání jako standardní léčebné metody v epileptologii se jí však dostalo až v posledních 20–30 letech. Své nezastupitelné místo má v dětské epileptologii, zejména v terapii infantilních spazmů (Westova syndromu), Lennox-Gastautova, Rettova a Dravetové syndromu, TSC (tuberous sclerosis complex) a myoklonicko-atonické epilepsie (MAE). Právě u MAE je efektivita KD nejvyšší (nezřídka vede i k plné klinické kompenzaci), a je proto stále častěji preferována před farmakoterapií. Klíčový význam má pak v léčbě dvou specifických syndromů – GLUT-1 deficience a deficitu pyruvát dehydrogenázy (PDHD), u kterých lze hovořit o terapii kauzální [7]. V poslední době narůstá využití také v akutních stavech, tj. v léčbě super-refrakterního status epilepticus vč. „Febrile Infection – Related Epilepsy Syndrome“ (FIRES), kde je účinnost ketoterapie ve srovnání s intravenózními antiepileptiky, anestetiky i různými typy imunoterapie nejvyšší, obzvláště v iniciálním stadiu nemoci [21].
KD tedy rozhodně není terapií výhradně farmakorezistentních epilepsií, natož pak terapií „poslední volby“, jak bývá někdy chápána. Naopak, dřívějších indikací přibývá [7]. Výčet klinických jednotek s nadprůměrnou účinností KT, u kterých je časná indikace plně opodstatněná, předkládá tabulka 2.
Tab. 2. Onemocnění a epileptické syndromy (abecedně uspořádané) s dokumentovaným nadprůměrným benefitem ketoterapie (alespoň o 20 % vyšší, než je obecně uváděný 50% průměr ve smyslu 50% redukce záchvatů). 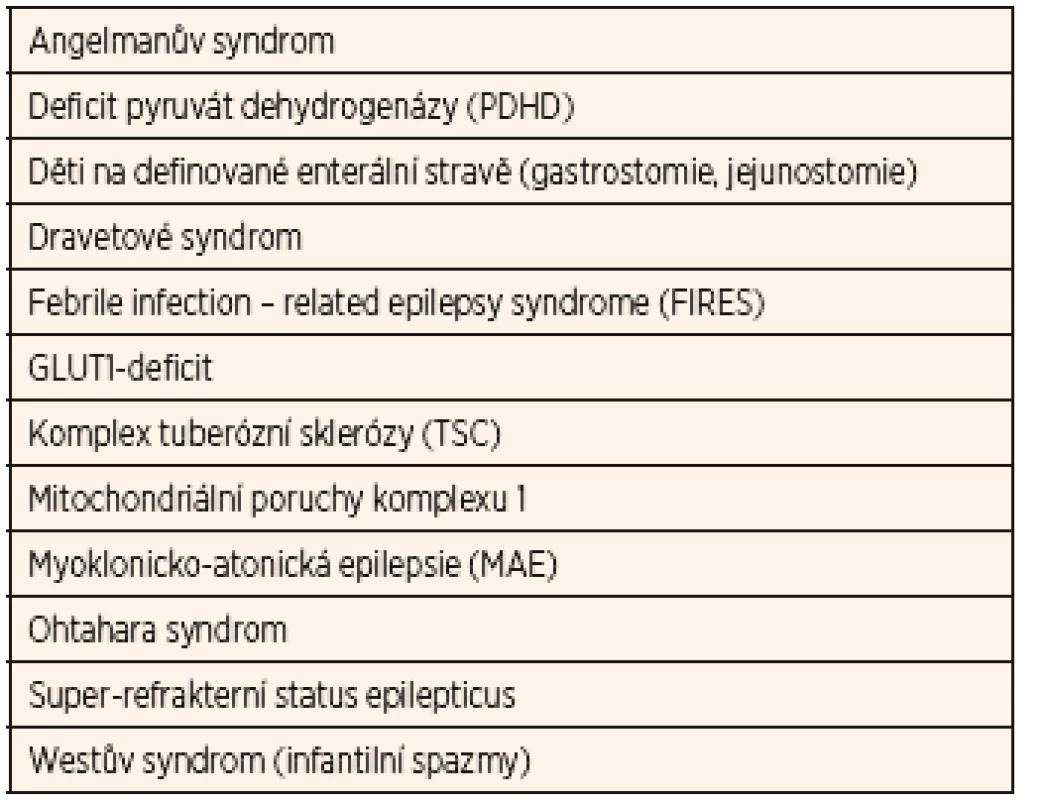
Převzato z Kossoff EH, Zupec-Kania BA, Auvin S, et al. Optimal clinical management of children receiving dietary therapies for epilepsy: Updated recommendations of the International Ketogenic Diet Study Group. Epilepsia Open 2018; 3 (2): 175–192. Účinnost KD u dětí je nezpochybnitelná. V současné době je již doložená čtyřmi kvalitními randomizovanými studiemi, které shodně potvrzují dříve deklarovanou efektivitu – přibližně 50 % respondérů (definováno jako alespoň 50% redukce záchvatů) a 15 % pacientů (míněno z celé kohorty) je zcela bez záchvatů [22–25]. Příznivý efekt je prokázán jak na generalizované, tak na fokální záchvaty. Základním předpokladem účinnosti je však správná selekce kandidátů, výběr vhodného nutričního režimu a velmi úzká spolupráce rodiny [7].
Klasická KD je velmi přísná dieta s extrémně vysokým obsahem tuků, velmi nízkým obsahem cukrů a ve své tradiční podobě i restrikcí kalorického příjmu. Je sestavována lékařem a nutričním specialistou, vždy individuálně pro konkrétního pacienta. Základními parametry, podmiňujícími výsledné složení jídelníčků jsou:
- ketogenní poměr – udává poměrné zastoupení makronutrientů, tj. tuků, cukrů a bílkovin ve stravě (např. 4 : 1 = 4 díly tuků na 1 díl bílkovin a cukrů),
- množství bílkovin,
- kalorický příjem a objem tekutin.
Iniciovat léčbu lze 12–72hodinovým hladověním („fasting“ protokoly) nebo graduovaně, tj. postupným navyšováním ketogenního poměru bez úvodního hladovění („non-fasting“ protokoly). „Fasting“ protokoly vedou k rychlejšímu navození ketózy a potenciálně tak k rychlejšímu nástupu antikonvulzivního účinku. „Non-fasting“ protokoly jsou naproti tomu zatíženy menším rizikem akutních komplikací (metabolická acidóza, zvracení, dehydratace, hypoglykémie). Z pohledu dlouhodobé účinnosti není úvodní hladovění nejspíše mandatorní. Nástup účinku lze při dobré compliance očekávat v horizontu 2 týdnů až několika měsíců. Není-li dieta efektní, přerušení má být zvažováno nejdříve po 3 měsících léčby (reálně po 5–6 měsících), v případě dobrého efektu pak po 2 letech. Dlouhodobé setrvání na léčbě je spojeno s vyšší nemocností, dyslipidémiemi, obstipací, častějším výskytem nefrolithiázy, hormonálních odchylek a osteoporózy [7].
U adolescentů (a alternativně i u mladších dětí) využíváme namísto klasické ketogenní diety benevolentnější modifikace, především MAD a LGIT. Management těchto diet je podstatně snažší, jídelníčky jsou chutnější a pro pacienta tedy přijatelnější. Účinnost MAD a LGIT je také poměrně dobře zdokumentovaná – v souhrnu platí, že procento respondérů je s klasickou KD srovnatelné, šance na úplnou klinickou remisi je však podstatně nižší. V praxi proto MAD považujeme za sice účinnou, ale spíše paliativní terapii, u dětských pacientů s předpokladem významného benefitu stále preferujeme iniciaci klasickou KD [20].
MUDr. Ondřej Horák
Klinika dětské neurologie LF MU a FN Brno
Centrum pro epilepsie Brno
Černopolní 9
613 00 Brno
e-mail: horak.ondrej@fnbrno.cz
Zdroje
1. Brázdil M, Hadač J. Definice farmakorezistentní epilepsie, příčiny intraktability. In: Brázdil M, Hadač J, Marusič P (eds). Farmakorezistentní epilepsie. Praha: Stanislav Juhaňák – Triton, 2011 : 12–22.
2. Scheffer IE, Berkovic S, Capovilla G, et al. ILAE classification of the epilepsies: Position paper of the ILAE Commission for Classification and Terminology. Epilepsia 2017 Apr; 58 (4): 512–521.
3. Brázdil M. Proměny epileptochirurgie ve 21. století. Neurol praxi 2015; 16 (2): 77–79.
4. Holland KD, Glauser TA. Response to carbamazepine in children with newly diagnosed partial onset epilepsy. Neurology 2007; 69 (6): 596–599.
5. Kwan P, Arzimanoglou A, Berg AT, et al. Definition of drug resistant epilepsy: consensus proposal by the ad hoc Task Force of the ILAE Commission on Therapeutic Strategies. Epilepsia 2010; 51 : 1069–1077.
6. Horák O. Dětská epileptochirurgie – specifika a současné trendy. Neurol praxi 2018; 19 (1): 11–15.
7. Horák O. Nefarmakologická léčba epilepsie u dětí. In: Ošlejšková H, et al. Aktuální kapitoly z dětské neurologie pro praxi. Olomouc: Solen, 2018 : 118–126.
8. Barba C, Specchio N, Guerrini R, et al. Increasing volume and complexity of pediatric epilepsy surgery with stable seizure outcome between 2008 and 2014: A nationwide multicenter study. Epilepsy & Behavior 2017; 75 : 151–157.
9. Lamberink HJ, Boshuisen K, Van Rijen PC, et al. Changing profiles of pediatric epilepsy surgery candidates over time: A natiowide single-center experience from 1990 to 2011. Epilepsia 2015; 56 (5): 717–725.
10. Cloppenborg T, May TW, Blümcke I, et al. Trends in epilepsy surgery: stable surgical numbers despite increasing presurgical volumes. J Neurol Neurosurg Psychiatry 2016; 87 : 1322–1329.
11. Hanáková P, Brázdil M, Novák Z, et al. Long-term outcome and predictors of resective surgery prognosis in patients with refractory extratemporal epilepsy. Seizure 2014; 23 : 266–273.
12. Baumgartner JE, Blout JP, Blauwblomme T, et al. Technical descriptions of four hemispherectomy approaches: From the Pediatric Epilepsy Surgery Meeting at Gothenburg 2014. Epilepsia 2017; 58 (Suppl 1): 46–55.
13. Simasathien T, Najm I, Gupta A, et al. Improved outcomes with earlier surgery for intractable frontal lobe epilepsy. Ann Neurol 2013; 73 (5): 646–654.
14. D’Argenzio LD, Colonnelli MCh, et al. Cognitive outcome after extratemporal epilepsy surgery in childhood. Epilepsia 2011; 52 (11): 1966–1972.
15. Marusič P, Brázdil M. Epileptochirurgické zákroky. Resekční zákroky. In: Brázdil M, Hadač J, Marusič P (eds). Farmakorezistentní epilepsie. Praha. Stanislav Juhaňák – Triton, 2011 : 1–207.
16. Brázdil M, Vojtěch Z. Semiinvazivní a invazivní video-EEG. In: Brázdil M, Hadač J, Marusič P (eds). Farmakorezistentní epilepsie. Praha: Stanislav Juhaňák – Triton, 2011 : 95–103.
17. Kršek P, Hadač J. Hemisferektomie. In: Brázdil M, Hadač J, Marusič P (eds). Farmakorezistentní epilepsie. Praha: Stanislav Juhaňák – Triton, 2011 : 220–222.
18. Brázdil M, Kalina M. Stimulace nervus vagus. In: Brázdil M, Hadač J, Marusič P (eds). Farmakorezistentní epilepsie. Praha: Stanislav Juhaňák – Triton, 2011 : 224–228.
19. Kuba R, Brázdil M, Kalina M, et al. Vagus nerve stimulation: Longitudinal follow-up of patients treated for 5 years. Seizure 2009; 18 : 269–274.
20. Horák O. Ketogenní dieta – účinná nefarmakologická léčba dětské a adolescentní epilepsie. Cesk Slov Neurol N 2019; 82 (1): 8–14.
21. Gaspard N, Hirsch LJ, Sculier C, et al. New-onset refractory status epilepticus (NORSE) and febrile infection-related epilepsy syndrome (FIRES): State of the art and perspectives. Epilepsia 2018; 59 (4): 745–752.
22. Neal EG, Chaffe HM, Schwartz R, et al. A randomised trial of classical and medium-chain triglyceride ketogenic diets in the treatment of childhood epilepsy. Epilepsia 2009; 50 (5): 1109–1117.
23. Freeman JM, Vining EP, Kossoff EH, et al. A blinded, crossover study of the efficacy of the ketogenic diet. Epilepsia 2009; 50 (2): 322–325.
24. Sharma S, Sankhyan N, Gulati S, et al. Use of the modified Atkins diet for the treatment of refractory childhood epilepsy: a randomized controlled trial. Epilepsia 2013; 54 (3): 481–486.
25. Lambrechts DA, de Kinderen RJ, Vles JS, et al. A randomized controlled trial of the ketogenic diet in refraktory childhood epilepsy. Acta Neurol Scand 2017; 135 (6): 231–239.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2019 Číslo 3- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Gastroezofageální reflux a gastroezofageální refluxní onemocnění u kojenců a batolat
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Editorial: Dětská neurologie
- Přehled nových, a ještě novějších léků na Duchennovu svalovou dystrofii a spinální svalovou atrofii
- Možnosti nefarmakologické léčby epilepsie u dětí
- Novorozenecké záchvaty
- Fibromuskulárna dysplázia u 2-ročného dieťaťa – kazuistika
- Klinické a laboratórne charakteristiky detí s orálnym alergickým syndrómom
- Primárna pľúcna hemosideróza – skúsenosti z Banskej Bystrice
- Závažné primární imunodeficience a možnosti jejich časné diagnostiky, uvedení testu TREC/KREC
- Životné jubileum prof. MUDr. Alexandra Jurka, DrSc. Srdce pre deti
- PUBLIKACE ČESKÝCH PEDIATRICKÝCH NEFROLOGŮ ZA POSLEDNÍ 4 ROKY V ČASOPISECH (HOME PUBMED)
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Závažné primární imunodeficience a možnosti jejich časné diagnostiky, uvedení testu TREC/KREC
- Primárna pľúcna hemosideróza – skúsenosti z Banskej Bystrice
- Přehled nových, a ještě novějších léků na Duchennovu svalovou dystrofii a spinální svalovou atrofii
- Fibromuskulárna dysplázia u 2-ročného dieťaťa – kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



