-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Detekcia regulačného proteínu p16/INK4A v dysplastickom dlaždicovom epiteli krčka maternice ako diagnostický nástroj prevencie karcinómu
Detection of Regulatory Protein p16/INK4A in the Dysplastic Cervical Squamous Cell Epithelium is a Diagnostic Tool for Carcinoma Prevention
Parallel sections from 423 randomly selected blocks representing biopsies of 178 women with the diagnosis of cervical dysplasia and/or erosion were stained for p16 polypeptide. The p16/INK4A (inhibitory kinase 4) protein is a cellular division regulator, expression of which increases in the presence of oncoprotein E7, encoded by human papillomavirus (HPV). Expression of p16 protein was seen in the nuclei and cytoplasm of dysplastic squamous epithelium cells as well as in carcinoma cells. In 16.6% of erosion cases, the p16 antigen was present in the basal and suprabasal layer of the surrounding squamous epithelium revealing features of CIN I/LSIL. In CIN I/LSIL as classified by HE staining, the p16 antigen was found in 65 out of 80 (81%) cases. The p16 protein was typically seen in dysplastic basal and suprabasal cells encompassing a confluent layer in the lowest third segment of stratified epithelium. In CIN II and CIN III grouped as HSIL, the positive rate of p16 antigen presence was 95% (in 45 cases out of 47) and/or 100% (in each of 27 cases), respectively. The typical sign of p16 antigen distribution in HSIL was its staining over two thirds and/or throughout the whole dysplastic epithelium. Extensive staining for p16 antigen was registered within nuclei as well as cytoplasm of neoplastic cells in all 6 cervical squamous cell carcinomas, which were examined in many sections when being used as positive controls. Based on our experience, we consider the p16 antigen staining a helpful tool indicating dysplastic cells and estimating their extent.
Key words:
human papillomavirus – cervical epithelium – CIN/SIL – p16 protein – immunohistochemical staining
Autori: J. Rajčáni 1; M. Adamkov 2; J. Hybenová; E. Moráveková; Ľ. Lauko; D. Felcanová; M. Benčat
Pôsobisko autorov: Laboratórium patologickej anatómie, Alpha Medical a. s., Martin ; Virologický ústav SAV, Bratislava, emeritný vedecký pracovník 1; Ústav histológie a embryológie Jesseniovej LFUK, Martin 2
Vyšlo v časopise: Čes.-slov. Patol., 45, 2009, No. 4, p. 101-107
Kategória: Původní práce
Súhrn
V paralelných rezoch zo 423 náhodne vybraných bločkov v bioptickom materiáli pochádzajúcom od 178 pacientok s diagnózou dysplázia epitelu alebo erózia krčka maternice sme vykonali imunohistochemické farbenie na polypeptid p16. Proteín p16/INK4A (inhibitor kinase 4) je regulátor bunkového delenia, ktorého syntéza stúpa v prítomnosti onkoproteínu E7, kódovaného papilovírusmi ľudí (HPV). Expresiu proteínu p16 sme pozorovali v jadrách ako aj v cytoplazme dysplastických buniek dlaždicového epitelu ako aj buniek karcinómu. Pri 16,6 % prípadov erózii sme pozorovali zreteľnú pozitivitu antigénu p16 v bazálnych a suprabazálnych bunkách okolitého nerohovatejúceho dlaždicového epitelu, ktorý niesol znaky CIN I/LSIL. Pri CIN I/LSIL sme z celkového počtu 80 vyšetrených prípadov pozorovali pozitívne farbenie na antigén p16 v 65 (81 %) prípadoch. Typickým nálezom bola prítomnosť antigénu p16 v dysplastických bazálnych a suprabazálnych bunkách vytvárajúcich kontinuálnu vrstvu v spodnej tretine epitelu. Pri CIN II/HSIL ako aj pri CIN III/ HSIL sme nachádzali antigén p16 v 95 % (45/47), respektíve až v 100 % (27/27) všetkých vyšetrených prípadov. Typickým znakom bola distribúcia antigénu p16 vo viac ako jednej tretine zmeneného epitelu alebo difúzna lokalizácia v celej jeho šírke. Intenzívne farbenie na proteín p16 sme pozorovali v jadrách a v cytoplazme nádorových buniek pri 6 karcinómoch krčka maternice, ktorých bločky boli vyšetrené v desiatkach rezov ako pozitívne kontroly. Na základe predkladaných skúseností možno povedať, že farbenie na antigén p16 je dobrou diagnostickou pomôckou, ktorá upozorní na prítomnosť dysplázie i na jej rozsah.
Kľúčové slová:
papilómavírus ľudí (HPV) – epitel krčka maternice – CIN/SIL – proteín p16 – imunohistochemické farbenieÚvod
Papilomavírusy ľudí a zvierat sú malé neobalené vírusy (priemer 55 nm) obsahujúce dvojvláknovú DNA (9, 32). Virióny (častice vírusu) majú ikozaedrovú symetriu; sú zložené zo 72 podjednotiek, tvorených štruktúrnymi bielkovinami kapsidu L1 a L2 (odvodené od slova late, t.j. neskoré bielkoviny). Vo vnútri kapsidu sa nachádza dvojvláknová dsDNA pozostávajúca z približne 8000 bázových párov (bp). Tá okrem dvoch bielkovín kapsidu kóduje najmenej 7 (niekedy 8) neštruktúrnych proteínov označovaných ako E1-E8 (od slova early, skoré bielkoviny). Prepis vírusových génov (syntéza vírusovej mRNA) je riadený promótormi v dlhej kontrolnej oblasti (LCR, long control region) vírusovej DNA (vDNA). K nej najbližšie ležia čítacie rámce génov, ktoré kódujú neštruktúrne onkogénne bielkoviny E5, E6 a E7. Toto usporiadanie génov má rozhodujúci význam pre ich onkogénny účinok, ktorý sa prejaví, keď sa príslušný fragment vDNA integruje do DNA hostiteľskej bunky (2, 8, 11, 30).
V súvislosti s tvorbou nádorov sa zdôrazňujú tzv. rizikové genotypy papilomavírusu ľudí (HPV, human papillomavirus), ktoré s rozličnou pravdepodobnosťou vyvolávajú ťažkú dyspláziu dlaždicového epitelu (HSIL, high grade squamous intraepithelial lesion) ako aj karcinóm krčka maternice (tabuľka 1). Málo rizikové genotypy vyvolávajú prevažne benígne nádorové ochorenia kože a slizníc. Pojem genotyp súvisí s poznatkami, ktoré boli získané porovnaním sekvencií génu L1 rozličných papilomavírusov. Genotypy sa zhodujú v géne L1 na 90 %, ich podtypy sú zhodné do 98 % bp, kým varianty tohože genotypu sa líšia menej ako v 2 % nukleotidov (bp). Súčasná klasifikácia uznáva 96 genotypov zadelených do rodov Alpha , Beta-, Gamma-, Mu a Nupapillomavirus. Najviac genotypov HPV prináleží rodu Alfapapilomavírus, do ktorej boli zadelené aj vysoko rizikové genotypy HPV-16, 18, 45, 31-35 a ďalšie (HR-HPV, high risk HPV), napádajúce dlaždicový epitel sliznice genitálu a ústnej dutiny ako aj rohovatejúci dlaždicový epitel kože (35).
Tab. 1. Rizikové (tučne) a menej rizikové genotypy papilomavírusov ľudí podľa frekvencie ich výskytu 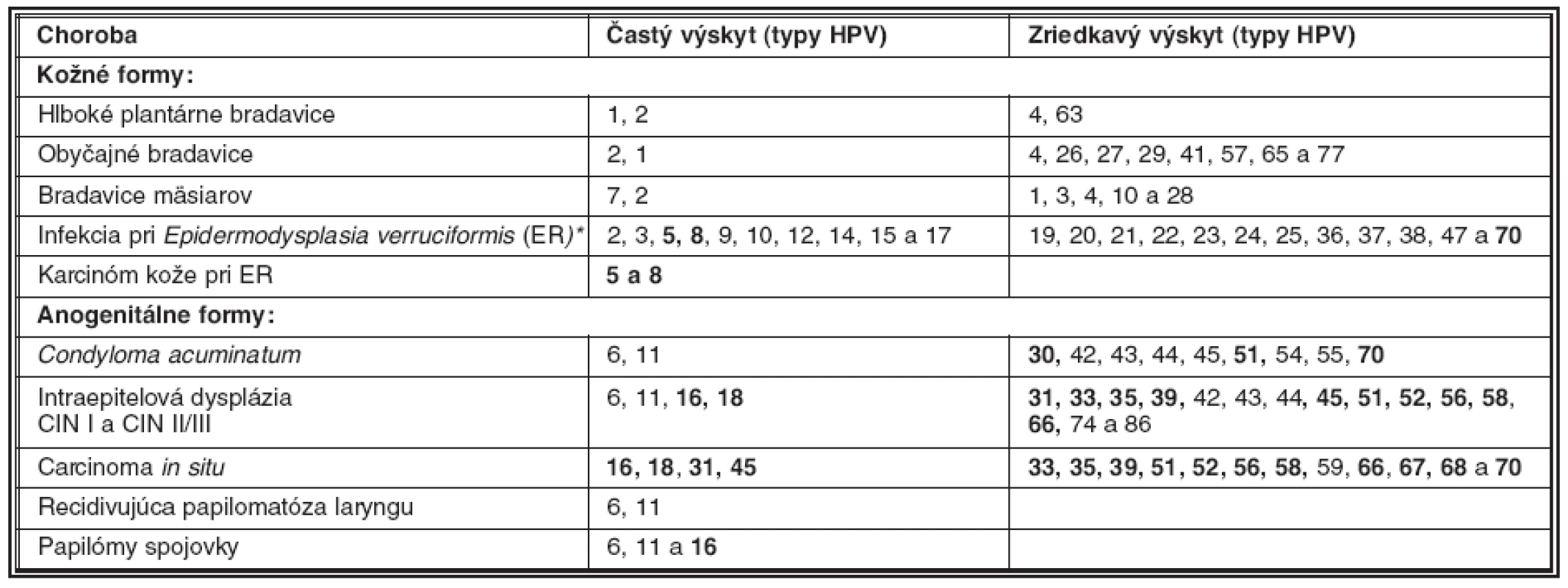
# modifikované podľa ref. 32 a 35. * ER je vrodené ochorenie kože s vysokou vnímavosťou na HPV Genotypy HR-HPV sú vyznačené tučne Replikačný cyklus papilomavírusov pri akútnej infekcii čapíka maternice začína v bazálnych a suprabazálnych bunkách nerohovatejúceho dlaždicového epitelu. Prepisom génov a následnou transláciou vírusových mRNA pri produktívnom rozmnožovaní sa tvoria skoré ako aj neskoré vírusové proteíny (3). Bielkoviny kapsidu sú schopné autoagregácie, pričom pomocnú úlohu zohráva proteín E4. Princíp autoagregácie bielkovín kapsidu sa využíva pri výrobe vakcíny, ktorá najčastejšie pozostáva z proteínu L1 genotypov HPV-16 a HPV-18. Rekombinantný L1 proteín sa zabuduje do nepravých viriónov, neobsahujúcich vDNA (13). Keďže vírus nekóduje enzýmy, potrebné pre kopírovanie nových molekúl vDNA, tvorba infekčných častíc je viazaná na delenie buniek bazálnych a suprabazálnych vrstiev epitelu (kmeňové a prechodné bunky). V nich sa nová vDNA kopíruje pomocou bunkových enzýmov (zo skupiny DNA polymerázy), ktoré sa aktivujú pri bunkovom delení. Okrem tejto, tzv. vegetatívnej formy rozmnožovania vDNA, existuje aj iná forma, ktorá pomocou proteínov E1/E2 zabezpečí v období latencie znovurozdelenie vDNA do dcérinných buniek epitelu bez tvorby infekčných častíc (4, 24).
Morfologickým znakom produktívnej replikácie HPV v bazálnych a suprabazálnych bunkách dlaždicového epitelu je tvorba koilocytov. Koilocyty, ktoré majú charakteristické perinukleárne vakuoly, pozorujeme ako v náteroch, tak aj v histologických rezoch. V ich jadre vidno pri vyšetrení elektrónovým mikroskopom agregáty viriónov, usporiadané do mriežke podobných útvarov (pri niektorých genotypoch sú základom inklúznych teliesok). Okolo nich vymizne chromatín, ktorý sa hromadí na vnútornej stene bunkovej membrány (nástenná hyperchromatóza). Známkou hyperplázie okrem hrotových výbežkov a zvlneného rozhrania dlaždicového epitelu (bez porušenia bazálnej membrány) je akantóza, parakeratóza alebo hyperkeratóza, t.j. zmeny totožné s nálezmi pri condyloma acuminatum (22, 23, 31). Okrem koilocytózy pozorujeme proliferáciu a hyperpláziu kmeňových a prechodných buniek s tvorbou prstovitých výbežkov (papilomatóza), miestami zasahujúcich do okolia alebo do vnútra žliazok vystlatých cylindrickým epitelom (39). Pre CIN I (cervical intraepithelial neoplasia) je charakteristická premena buniek pôvodného epitelu so zmenou pomeru veľkosti jadra k objemu cytoplazmy, ktorú charakterizujú dysplastické bunky v rozsahu spodnej tretiny epitelu (28). Pri CIN I, označovanom tiež ako LSIL (low grade squamous intraepithelial lesion) je v epiteli infikovanom HPV prítomná jej DNA, ktorú možno detegovať metódou hybridizácie in situ, metódou PCR (polymerázová reťazová reakcia) alebo metódou záchytu DNA tvorbou hybridných molekúl s fragmentmi komplementárnej RNA (hybrid capture, HC-2). Metódou označených protilátok je možné dokázať prítomnosť antigénov kódovaných HPV, čo je však pri použití parafínových rezov nepresné a pomerne málo citlivé.
Koilocyty sa vyskytujú najmä pri miernom stupni dysplázie CIN I/LSIL, ktorá sa chápe ako prvý stupeň vnútroepitelovej cervikálnej neoplázie (28). Niektorí však termín „neoplázia“ pre túto fázu infekcie HPV nepovažujú za výstižný, lebo podľa nich ešte nejde o skutočné nádorové bujnenie hostiteľských buniek, ale len o ich imortalizáciu nesúcu známky dysplázie. Z uvedeného dôvodu časť autorov preferuje spoločný termín SIL (squamous intraepithelial lesion) pre všetky stupne dysplázií, ktoré delia na stupne LSIL a HSIL, čo sú termíny pôvodne záväzné pre cytologickú klasifikáciu (20, 21). Len pri časti rýchle postupujúcich prípadov CIN I nastane rýchly prechod do fázy CIN II/CIN III (15). Infekcia so známkami CIN I/LSIL sa pomerne často spontánne vyhojí, inokedy však postupne prechádza do chronickej (latentnej) fázy. Niektoré štúdie na veľkých súboroch pacientok, u ktorých bol diagnostikovaný stupeň CIN II alebo CIN III, zistili pretrvávajúcu latenciu HR-HPV DNA po dobu najmenej 12 mesiacov (33). V prvej etape latencie, ktorá nadväzuje na produkciu vírusu, môže dôjsť k postupnej eliminácii infikovaných buniek produkujúcich vírusové antigény. Mnohé koilocyty zanikajú apoptózou, hoci na druhej strane práve vírusom spúšťané mechanizmy imortalizácie bránia apoptóze. Tým umožnia dlhodobé pretrvávanie vDNA v jadrách nosičských buniek spojené s expresiou proteínov E1/E2 v léziách, ktoré medzitým prestali produkovať vírus. Navodí sa dlhodobá symbióza vDNA s hostiteľskou bunkou, charakterizovaná pretrvávaním genómu HPV.
Pri stimulácii imortalizovaných buniek epitelu v prítomnosti HPV spočiatku dominuje vírusový proteín E5, ktorý zvyšuje vnímavosť hostiteľských buniek na prítomnosť vonkajších rastových podnetov (rastových faktorov). Tento mechanizmus pôsobí najmä pri LSIL, pri ktorej je expresia onkoproteínu E7 ešte relatívne nízka. Neskôr, pri časti prípadov infekcie vysokorizikovými kmeňmi HPV (HR-HPV) nastáva integrácia určitého úseku HPV DNA do niektorého chromozómu hostiteľskej bunky (38). Integrovaný fragment vDNA kóduje onkoproteíny E6 a E7, zasahujúce do regulácie cyklu delenia hostiteľských buniek (6, 37). Tie totiž reagujú s oboma kľúčovými proteínmi, ktoré riadia bunkové delenie. Bola opísaná interakcia E6 s proteínom p53 a interakcia E7 s proteínom Rb (retinoblastómový proteín). Mechanizmus spojený s vysokou expresiou proteínu E7 vstupuje do činnosti najmä pri CIN II/HSIL, ktorá postupne prechádza do stupňa CIN III/HSIL.
Schodnejšou cestou, akou je dôkaz prítomnosti veľkého množstva neštruktúrneho vírusového proteínu E6/E7, respektíve ich mRNA (34) v dysplastických bunkách, je dôkaz nadprodukcie bunkového proteínu p16/INK4A. Ide o regulačnú bielkovinu, ktorá za fyziologických okolností inhibuje cyklín dependentné kinázy (cdk4/6) asociované s bunkovými cyklínmi, najmä cyklínom D1 (obr. 1). V dysplastických bunkách infikovaného epitelu, špecificky stimulovaných k opakovanému deleniu onkogénnymi proteínmi E6/E7, sa bielkovina p16/INK4 tvorí v nadbytku (14, 26, 27, 29). Za fyziologických okolností je bielkovina p16 spätne inhibovaná prítomnosťou voľného proteínu Rb (19). Jeho vyviazanie v dôsledku asociácie s proteínom E7 zvyšuje expresiu a následnú syntézu p16. Produkcia p16 bezprostredne súvisí s prítomnosťou skorého proteínu E7 v dysplastickej, respektíve neoplastickej bunke, jej nadprodukcia je preto špecifická pre HPV aj keď tomu tak nie je z pohľadu lokalizácie genetického kódu (gén pre p16 nie je súčasťou genómu vírusu).
Obr. 1. Cyklín dependentné kinázy (cdk 4/6) po interakcii s cyklínom D alebo E fosforylujú retinoblastómový proteín (pRb), čím sa inaktivuje jeho schopnosť viazať faktor E2F. Transkripčný faktor E2F, ktorý sa uvoľnil z väzby z fosforylovanej formy pRb (ppRb) sa dostáva do jadra, kde iniciuje prepis génov, kódujúcich syntézu enzýmov pre kopírovanie chromozómovej DNA (začína syntéza bunkovej DNA, čím bunka vchádza do fázy S svojho cyklu delenia). Zvýšená hladina regulačného proteínu p16/INK4 (inhibitor kinase 4) pri dysplázii je dôsledkom vychytania pRb vírusovým onkoproteínom E7. Celý systém dáva do chodu proteín E6, ktorý viaže inhibítory cyklínov (p53, proteíny p27 a p21).V dôsledku prítomnosti onkoproteínov E6/E7 sa napokon bunka chová ako keby mala málo proteínu p16/INK4 ako aj nedostatok fosfoproteínu pRb, čo spätne indukuje nadmernú expresiu p16 (prepisuje sa bunkový gén CDKN2A, ktorý kóduje p16). Zvýšená expresia p16 môže nastať nielen z dôvodu narušenia spätnej väzby, ale aj v dôsledku uvoľnenia faktora E2F. INK = inhibitor kinase KIP = kinase inhibitor protein CIP = cyclin inhibitor protein Cdk = cyclin dependent kinase 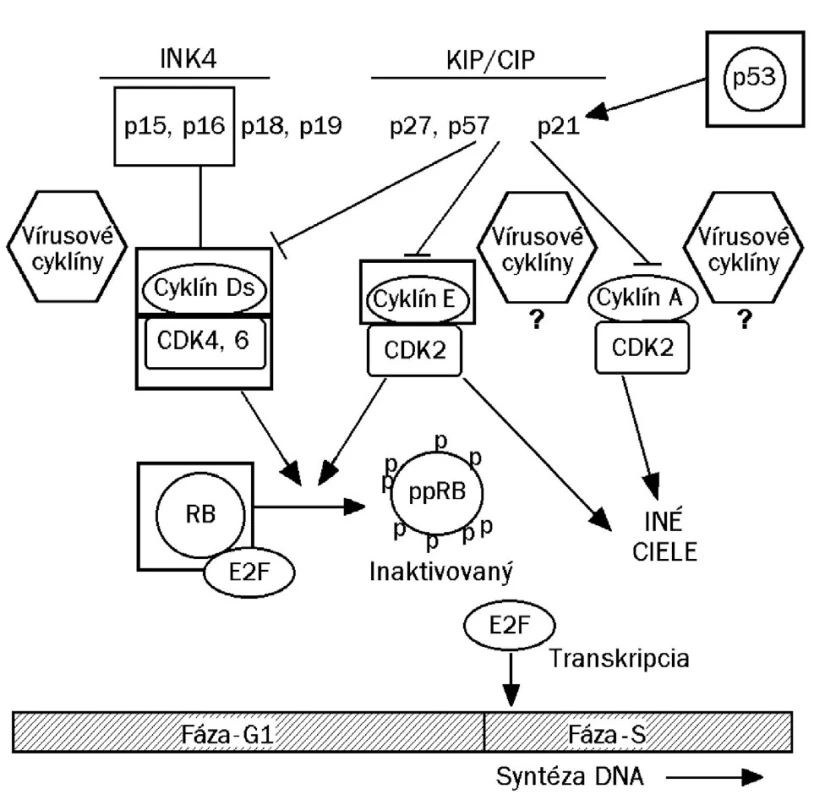
Materiál a Metódy
Ako uvádza tabuľka 2, z celkového počtu náhodne vybraných 423 bioptických vzoriek z materiálu Laboratória patologickej anatómie Alpha Medical a.s. Martin, pochádzajúcich od 178 pacientok s diagnózou erózia (N86) a dysplázia epitelu krčka maternice rozličného stupňa (N87), sme opätovne farbili na antigén p16 v priemere 2,4 sklíčok na pacientku. Celkom sme vyšetrili a porovnali s pôvodným farbením na HE rezy z 40 bločkov od 24 pacientok (priemer 1,7) s diagnózou erózia (vybrané ako negatívne kontroly), 202 bločkov od 80 pacientok (priemer 2,5) s diagnózou CIN I/LSIL (N87.0), 113 bločkov od 47 pacientok (priemer 2,4) s diagnózou CIN II/HSIL (N87.1) a napokon 67 bločkov od 27 pacientok (priemer 2,5) s diagnózou CIN III/HSIL (N87.2). Ako pozitívne kontroly sme vyšetrili 10 bločkov vo viacerých rezoch od 6 pacientok s diagnózou karcinóm krčka maternice.
Tab. 2. Súhrn nálezov antigénu p16/INK4 v bioptickom materiáli 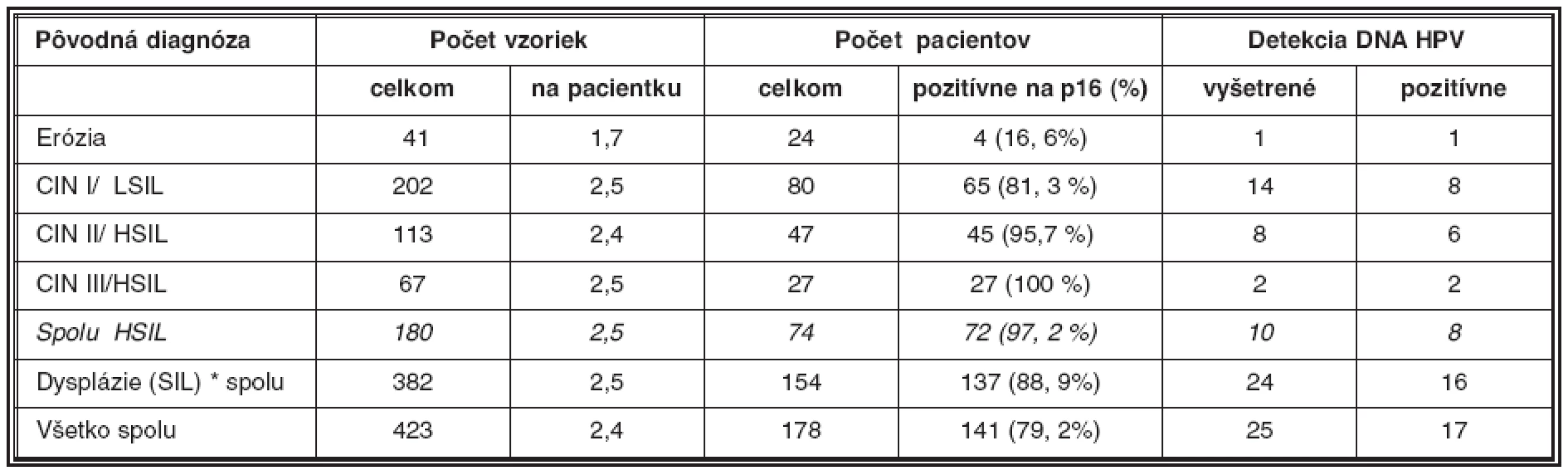
*Vo dvoch prípadoch stredne ťažkej dysplázie nebolo možné nájsť dlaždicový epitel v paralelných rezoch. Bločky sme selektovali na základe odhadu prítomnosti povrchového dlaždicového epitelu v stereo mikroskope; z nich boli pripravené 4 μm rezy, ktoré po odparafínovaní boli opracované reagenciami na detekciu antigénu p16 pomocou súpravy CINtec Histology kit (MTM laboratories AG, Heidelberg). Kľúčovou súčasťou kitu je myšacia monoklonová protilátka anti-p16/INK4A. Pri farbení sme postupovali podľa návodu výrobcu (ručná procedúra). Stručne bol postup nasledujúci: odparafínované rezy boli opracované roztokom na odmaskovanie antigénu, ako aj roztokom H2O2 na blokovanie endogénnej peroxidázy. Monoklónová protilátka anti-p16 (nariedená výrobcom) bola aplikovaná pri izbovej teplote po dobu 30 minút. Na vizualizáciu antigénu sme po aplikácii označenej druhej protilátky použili roztok DAB (diamino benzidín). Napokon sme rezy dofarbené hematoxylínom montovali do permanentného média. V prípade nejasného výsledku sme paralalené rezy farbili roztokom pre negatívne kontroly (súčasť kitu).
Výsledky a diskusia
Pri CIN I/LSIL bola typickým nálezom prítomnosť antigénu p16 v pásme dysplasticky zmenených buniek v segmente zodpovedajúcom spodnej tretine dlaždicového epitelu, t.j. oblasti jej bazálnej a suprabazálnej vrstvy (obr. 2.). Aj v prípadoch rozsiahlejšej koilocytózy kombinovanej s vakuolizáciou buniek vrchných vrstiev dlaždicového epitelu bol nález antigénu p16 obmedzený na jeho spodnú vrstvu, ktorá vykazovala znaky dysplázie ako je atypia jadier, nárast jadrovej cytoplazmovej relácie, hyperchromázia a anizonukleóza. Ako uvádza tabuľka 2, pri CIN I/LSIL sme asociáciu s antigénom p16 prítomným v typickej lokalizácii pozorovali pri 81% prípadov. To súhlasí s údajmi iných autorov, ktorí udávajú intenzívne parabazálne farbenie na p16 pri najmenej 47 % prípadov pri započítaní súvislého parabazálneho farbenia p16 slabšej intenzity, celková pozitivita stúpa na najmenej 74% biopsií CIN I/LSIL (5, 10). Yildiz et al. (40) opisujú pri CIN I súvislé parabázálne farbenie silnej intenzity, súvislé parabazálne farbenie slabej intenzity ako aj farbenie nesúvisle „roztrúsených“ buniek. Na rozdiel od súvislého farbenia parabazálnej vrstvy epitelu sme aj v niektorých našich prípadoch pozorovali pozitívne farbenie ojedinelých roztrúsených buniek epitelu v netypickej lokalizácii. V súlade s pokynmi v návode, dodanom výrobcom kitu, ako aj s údajmi v literatúre, sme nesúvislú distribúciu antigénu p16 nepovažovali za špecifický indikátor prítomnosti HPV. Väčšiu istotu v tomto smere by poskytol test na DNA HPV, ktorý by mohol iniciovať patológ. Vzhľadom k tomu, že takýto postup zatiaľ nie je u nás zaužívaný, bol aj počet vyšetrení na DNA HPV relatívne nízky, takže z neho nebolo možné vyvodiť preukazné závery (tabuľka 2). Nálezy antigénu p16 pri CIN I/LSIL sme teda hodnotili ako pozitívne len v prípadoch súvislej segmentovej (parabazálnej) distribúcie farbenia. Preto sa ich frekvencia zhoduje s údajmi autorov uvádzajúcich ako pozitívne všetky stupne intenzity súvislého farbenia v parabazálnej lokalizácii. Súvislé parabazálne farbenie slabšej intenzity s ložiskovou distribúciou umožnilo odlíšiť aj demarkačnú čiaru pôvodneho, nezmeneného epitelu. Tento kľúč sme použili pri hodnotení nálezov v skupine diagnostikovanej ako erózia, ktorú sme do prehľadu zadelili ako negatívnu kontrolu. Pri reepitelizovaných eróziách sme väčšinou nepozorovali pozitívne farbenie dlaždicového epitelu, hoci v 4 prípadoch (z celkového počtu 24) sme nachádzali nešpecifické farbenie ojedinelých buniek. V iných 4 prípadoch (16,6 %) sme však pozorovali súvislé parabazálne farbenie s fokálnou distribúciou, lokalizované v úsekoch viacvrstvového nerohovatejúceho dlaždicového epitelu, ktorý vykazoval známky počínajúcej dysplázie (tabuľka 3).
Obr. 2. CIN I/LSIL s pozitívnym farbením antigénu p16 v bazálnej a suprabazálnej vrstve dlaždicového epitelu. Ojedinelé koilocyty. Zväčš. 300x. 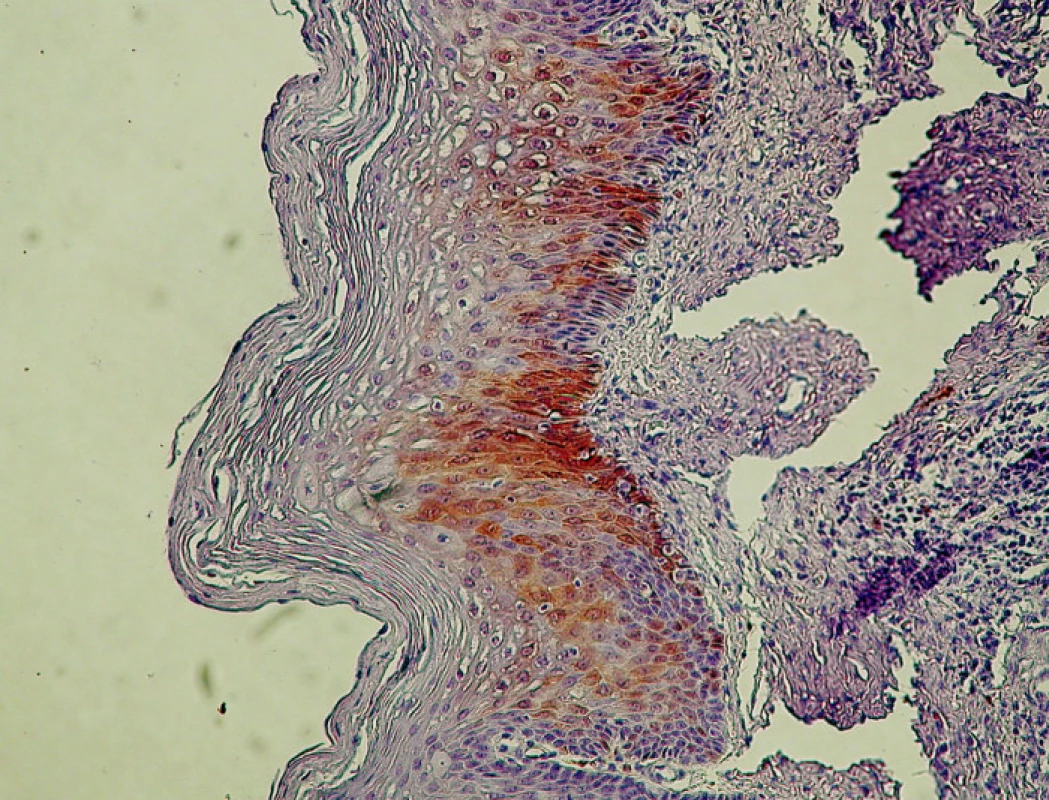
Tab. 3. Porovnanie hodnotenia stupňa dysplázie pred a po farbení na p16 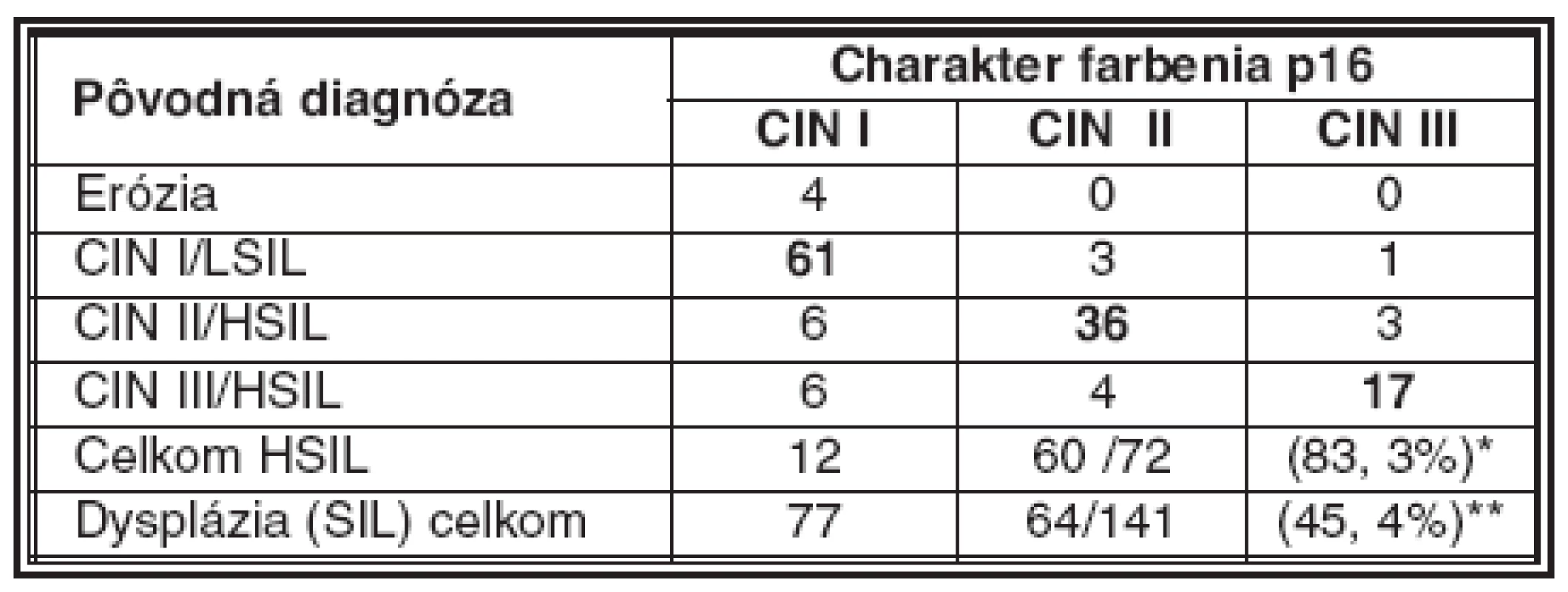
*úplná zhoda pri dysplázii stupňa HSIL 83, 3 % ** podiel dysplázie HSIL na celkovom počte prípadov SIL Pri rozsiahlejšej dysplázii suprabazálnej vrstvy, ktorá pri farbení HE by mohla byť interpretovaná ešte ako LSIL, intenzívnejšie súvislé farbenie na antigén p16 môže vzbudiť podozrenie na prechod do stupňa CIN II/HSIL (obr. 3). V takýchto prípadoch súčasne pozorovať aj rozvoj dyskeratózy, čoho prejavom je expresia cytokeratínov 8 a 17 (10). Uvedený fenomén je podľa niektorých autorov v korelácii s prechodom na vyšší stupeň dysplázie. Nárast expresie p16 ako aj iných korelujúcich proteínov súvisí s integráciou genómu HPV do chromozómu hostiteľských buniek (5, 40). Integrovaný fragment DNA HPV, ktorý nesie iba gény kódujúce proteíny E5/E7, stimuluje proces skutočnej intraepitelovej neoplázie, ktorej znakom sú dysplázie stupňa HSIL (2, 8, 11, 30). Vo väčšine prípadov, zaradených ako CIN II/HSIL, sme v širokej súvislej vrstve dysplastických buniek zaberajúcich približne dve tretiny dlaždicového epitelu pozorovali pozitívny nález p16 pri vyše 96 % vyšetrených vzoriek (tabuľka 2). Nález pozitívneho farbenia na p16 je pri CIN II natoľko jednoznačný, že nevznikajú pochybnosti spojené s prípadmi roztrúsenej či netypickej lokalizácie antigénu respektíve nízkej intenzity jeho farbenia, ktoré sú príčinou nejednotnej interpretácie nálezov pri stupni CIN I/LSIL (25).
Obr. 3. Intenzívna reakcia p16 v bunkách bazálnej a parabazálnej vrstvy, presuhujúca do polovice viacvrstvového dlaždicového epitelu pri stupni CIN II/HSIL. Zväčš. 480x 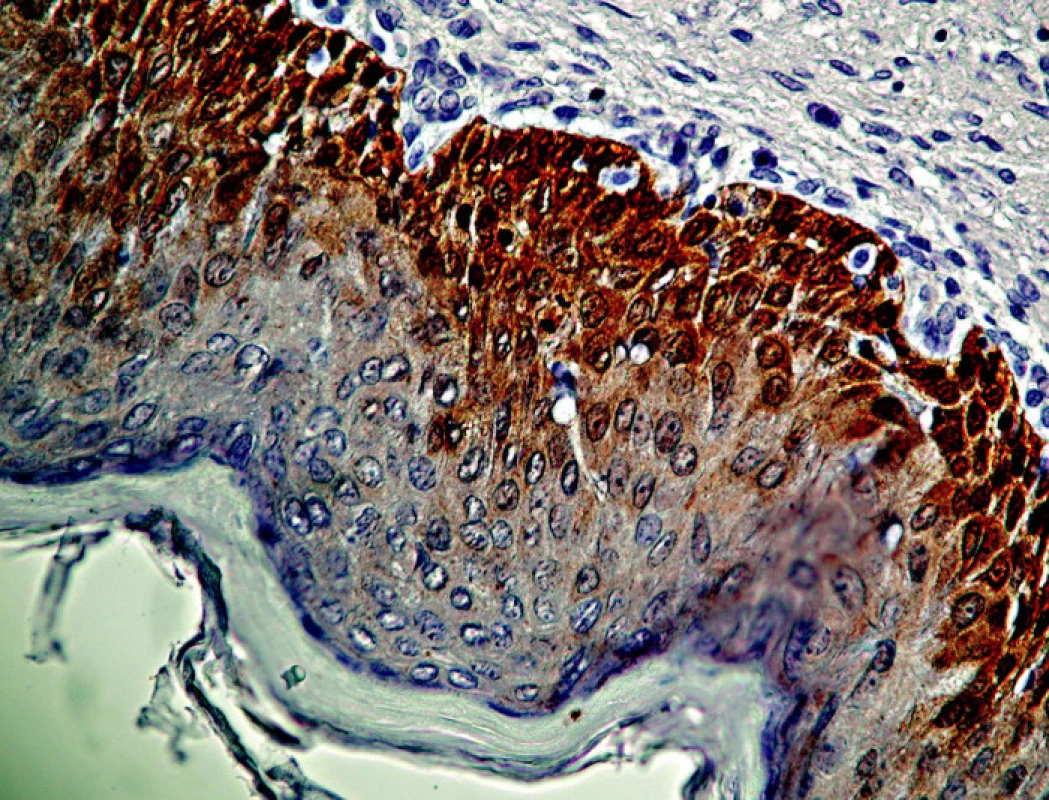
Viaceré štúdie ukázali, že dôsledkom integrácie genómu HPV nastáva výrazný pokles produkcie proteínu L1 ako aj pokles tvorby viriónov (2, 9). Klesá aj obsah vDNA, lebo kopírovanie genómu HPV je pri HSIL menej intenzívne. Počet prítomných kópii HPV DNA sa pri ťažkej dysplázii prakticky rovná počtu nosičských a deliacich sa buniek. Okrem latentne pretrvávajúcich kruhových (epizómových) molekúl v jadrách buniek dysplastického epitelu je HPV DNA v tomto štádiu reprezentovaná integrovanými fragmentami vDNA. Kompletné molekuly vDNA prítomné v minimálnom počte už nie sú určené na zabudovanie do viriónov, ako to je pri LSIL. V súvislosti s týmito zmenami stúpa produkcia proteínu E7 a klesá infekčnosť epitelu, ako aj pravdepodobnosť detekcie vírusovej DNA, čoho dôsledkom sú jej nižšie hodnoty v teste „real time“ PCR alebo HC-2. Kým pri miernej dysplázii dochádza k apoptóze proliferujúcich buniek, pri rozsiahlej dysplázii, respektíve neoplázii buniek dlaždicového epitelu nedochádza ani k terminálnej diferenciácii ani k apoptóze, čo môže byť dôsledkom pôsobenia anti-apoptotických proteínov (41). V štádiu HSIL dochádza napríklad k aktivácii bunkových proto-onkogénov, akým je napríklad produkt génu c-myc, čo vedie k autonómnemu deleniu nosičských buniek a k strate ich diferenciácie (7).
Pri stupni CIN III/HSIL príslušná monoklónová protilátka deteguje spojitú a difúznu lokalizáciu antigénu p16 v celej šírke zmeneného epitelu, pozostávajúceho z výrazne dysplastických buniek (obr. 4). Antigén p16 bol prítomný v ich jadre ako aj cytoplazme. Pozitívny nález antigénu p16 bol zistený vo všetkých (100 %) nami vyšetrených prípadoch biopsií pôvodne klasifikovaných ako CIN III/HSIL (tabuľka 2). Pokiaľ v niektorých prípadoch farbenie nemalo difúzny charakter, bolo možné uvažovať o nižšom stupni dysplázie. Takéto prípady mohli súvisieť aj s tým, že pri opakovanom rezaní už nebolo možné nájsť pôvodné miesto v dysplatickom epiteli, hodnotené ako HSIL (porov. tabuľku 3). Intenzívny nález antigénu p16 sme pozorovali v neoplastickom epiteli pri ca in situ. V invazívne rastúcich karcinómoch bola pozitívna reakcia rozsiahla; antigén p16 sa nachádzal ako v oblasti, ktorá mala ešte vzhľad ca in situ, tak aj v bunkách invazívne rastúceho, respektíve nediferencovaného nádoru (obr. 5).
Obr. 4. Difúzna pozitivita farbenia antigénu p16 zasahuje celú vrstvu epitelu pri CIN III/CIS/HSIL. Zväčš. 300x 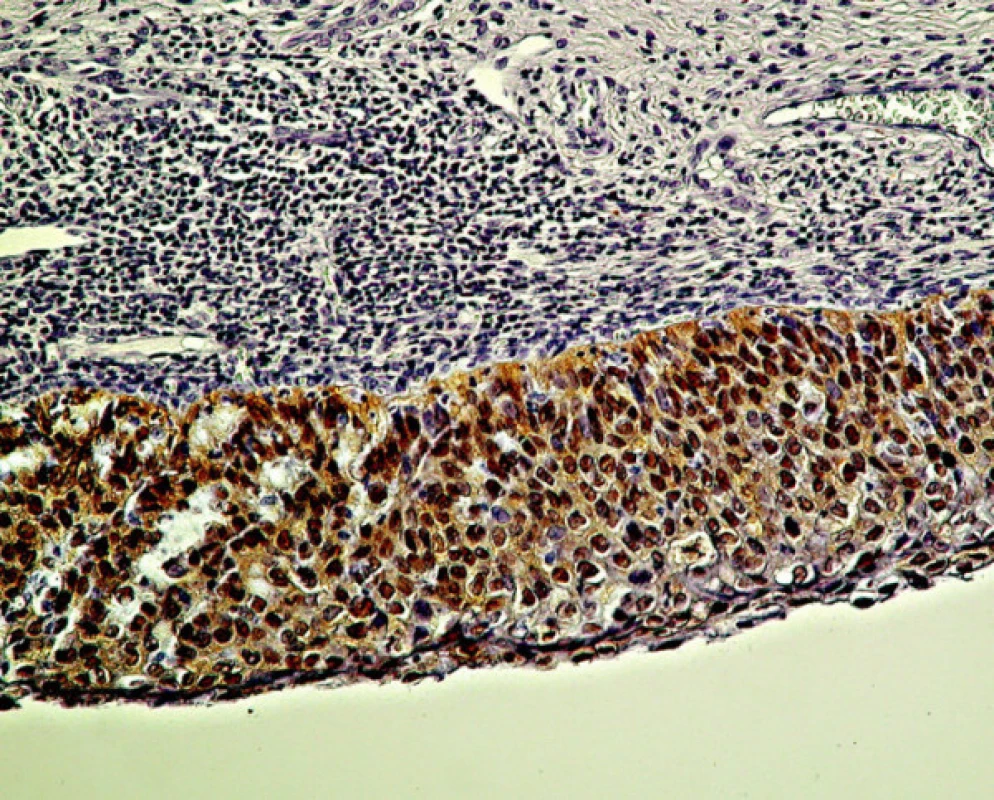
Obr. 5. Invazívny rast karcinómu krčka maternice s rozsiahlou pozitivitou farbenia na antigén p16. Zväčš. 120x 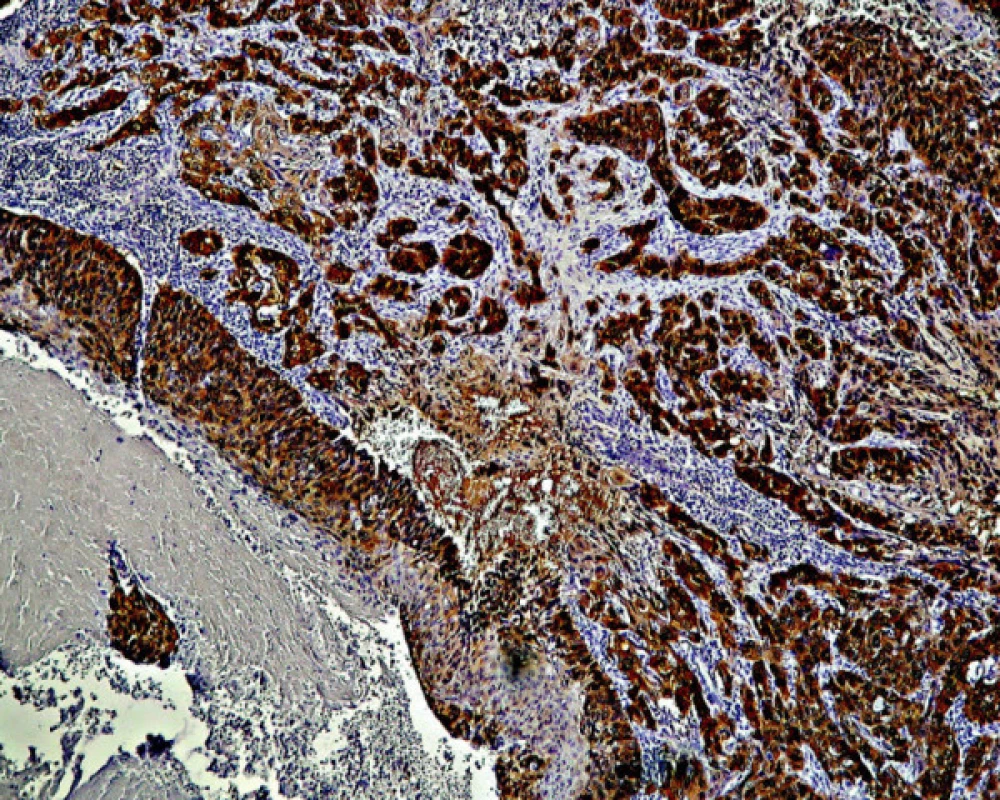
Vzhľadom na 100 % pravdepodobnosť výskytu nadprodukcie antigénu p16 pri stupňoch HSIL ako aj vzhľadom na jeho difúznu zonálnu distribúciu v celej hrúbke alebo vo veľmi širokom segmente (> 50 %) dlaždicového epitelu vykazujúceho známky silnej alebo stredne rozsiahlej dysplázie, je možné farbenie antigénu p16 použiť aj ako pomocnú metódu pri rozlišovaní dysplázie stupňa HSIL od stupňa LSIL, najmä pokiaľ by vznikli diagnostické rozpaky pri štandardnom farbení na HE. Pri rešpektovaní už zmienených výhrad diskutovaných pri opise nálezov LSIL, distribúcia farbenia na p16 v širokej vrstve (> 50 %) alebo celej hrúbke dlaždicového epitelu na strane jednej alebo v jeho užšom parabazálnom pásme (< 30 %) na strane druhej, farbenie na p16 pomáha upresniť rozsah dysplázie (25). V 12 zo 72 prípadov klasifikovaných ako CIN II, respektíve CIN III bola len segmentovaná distribúcia antigénu p16 v parabazálnej vrstve dlaždicového epitelu (tabuľka 3). Z pohľadu stupňa HSIL sme našli úplnú zhodu v 83,3 % vyšetrených vzoriek. Hoci vo zvyšných 16,7 % prípadoch bola badateľná mierna tendencia k zadeleniu dysplázie do vyššieho stupňa, je potrebné vziať do úvahy aj skutočnosť, že neskôr pripravené paralelné rezy nemuseli znázorniť presne rovnakú oblasť. Naopak, v ojedinelých prípadoch (3 zo 65; 4,6 %), pôvodne zadelených ako CIN I/LSIL, sme pozorovali distribúciu antigénu p16, ktorá je skôr charakteristická pre CIN II/HSIL a v jednom prípade aj pre CIN III/HSIL (1/65, 1,5 %). Napriek veľmi kritickému hodnoteniu, sme pri diagnóze CIN I/LSIL našli úplnú zhodu v 93,4 % biopsií.
Často diskutovaným markerom cervikálnej intraepitelovej neoplázie (CIN/SIL) je proteín Ki-67, marker asociovaný s proliferatívnymi zmenami bunkových jadier, ktorý je tiež prítomný v jadrách dysplastických buniek v parabazálnej lokalizácii (16). Pri opätovnom farbení na antigén Ki-67 na rozlíšenie stupňa LSIL od stupňov HSIL bol zavedený tzv. stratifikačný index (počet pozitívnych jadier v parabazálnom pásme 100 μm). Jeho pomocou bola opísaná úplná zhoda s klasifikačným zadelením na základe farbenia HE pri 83 % prípadov. Pre relatívnej nezhode vo zvyšných 11 zo 65 prípadov prevažovala tendencia klasifikovať dysplastické zmeny do vyššieho (horšieho) stupňa. Na základe lokalizácie antigénu Ki-67 klasifikované zmeny CIN I boli pôvodne klasifikované ako CIN II vo 2 prípadoch a na základe distribúcie Ki-67 zatriedené dysplázie CIN II boli pôvodne klasifikované ako CIN III v 9 prípadoch. Farbenie na antigén Ki-67 bolo použité aj na sledovanie progresie lézie stupňa LSIL do stupňa HSIL, ktorá podľa autorov nastala v 11% nimi sledovaných prípadoch (17). Pri progresii od stupňa LSIL do stupňa HSIL bol opísaný pokles hladiny proteínu Rb v dysplastickej vrstve epitelu, čo je jav nepriamo úmerný vzostupu expresie proteínu Ki-67 (18). Pri poklese hladiny pRb stúpa aj expresia proteínov p21 a p27 (obr. 1); znížená dostupnosť proteínu pRb súvisí s prítomnosťou vysokého množstva bielkoviny E7, čo pravdepodobne vyvolá nadprodukcia ako Ki-67 tak aj p16.
Súbežné farbenie dysplastických lézií (CIN/SIL) na antigény p16/INK4 a Ki-67 napokon ukázalo užitočnosť oboch uvedených markerov (1, 12, 36). Nevýhodou farbenia na Ki-67 je nešpecifické zafarbenie pri približne 10% reaktívnych proliferácií (12), čo je podobný jav ako roztrúsené farbenie cytoplazmy ojedinelých proliferujúcich buniek na antigén p16. Keďže distribúciou p16 lepšie definuje špecifickosť výsledku svojou lokalizáciou (porov. obr. 4), sa farbenie na p16 používa v širšej miere. Typická segmentová lokalizácia p16 v parabazálnom pásme rozličnej šírky alebo v celej šírke dysplastickej zóny sa ukázala na prvý pohľad vhodnejšia pre rýchlu orientáciu než stratifikačný index Ki-67. To sa preukázalo aj pri klasifikácii dysplázie nerohovatejúceho dlaždicového epitelu pri análnych prekancerózach označovaných ako AIN (1, 36).
Korešpondujúci autor:
Doc. MUDr. Marián Benčat, CSc.
Vedúci laboratória patologickej anatómie
Alpha medical a.s.
Červenej armády 25
036 01 Martin
Tel.: +421434010914
Fax: +421434220043
E-Mail: marian.bencat@alphamedical.sk
Zdroje
1. Bean S.M., Eltoum I., Whitlow L. et al.: Immunohistochemical expression of p16 and Ki-67 correlates with degree of anal intraepithelial neoplasia. Am J Surg Pathol 31, 2007, 555–561.
2. Cullen A., Reid R., Campion M. et al.: Analysis of the physical state of different human papillomavirus DNAs in epithelial and invasive cervical neoplasm. J Virol 65, 1991, s. 606–612.
3. Dourbar J.: The papillomavirus life cycle. J clin Virol. 32 (suppl), 2005, S7-S15.
4. Flores E.R., Lambert P.F.: Evidence for switch in the mode oh human papillomavirus DNA replication during the viral life cycle. J Virol 71, 1997, s. 7167–7179.
5. Dray M., Russel P., Dalrymple C. et al.: p16/INK4a as a complementarz marker of high grade intraepithelial lesions of the uterine cervix. I. Experience with squamous lesions in 189 consecutive cervical biopsies. Pathology 37, 2005, s. 112–124.
6. Dyson N., Howley, P.M., Munger, K. et al.: The human papillomavirus 16 E7 oncoprotein is able to bind the retinoblastoma gene product. Science 243, 1989, s. 934–937.
7. Golijow C.D., Abba, M.C., Mourón, S.A. et al.: C-myc gene amplification detected in preinvasive intraepithelial lesions. Int J Gynecol Cancer 11, 2001, 463–465.
8. Hopman A.H., Smedts F., Dignef W. et al.: Transition of high-grade cervical intraepithelial neoplasia in micro-invasive neoplasia to microinvasive carcinoma is characterized by integration of HPV 16/18 and numerical chromosome abnormalities. J Pathol 202, 204, s. 23–33.
9. Howley P.A., Lowy D.R.: Papillomaviruses, s. 2299–2354, in Knipe DM, Howley PM (ed), Fieldęs Virology, 5th edition, Walters Kluver/Lippincott, Wiliams and Wilkins, Philadelphia, 2007.
10. Ikeda K., Tate G., Suzuki T., Mitsuya T.: Coordinate expression of cytokeratin 8 and cytokeratin 17 immunohistochemical staining in cervical intraepithelial neoplasia and cervical squamous cell carcinoma: an immunohistochemical analysis and review of the literature. Gynecologic Oncol. 108, 598–602, 2008.
11. Jeon S., Lambert P.F.: Integration of HPV 16 DNA into the human genome leads to increased stability of E6/E7 mRNAs: implications for cervical carcinogenesis. Proc Natl Acad Sci USA 92, 1995, s. 1654–1658.
12. Keating J.T., Cviko A., Rietdorf S. et al.: K-67, cyclin E and p16/INK4 are complimentary surrogate biomarkers for human papillomavirus-related cervical neoplasia. Am J Surg Pathol 25, 2001, 884–891.
13. Kirnbauer R., Booy F., Cheng N. et al: Papillomavirus L1 major capsid protein self-assembles into virus particles that are high immunogenic. Proc Natl Acad Sci USA 89, 1992, s. 12180–12184.
14. Klaes, R., Friedrich, T, Spitkovski, D. et al.: Over expression of p16/INK4A as a specific marker for dysplastic and neoplastic epithelial cells of the cervix uteri. Int. J Cancer 92, 276–284, 2001.
15. Koutsky I.A., Holmes K.K., Critchlow, C.W. et al.: A cohort study of the risk of cervical intraepithelial neoplasia grade 2 and 3 in relation to papillomavirus infection. New Engl J Med. 327, 1992, s. 1272–1278.
16. Kruse A.J., Baak J.P.A., deBruin P.C. et al.: Ki-67 immunoquantitation in cervical intraepithelial neoplasia (CIN): a sensitive marker for grading. J Pathol. 196, 2001, 48–54.
17. Kruse A.J., Baak J.P.A, Janssen E.A. et al.: Low and high risk CIN I and II lesions: prospective predictive value of grade, HPV and Ki-67. J Pathol 199, 2003, 462–470.
18. Kruse A.J., Skaland I., Janssen E.A. et al.: Quantitative molecular parameters to identify low and high risk early CIN lesions: role of markers of proliferative activity and differentiation and Rb availability. In J Gynecol Pathol 23, 2004, s.100–109.
19. Li Y., Nichols M.A., Shay J.W. et al.: Transcriptional repression of the D type cyclin dependent kinase p16 by retinoblastoma susceptibility gene product pRb. Cancer Res 54, 1994, s. 5816–5820.
20. Luff R.D.: The Bethesda System for reporting cervical vaginal cytologic diagnoses. Report of the 1991 Bethesda Workshop. Hum Pathol 23, 1992, s. 719–721.
21. NCI: National Cancer Institute Workshop: the 1988 Bethesda system for reporting cervical/vaginal cytologic diagnoses. J.A.M.A. 262, 1989, s. 931–934.
22. Meisels, A, Fortin, R.: Condylomatous lesions of the cervix and vagina. I. Cytologic patterns. Acta cytol. 20, 505–809, 1976.
23. Meisels, A Fortin, R, Roy, M: Condylomatous lesions of the cervix II. Cytologic, colposcopic and histopathologic study. Acta Cytol. 21, 379–390, 1977.
24. Meyers C., Laimins L.A.: In vitro systems for the study and propagation of human papillomaviruses. Curr Topics Microbiol Immunol 186, 1994, s. 199–215.
25. Mulvany, NJ, Allen, DG, Wilson, SM: Diagnostic utility of p16/INK4A: a reappraisal of its use in cervical biopsies. Pathology 40, 335–344, 2008.
26. Murphy N, Ring, M, Killalea AG, Uhlmann, V et al.: p16/INK4A as a marker for cervical dyskaryosis: CIN and cGIN in cervical biopsies and ThinPrep smears. J clin Pathol. 56, 56–63, 2003.
27. Murphy, N, Ring, M, Heffron, CCBB et al.: p16/INK4a, CDC6 and MCM5: predictive biomarkers in cervical preinvasive neoplasia and cervical cancer. J clin Pathol 58, 525–534, 2005.
28. Ondriáš F: Patológia cervixu maternice. Agentúra EURODOS, Bratislava, 2005.
29. O’Neill, CJ, McCluggage WG: p16 expression in the female genital tract and its value in diagnosis. Adv clin Pathol. 13, 8–15, 2006.
30. Phelps, W.C., Yee, C.L., Munger K. et al.: The human papillomavirus type 16 E7 gene encodes transactivation and transformation functions similar to those of adenovirus E1A. Cell 53, 1988, s. 539–647.
31. Purola, E., Savia, E: Cytology of gynecologic condyloma acuminatum. Acta Cytol. 21, 26–31, 1977.
32. Rajčáni, J.: Čeľaď Papillomaviridae. s. 324–330, in Rajčáni J., Čiampor F., Lekárska Virológia, Veda, Vyd. SAV, Bratislava, 2006.
33. Rodriguez A.C., Schiffman M., Herrero R. et al.: Rapid clearance of human papillomavirus and implications for clinical focus on persistent infections. J Natl Cancer Inst 100, 2008, s. 513–517.
34. Varnai A.D., Bollman M., Bankfalvi A. et al.: Predictive testing of cervical pre-cancer by detecting human papillomavirus E6/E7 mRNA in cervical cytologies up to high grade squamous intraepithelial lesions: diagnostic and prognostic implications. Oncol. Rep. 19, 2008, s. 457–465.
35. deVilliers E.M., Fauquet C.L., Brocker T., Bernard H.U., zurHausen H.: Classification of papillomaviruses. Virology 324Ł 2004, s. 17–27.
36. Waltz A.E., Lachago J., Bose S.: p16 and Ki-67 immunostaining is a useful adjunct in the assessment of biopsies for HPV associated anal intraepithelial neoplasia. Am J Surg Pathol 30, 795–801, 2006.
37. Werness B.A., Levine A.J., Howley P.M. et al.: Association of human papillomavirus types 16 and 18 E6 proteins with p53. Science 248, 1990, s. 76–79.
38. White A., Livanos F.M., Tlsty T.D.: Differential disruption of genomic integrity and cell cycle regulation in normal human fibroblasts by the HPV oncoproteins. Genes Dev 8, 1994, s. 666–677.
39. Wright T.C., Kurman R.J., Ferenczy A.: Precancerous lesions of the cervix, s. 253–321, in Kurman R.J. (ed), Blausteinęs Patology of the Female Genital Tract, 5th ed., Springer, New York/Berlin, 2001.
40. Yildiz, IZ, Usubutun A, Firet P et al.: Efficiency of immunohistochemical p16 expression and HPV typing in cervical squamous cell intraepithelial lesion grading and review of the literature. Pathol Res Pract 203, 445–449, 2007.
41. Zanotti S., Fiseler-Eckhoff A., Mannherz H.G.: Changes in the topological expression of markers of differentiation and apoptosis in defined stages of human cervical dysplázia and carcinoma. Gynecologic Oncology 89, 2003, 376–384.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek Jaká je vaše diagnóza?Článek Prof. Hlava v PardubicíchČlánek JAKÁ JE VAŠE DIAGNÓZA?Článek JAK SE VÁM LÍBÍ?Článek Pláč českého jazykaČlánek Plán akcí IPZV – jaro 2010
Článok vyšiel v časopiseČesko-slovenská patologie

2009 Číslo 4-
Všetky články tohto čísla
- Jaká je vaše diagnóza?
- Detekcia regulačného proteínu p16/INK4A v dysplastickom dlaždicovom epiteli krčka maternice ako diagnostický nástroj prevencie karcinómu
- Plán akcí IPZV – jaro 2010
- Imunohistologický průkaz mamaglobinu v diferenciální diagnostice mezi apokrinním karcinomem kůže a kožní metastázou karcinomu prsu
- Prof. Hlava v Pardubicích
- Nezvyčajná klinická prezentácia pečeňového yolk sac tumoru v periapendikálnej oblasti Kazuistika a prehľad literatúry
- Kongenitální epulis z granulárních buněk: popis případu
- JAKÁ JE VAŠE DIAGNÓZA?
- JAK SE VÁM LÍBÍ?
- ROČNÍK 45 (Česko-slovenská patologie)
- Pláč českého jazyka
- Nové aspekty patobiologie nádorů
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Detekcia regulačného proteínu p16/INK4A v dysplastickom dlaždicovom epiteli krčka maternice ako diagnostický nástroj prevencie karcinómu
- Kongenitální epulis z granulárních buněk: popis případu
- Nové aspekty patobiologie nádorů
- JAKÁ JE VAŠE DIAGNÓZA?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



