-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Eskalace dávky na intraprostatickou lézi – výsledky akutní a časné chronické toxicity
Dose escalation to the intraprostatic lesion – the results of acute and early late toxicity
Aim:
To evaluate the feasibility and toxicity of dose escalation to the intraprostatic lesion to 84.84 Gy in 40 fractions using simultaneous integrated boost (SIB).Methods:
Between September 2009 and September 2012, we treated 41 patients with intensity-modulated radiotherapy (IMRT) for prostate cancer using SIB. Intraprostatic lesion was defined by MRI or MRI plus spectroscopy, transrectal ultrasound and physical examination. The prescribed doses were 84.84 Gy, 80 Gy and 76 Gy in 40 fractions to the intraprostatic lesion, high risk volume and prostate with seminal vesicles (SIB 84.84). Late toxicity was prospectively scored according to the RTOG/FC-LENT scale. The results were compared to 138 patients treated with IMRT covering the prostate and base of seminal vesicles to 78 Gy (IMRT 78).Results:
Acute genitourinary toxicity grade ≥ 2 was observed in 9.6% (SIB 84.84) and 33.3% (IMRT 78), with a significant difference (p < 0.01). Acute gastrointestinal toxicity grade ≥ 2 occurred in 16% of patients treated with IMRT and in 2.5% receiving SIB with a significant difference (p = 0.01). With a median follow up of 24.1 months, the cumulative incidence of grade ≥ 2 late genitourinary toxicity was 10.2% for IMRT 78 and 5% for SIB 84.84. This difference did not reach statistical difference (p = 0.24). The late gastrointestinal toxicity grade ≥ 2 developed in 13% of cases in the IMRT 78 group and 7.4% in SIB 84.84 group which was not statistically significant (log rank p = 0.24).Conclusion:
Simultaneous integrated boost enables dose escalation up to 84.84 Gy in 40 fractions to the intraprostatic lesion with a low rate of gastrointestinal and genitourinary toxicity.Key words:
prostate cancer, radiotherapy, simultaneous integrated boost.
Autori: Martin Doležel 1,2,3; Karel Odrážka 1,2; Jaroslav Vaňásek 1; Milan Mrklovský 1; Petr Hoffmann 4
; Karel Lucký 5; Igor Hartmann 3,6
Pôsobisko autorov: KOC Pardubická krajská nemocnice a. s. a Multiscan s. r. o., Pardubice 1; 1. lékařská fakulta, Univerzita Karlova v Praze 2; Lékařská fakulta UP, Olomouc 3; Radiologická klinika FN, Hradec Králové 4; Urologické oddělení, Pardubická krajská nemocnice a. s. 5; Urologická klinika FN, Olomouc 6
Vyšlo v časopise: Ces Urol 2013; 17(3): 175-182
Kategória: Původní práce
Súhrn
Cíl:
Zhodnotit využití a toxicitu dávkové eskalace na intraprostatickou lézi dávkou 84.84 Gy v 40 frakcích pomocí techniky simultánního integrovaného boostu (SIB).Metody:
Od září 2009 do září 2012 bylo na našem pracovišti léčeno technikou simultánního integrovaného boostu pomocí IMRT 41 pacientů. Lokalizace intraprostatické léze byla definována pomocí magnetické rezonance, MR spektroskopie, transrektálního ultrazvuku a klinického vyšetření. Předepsaná dávka byla 84.84 Gy, 80 Gy a 76 Gy ve 40 frakcích na oblast intraprostatické léze, přilehlou oblast s vysokým rizikem a zbytek prostaty včetně semenných váčků (SIB 84,84). Chronická toxicita byla hodnocena dle RTOG/FC-LENT škály. Výsledky byly porovnány s výsledky léčby 138 pacientů léčených IMRT na oblast prostaty a báze semenných váčků dávkou 78 Gy (IMRT 78).Výsledky:
Akutní genitourinární toxicita druhého a vyššího stupně byla pozorována u 9,6 % a 33,3 % pacientů léčených SIB 84,84 a IMRT 78, rozdíl byl statisticky signifikantní (p < 0,01). Akutní gastrointestinální toxicita druhého a vyššího stupně byla přítomna u 16 % (IMRT 78) respektive 2,5 % (SIB 84,84) mužů, rozdíl nabyl statistického významu (p = 0,01). Při mediánu sledování 24,1 měsíce byla incidence chronické genitourinární (GU) toxicity stupně ≥ 2 10,2 % (IMRT 78) a 5 % (SIB 84,84), bez statistického významu (p = 0,24). Chronická gastrointestinální toxicita druhého a vyššího stupně byla 13 % u IMRT 78 a 7,4 % u SIB 84,84, opět bez statistického významu (p = 0,24).Závěr:
Simultánní integrovaný boost umožňuje eskalaci dávky na intraprostatickou lézi do 84.84 Gy ve 40 frakcích při nízké míře gastrointestinální a genitourinární toxicity.Klíčová slova:
karcinom prostaty, radioterapie, simultánní integrovaný boost.ÚVOD
Karcinom prostaty je ve vyspělých zemích nejčastěji se vyskytující nádorové onemocnění u mužů. Radiobiologická i retrospektivní klinická data opakovaně prokázala dávkovou závislost tohoto tumoru (1–3). Dávková eskalace zlepšuje biochemickou kontrolu a redukuje výskyt distančních metastáz. Retrospektivní data s dlouhou dobou sledování prokázala nejen signifikantní snížení výskytu metastáz při radioterapii s vysokou dávkou, ale i jednoznačný vztah mezi lokální kontrolou, výskytem distančních metastáz a přežitím (4, 5). Klinický benefit eskalace dávky u pacientů s karcinomem prostaty byl potvrzen několika randomizovanými studiemi (6–9). Signifikantní zlepšení výsledků s sebou ovšem přineslo vzhledem k použité technice (3D konformní radioterapie pomocí fotonů, případně boost formou protonů) rovněž vyšší toxicitu.
Díky technologickému pokroku byly do klinické praxe zavedeny nové technologie jako radioterapie s modulovanou intenzitou (IMRT) a recentně i obrazem řízená radioterapie (IGRT). Metoda IMRT umožňuje dosáhnout lepší prostorové distribuce dávky než pomocí 3D konformní radioterapie (3D-CRT) zejména u cílových objemů konkávního tvaru, což vede k významnému šetření zdravých tkání (10). Tento teoretický předpoklad potvrdil Zelefsky z Memorial Sloan-Kettering Cancer Center, který při komparaci toxicity pacientů s karcinomem prostaty léčených dávkou 81 Gy pomocí IMRT a 3D-CRT pozoroval signifikantní redukci chronické rektální toxicity 2. stupně v rameni s IMRT ve srovnání s 3D-CRT (2 % vs. 10 %, p < 0,001) (11).
Pro úspěšnou léčbu pomocí radioterapie je nezbytná rovněž správná aplikace dávky. Obrazem řízená radioterapie umožňuje díky přesnému nastavení pacientů před každou frakcí redukovat bezpečnostní lem pro plánovací cílový objem (PTV). Po eliminaci chyby při nastavení je následně hlavním úkolem bezpečnostního lemu obsáhnout pouze pohyby prostaty v průběhu ozáření, které v naprosté většině případů nepřekročí 5 mm (12). Tato redukce lemu pro PTV vede k dalšímu snížení zatížení rizikových orgánů v okolí. Zelefsky recentně prokázal, že tato technologie kromě snížení toxicity rovněž zlepšuje onkologické výsledky (13).
Přestože je nádor prostaty velice často multifokální, ukazuje se, že signifikantním prediktorem léčebného výsledku nejsou malé či mikroskopické tumory, nýbrž velké dominující nádory (14). Analogicky je graficky i histopatologicky prokázáno, že lokální recidivy po radioterapii jsou lokalizovány právě v místě primárního tumoru (15, 16).
Ideálním řešením nutnosti eskalace dávky při postupně se zpřísňujících kritériích pro rizikové orgány je využití simultánního integrovaného boostu na oblast dominantní intraprostatické léze. Simultánní integrovaný boost (SIB) je radiační technika, která umožňuje ozáření různých cílových objemů různou dávkou při jediné frakci v závislosti na riziku recidivy či perzistence (17–20). Jelikož klinická vyšetření pro určení lokalizace intraprostatické léze (transrektální ultrazvuk, MR/MRS, palpační vyšetření) mají jednotlivě nízkou senzitivitu i specificitu, je nezbytné pro určení cílového objemu s vysokou přesností kombinace všech zmíněných metod.
METODIKA
Všichni léčení pacienti měli na provedených vyšetřovacích metodách (TRUS, MR/MRS, palpační vyšetření, případně PET/CT využívající značený cholin) ložisko patrné v identické oblasti. Před zahájením konturace byla provedena fúze plánovacího CT s MR. Vzhledem k rozdílné míře rizika lokální perzistence tumoru byly zakresleny tři klinické cílové objemy – oblast makroskopického nádoru (GTV), oblast s vysokým rizikem mikroskopického šíření (CTVTUMOR) a zbytek prostaty a baze semenných váčků (CTVPROSTATA) k eliminaci multifokálního mikroskopického tumoru (SIB 84,84). Plánovací cílový objem (PTV) byl získán expanzí klinických objemů. PTV (GTV) o 2–3 mm, PTV (CTVTUMOR) o 3 mm a PTV (CTVPROSTATA) o 6 mm. Rizikové orgány (rektum, močový měchýř, sigma a tenké střevo) byly konturovány v řezech PTV (CTVPROSTATA) a v řezech do 1 cm nad a pod touto oblastí. Předepsaná dávka byla 84,84 Gy à 2,121 Gy, 80 Gy à 2 Gy a 76 Gy à 1,9 Gy pro PTV (GTV), PTV (CTVTUMOR) a PTV (CTVPROSTATA). Dávka 50 Gy byla povolena maximálně pro 50 % objemu konečníku, dávku 70 Gy mohlo obdržet maximálně 15–20 % objemu rekta a dávka 75 Gy nesměla přesáhnout 3–5 % objemu rizikového orgánu. Maximum na rektum nesmělo být větší než 80 Gy. V případě močového měchýře nesměla dávka 50 Gy přesáhnout 25–35 ccm, dávka 70 Gy 20 ccm a dávka 75 Gy 5–10 ccm. Maximum dávky nesmělo přesáhnout 82 Gy (obr. 1, 2).
Obr. 1. Zakreslení intraprostatické léze Fig. 1. Contour of intraprostatic lesion 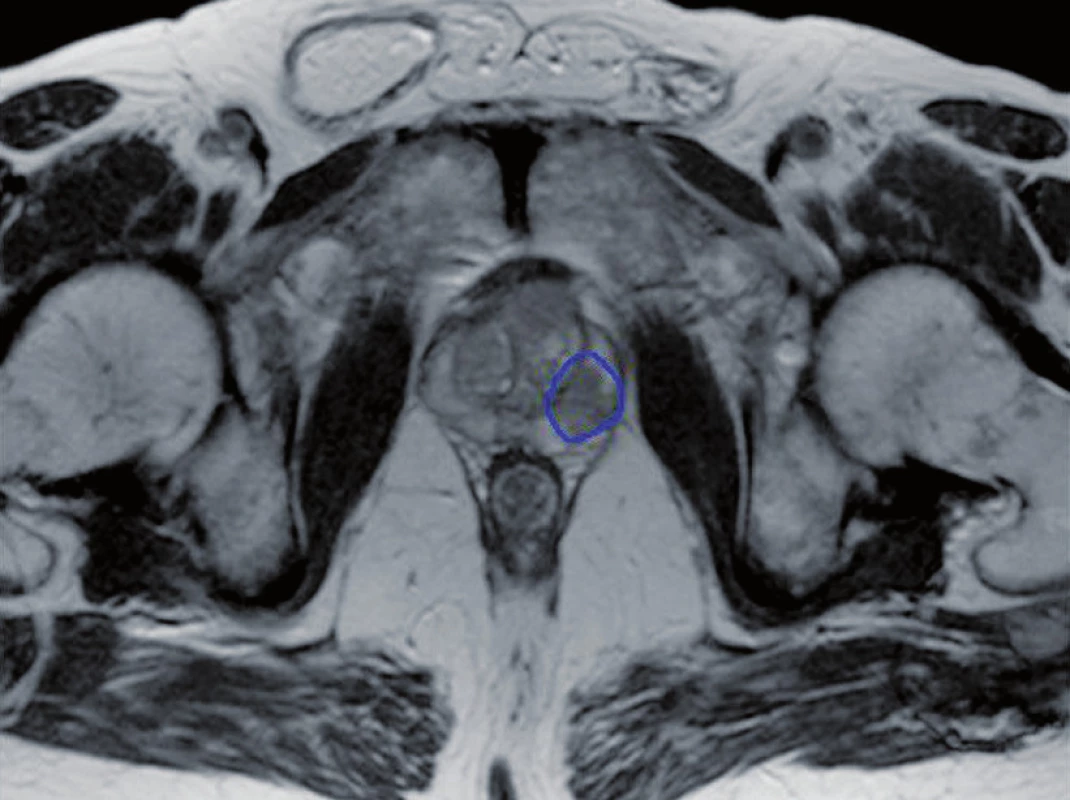
Obr. 2. Dávková distribuce pomocí techniky simultánního integrovaného boostu Fig. 2. Dose distribution using simultaneous integrated boost 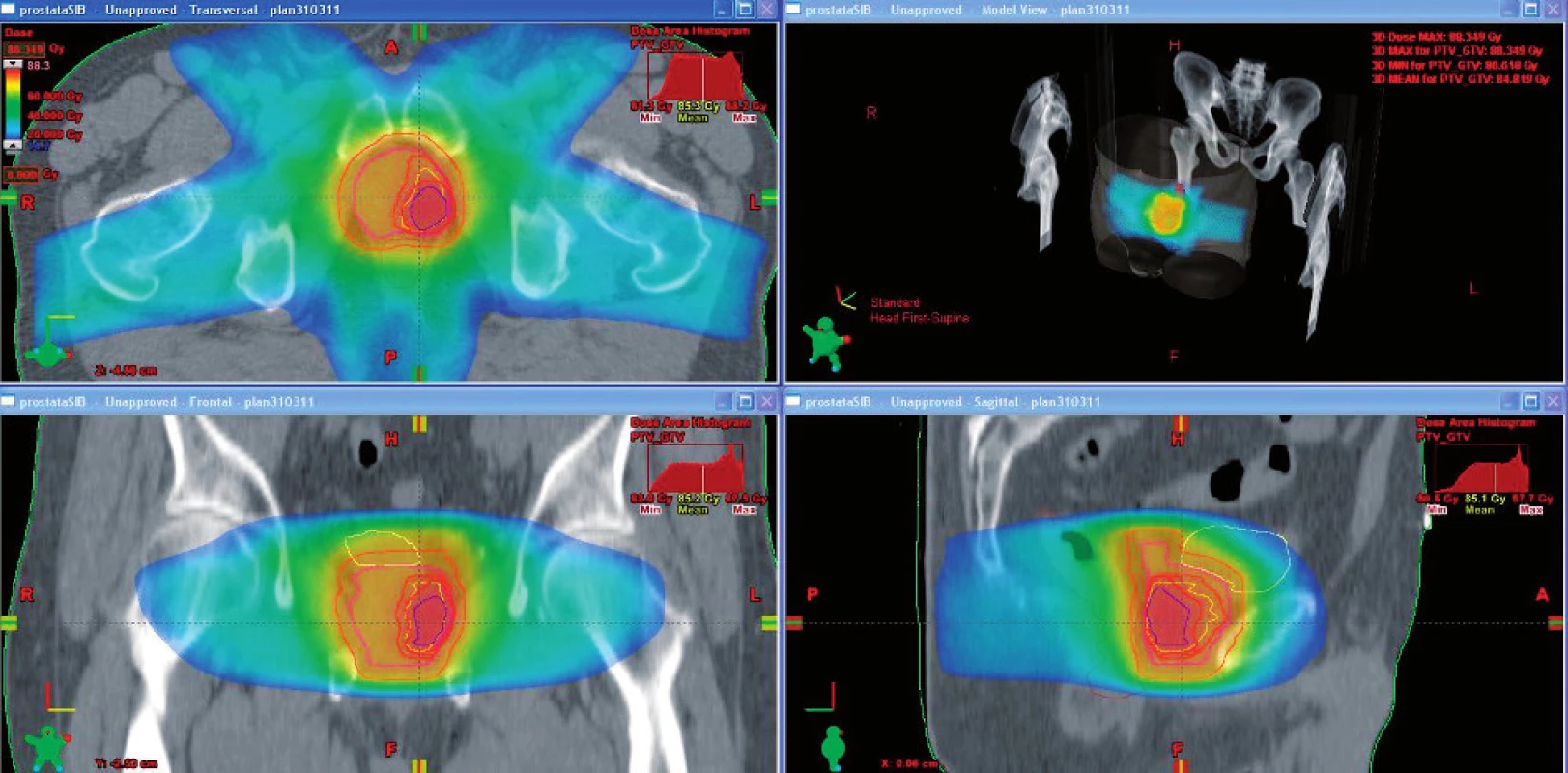
Pacienti byli před léčbou instruováni, aby respektovali specifický dietní režim, jehož cílem bylo omezení plynatosti střev, evakuace rekta před ozařováním a zajištění konstantní náplně močového měchýře. Ověření pozice pacienta a její korekce byla prováděna před každým ozářením (OBI 1.3, Varian) pomocí kilovoltážního CT kónickým svazkem (CBCT).
Pacienti byli sledováni v průběhu radioterapie i následně po jejím ukončení. V průběhu ozařování byli vyšetřeni minimálně 1krát týdně a vždy rovněž současně s poslední ozařovací frakcí. První kontrola po ozáření byla za měsíc po ukončení léčby, druhá za 3 měsíce po dokončení radioterapie a další vždy v odstupu 3 měsíců po dobu prvních 2 let. Následující 3 roky se interval prodloužil na 6 měsíců a po 5 letech od ukončení radioterapie byli pacienti dispenzarizováni vždy 1krát ročně. Vyšetření sestávalo z anamnézy, fyzikálního vyšetření a odběru PSA. Při každé kontrole byla důsledně vyšetřována tolerance léčby se zaměřením na symptomy pozdní gastrointestinální a genitourinární toxicity. Pro její hodnocení byla použita Fox Chase (FC) modification of the Radiation Therapy Oncology Group (RTOG) and Late Effects Normal Tissue Task Force (LENT) toxicity criteria.
Klinické výsledky byly následně porovnány s výsledky pacientů léčených pomocí IMRT dávkou 78 Gy v 39 frakcích (IMRT 78). CTV zahrnoval celou prostatu a bázi semenných váčků. PTV byl definován jako CTV s lemem 10 mm. Rizikové orgány byly konturovány identicky jako u techniky simultánního integrovaného boostu (v řezech PTV a v řezech do 1 cm nad a pod oblastí PTV). Použito bylo pět koplanárních polí (45°, 100°, 180°, 260°, 315°). Modulace intenzity svazku byla prováděna dynamickým vícelistovým kolimátorem technikou sliding window. Verifikace nastavení byla prováděna pomocí portálového zobrazení jednou týdně. Pro porovnání incidence toxicity bylo použito Fisherova testu.
VÝSLEDKY
Od září 2009 do září 2012 jsme na našem pracovišti léčili suprakonvenční dávkou na oblast dominantní intraprostatické léze pomocí metody SIB 41 pacientů. Analýza struktury pacientů týkající se věku, TNM stadia, rizikové skupiny, GS, objemu prostaty, velikosti intraprostatické léze a hormonální léčby je popsána v přiložené tabulce 1.
Tab. 1. Charakteristika pacientů Table 1. Patient characteristic 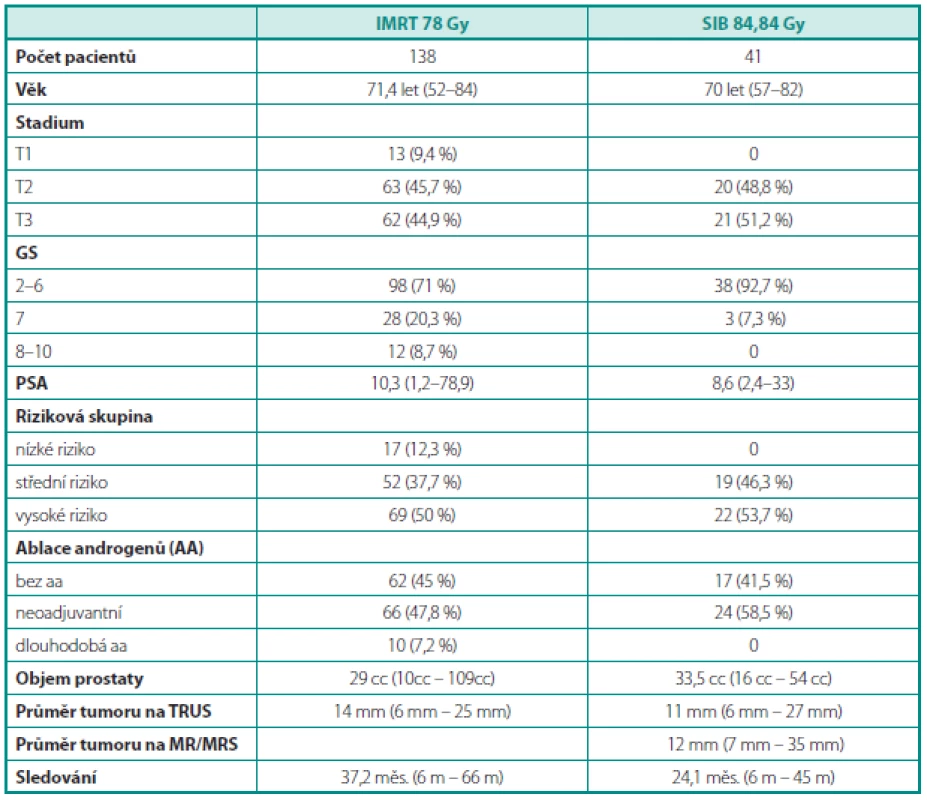
GS – Gleason skóre, TRUS – transrektální ultrazvuk, MR – magnetická rezonance, MRS – spektroskopie, IMRT – radioterapie s modulovanou intenzitou, SIB – simultánní integrovaný boost GS – Gleason score, TRUS – transrectal ultrasound, MR – magnetic resonance imaging, MRS – magnetic resonance spectroscopy, IMRT – intensity modulated radiotherapy, SIB – simultaneous integrated boost Akutní genitourinární toxicita prvního, druhého a čtvrtého stupně byla pozorována v 36,6 %, 4,8 % a 4,8 %, zatímco 53,8 % mužů bylo bez symptomů. Akutní gastrointestinální toxicita nultého, prvního a druhého stupně byla prokázána u 82,9 %, 14,6 % a 2,5 % pacientů. Při srovnání s pacienty léčenými technikou IMRT dávkou 78 Gy bylo statisticky potvrzeno, že SIB 84,84 snižuje akutní toxicitu G≥1 i akutní toxicitu G≥2.
Chronická genitourinární toxicita prvního, druhého a třetího stupně byla přítomna u 14,6 %, 2,5 % a 2,5 % mužů. Zcela bez příznaků toxicity bylo 80,4 % pacientů. Technika SIB 84,84 snížila toxicitu G1–4, neovlivnila však klinicky závažnou toxicitu druhého a vyššího stupně. Chronická gastrointestinální toxicita prvního a druhého stupně byla pozorována u 14,6 % a 7,4 % nemocných. Toxicita vyššího stupně nebyla přítomna u žádného muže, bez příznaků bylo 78 % pacientů. Použitá technika eskalace dávky snížila toxicitu G1–4 pouze na hranici statického významu a neovlivnila toxicitu druhého a vyššího stupně (tab. 2).
Tab. 2. Srovnání akutní a chronické toxicity mezi IMRT 78 a SIB 84,84 Table 2. Comparison of acute and late toxicity between IMRT 78 and SIB 84.84 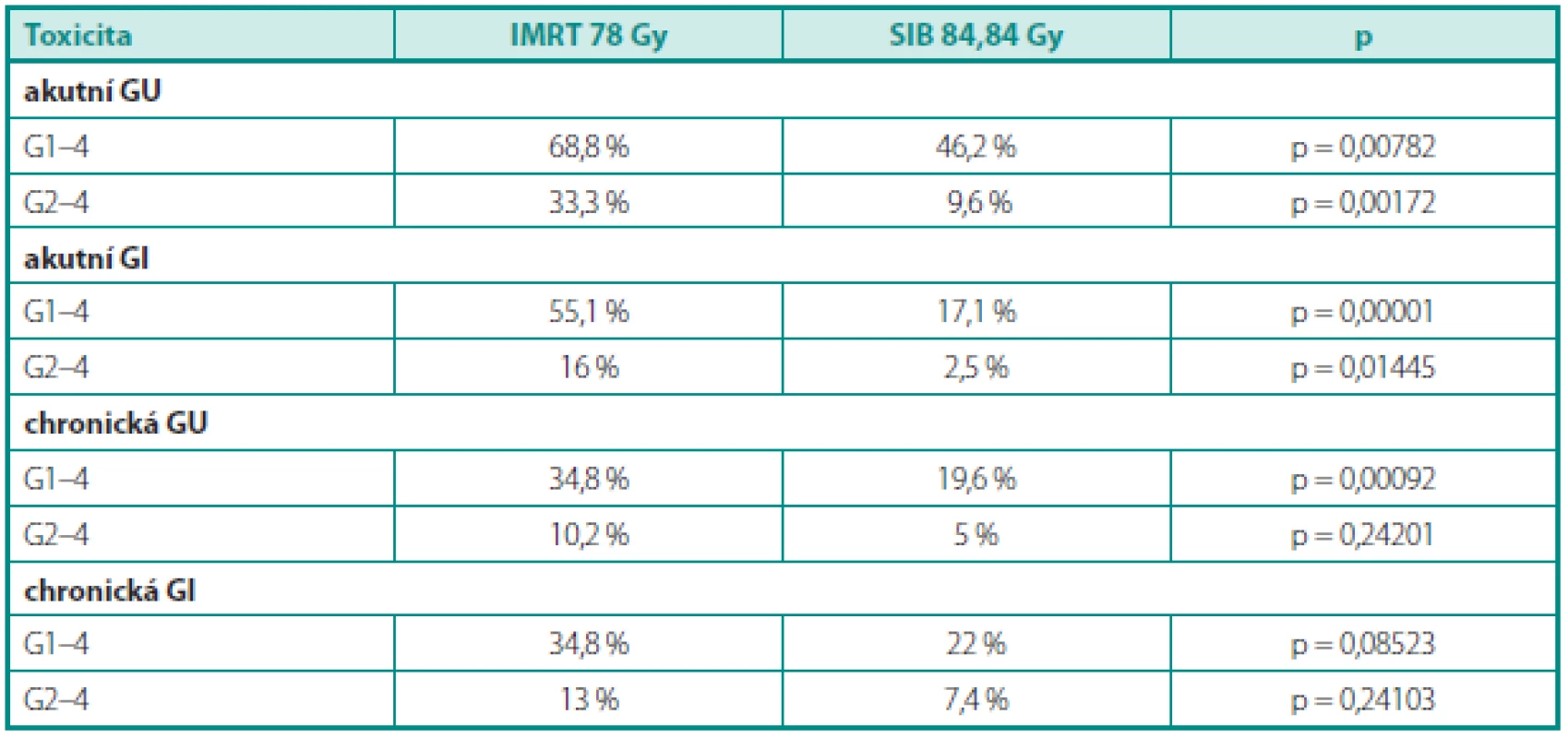
GU – genitourinární, GI – gastrointestinální, IMRT – radioterapie s modulovanou intenzitou, SIB – simultánní integrovaný boost GU – genitourinary, GI – gastrointestinal, IMRT – intensity modulated radiotherapy, SIB – simultaneous integrated boost DISKUSE
Retrospektivní i prospektivní randomizované studie prokázaly u pacientů s karcinomem prostaty lepší výsledky při použití vyšších dávek. Moderní technologie s sebou přináší nejen možnosti šetření rizikových orgánů díky prudšímu dávkovému spádu ale rovněž možnosti korekce nastavení před každou frakcí s možností bezpečné redukce lemu pro PTV o několik mm. Zmenšení lemu o 4–5 mm vede k redukci cílového objemu u nádoru prostaty o 30–40 %. Stále přísnější kritéria pro rizikové orgány však umožňují pouze limitovanou eskalaci dávky při dodržení doporučených limitů. Technika simultánního integrovaného boostu na intraprostatickou lézi se zdá býti ideálním řešením této situace. Je pro ni však nezbytné splnit několik podmínek – mít maximální jistotu o správné lokalizaci léze, zajistit přesné nastavení pacienta resp. prostaty před každým ozářením pomocí IGRT a rovněž nepodcenit multifokální výskyt karcinomu prostaty. Kombinace TRUS + MR/MRS + palpačního vyšetření případně PET/CT s cholinem jistě není dokonalá, přináší však z našeho pohledu akceptabilní míru jistoty. U všech našich pacientů byla prováděna verifikace nastavení pomocí CBCT, které hodnotil radiační onkolog. Vzhledem k multifokánímu výskytu nádoru prostaty byla proto „nejméně riziková oblast“ ozářena relativně vysokou dávkou, která by měla maximálně eliminovat mikroskopickou nemoc.
Použitá dávka na dominantní intraprostatickou lézi (84,84 Gy v 40 frakcích) je při nízkém αβ nádoru prostaty ekvivalentem téměř 90 Gy, přičemž cílem eskalace dávky je pochopitelně dosažení lepších onkologických výsledků (zejména lepší biochemické kontroly). Přesto byla při srovnání s pacienty léčenými IMRT dávkou 78 Gy akutní toxicita menší a chronická na hranici statistické významnosti. Důvodem je bezpochyby kombinace nižší dávky na oblast s nižším rizikem a použití menšího lemu. Je však třeba rovněž poukázat na fakt, že medián sledování je pouze 24 měsíců. To je doba, kdy lze jistě hodnotit chronickou toxicitu gastrointestinální, ovšem pro definitivní hodnocení genitourinární toxicity je třeba delší dobu sledování (21–26). Přesto lze vzhledem k dosaženým hodnotám akutní toxicity, které jsou s výsledky chronické toxicity spojeny, konstatovat, že eskalace dávky na intraprostatickou lézi vysoce pravděpodobně nepovede k signifikantně vyšší chronické toxicitě.
Tato práce představuje první publikované klinické výsledky eskalace dávky pomocí techniky obrazem řízené radioterapie a techniky simultánního integrovaného boostu v České republice a současně nejvyšší eskalaci dávky pomocí této techniky celosvětově.
ZÁVĚR
Simultánní integrovaný boost umožňuje eskalaci dávky na intraprostatickou lézi do 84,84 Gy ve 40 frakcích při nízké míře akutní a časné chronické gastrointestinální a genitourinární toxicity.
Došlo: 22. 4. 2013.
Přijato: 25. 4. 2013.
Kontaktní adresa
MUDr. Martin Doležel, Ph.D.
KOC Pardubická krajská nemocnice a.s. a Multiscan s.r.o.
Kyjevská 44, 532 03 Pardubice
e-mail: dolezelm@email.cz
Střet zájmů: Autoři deklarují, že nemají žádné vazby na firmy či instituce v souvislosti s tímto článkem.
Zdroje
1. Hanks GE, Hanlon AL, Epstein B, et al. Dose response in prostate cancer with 8-12 years follow-up. Int J Radiat Oncol Biol Phys 2002; 54 : 427–435.
2. Levegrün S, Jackson A, Zelefsky MJ, et al. Risk group dependence of dose-response for biopsy outcome after three-dimensional conformal radiation therapy of prostate cancer. Radiother Oncol 2002; 63 : 11–26.
3. Zelefsky MJ, Leibel SA, Gaudin PB, et al. Dose escalation with three-dimensional conformal radiation therapy affects the outcome in prostate cancer. Int J Radiat Oncol Biol Phys 1998; 41 : 491–500.
4. Zelefsky MJ, Reuter VE, Fuks Z, et al. Influence of local tumor control on distant metastases and cancer related mortality after external beam radiotherapy for prostate cancer. J Urol 2004; 179 : 1368–1373.
5. Zelefsky MJ, Yamada Y, Fuks Z, et al. Long-term results of conformal radiotherapy for prostate cancer: impact of dose escalation on biochemical tumor control and distant metastases-free survival outcomes. Int J Radiat Oncol Biol Phys 2008; 71 1028–1033.
6. Al-Mamgani A, van Putten WLJ, Heemsbergen WD, et al. Update of the Dutch multicenter dose escalation trial of radiotherapy for prostate cancer. Int J Radiat Oncol Biol Phys 2008; 72 : 980–988.
7. Dearnaley DP, Hall E, Lawrence D, et al. Phase III pilot study of dose escalation using conformal radiotherapy in prostate cancer: PSA control and side effects. B J Cancer 2005; 92 : 488–498.
8. Kuban DA, Tucker SL, Dong L, et al. Long-term results of the M. D. Anderson randomized dose-escalation trial for prostate cancer. Int J Radiat Oncol Biol Phys 2008; 71 : 67–74.
9. Zietman AL, DeSilvio ML, Slater JD, et al. Comparison of conventional-dose vs high dose conformal radiation therapy in clinically localized adenocarcinoma of the prostate: A randomized controlled trial. JAMA 2005; 294 : 1233–1239.
10. Odrazka K, Zouhar M, Petera J, et al. Comparison of rectal dose-volume constraints for IMRT prostate treatment planning. Phys Med 2005; 21 : 129–135.
11. Zelefsky MJ, Fuks Z, Happersett L, et al. Clinical experience with intensity modulated radiation therapy (IMRT) in prostate cancer. Radiother Oncol 2000; 55 : 241–249.
12. Langen KM, Willoughby TR, Meeks SL, et al. Observations on real-time prostate gland motion using electromagnetic tracking. Int J Radiat Oncol Biol Phys 2008; 71 : 1084–1090.
13. Zelefsky MJ, Kollmeier M, Cox B, et al. Improved clinical outcomes with high-dose image guided radiotherapy compared with non-IGRT for the treatment of clinically localized prostate cancer. Int J Radiat Oncol Biol Phys 2012; 84 : 125–129.
14. Wise AM, Stamey TA, McNeal JE, et al. Morphologic and clinical significance of multifocal prostate cancers in radical prostatectomy specimens. Urology 2002; 60 : 264–269.
15. Cellini N, Morganti AG, Mattiucci GC, et al. Analysis of intraprostatic failures in patients treated with hormonal therapy and radiotherapy: implications for conformal therapy planning. Int J Radiat Oncol Biol Phys 2002; 53 : 595–599.
16. Pucar D, Hricak H, Shukla-Dave A, et al. Clinically significant prostate cancer local recurrence after radiation therapy occurs at the site of primary tumor: magnetic resonance imaging and step-section pathology evidence. Int J Radiat Oncol Biol Phys 2007; 69 : 62–69.
17. Dolezel M, Odrazka K, Vaculikova M, et al. Dose escalation in prostate radiotherapy up to 82 Gy using simultaneous integrated boost: direct comparison of acute and late toxicity with 3D-CRT 74 Gy and IMRT 78 Gy. Strahlenther Onkol 2010; 186 : 197–202.
18. Doležel M. Cílená radioterapie karcinomu prostaty. Hradec Králové: Nukleus 2011.
19. Fonteyne V, Villeirs G, Speleers B, et al. Intensity-modulated radiotherapy as primary therapy for prostate cancer: report on acute toxicity after dose escalation with simultaneous integrated boost to intraprostatic lesion. Int J Radiat Oncol Biol Phys 2008; 72 : 799–807.
20. Pinkawa M, Attieh C, Piroth MD, et al. Dose-escalation using intensity-modulated radiotherapy for prostate cancer--evaluation of the dose distribution with and without 18F-choline PET-CT detected simultaneous integrated boost. Radiother Oncol 2009; 93 : 213–219.
21. Teshima T, Hanks GE, Hanlon AL, et al. Rectal bleeding after conformal 3D treatment of prostate cancer: time to occurrence, response to treatment and duration of morbidity. IntJ Radiat Oncol Biol Phys 1997; 39 : 77–83.
22. Marks LB, Carroll PR, Dugan TC, et al. The response of the urinary bladder, urethra, and ureter to radiation and chemotherapy. Int J Radiat Oncol Biol Phys 1995; 31 : 1257–1280.
23. Zelefsky MJ, Cowen D, Fuks Z, et al. Long term tolerance of high dose three-dimensional conformal radiotherapy in patients with localized prostate carcinoma. Cancer 1999; 85 : 2460–2468.
24. Odrážka K. Trojrozměrná konformní radioterapie karcinomu prostaty. Praha: Galén 2002.
25. Odrazka K, Dolezel M, Vanasek J, et al. Late toxicity after conformal and intensity-modulated radiation therapy for prostate cancer: impact of previous surgery for benign prostatic hyperplasia. Int J Urol 2010; 17 : 784–790.
26. Odrážka K, Vaculíková M, Doležel M, et al. Chronická toxicita trojrozměrné konformní radioterapie (3D-CRT) karcinomu prostaty. Klin Onkol 2006; 19 : 222–227.
Štítky
Detská urológia Nefrológia Urológia
Článok vyšiel v časopiseČeská urologie
Najčítanejšie tento týždeň
2013 Číslo 3- Aktuálne európske odporúčania pre liečbu renálnej koliky v dôsledku urolitiázy
- MUDr. Šimon Kozák: V algeziológii nič nefunguje zázračne cez noc! Je dôležité nechať si poradiť od špecialistov
- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Editorial
- Možnosti léčby kastračně refrakterního karcinomu prostaty, co nového k roku 2013
- Moderní radioterapie lokalizovaného karcinomu prostaty
- Management poranění ledvin na Urologické klinice FN Plzeň
- Eskalace dávky na intraprostatickou lézi – výsledky akutní a časné chronické toxicity
- Využití dvoufázové 3 T MRI angiografie v plánování operační léčby u nádorů ledvin
- Je vhodné podávat ATB profylaxi kojencům se závažnou hydronefrózou před provedení pyeloplastiky?
- Výsledky biopsie renálních tumorů na urologickém oddělení FN Ostrava
- Exprese genů BCL-2 a BAX-1 ve tkáni Ta, T1uroteliálních karcinomů močového měchýře a jejich prognostický význam
- 1. ostravské urologicko-neurologické sympozium
- Česká urologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Je vhodné podávat ATB profylaxi kojencům se závažnou hydronefrózou před provedení pyeloplastiky?
- Moderní radioterapie lokalizovaného karcinomu prostaty
- Management poranění ledvin na Urologické klinice FN Plzeň
- Výsledky biopsie renálních tumorů na urologickém oddělení FN Ostrava
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



